Все об атоме и его строении. Спиновое квантовое число m s. Главное квантовое число n
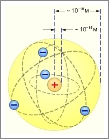
Первая модель строения атома была предложена Дж. Томсоном в 1904 г., согласно которой атом – положительно заряженная сфера с вкрапленными в нее электронами. Несмотря на свое несовершенство томсоновская модель позволяла объяснить явления испускания, поглощения и рассеяния света атомами, а также установить число электронов в атомах легких элементов.
Если вы получаете электроны, превращаясь в отрицательный ион, это называется анионом. Это множество всех атомов, которые имеют одинаковое количество протонов. Простейший атом имеет протон и электрон и называется проституцией. Что, помимо протона и электрона, называется дейтерием. Атом, который имеет еще один нейтрон, чем дейтерий, называется тритием. Итак, мы понимаем, что на самом деле существует три разных типа этого элемента.
Вызываются атомы, которые отличаются только количеством нейтронов, представляющими такое же количество протонов и электронов. Атомы, имеющие одинаковое массовое число, одинаковое атомное число и разное количество нейтронов, являются изобарами. Атомы, которые имеют одинаковое количество нейтронов и отличаются по своим атомным и массовым числам, являются изотонами. Виды, которые представляют такое же количество электронов, называются изоэлектронными. В предыдущем примере, поскольку загрузка кальция положительна, было потеряно два электрона.
Рис. 1. Атом, согласно модели Томсона. Электроны удерживаются внутри положительно заряженной сферы упругими силами. Те из них, которые находятся на поверхности, могут легко «выбиваться» , оставляя ионизированный атом.
2.2 Модель Резерфорда
Модель Томсона была опровергнута Э. Резерфордом (1911 г.), который доказал, что положительный заряд и практически вся масса атома сконцентрированы в малой части его объема – ядре, вокруг которого двигаются электроны (рис. 2).
Тогда его количество электронов равно 1 8. Сера, когда она представляет / демонстрирует отрицательный заряд, получила два электрона, получая с 18 электронами. История атомных моделей. На греческом языке слово, определяющее эту идею, является атомом. Далтон, английский ученый, который, наблюдая экспериментальные результаты реакционных газовых масс, постулировал, что атом нераздельный, массивный, сферический и крошечный. Он также заявил, что атомы одной и той же массы представляют собой атомы одного и того же элемента, а атомы разных элементов - разные.

Рис. 2. Эта модель строения атома известна как планетарная, т. к. электроны вращаются вокруг ядра подобно планетам солнечной системы.
Согласно законам классической электродинамики, движение электрона по окружности вокруг ядра будет устойчивым, если сила кулоновского притяжения будет равна центробежной силе. Однако, в соответствии с теорией электромагнитного поля, электроны в этом случае должны двигаться по спирали, непрерывно излучая энергию, и падать на ядро. Однако атом устойчив.
Атомная модель Далтона известна как «бильярдный шар». После обнаружения протонов и электронов, меньших частиц, чем атом, было несостоятельно поддерживать концепцию атомной неделимости. Затем Томсон определил атом со следующими характеристиками. делимым; массивное; сферическая; крошечные.
Эта модель стала известна как «пудинг изюма», потому что она относится к атому как к положительной массе с инкрустированными электронами, такими как изюм. в этой массе. Открытие радиоактивных частиц позволило Резерфорду создать уникальный эксперимент, благодаря которому была доказана структура вещества. Это бомбардировка альфа-частиц на очень тонком золотом лезвии. В теоретических терминах ожидалось, что все альфа-частицы пересекают слайд, не испытывая отклонений по траектории. Но к изумлению Резерфорда и его помощников были замечены следующие факты. большинство из них пересекли лезвие без отклонений по траектории. некоторые из этих излучений понесли отклонения в их траектории. несколько ударов и вернулся.
К тому же при непрерывном излучении энергии у атома должен наблюдаться непрерывный, сплошной спектр. На самом деле спектр атома состоит из отдельных линий и серий.
Таким образом, данная модель противоречит законам электродинамики и не объясняет линейчатого характера атомного спектра.
2.3. Модель Бора
В 1913 г. Н. Бор предложил свою теорию строения атома, не отрицая при этом полностью предыдущие представления. В основу своей теории Бор положил два постулата.
Это заставило Резерфорда сделать вывод о том, что в атоме преобладает пустота и что она имеет плотную, небольшую и положительную центральную область, называемую ядром. Резерфорд является отцом ядерного или планетарного атома. Он предположил, что электроны, вращающиеся вокруг ядра, так же, как планеты вращаются вокруг Солнца. В ядре были протоны и нейтроны. Что касается нейтронов, Резерфорд предсказал его существование, но экспериментально это не подтвердило. Позднее это сделал британский физик Чадвик.
Атомная модель Резерфорда-Бора. Бор, основанный на спектре излучения света газообразного водорода, постулировал, что электросфера разделена на семь уровней или электронные слои. Электрон, вращаясь по слою или уровню, не получает или не теряет энергию, т.е. его энергия постоянна. Но если он это сделает, он перейдет на более энергичный уровень. В этом состоянии мы находим возбужденный электрон, поскольку он имеет больше энергии, чем в основном состоянии. Спонтанно, электрон возвращается к своей первоначальной орбите, высвобождая полученную энергию в виде электромагнитных волн.
Первый постулат говорит о том, что электрон может вращаться вокруг ядра только по определенным стационарным орбитам. Находясь на них, он не излучает и не поглощает энергию (рис.3).
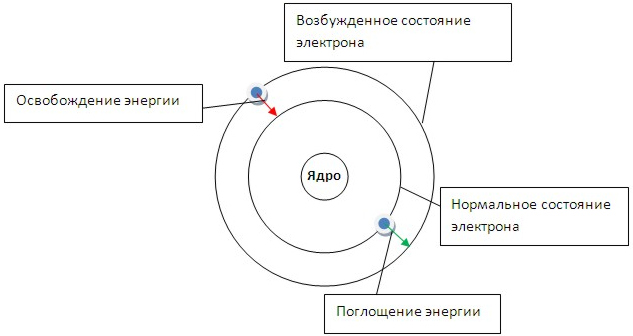
Рис. 3. Модель строения атома Бора. Изменение состояния атома при переходе электрона с одной орбиты на другую.
Эти прыжки известны как квантовые скачки. Текущая атомная модель - принципы. Текущая атомная модель состоит из вклада трех ученых - от Бройля, Гейзенберга и Шредингера, которые являются авторами следующих принципов. де Бройль - электронная двойственность. По этому принципу можно утверждать, что электрон представляет / демонстрирует смешанное поведение частиц и волн. Гейзенберг - неопределенность. По этому принципу в то же время невозможно определить положение и энергию электрона. Шредингера - волновые уравнения.
Это математические уравнения с вероятностным фактором. Его интерпретация приводит к концепции орбиты. Когда мы говорим об атоме, разные мысли, выдвигаемые в истории науки, приходят на ум. Сначала греческие философы выдвинули идею о том, что материя состоит из очень мелких частиц и что эти частицы неделимы. Эти частицы назывались.
При движении по любой стационарной орбите запас энергии электрона (Е 1, Е 2 …) остается постоянным. Чем ближе к ядру расположена орбита, тем меньше запас энергии электрона Е 1 ˂ Е 2 …˂ Е n . Энергия электрона на орбитах определяется уравнением:
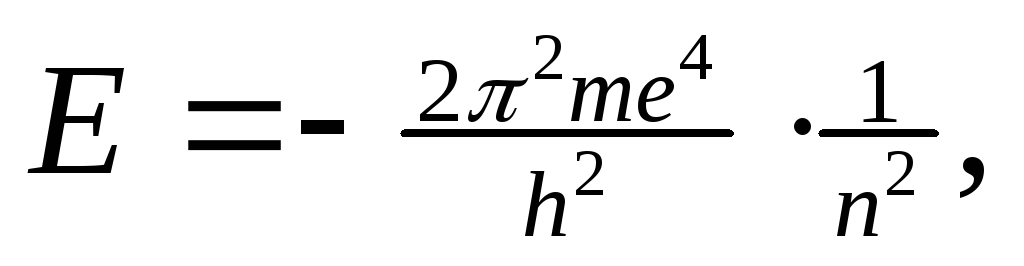
где m – масса электрона, h – постоянная Планка, n – 1, 2, 3… (n=1 для 1-ой орбиты, n=2 для 2-ой и т.д.).
Со временем исследования стали все глубже и глубже в поисках конкретного объяснения, полезной атомной модели, поскольку модель полезна только при правильном объяснении конкретного явления или эксперимента без конфликта с предыдущими экспериментами. В поисках правдоподобной модели, то есть модели, которая лучше всего объяснила явление, было разработано несколько моделей, но только три из них получили известность.
С целью углубления своих исследований, Англия должна была пройти руководство Томсона в исследованиях свойств и радиоактивных выбросов. В своих исследованиях он смог через эксперименты бомбардировать тонкую золотую лезвие альфа-частицами. Он заметил, что большая часть альфа-частиц, испущенных, прошла через лезвие, не испытывая никаких отклонений. Однако небольшая часть частиц имела отклонение. При этом он мог заключить, что у атома было небольшое ядро и большая пустая область.
Второй постулат говорит о том, что при переходе с одной орбиты на другую электрон поглощает или выделяет квант (порцию) энергии.
Если подвергнуть атомы воздействию (нагреванию, облучению и др.), то электрон может поглотить квант энергии и перейти на более удаленную от ядра орбиту (рис. 3). В этом случае говорят о возбужденном состоянии атома. При обратом переходе электрона (на более близкую к ядру орбиту) энергия выделяется в виде кванта лучистой энергии – фотона. В спектре это фиксируется определенной линией. На основании формулы
В своем эксперименте Резерфорд заявил, что электроны наделены отрицательными зарядами, но в ядре были положительные заряды. Таким образом, на основе планетной системы Резерфорд предложил аналогичную модель для атома водорода. Таким образом, электрон мог бы только изменить свой уровень, если он приобрел или потерял энергию.
Его спросили о том, что если электрон излучает энергию без остановки, он столкнется с ядром, что может привести к краху. Этот опрос проходил через несколько формулировок, пока он не был переформулирован ученым Луи де Бройлем, который говорит, что электроны вращаются вокруг ядра, но не на определенных орбитах, как заявил Бор.
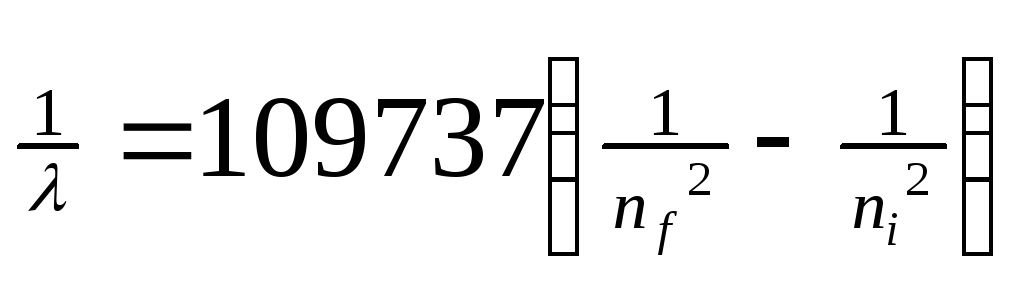 ,
,
где λ – длина волны, n = квантовые числа, характеризующие ближнюю и дальнюю орбиты, Бор рассчитал длины волн для всех серий в спектре атома водорода. Полученные результаты соответствовали экспериментальным данным. Стало ясным происхождение прерывистых линейчатых спектров. Они – результат излучения энергии атомами при переходе электронов из возбужденного состояния в стационарное. Переходы электронов на 1-ю орбиту образуют группу частот серии Лаймана, на 2-ю – серию Бальмера, на 3-ю серию Пашена (рис. 4,табл. 1).
Атом является основной единицей материи. Атом является наименьшей частицей элемента, который может принимать участие в химических реакциях и может существовать или не существовать отдельно. Он состоит из субатомных частиц, т.е. протонов, нейтронов и электронов.
Ответ: Ответ: Джон Далтон Джон Далтон предложил теорию этики. Согласно Далтону, материя состоит из мельчайших частиц, называемых Атом - наименьшая частица материи. Атомы неделимы и не могут быть созданы или уничтожены. Кроме того, атомы одного и того же элемента одинаковы во всех отношениях и объединяются с другими атомами с образованием молекул или соединений. Он может участвовать в химических реакциях и может существовать или не существовать отдельно. Атом состоит из субатомных частиц, т.е. протонов, нейтронов и электронов.
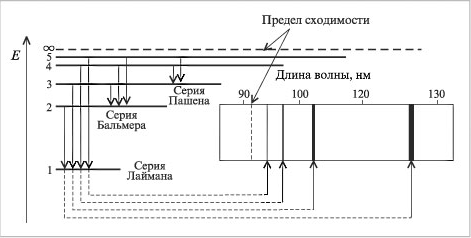
Рис. 4. Соответствие между электронными переходами и спектральными линиями атома водорода.
Таблица 1
Проверка формулы Бора для серий водородного спектра
Однако, теория Бора не смогла объяснить расщепление линий в спектрах многоэлектронных атомов. Бор исходил из того, что электрон – это частица, и использовал для описания электрона законы, характерные для частиц. Вместе с тем накапливались факты, свидетельствующие о том, что электрон способен проявлять и волновые свойства. Классическая механика оказалась не в состоянии объяснить движение микрообъектов, обладающих одновременно свойствами материальных частиц и свойствами волны. Эту задачу позволила решить квантовая механика – физическая теория, исследующая общие закономерности движения и взаимодействия микрочастиц, обладающих очень малой массой (табл. 2).
Эксперимент по дисперсии альфа-частиц был проведен Дж. Резерфордом. Его эксперименты показали, что атом в основном пуст и имеет положительно заряженное тяжелое тело в центре, называемом ядром. Центральное ядро положительно заряжено и отрицательно заряженные электроны тяготеют вокруг ядра.
Ответ: Ответ: большая часть атома пуста. Резерфорд открыл ядро и обеспечил основу современной атомной структуры благодаря своему опыту рассеяния альфа-частиц. Согласно Резерфорду, атом состоит из двух частей: ядра и внеядерной части. Его эксперимент показал, что атом в значительной степени пуст и имеет тяжелую часть, положительно заряженную в центре, называемом ядром. Три фундаментальные частицы атома - это позитронные, нейтринные и гамма-лучи-мезоны, кварки и ядра нейтрино, антикварки и электроны.
Таблица 2
Свойства элементарных частиц, образующих атом
Первые указания о сложном строении атома были получены при изучении процессов прохождения электрического тока через жидкости. Опыты выдающегося английского ученого М.Фарадея в тридцатых годах XIX в. навели на мысль о том, что электричество существует в виде отдельных единичных зарядов.
Протон, нейтрон и электрон. Ответ: Ответ: Протон, Нейтрон и Электрон атом состоит из центрального ядра, содержащего нейтронные протоны. Электроны вращаются вокруг ядра на разных воображаемых путях, называемых орбитами или оболочками. Ответ: электрон. Томсон обнаружил электроны в экспериментах с электронным лучом. Согласно Томсону, атомы делятся, атомы содержат отрицательно заряженные частички, называемые электронами. Гольдштейн обнаружил протоны. Гольдштейн обнаружил протоны в экспериментах с анодным лучом.
Согласно Гольдштейну, атомы содержат положительно заряженные частицы, называемые протонами. Поскольку атомы содержат отрицательно заряженные частицы, они должны содержать положительно заряженные частицы, чтобы быть электрически нейтральными. Нейтрон был обнаружен Джеймс Чадвик? Резерфорд? Джон Далтон Ответ: Ответ: Джеймс Чадвик Джеймс Чадвик обнаружил нейтроны.
Величины этих единичных зарядов электричества были определены в более поздних экспериментах по пропусканию электрического тока через газы (опыты с так называемыми катодными лучами). Было установлено, что катодные лучи - это поток отрицательно заряженных частиц, которые получили названия электронов .
Прямым доказательством сложности строения атома было открытие самопроизвольного распада атомов некоторых элементов, названное радиоактивностью. (А.Беккерель, 1896 г.). Последовавшее за этим установление природы α -, β -, и γ — лучей, образующихся при радиоактивном распаде (Э.Резерфорд, 1899-1903 гг.), открытие ядер атомов (Э.Резерфорд, 1909-1911 гг.), определение заряда электрона (Р.Милликен , 1909 г.) позволили Э.Резерфорду в 1911 г. предложить одну из первых моделей строения атома.
Согласно Чадвику, атомы содержат нейтральные частицы, называемые нейтронами в их ядрах с субатомными частицами. Число протонов, присутствующих в атоме элемента, известно как Атомный вес? Номер Протона? Атомный номер? Массовый номер Ответ: Ответ: атомный номер. Атомное число элемента - это число протонов в ядре атома. Поскольку атомы электрически нейтральны, число протонов равно числу электронов в атоме.
Сумма чисел протонов и нейтронов в атоме элемента известна как? Изотопное число Атомное число Молекулярный вес Массовое число Ответ: Ответ: Массовый номер Массовый номер элемента представляет собой сумму числа протонов и нейтронов в ядре атома. Средняя масса атома элемента известна как? Молекулярный вес? Атомное число? Масса атома в периодической таблице часто дается как десятичная и средняя масса изотопов отличается от элемента в единицах атомной массы.
Модель Резерфорда. Суть планетарной модели строения атома (Э.Резерфорд, 1911 г.) можно свести к следующим утверждениям:
1. В центре атома находится положительно заряженное ядро, занимающее ничтожную часть пространства внутри атома.
2. Весь положительный заряд и почти вся масса атома сосредоточены в его ядре (масса электрона равна 1/1823 а.е .м .).
Атомная масса отдельных атомов элемента представляет собой целое число единиц атомной массы. Согласно Резерфорду, атом состоит из двух следующих частей: Протоны и нейтроны Нейтроны и электроны Электроны и протоны Ядро и внеядерная часть Ответ: Ответ: основная и внеядерная часть Резерфорд открыл ядро и обеспечил основу современной атомной структуры благодаря опыту дисперсии альфа-частиц. Его эксперимент показал, что атом в основном пуст и имеет положительно заряженную тяжелую часть в центре, называемом ядром.
Центральное ядро положительно заряжено и отрицательно заряженные электроны движутся вокруг ядра. Объем ядра относительно объема атома пренебрежимо мал 25% 50% 75% Ответ: Ответ: пренебрежимо малый Атом в основном пуст и имеет положительно заряженную тяжелую часть при центр называется ядром.
3. Вокруг ядра вращаются электроны. Их число равно положительному заряду ядра.
Эта модель оказалась очень наглядной и полезной для объяснения многих экспериментальных данных, но она сразу обнаружила и свои недостатки. В частности, электрон, двигаясь вокруг ядра с ускорением (на него действует центростремительная сила), должен был бы, согласно электромагнитной теории, непрерывно излучать энергию. Это привело бы к тому, что электрон должен был бы двигаться вокруг ядра по спирали и в конце концов упасть на него. Никаких доказательств того, что атомы непрерывно исчезают, не было, отсюда следовало, что модель Резерфорда в чем-то ошибочна.
Теория Бора. В 1913 г. датский физик Н.Бор предложил свою теорию строения атома. Как и Резерфорд, он считал, что электроны двигаются вокруг ядра подобно планетам, движущимся вокруг Солнца. Однако к этому времени Дж.Ф ранк и Г.Герц (1912 г.) доказали дискретность энергии электрона в атоме и это позволило Бору положить в основу новой теории два необычных предположения (постулата):
1. Электрон может вращаться вокруг ядра не по произвольным, а только по строго определенным (стационарным) круговым орбитам.
Радиус орбиты r и скорость электрона v связаны квантовым соотношением Бора:
mr v = n ћ
где m - масса электрона, n - номер орбиты, ћ - постоянная Планка (ћ = 1,05∙10 -34 Дж∙с).
2. При движении по стационарным орбитам электрон не излучает и не поглощает энергии.
Таким образом, Бор предположил, что электрон в атоме не подчиняется законам классической физики. Согласно Бору, излучение или поглощение энергии определяется переходом из одного состояния, например с энергией Е 1 , в другое - с энергией Е 2 , что соответствует переходу электрона с одной стационарной орбиты на другую. При таком переходе излучается или поглощается энергия ∆ E , величина которой определяется соотношением
∆ E = E 1 – E 2 = hv ,
где v - частота излучения, h = 2 p ћ = 6,62∙10 -34 Дж∙с .
Бор, используя данное уравнение, рассчитал частоты линий спектра атома водорода, которые очень хорошо согласовывались с экспериментальными значениями, но было обнаружено также и то, что для других атомов эта теория не давала удовлетворительных результатов.
Квантовая модель строения атома. В последующие годы некоторые положения теории Бора были переосмыслены и дополнены. Наиболее существенным нововведением явилось понятие об электронном облаке, которое пришло на смену понятию об электроне только как частице. Теорию Бора сменила квантовая теория, которая учитывает волновые свойства электрона и других элементарных частиц, образующих атом.
Свойства элементарных частиц, образующих атом
|
Частица |
Заряд |
Масса |
||
|
Кл |
условн . ед. |
а.е .м . |
||
|
Электрон |
1,6∙10 -19 |
9,10∙10 -28 |
0,00055 |
|
|
Протон |
1,6∙10 -19 |
1,67∙10 -24 |
1,00728 |
|
|
Нейтрон |
1,67∙10 -24 |
1,00866 |
||
В основе современной теории строения атома лежат следующие основные положения:
1. Электрон имеет двойственную (корпускулярно-волновую) природу. Он может вести себя и как частица, и как волна, подобно частице, электрон обладает определенной массой и зарядом; в то же время, движущийся электрон проявляет волновые свойства, например, характеризуется способностью к дифракции. Длина волны электрона λ и его скорость v связаны соотношением де Бройля :
λ = h / mv ,
где m - масса электрона.
2. Для электрона невозможно одновременно точно, измерить координату и скорость. Чем точнее мы измеряем скорость, тем больше неопределенность в координате, и наоборот. Математическим выражением принципа неопределенности служит соотношение
∆ x ∙ m ∙∆ v > ћ /2,
где ∆х - неопределенность положения координаты, ∆ v - погрешность измерения скорости.
3. Электрон в атоме не движется по определенным траекториям, а может находиться в любой части около ядерного пространства, однако вероятность его нахождения в разных частях этого пространства неодинакова. Пространство вокруг ядра, в котором вероятность нахождения электрона достаточно велика, называют орбиталью .
4. Ядра атомов состоят из протонов и нейтронов (общее название - нуклоны ). Число протонов в ядре равно порядковому номеру элемента, а сумма чисел протонов и нейтронов соответствует его массовому числу.
Последнее положение было сформулировано после того, как в 1920 г. Э.Резерфорд открыл протон, а в 1932 г. Дж.Ч едвик - нейтрон.
Различные виды атомов имеют общее название - нуклиды . Нуклиды достаточно характеризовать любыми двумя числами из трех фундаментальных параметров: А - массовое число, Z - заряд ядра, равный числу протонов, и N - число нейтронов в ядре. Эти параметры связаны между собой соотношениями:
Z = А — N, N = А — Z , А= Z + N.
Нуклиды с одинаковым Z , но различными А и N , называют изотопами .
Сформулированные выше положения составляют суть новой теории, описывающей движение микрочастиц, - квантовой механики (механику, применимую к движению обычных тел и описываемую законами Ньютона, стали называть классической механикой). Наибольший вклад в развитие этой теории внесли француз Л. де Бройль, немец В.Гейзенберг, австриец Э.Шредингер, англичанин П.Дирак. Впоследствии каждый из этих ученых был удостоен Нобелевской премии.
- Абсолютные и относительные координаты Что называется абсолютными координатами точек
- Какие меры относились к политике военного коммунизма
- Лунин, михаил сергеевич Лунин Николай Иванович: витамины
- Скончался академик борис сергеевич соколов Соколов, Борис Сергеевич Информацию О
- Рецепты варенья из кабачков с лимоном, с курагой и в ананасовом соке
- Как приготовить вкусные куриные сердечки с картофелем в мультиварке Куриные сердечки рецепт в мультиварке с картофелем
- Сырный суп с курицей и грибами Куриный суп с сыром и грибами

 Live Journal
Live Journal Facebook
Facebook Twitter
Twitter