Сравнить валентные возможности атомов o и s. Данный урок посвящен повторению понятия «валентность» и изучению принципов определения валентных возможностей атомов химических элементов. В ходе изучения материала вы узнаете, сколько атомов других химических
Цели.
- Развить представления о валентности как основном свойстве атома, выявить закономерности изменения радиусов атомов химических элементов в периодах и группах периодической системы.
- Используя интегрированный подход, развивать у учащихся умения сравнивать, сопоставлять, находить аналогии, предсказывать практический результат на основании теоретических рассуждений.
- Создавая ситуации успеха, преодолевать психологическую инерцию учащихся.
- Развивать образное мышление, способности к рефлексии.
Оборудование: Таблица “ Валентность и электронные конфигурации элементов”, мультимедиа.
Валентность. Валентные возможности атомов
Как и азот и фосфор, мышьяк обладает довольно стабильным гидридом АсН 3, который является источником важного семейства органических производных. Фосфор и мышьяк имеют очень сходные электроотрицательности, и для этих двух элементов наиболее предпочтительны пентавалентные соединения кислорода. Арсеник приближается к сурьме и висмуту по его кристаллической структуре и по тому, что устойчивое разнообразие проводит тепло и электроэнергию. Его металлический характер также проявляется в арсенидах металлов, которые часто обладают свойствами сплава.
Эпиграф. Логика, если она отражается в истине и здравом смысле, всегда ведёт к цели, к правильному результату.
Урок комбинированный, с элементами интеграции. Используемые методы обучения: объяснительно-иллюстрированый, эвристический и проблемный.
I этап. Ориентировочно-мотивационный
Урок начинается с “настройки” (звучит музыка – симфония №3 Й. Брамса).
Электронная процессия, способы подключения
Эта электронная процессия предлагает несколько теоретических возможностей связи с другими атомами, что подразумевает различные структурные свойства. Структура трикоординатных соединений мышьяка может быть объяснена двумя способами. Для наших подписчиков статья состоит из 8 страниц.
Мышьяк использовался для многих инсектицидов, ядов крыс и продуктов из пестицидов, таких как определенные краски, обои и керамика. Острые отравления сурьмой предлагают много аналогов острому отравлению мышьяком. Хроническое отравление реже и похоже на хроническое отравление мышьяком.
Учитель: Слово “валентность” (от лат. valentia) возникло в середине XIX в., в период завершения второго химико-аналитического этапа развития химии. К тому времени было открыто более 60 элементов.
Истоки понятия “валентность” содержатся в работах разных ученых. Дж. Дальтон установил, что вещества состоят из атомов, соединенных в определенных пропорциях Э. Франкланд, собственно, и ввел понятие валентности как соединительной силы. Ф.А. Кекуле отождествлял валентность с химической связью. А.М.Бутлеров обратил внимание на то, что валентность связана с реакционной способностью атомов. Д.И. Менделеев создал периодическую систему химических элементов, в которой высшая валентность атомов совпадала с номером группы элемента в системе. Он же ввел понятие “переменная валентность”.
Вопрос. Что такое валентность?
Вчитайтесь в определения, взятые из разных источников (учитель показывает слайды через мультимедиа):
“Валентность химического элемента – способность его атомов соединяться с другими атомами в определенных соотношениях”.
“Валентность – способность атомов одного элемента присоединять определенное количество атомов другого элемента”.
“Валентность – свойство атомов, вступая в химические соединения, отдавать или принимать определенное количество электронов (электровалентность) или объединять электроны для образования общих для двух атомов электронных пар (ковалентность)”.
Какое определение валентности, по вашему мнению, более совершенно и в чем вы видите недостатки других? (Обсуждение в группах.)
Валентность и валентные возможности – важные характеристики химического элемента. Они определяются структурой атомов и периодически изменяются с увеличением зарядов ядер.
Учитель. Таким образом, делаем вывод, что:
Что, по-вашему, означает понятие “ валентная возможность”?
Учащиеся высказывают свое мнение. Вспоминают значение слов “возможность”, “возможный”, уточняют смысл этих слов в толковом словаре С.И.Ожегова:
“Возможность – средство, условие, необходимое для осуществления чего-нибудь”;
“Возможный – такой, который может произойти, осуществимый, допустимый, дозволительный, мыслимый”.
(учитель показывает следующий слайд)
Потом учитель подводит итог.
Учитель. Валентные возможности атомов – это допустимые валентности элемента, весь спектр их значений в различных соединениях.
II этап. Операционно-исполнительный
Работа с таблицей “ Валентность и электронные конфигурации элементов”.
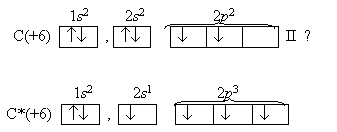
Учитель. Поскольку валентность атома зависит от числа неспаренных электронов, полезно рассмотреть структуры атомов в возбужденных состояниях, учитывая валентные возможности. Запишем электронографические формулы распределения электронов по орбиталям в атоме углерода. С их помощью определим, какую валентность проявляет углерод С в соединениях. Звездочкой (*) обозначают атом в возбужденном состоянии:

Таким образом, углерод проявляет валентность IV
за счёт расспаривания
2s 2 – электронов и перехода одного из
них на вакантную орбиталь
. (Вакантный –
незанятый, пустующий (С. И. Ожегов))
Почему валентность С- II и IV , а H-I , He-O , Be – II , B – III , P -V ?
Сопоставьте электронографические формулы элементов (схема №1) и установите причину разной валентности.
Работа в группах:
Учитель. Итак, от чего зависят валентность и валентные возможности атомов? Давайте рассмотрим эти два понятия во взаимосвязи (схема №2).
Расход энергии (Е) на перевод атома в возбужденное состояние компенсируется энергией, выделяющейся при образовании химической связи.
В чем отличие атома в основном (стационарном) состоянии от атома в возбужденном состоянии (схема №3)?
Учитель. Могут ли быть следующие валентности у элементов: Li -III , О – IV , Ne – II ?
Поясните свой ответ, используя электронные и электронографические формулы этих элементов (схема №4).
Работа в группах.
Ответ. Нет, так как в этом случае затраты энергии на перемещение электрона
(1s -> 2p или 2p -> 3s) настолько велики, что не могут быть компенсированы энергией, выделяющейся при образовании химической связи.
Учитель. Есть ещё один вид валентной возможности атомов – это наличие неподеленных электронных пар (образование ковалентной связи по донорно – акцепторному механизму):
III этап. Оценочно-рефлексивный
Подводятся итоги, характеризуется работа учащихся на уроке (возвращение к эпиграфу урока). Затем подводится резюме – отношение ребят к уроку, учебному предмету, учителю.
1. Что не понравилось на уроке?
2. Что понравилось?
3. Какие вопросы остались для тебя неясными?
4. Оценка работы преподавателя и своей работы? (обоснованная).
Домашнее задание (по учебнику О.С. Габриеляна, Химия-10; профильный уровень, параграф №4, упр.4)
Свойства атома во многом определяется строением его внешнего электронного слоя. Электроны, находящиеся на внешнем, а иногда и на предпоследнем, электронном слое атома могут принимать участие в образовании химических связей. Такие электроны называют валентными. Например, в атоме фосфора 5 валентных электронов: (рис. 1).
![]()
Рис. 1. Электронная формула атома фосфора
Валентные электроны атомов элементов главных подгрупп расположены на s- и р-орбиталях внешнего электронного слоя. У элементов побочных подгрупп, кроме лантаноидов и актиноидов, валентные электроны расположены на s-орбитали внешнего и d-орбиталях предпоследнего слоев.
Валентность - это способность атома образовывать химические связи. Данное определение и само понятие валентность корректны только по отношению к веществам с ковалентным типом связи. Для ионных соединений это понятие неприменимо, вместо него используют формальное понятие «степень окисления».
Валентность характеризуется числом электронных пар, образующихся при взаимодействии атома с другими атомами. Например, валентность азота в аммиаке NH3 равна трем (Рис. 2).
Рис. 2. Электронная и графическая формулы молекулы аммиака
Количество электронных пар, которое может образовать атом с другими атомами, зависит, в первую очередь, от числа его неспаренных электронов. Например, в атоме углерода два неспаренных электрона - на 2р-орбиталях (Рис. 3). По числу неспаренных электронов мы можем сказать, что такой атом углерода может проявлять валентность, равную II.

Рис. 3. Электронное строение атома углерода в основном состоянии
Во всех органических веществах и некоторых неорганических соединениях углерод четырехвалентен. Такая валентность возможна только в возбужденном состоянии атома углерода, в которое он переходит при получении дополнительной энергии.
В возбужденном состоянии в атоме углерода распариваются 2s-электроны, один из которых переходит на свободную 2р-орбиталь. Четыре неспаренных электрона могут участвовать в образовании четырех ковалентных связей. Возбужденное состояние атома принято обозначать «звездочкой» (Рис. 4).

Рис. 4. Электронное строение атома углерода в возбужденном состоянии
Может ли азот иметь валентность, равную пяти - по числу его валентных электронов? Рассмотрим валентные возможности атома азота.
В атоме азота два электронных слоя, на которых расположено всего 7 электронов (Рис. 5).
Рис. 5. Электронная схема строения внешнего слоя атома азота
Азот может образовать три общие электронные пары с тремя другими электронами. Пара электронов на 2s-орбитали тоже может участвовать в образовании связи, но по другому механизму - донорно-акцепторному, образуя четвертую связь.
Распаривание 2s-электронов в атоме азота невозможно, т. к. на втором электронном слое нет d-подуровня. Поэтому высшая валентность азота равна IV.
Подведение итога урока
На уроке вы научились определять валентные возможности атомов химических элементов. В ходе изучения материала вы узнали, сколько атомов других химических элементов может присоединить к себе конкретный атом, а также почему элементы проявляют разные значения валентности.
Источники
http://www.youtube.com/watch?t=3&v=jSTB1X1mD0o
http://www.youtube.com/watch?t=7&v=6zwx_d-MIvQ
http://www.youtube.com/watch?t=1&v=qj1EKzUW16M
http://interneturok.ru/ru/school/chemistry/11-klass - конспект
- Митрополит алексий московский святитель и чудотворец краткая биография Митрополит алексий годы
- Попробуем разобраться в см - Документ
- Открытия галилея в области астрономии
- Сопливые грибы но не маслята
- Имена мальчиков рожденных в январе Азербайджанские имена родившиеся в январе по гороскопу
- Суточный диурез у беременных женщин
- Как рассчитать налог на автомобиль по лошадиным силам Изменения по транспортному налогу в году

 Live Journal
Live Journal Facebook
Facebook Twitter
Twitter