Свойства ковалентной связи
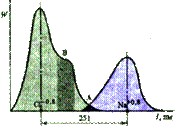
Между образовавшимися ионами возникает электростатическое притяжение, которое называется ионной связью. Вернее, такой взгляд удобен. На деле ионная связь между атомами в чистом виде не реализуется нигде или почти нигде, обычно на деле связь носит частично ионный, а частично ковалентный характер. В то же время связь сложных молекулярных ионов часто может считаться чисто ионной. Важнейшие отличия ионной связи от других типов химической связи заключаются в ненаправленности и ненасыщаемости. Именно поэтому кристаллы, образованные за счёт ионной связи, тяготеют к различным плотнейшим упаковкам соответствующих ионов.
Характеристикой подобных соединений служит хорошая растворимость в полярных растворителях (вода, кислоты и т. д.). Это происходит из-за заряженности частей молекулы. При этом диполи растворителя притягиваются к заряженным концам молекулы, и, в результате Броуновского движения , «растаскивают» молекулу вещества на части и окружают их, не давая соединиться вновь. В итоге получаются ионы, окружённые диполями растворителя.
При растворении подобных соединений, как правило, выделяется энергия, так как суммарная энергия образованных связей растворитель-ион больше энергии связи анион-катион. Исключения составляют многие соли азотной кислоты (нитраты), которые при растворении поглощают тепло (растворы охлаждаются). Последний факт объясняется на основе законов, которые рассматриваются в физической химии . Взаимодействие ионов
Если атом теряет один или несколько электронов, то он превращается в положительный ион - катион (в переводе с греческого - "идущий вниз). Так образуются катионы водорода Н+, лития Li+, бария Ва2+. Приобретая электроны, атомы превращаются в отрицательные ионы - анионы (от греческого "анион" - идущий вверх). Примерами анионов являются фторид ион F−, сульфид-ион S2−.
Катионы и анионы способны притягиваться друг к другу. При этом возникает химическая связь, и образуются химические соединения. Такой тип химической связи называется ионной связью:
Ионная связь - это химическая связь, образованная за счет электростатического притяжения между катионами и анионами.
Пример образования ионной связи
Рассмотрим способ образования на примере "хлорида натрия" NaCl . Электронную конфигурацию атомов натрия и хлора можно представить: N a 11 1 s 2 2 s 2 2 p 6 3 s 1 {\displaystyle {\mathsf {Na^{11}1s^{2}2s^{2}2p^{6}3s^{1}}}} и C l 17 1 s 2 2 s 2 2 p 6 3 s 2 3 p 5 {\displaystyle {\mathsf {Cl^{17}1s^{2}2s^{2}2p^{6}3s^{2}3p^{5}}}} . Это атомы с незавершенными энергетическими уровнями. Очевидно, для их завершения, атому натрия легче отдать один электрон, чем присоединить семь, а атому хлора легче присоединить один электрон, чем отдать семь. При химическом взаимодействии атом натрия полностью отдает один электрон, а атом хлора принимает его.
Схематично это можно записать так:
N a − e → N a + {\displaystyle {\mathsf {Na-e\rightarrow Na^{+}}}} - ион натрия, устойчивая восьмиэлектронная оболочка ( N a + 1 s 2 2 s 2 2 p 6 {\displaystyle {\mathsf {Na^{+}1s^{2}2s^{2}2p^{6}}}} ) за счет второго энергетического уровня. C l + e → C l − {\displaystyle {\mathsf {Cl+e\rightarrow Cl^{-}}}} - ион хлора, устойчивая восьмиэлектронная оболочка.Между ионами N a + {\displaystyle {\mathsf {Na^{+}}}} и C l − {\displaystyle {\mathsf {Cl^{-}}}} возникают силы электростатического притяжения, в результате чего образуется соединение.
Образом атомы щелочных и щелочноземельных металлов, соединяясь с атомами галогенов . То есть прежде всего посмотрите на химическую формулу вещества. Вот, например, поваренная соль – хлористый натрий, NaCl. Натрий – щелочной металл, находится в первой группе таблицы Менделеева, хлор – газ, галоген, находится в седьмой группе. Следовательно, в молекуле поваренной соли – ионная химическая связь . Или, например, фтористый калий , КF. Калий - также щелочной металл, причем еще более активный, чем натрий. Фтор – галоген, еще более активный, чем хлор. Поэтому в молекуле этого вещества – тоже ионная химическая связь .
Разумеется, термины «отдает» и «принимает» в известной степени условны, так как полной отдачи и приема электронов не существует. Речь идет лишь о смещении электронной плотности от электроположительного атома к электроотрицательному атому в большей или меньшей степени. Таким образом, любую ионная связь одновременно можно считать и ковалентной.
Рассмотрите ионную связь на примере хорошо известной поваренной соли – хлорида натрия , NaCl. Атом натрия, имеющий один электрон на внешнем слое, и атом хлора, имеющий, соответственно, семь внешних электронов. После образования связи превращаются в положительно и отрицательно заряженные ионы, имеющие по восемь электронов на внешних оболочках. Таким образом, эти ионы
Ионная связь
Теория химической связи занимает важнейшее место в современной химии . Она объясняет, почему атомы объединяются в химические частицы , и позволяет сравнивать устойчивость этих частиц . Используя теорию химической связи , можно предсказать состав и строение различных соединений . Понятие о разрыве одних химических связей и образовании других лежит в основе современных представлений о превращениях веществ в ходе химических реакций .
Химическая связь - это взаимодействие атомов , обусловливающее устойчивость химической частицы или кристалла как целого . Химическая связь образуется за счет электростатического взаимодействия между заряженными частицами : катионами и анионами, ядрами и электронами . При сближении атомов начинают действовать силы притяжения между ядром одного атома и электронами другого, а также силы отталкивания между ядрами и между электронами . На некотором расстоянии эти силы уравновешивают друг друга , и образуется устойчивая химическая частица .
При образовании химической связи может произойти существенное перераспределение электронной плотности атомов в соединении по сравнению со свободными атомами .
В предельном случае это приводит к образованию заряженных частиц - ионов (от греческого "ион" - идущий).
1 Взаимодействие ионов
Если атом теряет один или несколько электронов , то он превращается в положительный ион - катион (в переводе с греческого – «идущий вниз »). Так образуются катионы водорода Н + , лития Li + , бария Ва 2+ . Приобретая электроны, атомы превращаются в отрицательные ионы - анионы (от греческого "анион" - идущий вверх ). Примерами анионов являются фторид ион F − , сульфид-ион S 2− .
Катионы и анионы способны притягиваться друг к другу . При этом возникает химическая связь , и образуются химические соединения . Такой тип химической связи называется ионной связью :
2 Определение Ионной связи
Ионная связь - это химическая связь, образованная за счет электростатического притяжения между катионами и анионами .
Механизм образования ионной связи можно рассмотреть на примере реакции между натрием и хлором . Атом щелочного металла легко теряет электрон , а атом галогена - приобретает . В результате этого возникает катион натрия и хлорид-ион . Они образуют соединение за счет электростатического притяжения между ними .
Взаимодействие между катионами и анионами не зависит от направления , поэтому о ионной связи говорят как о ненаправленной . Каждый катион может притягивать любое число анионов , и наоборот . Вот почему ионная связь является ненасыщенной . Число взаимодействий между ионами в твердом состоянии ограничивается лишь размерами кристалла . Поэтому "молекулой " ионного соединения следует считать весь кристалл .
Для возникновения ионной связи необходимо , чтобы сумма значений энергии ионизации E i (для образования катиона) и сродства к электрону A e (для образования аниона) должна быть энергетически выгодной . Это ограничивает образование ионной связи атомами активных металлов (элементы IA- и IIA-групп, некоторые элементы IIIA-группы и некоторые переходные элементы) и активных неметаллов (галогены, халькогены, азот).
Идеальной ионной связи практически не существует . Даже в тех соединениях, которые обычно относят к ионным , не происходит полного перехода электронов от одного атома к другому ; электроны частично остаются в общем пользовании . Так, связь во фториде лития на 80% ионная , а на 20% - ковалентная . Поэтому правильнее говорить о степени ионности (полярности ) ковалентной химической связи . Считают, что при разности электроотрицательностей элементов 2,1 связь является на 50% ионной . При большей разности соединение можно считать ионным .
Ионной моделью химической связи широко пользуются для описания свойств многих веществ , в первую очередь, соединений щелочных и щелочноземельных металлов с неметаллами . Это обусловлено простотой описания таких соединений : считают, что они построены из несжимаемых заряженных сфер , отвечающих катионам и анионам . При этом ионы стремятся расположиться таким образом, чтобы силы притяжения между ними были максимальными, а силы отталкивания - минимальными.
Ионная связь - прочная химическая связь, образующаяся между атомами с большой разностью (>1,7 по шкале Полинга) электроотрицательностей , при которой общая электронная пара полностью переходит к атому с большей электроотрицательностью. Это притяжение ионов как разноименно заряженных тел. Примером может служить соединение CsF, в котором «степень ионности» составляет 97 %.
Ионная связь - крайний случай поляризации ковалентной полярной связи . Образуется между типичными металлом и неметаллом . При этом электроны у металла полностью переходят к неметаллу . Образуются ионы.
Если химическая связь образуется между атомами, которые имеют очень большую разность электроотрицательностей (ЭО > 1.7 по Полингу) , то общая электронная пара полностью переходит к атому с большей ЭО . Результатом этого является образование соединения противоположно заряженных ионов :
Между образовавшимися ионами возникает электростатическое притяжение , которое называется ионной связью . Вернее, такой взгляд удобен . На деле ионная связь между атомами в чистом виде не реализуется нигде или почти нигде , обычно на деле связь носит частично ионный , и частично ковалентный характер . В то же время связь сложных молекулярных ионов часто может считаться чисто ионной . Важнейшие отличия ионной связи от других типов химической связи заключаются в ненаправленности и ненасыщаемости . Именно поэтому кристаллы, образованные за счёт ионной связи, тяготеют к различным плотнейшим упаковкам соответствующих ионов.
3 Ионные радиусы
В простой электростатической модели ионной связи используется понятие ионных радиусов . Сумма радиусов соседних катиона и аниона должна равняться соответстующему межъядерному расстоянию :
r 0 = r + + r −
При этом остается неясным , где следует провести границу между катионом и анионом . Сегодня известно , что чисто ионной связи не существует , так как всегда имеется некоторое перекрывание электронных облаков . Для вычисления радиусов ионов используют методы исследования , которые позволяют определять электронную плотность между двумя атомами . Межъядерное расстояние делят в точке , где электронная плотность минимальна .

Размеры иона зависят от многих факторов . При постоянном заряде иона с ростом порядкового номера (а, следовательно, заряда ядра ) ионный радиус уменьшается . Это особенно хорошо заметно в ряду лантаноидов , где ионные радиусы монотонно меняются от 117 пм для (La 3+) до 100 пм (Lu 3+) при координационном числе 6 . Этот эффект носит название лантаноидного сжатия .
В группах элементов ионные радиусы в целом увеличиваются с ростом порядкового номера . Однако для d -элементов четвертого и пятого периодов вследствие лантаноидного сжатия может произойти даже уменьшение ионного радиуса (например, от 73 пм у Zr 4+ до 72 пм у Hf 4+ при координационном числе 4).
В периоде происходит заметно уменьшение ионного радиуса , связанное с усилением притяжения электронов к ядру при одновременном росте заряда ядра и заряда самого иона : 116 пм у Na + , 86 пм у Mg 2+ , 68 пм у Al 3+ (координационное число 6). По этой же причине увеличение заряда иона приводит к уменьшению ионного радиуса для одного элемента : Fe 2+ 77 пм, Fe 3+ 63 пм, Fe 6+ 39 пм (координационное число 4).
Сравнение ионных радиусов можно проводить только при одинаковом координационном числе , поскольку оно оказывает влияние на размер иона из-за сил отталкивания между противоионами . Это хорошо видно на примере иона Ag + ; его ионных радиус равен 81, 114 и 129 пм для координационных чисел 2, 4 и 6 , соответственно .
Структура идеального ионного соединения , обусловленная максимальным притяжением между разноименными ионами и минимальным отталкиванием одноименных ионов , во многом определяется соотношением ионных радиусов катионов и анионов . Это можно показать простыми геометрическими построениями.
4 Энергия ионной связи
Энергия связ и для ионного соединения - это энергия , которая выделяется при его образовании из бесконечно удаленных друг от друга газообразных противоионов . Рассмотрение только электростатических сил соответствует около 90% от общей энергии взаимодействия , которая включает также вклад неэлектростатических сил (например, отталкивание электронных оболочек ).
При возникновении ионной связи между двумя свободными ионами энергия их притяжения определяется законом Кулона :
E(прит.) = q+ q− / (4π r ε),
где q+ и q− - заряды взаимодействующих ионов , r - расстояние между ними , ε - диэлектрическая проницаемость среды .
Так как один из зарядов отрицателен , то значение энергии также будет отрицательным .
Согласно закону Кулона , на бесконечно малых расстояниях энергия притяжения должна стать бесконечно большой . Однако этого не происходит , так как ионы не являются точечными зарядами . При сближении ионов между ними возникают силы отталкивания , обусловленные взаимодействием электронных облаков . Энергия отталкивания ионов описывается уравнением Борна :
Е(отт.) = В / rn,
где В - некоторая константа , n может принимать значения от 5 до 12 (зависит от размера ионов ). Общая энергия определяется суммой энергий притяжения и отталкивания :
Е = Е(прит.) + Е(отт.)
Её значение проходит через минимум . Координаты точки минимума отвечают равновесному расстоянию r 0 и равновесной энергии взаимодействия между ионами E 0 :
E0 = q+ q− (1 - 1 / n) / (4π r0 ε)
В кристаллической решетке всегда имеет место большее число взаимодействий , чем между парой ионов . Это число определяется в первую очередь типом кристаллической решетки . Для учета всех взаимодействий (ослабевающих с увеличением расстояния) в выражение для энергии ионной кристаллической решетки вводят так называемую константу Маделунга А :
E(прит.) = A q+ q− / (4π r ε)
Значение константы Маделунга определяется только геометрией решетки и не зависит от радиуса и заряда ионов . Например, для хлорида натрия она равна 1,74756 .
5 поляризация ионов
Помимо величины заряда и радиуса важной характеристикой иона являются его поляризационные свойства . Рассмотрим этот вопрос несколько подробнее. У неполярных частиц (атомов, ионов, молекул) центры тяжести положительных и отрицательных зарядов совпадают . В электрическом поле происходит смещение электронных оболочек в направлении положительно заряженной пластины , а ядер - в направлении отрицательно заряженной пластины . Вследствие деформации частицы в ней возникает диполь , она становится полярной .
Источником электрического поля в соединениях с ионным типом связи являются сами ионы . Поэтому, говоря о поляризационных свойствах иона , необходимо различать поляризующее действие данного иона и способность его самого поляризоваться в электрическом поле .
Поляризующее действие иона будет тем большим , чем больше его силовое поле , т. е. чем больше заряд и меньше радиус иона . Поэтому в пределах подгрупп в Периодической системе элементов поляризующее действие ионов понижается сверху вниз , так как в подгруппах при постоянной величине заряда иона сверху вниз увеличивается его радиус .
Поэтому поляризующее действие ионов щелочных металлов например растет от цезия к литию , а в ряду галогенид-ионов - от I к F . В периодах поляризующее действие ионов растет слева направо вместе с увеличением заряда иона и уменьшением его радиуса .
Поляризуемость иона , способность его к деформации растут с уменьшением силового поля , т. е. с уменьшением величины заряда и увеличением радиуса . Поляризуемость анионов обычно выше , чем катионов и в ряду галогенидов растет от F к I .
На поляризационные свойства катионов оказывает влияние характер их внешней электронной оболочки . Поляризационные свойства катионов как в активном , так и в пассивном смысле при одинаковом заряде и близком радиусе растут при переходе от катионов с заполненной оболочкой к катионам с незаконченной внешней оболочкой и далее к катионам с 18-электронной оболочкой .
Например, в ряду катионов Mg 2+ , Ni 2+ , Zn 2+ поляризационные свойства усиливаются . Эта закономерность согласуется с изменением в приведенном в ряду радиуса иона и строения его электронной оболочки:
Для анионов поляризационные свойства ухудшаются в такой последовательности:
I - , Br - , Cl - , CN - , OH - , NO 3 - , F - , ClO 4 - .
Результатом поляризационного взаимодействия ионов является деформация их электронных оболочек и, как следствие этого, сокращение межионных расстояний и неполное разделение отрицательного и положительного зарядов между ионами.
Например, в кристалле хлорида натрия величина заряда на ионе натрия составляет +0,9 , а на ионе хлора - 0,9 вместо ожидаемой единицы . В молекуле KCl , находящейся в парообразном состоянии , величина зарядов на ионах калия и хлора составляет 0,83 единицы заряда , а в молекуле хлороводорода - лишь 0,17 единицы заряда.
Поляризация ионов оказывает заметное влияние на свойства соединений с ионной связью , понижая их температуры плавления и кипения , уменьшая электролитическую диссоциацию в растворах и расплавах и др .
Ионные соединения образуются при взаимодействии элементов , значительно различающихся по химическим свойствам . Чем больше удалены друг от друга элементы в периодической системе , тем в большей степени проявляется в их соединениях ионная связь . Напротив , в молекулах, образованных одинаковыми атомами или атомами элементов, близких по химическим свойствам , возникают другие типы связи . Поэтому теория ионной связи имеет ограниченное применение .
6 Влияние поляризации ионов на свойства веществ и свойства Ионной связи и ионных соединений
Представления о поляризации ионов помогают объяснить различия в свойствах многих однотипных веществ . Например, сравнение хлоридов натрия и калия с хлоридом серебра показывает, что при близких ионных радиусах
поляризуемость катиона Ag+ , имеющего 18-электронную внешнюю оболочку , выше , что приводит к увеличению прочности связи металл-хлор и меньшей растворимости хлорида серебра в воде .
Взаимная поляризация ионов облегчает разрушение кристаллов , что приводит к понижению температур плавления веществ . По этой причине температура плавления TlF (327 oС) существенно ниже , чем RbF (798 oC). Температура разложения веществ также понижатся с усилением взаимной поляризации ионов . Поэтому иодиды обычно разлагаются при более низких температурах , чем остальные галогениды , а соединения лития - термически менее устойчивы , чем соединения других щелочных элементов .
Деформируемость электронных оболочек сказывается и на оптических свойствах веществ . Чем более поляризована частица , тем ниже энергия электронных переходов . Если поляризация мала , возбуждение электронов требует более высокой энергии , что отвечает ультрафиолетовой части спектра . Такие вещества обычно бесцветны . В случае сильной поляризации ионов возбуждение электронов происходит при поглощении электромагнитного излучения видимой области спектра . Поэтому некоторые вещества , образованные бесцветными ионами, окрашены .
Характеристикой ионных соединений служит хорошая растворимость в полярных растворителях (вода, кислоты и т. д.) . Это происходит из-за заряженности частей молекулы . При этом диполи растворителя притягиваются к заряженным концам молекулы , и, в результате Броуновского движения , «растаскивают » молекулу вещества на части и окружают их , не давая соединиться вновь . В итоге получаются ионы окружённые диполями растворителя .
При растворении подобных соединений, как правило, выделяется энергия , так как суммарная энергия образованных связей растворитель-ион больше энергии связи анион-катион . Исключения составляют многие соли азотной кислоты (нитраты) , которые при растворении поглощают тепло (растворы охлаждаются ). Последний факт объясняется на основе законов, которые рассматриваются в физической химии .
Ионные соединения (например, хлорид натрия NaCl) - твердые и тугоплавкие от того, что между зарядами их ионов ("+" и "–") существуют мощные силы электростатического притяжения .
Отрицательно заряженный ион хлора притягивает не только "свой " ион Na+ , но и другие ионы натрия вокруг себя . Это приводит к тому , что около любого из ионов находится не один ион с противоположным знаком , а несколько (рис. 1).
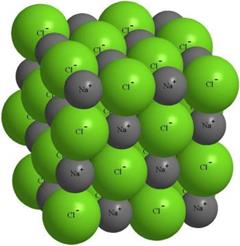
Рис. 1. Строение кристалла поваренной соли NaCl .
Фактически, около каждого иона хлора располагается 6 ионов натрия , а около каждого иона натрия - 6 ионов хлора .
Такая упорядоченная упаковка ионов называется ионным кристаллом . Если в кристалле выделить отдельный атом хлора , то среди окружающих его атомов натрия уже невозможно найти тот , с которым хлор вступал в реакцию . Притянутые друг к другу электростатическими силами , ионы крайне неохотно меняют свое местоположение под влиянием внешнего усилия или повышения температуры . Но если температура очень велика (примерно 1500°C ), то NaCl испаряется , образуя двухатомные молекулы . Это говорит о том, что силы ковалентного связывания никогда не выключаются полностью .
Ионные кристаллы отличаются высокими темпертурами плавления , обычно значительной шириной запрещенной зоны , обладают ионной проводимостью при высоких температурах и рядом специфических оптических свойств (например, прозрачностью в ближней области ИК спектра ). Они могут быть построены как из одноатомных , так и из многоатомных ионов . Пример ионных кристаллов первого типа - кристаллы галогенидов щелочных и щелочно-земельных металлов ; анионы располагаются по закону плотнейшей шаровой упаковки или плотной шаровой кладки , катионы занимают соответствующие пустоты . Наиболее характерные структуры такого типа - NaCl, CsCl, CaF2. Ионные кристаллы второго типа построены из одноатомных катионов тех же металлов и конечных или бесконечных анионных фрагментов . Конечные анионы (кислотные остатки) - NO3-, SO42-, СО32- и др . Кислотные остатки могут соединяться в бесконечные цепи , слои или образовывать трехмерный каркас , в полостях которого располагаются катионы , как, например, в кристаллических структурах силикатов . Для ионных кристаллов можно рассчитать энергию кристаллической структуры U (см. табл.), приближенно равную энтальпии сублимации ; результаты хорошо согласуются с экспериментальными данными . Согласно уравнению Борна-Майера , для кристалла , состоящего из формально однозарядных ионов :
U = -A/R + Ве-R/r - C/R6 - D/R8 + E0
(R - кратчайшее межионное расстояние , А - константа Маделунга , зависящая от геометрии структуры , В и r - параметры , описывающие отталкивание между частицами , C/R6 и D/R8 характеризуют соответствующие диполь-дипольное и диполь-квадрупольное взаимодействие ионов , E 0 - энергия нулевых колебаний , е - заряд электрона ). С укрупнением катиона возрастает вклад диполь-дипольных взаимодействий .
Ковалентная химическая связь обычно возникает между атомами неметаллов с одинаковой или не очень сильно различающейся электроотрицательностью. Если различие в электроотрицательности атомов, между которыми образуется химическая связь, велико (∆x превышает 1.7), то общая электронная пара практически полностью смещается к атому с большей электроотрицательностью. В результате этого образуются частицы, имеющие заряды – положительно и отрицательно заряженные ионы с устойчивой электронной конфигурацией атомов ближайшего благородного газа. Противоположно заряженные ионы прочно удерживаются силами электростатического притяжения – между ними возникает химическая связь, которая называется ионной.
Ионная связь, как правило, возникает между атомами типичных металлов и типичных неметаллов. Характерным свойством атомов металлов является то, что они легко отдают свои валентные электроны, тогда как атомы неметаллов способны легко их присоединять.
Рассмотрим возникновение ионной связи, например, между атомами натрия и атомами хлора в хлориде натрия NaCl.
Отрыв электрона от атома натрия приводит к образованию положительно заряженного иона – катиона натрия Na + .
Присоединение электрона к атому хлора приводит к образованию отрицательно заряженного иона – аниона хлора Cl — .
Между образовавшимися ионами Na + и Cl — , имеющими противоположный заряд, возникает электростатическое притяжение, в результате которого образуется соединение – хлорид натрия с ионным типом химической связи.
Ионная связь – это химическая связь, которая осуществляется за счет электростатического взаимодействия противоположно заряженных ионов.
Таким образом, процесс образования ионной связи сводится к переходу электронов от атомов натрия к атомам хлора с образованием противоположно заряженных ионов, имеющих завершенные электронные конфигурации внешних слоев.
Экспериментально установлено, что в действительности электроны не отрываются полностью от атома металла, а лишь смещаются в сторону атома хлора. Это смещение тем значительней, чем больше разность электроотрицательностей атомов, между которыми образуется ионная связь. Однако даже в случае фторида цезия CsF, в котором разность электроотрицательностей превышает 3.0, заряд атома цезия не равен 1+. Это означает, что электрон атома цезия не полностью переходит к атому фтора. В случае других соединений, для которых разность электроотрицательностей не так велика, смещение электрона еще меньше, и поэтому следует говорить об ионной химической связи с определенной долей ковалентной.
Соединения, в которых вклад ионной связи значителен, принято называть ионными. Большинство бинарных соединений, содержащих атомы металлов, являются ионными, т. е. в них химическая связь в значительной степени ионная. К числу таких соединений относятся галогениды, оксиды, сульфиды, нитриды и др.
Ионная связь возникает не только между простыми катионами и простыми анионами типа F — , Cl — , F 2- , но и между простыми катионами и сложными анионами типа NO 3 — , NO 4 2- , NO 4 3- или гидроксид-ионами ОН — . Подавляющее большинство солей и оснований являются ионными соединениями, например Na 2 SO 4 , Cu(NO 3) 2 , Mg(OH) 2 . Существуют ионные соединения, в состав которых входят сложные катионы, не содержащие атомы металла, например ион аммония NH 4 + , а также соединения, в которых сложными являются и катион, и анион, например сульфат аммония (NH 4) 2 SO 4 .
Вам необходимо включить JavaScript, чтобы проголосоватьСуществуют различные виды химической связи. Среди них ковалентная, металлическая, Ван-дер-ваальсова, водородная и ионная. Давайте выясним, что такое ионная связь и ее свойства каковы.
Осуществляемая путем перехода общей пары электрона от одного атома, менее электроотрицательного, к другому, более электроотрицательному, -вот что такое ионная связь. Примеры соединений, образованных ею, можно объединить общей особенностью - содержанием в соединении атомов с сильной электроотрицательностью и атомов металлов.
Атом металла без особого труда отдает электрон и становится катионом. А электроотрицательный атом, такой как атом галогена, легко принимает электрон, образуя отрицательно заряженный ион. Эти заряженные частицы - анионы и катионы - и образуют ту, которая имеет название "ионная связь". Примеры ее - это хлорид натрия, иодид лития и другие галоиды металлов (в основном щелочных).
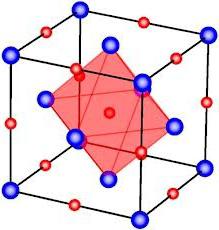 Но соединение не может быть образовано одной только ионной связью. Причиной этого является нескомпенсированность и отталкивания. Поэтому стоит говорить только о преимущественной ионной связи, тогда как наряду с ней есть и другая химическая связь. Это крайне важно знать.
Но соединение не может быть образовано одной только ионной связью. Причиной этого является нескомпенсированность и отталкивания. Поэтому стоит говорить только о преимущественной ионной связи, тогда как наряду с ней есть и другая химическая связь. Это крайне важно знать.
Не имеет свойств направленности и насыщаемости ионная связь. Примеры связей с направленностью и насыщаемостью - ковалентная, донорно-акцепторная связи. Ненасыщаемость и ненаправленность ионной проявляется потому, что при присоединении ионов с другим зарядом не происходит полная компенсация заряда. Могут быть присоединены и другие противоположнозаряженные ионы и так далее. именно поэтому вокруг иона располагается максимально возможное число подобных ему, но с другим знаком. Однако это число ограничено ввиду взаимного отталкивания ионов одинаково заряженных. Равновесие достигается при их определенном взаимном расположении, которое характеризуется координационным числом. Этот показатель зависит от соотношения радиусов ионов. Вещества с ионной связью зачастую имеют координацию куба или октаэдра и представляют собой кристаллы.
Так, кристалл поваренной соли - хлорид натрия - имеет кубическую решетку. В нем каждый ион хлора связан с шестью ионами натрия и каждый ион натрия - с шестью ионами хлора.
В оксидах щелочных и также наблюдается ионная связь. Примеры таких соединений: оксид кальция, оксид натрия и другие. Ионы могут состоять не только из одного атома, а из нескольких. Внутри такого сложного иона другая, а между самими ионами - ионная связь. Примеры: соли типа сульфата калия (здесь калий - катион, сульфат-ион - анион).
Следует также отметить, что свойства ионов веществ сильно разнятся со свойствами атомов и молекул этих веществ. Так, например, ионы хлора, входящие в состав хлорида натрия, не имеют цвета и запаха и пригодны в пищу, тогда как молекулярный хлор - зеленовато-желтый газ с резким запахом - является ядом. А атомы натрия с водой реагируют со взрывом, ионы же свободно растворяются.
- Зависимость скорости ферментативной реакции от температуры, pH и времени инкубации Как влияет температура на рн
- Зависимость скорости ферментативной реакции от температуры, pH и времени инкубации Ph от температуры
- Святые богоотцы иоаким и анна Иоаким и анна когда почитание
- Храм святой великомученицы екатерины в риме
- Численность последователей основных религий и неверующих
- Абсолютные и относительные координаты Что называется абсолютными координатами точек
- Какие меры относились к политике военного коммунизма

 Live Journal
Live Journal Facebook
Facebook Twitter
Twitter