Степень окисления как. Учимся определять валентность и степень окисления. В молекулах простых веществ: O2, S8 равна двум

В школе химия до сих пор занимает место одного из самых сложных предметов, который, ввиду того, что скрывает множество затруднений, вызывает у учеников (обычно это в период с 8 по 9 классы) больше ненависти и безразличия к изучению, чем интереса. Всё это снижает качество и количество знаний по предмету, хотя во многих сферах по сей день требуются специалисты в этой области. Да, сложных моментов и непонятных правил в химии иногда даже больше, чем кажется. Один из вопросов, которые волнуют большинство учеников, это что такое степень окисления и как определять степени окисления элементов.
Понятия окислителя и восстановителя являются относительными, поскольку вещество, которое действует как окислитель при восстановлении, может сделать это как уменьшение в другом. Окислитель и его восстановленная форма, или восстановитель и его окисленная форма образуют пару окислительно-восстановительных конъюгатов. Восстановленной формой окислителя является конъюгированный восстановитель, а окисленная форма восстанавливающего агента представляет собой конъюгированный окислитель. Чем сильнее слабый окислитель является его конъюгатным восстановителем, тем сильнее слабый восстановитель является его конъюгированным окислителем и наоборот.
Важное правило — правило расстановки, алгоритмы
Здесь много говорится о таких соединениях, как оксиды. Для начала, любой ученик должен выучить определение оксидов - это сложные соединения из двух элементов, в их составе находится кислород. К классу бинарных соединений оксиды относят по той причине, что в алгоритме кислород стоит вторым по очереди. При определении показателя важно знать правила расстановки и рассчитать алгоритм.
Окислительным числом элемента в соединении является электрический заряд, который был бы назначен ему, если бы электроны каждой из образованных им связей принадлежали исключительно самому электроотрицательному атому. В случае чисто ионных соединений число окисления каждого атома совпадает с зарядом его иона.
В окислительно-восстановительной реакции число окисления промежуточных видов изменяется. Элемент окисляется, когда его количество окисления увеличивается, т.е. переходит от восстановленной формы к более окисленной. Элемент уменьшается при уменьшении его количества окисления, т.е. от одной окисленной формы до меньшей.
- Окисление - это процесс, при котором вид увеличивает его число окисления.
- Сокращение - это процесс, при котором вид уменьшает его количество окисления.
Алгоритмы для кислотных оксидов
Степени окисления - это численные выражения валентности элементов. К примеру, кислотные оксиды образованы по определённому алгоритму: сначала идут неметаллы или металлы (их валентность обычно от 4 до 7), а после идёт кислород, как и должно быть, вторым по порядку, его валентность равняется двум. Определяется она легко - по периодической таблице химических элементов Менделеева. Также важно знать то, что степень окисления элементов - это показатель, который предполагает либо положительное, либо отрицательное число .
В начале алгоритма, как правило, неметалл, и его степень окисления - положительная. Неметалл кислород в оксидных соединениях имеет стабильное значение, которое равняется -2. Чтобы определить верность расстановки всех значений, нужно умножить все имеющиеся цифры на индексы у одного конкретного элемента, если произведение с учётом всех минусов и плюсов равняется 0, то расстановка достоверна.
Расстановка в кислотах, содержащих кислород
 Кислоты являются сложными веществами
, они связаны с каким-либо кислотным остатком и содержат в себе один или несколько атомов водорода. Здесь, для вычисления степени, требуются навыки в математике, так как показатели, необходимые для вычисления, цифровые. У водорода или протона он всегда одинаков — +1. У отрицательного иона кислорода отрицательная степень окисления -2.
Кислоты являются сложными веществами
, они связаны с каким-либо кислотным остатком и содержат в себе один или несколько атомов водорода. Здесь, для вычисления степени, требуются навыки в математике, так как показатели, необходимые для вычисления, цифровые. У водорода или протона он всегда одинаков — +1. У отрицательного иона кислорода отрицательная степень окисления -2.
После проведения всех этих действий можно определить степень окисления и центрального элемента формулы. Выражение для её вычисления представляет собой формулу в виде уравнения. Например, для серной кислоты уравнение будет с одним неизвестным.
Основные термины в ОВР
ОВР — это восстановительно-окислительные реакции .
- Степень окисления любого атома - характеризует способность этого атома присоединять или отдавать другим атомам электроны ионов (или атомов);
- Принято считать окислителями либо заряженные атомы, либо незаряженные ионы;
- Восстановителем в этом случае будут заряженные ионы или же, напротив, незаряженные атомы, которые теряют свои электроны в процессе химического взаимодействия;
- Окисление заключается в отдаче электронов.
Как расставлять степень окисления в солях
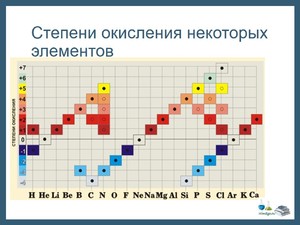 Соли состоят из одного металла и одного или нескольких кислотных остатков. Методика определения такая же, как и в кислотосодержащих кислотах.
Соли состоят из одного металла и одного или нескольких кислотных остатков. Методика определения такая же, как и в кислотосодержащих кислотах.
Металл, который непосредственно образует соль, располагается в главной подгруппе, его степень будет равна номеру его группы, то есть всегда будет оставаться стабильным, положительным показателем.
В качестве примера можно рассмотреть расстановку степеней окисления в нитрате натрия. Соль образуется с помощью элемента главной подгруппы 1 группы, соответственно, степень окисления будет являться положительной и равна единице. В нитратах кислород имеет одного значение — -2. Для того чтобы получить численное значение, для начала составляется уравнение с одним неизвестным, учитывая все минусы и плюсы у значений: +1+Х-6=0. Решив уравнение, можно прийти к тому факту, что численный показатель положителен и равен + 5. Это показатель азота. Важный ключ чтобы высчитать степень окисления — таблица .
Правило расстановки в основных оксидах
- Оксиды типичных металлов в любых соединениях имеют стабильный показатель окисления, он всегда не больше +1, или в других случаях +2;
- Цифровой показатель металла вычисляется при помощи периодической таблицы. Если элемент содержится в главной подгруппе 1 группы, то его значение будет +1;
- Значение оксидов, учитывая и их индексы, после умножения суммировано должны быть равны нулю, т.к. молекула в них нейтральна, частица, лишённая заряда;
- Металлы основной подгруппы 2 группы также имеют устойчивый положительный показатель, который равен +2.
Степени окисления в органических соединениях требуется уметь расставлять для решения заданий ЕГЭ по химии, в которых дается цепочка превращений органических веществ, часть из которых неизвестна. На данный момент это задания номер 32.
Для определения степени окисления в органических соединениях существует два метода. Суть их одинакова, но выглядят применение данных методов по-разному.
Первый способ я бы назвал методом блоков.
Метод блоков
Берем органическую молекулу, например, такого вещества, как 2-гидроксипропаналь
и изолируем друг от друга все фрагменты молекулы, содержащие по одному атому углерода следующим образом:
Суммарный заряд каждого такого блока принимаем равным нулю, как у отдельной молекулы. В органических соединениях водород всегда имеет степень окисления, равную +1, а кислород — -2. Обозначим степень окисления атома углерода в первом блоке переменной х. Таким образом, мы можем найти степень окисления первого атома углерода, решив уравнение:
x + 3∙(+1) = 0, где x – степень окисления атома углерода, +1 – степень окисления атома водорода, а 0 – заряд выбранного блока.
x + 3 = 0, отсюда x = -3.
Таким образом, степень окисления атома углерода в первом блоке равна -3.
Во второй блок, помимо одного атома углерода и двух атомов водорода, входит также и атом кислорода, который, как мы уже сказали, имеет в органических соединениях практически всегда степень окисления, равную -2. Как и в первом случае, обозначим степень окисления атома углерода второго блока через х, тогда получим следующее уравнение:
x+2∙(+1)+(-2) = 0, решая которое находим, что х = 0. Т.е. степень окисления второго атома углерода в молекуле равна нулю.
Третий блок состоит из одного атома углерода, одного атома водорода и двух атомов кислорода. Аналогично составим уравнение:
x +1∙(-2)+ 1 = 0, отсюда х, то есть степень окисления атома углерода в третьем блоке равна +1.
Второй метод расстановки степеней окисления в органических веществах я называю «метод стрелок».
Метод стрелок
Для того, чтобы его использовать, нужно нарисовать сначала развернутую структурную формулу органического вещества:
Под черточками между символами элементов понимают их общие электронные пары, которые между одинаковыми атомами можно считать распределенными поровну, а между разными – смещенными к одному из атомов, обладающему большей электроотрицательностью. Среди трех элементов С, Н и О наибольшую элетроотрицательность имеет кислород, затем углерод, а самое малое значение электроотрицательности у водорода. Поэтому, если показать стрелочкой смешение электронов в сторону более электроотрицательных атомов, мы получим следующую картинку:
Как можно заметить, между атомами углерода мы не стали рисовать стрелку, оставив обычную черточку, поскольку считается, что общая электронная пара между двумя атомами углерода практически не смещена ни к одному из них.
Будет интерпретировать последний рисунок следующим образом: каждый атом, из которого стрелка исходит, «теряет» один электрон, а каждый атом, в который стрелка входит, «принимает» электрон. При этом помним, что заряд электрона отрицателен и равен -1.
Таким образом, первому атому углерода достается от трех атомов водорода по одному электрону (три входящих стрелки), в результате чего он приобретает условный заряд, т.е. степень окисления, равную -3, а каждый атома водорода — +1 (по одной исходящей стрелке).
Второму атому углерода достается от «верхнего» атома водорода один электрон (стрелка от H к С), и еще один электрон атом углерода «теряет», передавая его атому кислорода (стрелка от С к О). Таким образом, в атом углерода «входит» один электрон и один из него «выходит». Поэтому степень окисления второго атома углерода равна 0, как в отдельном атоме.
К атому кислорода направлены две стрелки, значит, он имеет степень окисления, равную -2, а от всех атомов водорода исходит по одной стрелке. То есть степень окисления всех атомов водорода равна +1.
В последний атом углерода входит одна стрелка от Н и исходит две стрелки к О, таким образом, «входит» один электрон и «выходят» два. Значит, степень окисления равна +1.
Нужно отметить, что на самом деле оба описанных метода весьма условны, как, собственно, и условно само понятие «степень окисления» в случае органических веществ. Тем не менее, в рамках школьной программы данные методы вполне справедливы и, главное, позволяют использовать их при расстановке коэффициентов в реакциях ОВР с органическими веществами. Лично мне нравится больше метод «стрелок». Советую усвоить оба метода: одним из них вы можете определять степени окисления, а вторым — убедиться в правильности полученных значений.
- Манная каша на молоке: пропорции и рецепты приготовления Манная каша 1 порция
- Суп-пюре из брокколи с сыром Рецепт крем супа из брокколи с сыром
- Гороскоп: характеристика Девы, рождённой в год Петуха
- Причины выброса токсичных веществ Несгораемые углеводороды и сажа
- Современный этап развития человечества
- Лилия яковлевна амарфий Могила лилии амарфий
- Значение имени мариям Имя марьям значение происхождение

 Live Journal
Live Journal Facebook
Facebook Twitter
Twitter