Гибридизация атомных орбиталей углерода в молекулах алканов. Номенклатура насыщенных углеводородов, их производные. Алканы: химические свойства
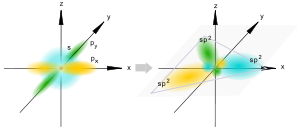
Гибридизация – выравнивание (смешивание) атомных орбиталей (s и р ) с образованием новых атомных орбиталей, называемых гибридными орбиталями .
Атомная орбиталь – это функция, которая описывает плотность электронного облака в каждой точке пространства вокруг ядра атома. Электронное облако – это область пространства, в которой с высокой вероятностью может быть обнаружен электрон
В этой реакции вполне возможно определить положение двойной связи, хотя это не стереоспецифическая реакция, поскольку она не указывает, какой из них является основным изомером. Смесь цис - и транс-изомеров обычно получают здесь, поскольку, когда карбонильное соединение подходит к соединению фосфора, его можно сделать спереди или сзади. Один первичный и один вторичный. Реакция происходит естественным путем через более стабильное промежуточное соединение, так как оно имеет самую низкую энергию и, следовательно, самую быструю.
Затем галогенид связывается с этим карбокатионом, давая в качестве продукта один алкилгалогенид, а не смесь. Добавление всегда происходит одинаково, т.е. имеет конкретную или региохимическую ориентацию. Этот факт был обнаружен российским химиком Марковниковым и известен как правило Марковникова. Механизм добавления галогена к двойной связи показывает, что оба атома галогена входят с противоположных сторон. Образование циклического промежуточного продукта на этой стадии предотвращает возможность поступления второго атома галогена на ту же сторону.
Sp-гибридизация
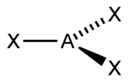
Происходит при смешивании одной s- и одной p-орбиталей. Образуются две равноценные sp-атомные орбитали, расположенные линейно под углом 180 градусов и направленные в разные стороны от ядра центрального атома. Две оставшиеся негибридные p-орбитали располагаются во взаимно перпендикулярных плоскостях и участвуют в образовании π-связей, либо занимаются неподелёнными парами электронов.
Другим примером того, что добавление галогена к двойной связи является анти, можно видеть ниже, где показана стереохимия реакции. На второй стадии бромид нуклеофильно атакует наиболее замещенный углерод, поскольку он является наиболее подходящим для электронного дефицита, вызванного атакой поляризованного брома.
Эта реакция представляет собой региохимию, и добавление реагентов является анти. С одной стороны - галоген, а с другой стороны - вода. Здесь побеждающий нуклеофил представляет собой воду, потому что он является растворителем, и поэтому его концентрация в реакции в подавляющем большинстве больше, чем концентрация бромида. Эта реакция является региохимической, но обратной к показанной Марковниковым.
Sp2-гибридизация

Sp2-гибридизация

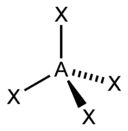
Происходит при смешивании одной s- и двух p-орбиталей. Образуются три гибридные орбитали с осями, расположенными в одной плоскости и направленными к вершинам треугольника под углом 120 градусов. Негибридная p-атомная орбиталь перпендикулярна плоскости и, как правило, участвует в образовании π-связей
Он ориентирован таким образом из-за стабильности свободных радикалов. На начальной стадии образуется алкоксидный радикал, который быстро реагирует с молекулой бромистоводородной кислоты с образованием молекулы спирта и бромидного радикала. Бромид имеет две альтернативы при взаимодействии с алкеном. Они представлены дорожками и в схеме №.
Возможность образования обоих радикалов реальна, но более стабильное пространство будет формироваться более быстро, и конечный шаг приведет к образованию большого количества продукта, описанного на следующем шаге. Другой путь приведет к продукту, который в этом случае не будет больше примеси в конечном продукте реакции.
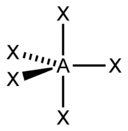
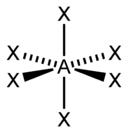
В таблице приведены примеры соответствия наиболее распространённых типов гибридизации и геометрической структуры молекул в предположении, что все гибридные орбитали участвуют в образовании химических связей (отсутствуют неподелённые электронные пары)
|
Тип гибридизации Реакция присоединения Антимарковников Схема №11. Поскольку эта реакция протекает через посредника по карбокации, часто можно видеть перегруппировки углеродного скелета и, следовательно, достигать другого продукта, чем ожидалось. Это проблема, которая возникает во всех реакциях с карбокациями. Нападение протона будет на тот углерод, который может обеспечить наиболее стабильный способ передвижения на этом этапе. Этот посредник лучше вмещает положительный заряд в наиболее замещенный углерод, и поэтому нуклеофильная атака воды происходит только в этом месте, давая продукт. |
Число гибридных орбиталей |
Геометрия |
Структура |
Примеры |
|
Линейная |
Поскольку добавление реагента происходит на той же стороне, говорят, что имеет добавление Син. Короче это Антимарковников. Механизм этой реакции заключается в следующем. Эту стадию повторяют с каждым гидридом боргидрида до достижения. В котором три гидрида гидрида бора реагировали с тремя молекулами алкена. То есть один моль гидрида бора способен реагировать с тремя молями алкена. Ниже приведен подробный анализ того, что происходит на последней стадии, то есть окисление перекисью водорода в щелочной среде. Реакция между перекисью водорода и гидроксидом натрия, представляющим щелочную среду, является простой кислотно-щелочной реакции, где пероксид действует как кислота. |
BeF 2 , CO 2 , NO 2 + |
||
|
sp 2 |
Треугольная |
|
BF 3 , NO 3 - , CO 3 2- |
|
|
sp 3 |
Тетраэдрическая Этот нуклеофил быстро нападает на атом бора триалкилборана, тесно связанный с ним. Быстро сформированное соединение перестраивается, чтобы сохранить атом бора, который теперь связан с кислородом, а это, в свою очередь, к углероду. Это перегруппировка, которая не включает алкильный радикал, и поэтому окружающие ее атомы сохраняют свои относительные положения. Последний шаг повторяют дважды, каждый раз на каждой из алкильных групп триалкилборана. Затем конечная обработка перекисью водорода в щелочной среде в том же контейнере приводит к образованию трех молей спирта. Реакция окисления не протекает дальше. Озон быстро образует нестабильный химический вид, называемый молозонидом, перед алкеном, который перестраивается на более устойчивые или озонидные виды. Как можно видеть, гидролиз озонида водой дает альдегиды и кетоны в зависимости от случая, но в качестве побочного продукта реакции образуется также перекись окисления. |
|
CH 4 , ClO 4 - , SO 4 2- , NH 4 + |
|
|
dsp 2 |
Плоскоквадратная |
Перманганат калия в кислой среде является сильным окислителем, так что процесс окисления алкена не прекращается с образованием альдегида, но продолжает давать карбоновые кислоты. Обычно его используют в нейтральных растворах. Когда алкен является терминальным, в дополнение к карбоновой кислоте, если он является монозамещенным или кетоном, если он представляет собой дизамещенный геминал, получается диоксид углерода. В этой холодной реакции образуется гликоль. Химия эпоксидных смол относится к основным свойствам алкенов. Синтез эпоксидов. Эти соединения легко получают реакцией эпоксидирования. Он состоит из реакции пероксикислоты, среди которой пероксиуксусная кислота является наиболее распространенным реагентом в реакциях такого типа. |
Ni(CO) 4 , 2- |
|
|
sp 3 d |
Гексаэдрическая |
| ||
|
sp 3 d 2 , d 2 sp 3 |
Октаэдрическая Растворителем этой реакции может быть уксусная кислота. Логическим дополнением к образованию циклических эфиров является реакция открытия. В этом случае нуклеофильная атака основания находится на менее стерически затрудненном углероде. При обсуждении галогенирования алканов в третьей главе было замечено, что это реакция замещения, в которой участвуют свободные радикалы. В свете этого фона сразу возникает вопрос: если оба процесса галогенирования происходят через. Общий промежуточный продукт и, кроме того, генерируется таким же образом, можно ли тогда направить галогенирование к добавлению галогена к двойной связи или к замещению, если мы начнем с субстрата, который показывает возможность обеих реакций? Например, простой алкен. Браун, профессор химии в Университете Парду, является да, при условии тщательного выбора условий эксперимента. Он говорит, например, что: реакция присоединения к двойной связи происходит всякий раз, когда в реакции наблюдается значительная концентрация галогена. |
|
SF 6 , Fe(CN) 6 3- , CoF 6 3- |
4. Электровалентная, ковалентная, донорно-акцепторная, водородная связи. Электронное строение σ и π связи. Основные характеристики ковалентной связи: энергия связи, длина, валентный угол, полярность, поляризуемость.
Следовательно, если промежуточное звено не быстро обнаруживает молекулу галогена, оно будет возвращено к реагентам, что приведет к реакции замещения. Поскольку это реакция, стимулируемая свободными радикалами, должен использоваться аполярный растворитель, который помогает их генерировать, например, четыреххлористый углерод. Галогеном может быть хлор или бром, хотя обычно используется бром, и его концентрация будет зависеть от типа реакции, которую мы хотим выполнить. Поэтому, если мы хотим добавить галоген в двойную связь, мы должны использовать значительную концентрацию в реакционной среде.
Если между двумя атомами или двумя группами атомов имеет место электростатическое взаимодействие приводящее к сильному притяжению и образованию химической связи, то такая связь называется электровалентной или гетерополярной.
Ковалентная связь- химическая связь, образованная перекрытием пары валентных электронных облаков. Обепечивающие связь электронные облака называется общей электронной парой.
В противном случае, если мы хотим определить приоритетность реакции замещения, мы должны обеспечить, чтобы концентрация галогена была как можно меньшей в момент реакции. Все будет зависеть от типа галогенированного производного, который нам нужен. Напомним, что галоген теоретически может реагировать с любым из присутствующих в алкене водородов, однако использование брома может обеспечить дополнительное преимущество, заключающееся в том, что он является более селективным, чем хлор.
Галогенид радикала всегда будет извлекать тот водород, энергия связи которого является наименьшим, а аллильный водород, то есть тот, который связан с углеродом рядом с двойной связью, представляет эту особенность замечательным образом. Например, в следующем алкене. Диаграмма №7. Эта реакция очень полезна в синтезе и состоит из галогенирования углерода, смежного с двойной связью.
Донорно-акцепторная связь –это химическая связь между двумя атомами или группой атомов, осуществляемая за счет неподеленной пары электронов одного атома (донора) и свободного уровня другого атома (акцептора). Это связь отличается от ковалентной связи происхождением связи электронов.
Водородная связь -это вид химического взаимодейсвия атомов в молекуле отличающийся тем, что существенное участие в нем принимает атом водорода, уже связанный ковалентной связью с другими атомами
Конечно, необходимо, чтобы этот углерод имел по крайней мере один атом водорода. Радиус брома, образующийся на начальной стадии, экстрагирует водород, более слабо связанный с молекулой, образуя в свою очередь арильный радикал и небольшое количество бромистоводородной кислоты.
Затем шаг повторяется и последовательно. Схема № 26. Полученный продукт обычно называют аддуктом или циклопродукт. Эта реакция показана очень упрощенным образом, хотя результаты этих исследований могут вполне отражать то, что происходит в действительности. Реакция между бутадиеном в виде диена и этилена в виде диенофила показывает способ, в котором вовлеченные электроны перераспределяются для одновременного получения двух новых связей. Реакция протекает согласованным образом, то есть она протекает без наблюдения за образованием какого-либо промежуточного посредника между реагентами и аддуктом.
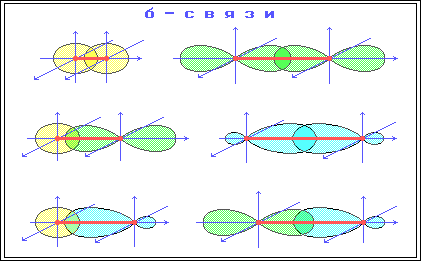
σ связь-это первая и более прочная связь, которая образуется при перекрывании электронных облаков в направлении прямой, соединяющий центры атомов.
σ связь-это обычные ковалентные связи атомов углерода с атомами водорода. Молекулы предельных углеродов содержат только σ связи.
π связь это менее прочная связь, которая образуется при перекрывании электронных плоскости атомов ядер
Какие факторы благоприятствуют этой реакции? В общем, эта реакция ускоряется наличием электронных донорных заместителей на диеновых и электронных акцепторах в диенофиле. Диенофильный репортер. электронный циклопродукт. , диенофильный репортер. электронный циклопродукт.
Ниже приведен еще один пример того, как функциональная группа может воздействовать на ориентацию между двумя молекулами. Это примеры стереоселективности, то есть молекулы реагентов будут аппроксимированы и будут присоединяться вследствие присутствия заместителей таким же образом, не производя других продуктов.
Электроны π и σ связи теряют свою принадлежность к определенному атому.
Особенности σ и π связи: 1)вращение атомов углерода в молекуле возможна в случае, если они соединены σ связью 2)появление π связи лишает атома углерода в молекуле в свободного вращения.
Длина связи- это расстояние между центрами связанных атомов.
Какую структуру может иметь диенофил? Диенофил не всегда должен быть алкеном. Это может быть ненасыщенный цикл, алкин и т.д. в последнем случае после реакции продукт сохраняет двойную связь от диенофила. По отношению к диенофилу он стереоспецифичен. Добавление диена на диенофиле имеет син-тип.
С одной стороны только плоскости двойной связи и сохранения ее стереохимии, как мы это уже видели. Другим особенным фактом этой реакции, также связанной с ее стереоселективностью, является то, что реакция диена на диенофил, помимо стереоспецифичности, имеет другое требование, которое должно предпочесть только одну из сторон плоскости, определяемую двойной связью в диенофил, и тот, который продуцирует эндо-аддукт, то есть тот, в котором электроны диенофильных заместителей максимально приближены к двойной связи, образующейся в диене.
Валентный угол- это угол между двумя связями, имеющий общий атом.
Энергия связи- энергия, выделяющаяся при образовании хим. связи и характеризующаяся ее прочность
Полярность связи обусловлена неравномерным распределением электронной плотности вследствие различий в электроотрицательностях атомов. По этому признаку ковалентные связи подразделяются на неполярные и полярные. Поляризуемость связи выражается в смещении электронов связи под влиянием внешнего электрического поля, в том числе и другой реагирующей частицы. Поляризуемость определяется подвижностью электронов. Полярность и поляризуемость ковалентных связей определяет реакционную способность молекул по отношению к полярным реагентам.
5.
Ионная связь (электровалентная)-
очень прочная химическая связь,
образующаяся между атомами с большой
разностью электроотрицательностей,
при которой общая электронная пара
переходит преимущественно к атому с
большей электроотрицательностью.
Ковалентная
связь – возникает за счет обобществления
электронной пары посредством обменного
механизма, когда каждый из взаимодействующих
атомов поставляет по одному электрону.
Донорно акцепторная связь (координационная
связь) химическая связь между двумя
атомами или группой атомов, осуществляемая
за счет неподеленной пары электронов
одного атома (донора) и свободной орбитали
другого атома (акцептора).пример NH4
Для возникновения
водородных связей важно, чтобы в молекулах
вещества были атомы водорода, связанные
с небольшими, но электроотрицательными
атомами, например: O, N, F. Это создает
заметный частичный положительный заряд
на атомах водорода. С другой стороны,
важно, чтобы у электроотрицательных
атомов были неподеленные электронные
пары. Когда обедненный электронами атом
водорода одной молекулы (акцептор)
взаимодействует с неподеленной
электронной парой на атоме N, O или F
другой молекулы (донор), то возникает
связь, похожая на полярную ковалентную.
При
образовании ковалентной связи в молекулах
органических соединений общая электронная
пара заселяет связывающие молекулярные
орбитали, имеющие более низкую энергию.
В зависимости от формы МО – σ-МО или
π-МО – образующиеся связи относят к σ-
или p-типу.
σ-Связь
– ковалентная связь, образованная при
перекрывании s-, p- и гибридных АО вдоль
оси, соединяющей ядра связываемых атомов
(т. е. при осевом перекрывании АО) .
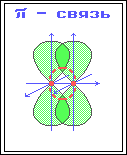
π-Связь
– ковалентная связь, возникающая при
боковом перекрывании негибридных р-АО.
Такое перекрывание происходит вне
прямой, соединяющей ядра атомов.
 π-Связи
возникают между атомами, уже соединенными
σ-связью (при этом образуются двойные
и тройные ковалентные связи) . π-Связь
слабее σ-связи из-за менее полного
перекрывания р-АО.
π-Связи
возникают между атомами, уже соединенными
σ-связью (при этом образуются двойные
и тройные ковалентные связи) . π-Связь
слабее σ-связи из-за менее полного
перекрывания р-АО.
 Различное
строение σ- и π-молекулярных орбиталей
определяет характерные особенности σ-
и π-связей.
1.σ-Связь
прочнее π-связи. Это обусловлено более
эффективным осевым перекрыванием АО
при образовании σ-МО и нахождением
σ-электронов между ядрами.
2.По
σ-связям возможно внутримолекулярное
вращение атомов, т. к. форма σ-МО допускает
такое вращение без разрыва связи (cм
аним. Картинку внизу)) . Вращение по
двойной (σ + π) связи невозможно без
разрыва π-связи!
3.Электроны
на π-МО, находясь вне межъядерного
пространства, обладают большей
подвижностью по сравнению с σ-электронами.
Поэтому поляризуемость π-связи значительно
выше, чем σ-связи.
Различное
строение σ- и π-молекулярных орбиталей
определяет характерные особенности σ-
и π-связей.
1.σ-Связь
прочнее π-связи. Это обусловлено более
эффективным осевым перекрыванием АО
при образовании σ-МО и нахождением
σ-электронов между ядрами.
2.По
σ-связям возможно внутримолекулярное
вращение атомов, т. к. форма σ-МО допускает
такое вращение без разрыва связи (cм
аним. Картинку внизу)) . Вращение по
двойной (σ + π) связи невозможно без
разрыва π-связи!
3.Электроны
на π-МО, находясь вне межъядерного
пространства, обладают большей
подвижностью по сравнению с σ-электронами.
Поэтому поляризуемость π-связи значительно
выше, чем σ-связи.
Характерные свойства ковалентной связи - направленность, насыщаемость, полярность, поляризуемость - определяют химические и физические свойства соединений.
Направленность связи обусловлена молекулярным строением вещества и геометрической формы их молекулы. Углы между двумя связями называют валентными.
Насыщаемость - способность атомов образовывать ограниченное число ковалентных связей. Количество связей, образуемых атомом, ограничено числом его внешних атомных орбиталей.
Полярность связи обусловлена неравномерным распределением электронной плотности вследствие различий в электроотрицательностях атомов. По этому признаку ковалентные связи подразделяются на неполярные и полярные (неполярные - двухатомная молекула состоит из одинаковых атомов (H 2 , Cl 2 , N 2) и электронные облака каждого атома распределяются симметрично относительно этих атомов; полярные - двухатомная молекула состоит из атомов разных химических элементов, и общее электронное облако смещается в сторону одного из атомов, образуя тем самым асимметрию распределения электрического заряда в молекуле, порождаядипольный момент молекулы).
Поляризуемость связи выражается в смещении электронов связи под влиянием внешнего электрического поля, в том числе и другой реагирующей частицы. Поляризуемость определяется подвижностью электронов. Полярность и поляризуемость ковалентных связей определяет реакционную способность молекул по отношению к полярным реагентам.
6.Номенклатура представляет собой систему правил, позволяющих дать однозначное название каждому индивидуальному соединению. Для медицины знание общих правил номенклатуры имеет особенно большое значение, так как в соответствии с ними строятся названия многочисленных лекарственных средств. В настоящее время общепринята систематическая номенклатура ИЮПАК (IUPAC - Международный союз теоретической и прикладной химии)*.
Однако до сих пор сохраняются и широко применяются (особенно в медицине) тривиальные (обыденные) и полутривиальные названия, использовавшиеся еще до того, как становилось известным строение вещества. В этих названиях могут отражаться природные источники и способы получения, особо заметные свойства и области применения. Например, лактоза (молочный сахар) выделена из молока (от лат. lactum - молоко), пальмитиновая кислота - из пальмового масла, пировиноградная кислота получена при пиролизе виноградной кислоты, в названии глицерина отражен его сладкий вкус (от греч. glykys - сладкий).
Тривиальные названия особенно часто имеют природные соединения - аминокислоты, углеводы, алкалоиды, стероиды. Употребление некоторых укоренившихся тривиальных и полутривиальных названий разрешается правилами ИЮПАК. К таким названиям относятся, например, «глицерин» и названия многих широко известных ароматических углеводородов и их производных.
Рациональная номенклатура предельных углеводородов
В отличие от тривиальной названия основываются на строении молекул. Названия сложных структур состовляют из названия блоков те радикалов связанных с основным навиболее важным узлом молекулы по этой номенклатуре алканы рассматриваются как производные метана у которого атомы водорода замещены соответствующими радикалами. Выбор метанового углерода произвольный поэтому 1 соедин может иметь неск названий.по этой номенклатуре алкены рассматривают как производные этилена а алкины-ацетилена.
7. Гомология органических соединений или закон гомологов - состоит в том, что вещества однойхимической функции и одинакового строения, отличающиеся друг от друга по своему атомному составу лишьна nСН 2, оказываются сводными и во всем своем остальном хим. характере, а различие их физическихсвойств возрастает или вообще изменяется правильно по мере увеличения разницы в составе,определяемой числом n групп СН 2. Такие хим. сходственные соединения образуют так наз. гомологическийряд, атомный состав всех членов которого возможно выразить общею формулою в зависимости от составапервого члена ряда и числа атомов углерода; органические вещества одного названия типо алканы только.
Изомеры- соединения имеющие одинаковый состав но разное строение и свойства.
8. Нуклеоф и льные и электроф и льные реаг е нты . Участвующие в замещения реакциях реагенты подразделяются на нуклеофильные и электрофильные. Нуклеофильные реагенты, или нуклеофилы, предоставляют свою паруэлектронов на образование новой связи и вытесняют из молекулы RX уходящую группу (X) с парой электронов, образовывавшей старую связь, например:
(где R - органический радикал).
К нуклеофилам относятся отрицательно заряженные ионы (Hal - , ОН - , CN - , NO 2 - , OR - , RS - , NH 2 - , RCOO - и др.), нейтральные молекулы, обладающие свободной парой электронов (например, Н 2 О, NH3, R 3 N, R 2 S, R 3 P, ROH, RCOOH), и металлоорганич. соединения R - Me с достаточно поляризованной связью С - Me + , т. е. способные быть донорами карбанионов R - . Реакции с участием нуклеофилов (нуклеофильное замещение) характерны главным образом Для алифатических соединений, например гидролиз (ОН - , Н 2 О), алкоголиз (RO - , ROH), ацидолиз (RCOO - , RСООН), аминирование (NH - 2 , NH 3 , RNH 2 и др.), цианирование (CN -) и т. д.
Электрофильные реагенты, или электрофилы, при образовании новой связи служат акцепторами пары электронов и вытесняют уходящую группу в виде положительно заряженной частицы. К электрофилам относятся положительно заряженные ионы (например, Н + , NO 2 +), нейтральные молекулы с электронным дефицитом, например SO 3 , и сильно поляризованные молекулы (СН 3 СОО - Br + и др.), причём поляризация особенно эффективно достигаетсякомплексообразованием с коэффициентами Льюиса (Hal + - Hal - · А, R + - Cl - · A, RCO + - Cl - · А, где A= A1C1 3 , SbCl 5 , BF 3 и др.). К реакциям с участием электрофилов (электрофильное замещение) относятся важнейшие реакцииароматических углеводородов (например, нитрование, галогенирование, сульфирование, реакция Фриделя - Крафтса):
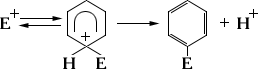
(E + = Hal + , NO + 2 , RCO + , R + и др.)
В определённых системах реакции с участием нуклеофилов осуществляются в ароматическом ряду, а реакции с участием электрофилов - в алифатическом (чаще всего в ряду металлоорганических соединений).
53. взаимодействие оксосоединений с металлорганическими (кетон или альдегид плюс металорганика)
Реакции широко используются для получения спиртов.при присоединении к формальдегиду реактива гриньяра(R-MgX) образуется первичный спирт, другим альдегидом вторичные, а кетонам тритичные спирты
- Манная каша на молоке: пропорции и рецепты приготовления Манная каша 1 порция
- Суп-пюре из брокколи с сыром Рецепт крем супа из брокколи с сыром
- Гороскоп: характеристика Девы, рождённой в год Петуха
- Причины выброса токсичных веществ Несгораемые углеводороды и сажа
- Современный этап развития человечества
- Лилия яковлевна амарфий Могила лилии амарфий
- Значение имени мариям Имя марьям значение происхождение

 Live Journal
Live Journal Facebook
Facebook Twitter
Twitter