В бинарном соединении суммарная валентность всех атомов одного элемента равна суммарной валентности всех атомов другого элемента. Валентность. Определение валентности. Элементы с постоянной валентностью
Понятие «валентность» применимо только к ковалентным соединениям. К ионным соединениям неприменимы понятия «валентность» и «молекула».
Степень окисления. Более универсальной характеристикой состояния атома в химическом соединении является степень окисления.
При определении степени окисления атомов предполагают, что все общие электронные
пары перешли к более электроотрицатальному атому. На самом деле такого полного смещения не происходит даже при взаимодействии элементов с большой разницей в электроотрицательности.
Однако условно считают такое смещение электронных пар полным не зависимо от реальной степени смещения.
Численное значение этой характеристики выражается в единицах заряда электрона и может иметь положительное, отрицательное и нулевое значение.
Количественно степень окисления определяется числом валентных электронов, смещенных от менее электроотрицательного атома в химическом соединении (положительная степень окисления) к более электроотрицательному атому (отрицательная степень окисления). Во многих случаях степень окисления численно совпадает с валентностью. Но так бывает не всегда.
Например, в молекуле азота степень окисления равна 0, так как между атомами азота
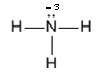
В молекуле гидразина химическая связь между атомами азота ковалентная неполярная, поэтому смещения общей электронной пары не происходит. Связь между атомами водорода и азота ковалентная полярная, у азота электроотрицательность выше, поэтому к каждому атому азота смещается по две общих электронных пары от атомов водорода, поэтому степень окисления азота равна – 2. Валентность же азота, как и в предыдущем случае равна III, так как атом азота образует три химические связи.В молекуле аммиака связи между атомом азота и атомами водорода ковалентные полярные, электроотрицательность азота выше, чем водорода, поэтому к атому азота от атомов водорода смещены три общие электронные пары. Следовательно, степень окисления азота в этом случае равна – 3. Валентность азота по-прежнему равна III.

Только в последнем случае значение валентности и степени окисления совпадают (по модулю). Из выше сказанного можно сделать вывод, что значение валентности и степени окисления по модулю не совпадают, если вещество содержит ковалентные неполярные связи.
Поэтому при определении степени окисления атома в соединении рекомендуется в структурных формулах электронные пары, которые в равной мере приналежато двум атомам, изображать черточкой, а те, которые смещены к атому более электроотрицательного элемента, - стрелкой. Например, в молекуле пероксида водорода Н 2 О 2 степень окисления кислорода равна –1, а валентность II:
| Выводы: |
1. Валентность – это способность атомов химического элемента образовывать определенное количество ковалентных связей (общих электронных пар)
2. У валентности нет заряда.
3. Валентность зависит от количества неспаренных электронов.
4. Степень окисления это условный заряд атома в химическом соединении, если предположить, что оно состоит из ионов.
5. Положительная степень окисления равна количеству отданных электронов, отрицательная степень окисления равна количеству принятых электронов.
6. Как правило, значение степени окисления и валентности совпадают по модулю. Этого не происходит только в том случае, если в веществе есть ковалентная неполярная связь.
Анализируя состав и строение веществ, образованных одним и тем же элементом, нетрудно убедиться, что большинство элементов могут иметь несколько разных значений валентности, т. е. обладают переменной валентностью.
Например, угарныйгаз СО образуется при сгорании веществ, содержащих углерод, в условиях недостаточного притока воздуха. В этом оксиде углерод двухвалентен, так как валентность кислорода равна II. Если же кислорода будет избыточное количество, то образуется углекислый газ СО 2 , в котором углерод четырехвалентен.
Рассмотрим строение атома кислорода и попытаемся объяснить, почему кислород в соединениях проявляет валентность равную II. Кислород – элемент главной подгруппы VI группы. Электронная конфигурация кислорода 1s 2 2s 2 2p 4 . Валентные электроны –2s 2 2p 4:
Из электронно-графической схемы последнего энергетического уровня кислорода следует, что атом кислорода имеет два неспаренных электрона, а значит, он может образовать только две общие электронные пары (химические связи) с другими атомами, поэтому проявляет валентность равную II.
Углерод – элемент главной подгруппы IVгруппы. Электронная конфигурация углерода
1s 2 2s 2 2p 2 . Валентные электроны – 2s 2 2p 2:
Атом углерода содержит два неспаренных электрона, а значит, он может образовать только две общие электронные пары (химические связи) с другими атомами, поэтому проявляет валентность равную II. Однако этот элемент в своих соединениях проявляет, кроме валентности II, валентность IV. Значит, в атоме углерода должно быть не два, а четыре неспаренных электрона. Они появляются в результате распаривания пары 2s -электронов: один из электронов, получив порцию энергии, переходит на вакантную (свободную)
p -орбиталь.
Процесс перехода электрона с одной орбитали на другую (в пределах одного энергетического уровня) называют возбуждение атома. Возбужденное состояние атома обозначают звездочкой сверху после знака элемента.
Таким образом, для углерода характерны валентности II и IV.
Обратите внимание, что в атомах водорода и кислорода нет вакантных орбиталей. Поэтому распаривание пар 2s - и 2p- электронов невозможно, эти элементы проявляют постоянную валентность.
В любом случае у элементов второго периода максимальная валентность не может быть больше четырех, так как на внешнем энергетическом уровне у атомов этих элементов всего четыре орбитали, и следовательно, атомы максимально могут образовать не больше четырех ковалентных связей.
Сера , как и кислород, – элемент главной подгруппы VI группы, но находится в третьем периоде. Электронная конфигурация кислорода 1s 2 2s 2 2p 6 3s 2 3p 4 . Валентные электроны – 3s 2 3p 4:

3s 2 3p 4 → 3s 2 3p 3 3d 1


В результате этого общее количество неспаренных электронов увеличивается до четырех. В таком состоянии атом серы четырехвалентен.
При поглощении дополнительной энергии распаривается и вторая пара электронов – один 3s -электрон переходит на следующую вакантную d -орбиталь:
3s 2 3p 3 3d 1 → 3s 1 3p 3 3d 2


В результате этого общее количество неспаренных электронов увеличивается до шести – атом серы шестивалентен. Итак, для серы возможны валентности II, IV и VI.
| Выводы: |
1. В зависимости от строения атома элементы проявляют постоянную или переменную валентность.
2. Атом при наличии свободных орбиталей на последнем энергетическом уровне может переходить в возбужденное состояние. При этом за счет распаривания электронных пар количество неспаренных электронов в атоме возрастает и атом проявляет более высокую валентность.
3. В случаях переменной валентности высшее ее значение равно номеру группы. Значение низшей валентности элементов-неметаллов равно разности (8 – № гр).
Почему валентность азота равна 3, а степень оксиления +5? Рассмотреть с точки строения атома.
Ответ:
Вопрос составлен абсолютно неправильно. В молекуле аммиака степень окисления азота = -3, а валентность 3, в ионе аммония степень окисления азота = -3, а валентность 4, в молекуде азота степень окисления азота = 0, а валентность 3. Валентность азота может быть 3 или 4 на внешнем энергетическом уровна атома азота 5 электронов. два из них спаренны, а три - не спаренны. Азот может образовывать связи по обменному механизму за счет трех неспаренных электронов, как например, в молекуле азота N2 или аммиака NH3. В образовании ковалентной связи по донорно-акцепторному механизму может участвует и пара электронов. В этом случае валентность азота равна 4, как, например, в ионе аммония NH4+, У атома азота - элемента второго периода- d-орбиталь отсутствует, свободных орбиталей нет, поэтому элекпронная пара не может распариться, и азот не может образовать 5 связей, т.е. быть пятивалентным. Степень окисления - условный заряд. Поэтому считается, что азот в соединениях с кислородом может отдать кислороду 5 своих электронов и иметь степень окисления +5
потому что валентность-это постоянная определенность химических элементов,а степень окисления переменная.
Похожие вопросы
- а) Задайте линейную функцию у = kх формулой, если известно, что её график параллелен прямой -5х - у + 4 = 0 __ Ответ нужен полностью, с решением. б) Определите, возрастает или убывает заданная вами линейная функция __ Ответ нужен полностью, с решением.
Cтраница 2
В азотистой кислоте валентность азота равна трем, поэтому она проявляет как окислительные, так и восстановительные свойства.
Тетраэдрическое расположение четырех валентностей азота в четвертичных аммониевых солях было впервые установлено в 1925 г. Миллсом и Уорреном на примере соединений типа IV: бромистый 4-фенил - 4 -карбэтокси-бис - пиперидиний-1 1 -спиран (XVIII) был получен из 4-фенилпиперидина и 3-карбэтокси - 1 5-дибромпентана. Если валентности азота расположены тетраэдрически, то плоскость кольца А должна лежать под прямым углом к плоскости кольца Б и весь катион в таком случае должен быть энантиоморфным.
Тетраэдрическое расположение четырех валентностей азота в четвертичных аммониевых солях было впервые установлено в 1925 г. Миллсом и Уорреном на примере соединений типа IV: бромистый 4-фенил - 4 -карбэтокси-бкс - пиперидиний-1 Г - спиран (XVIII) был получен из 4-фенилпиперидина и 3-карбэтокси - 1 5-дибромпентана. Если валентности азота расположены тетраэдрически, то плоскость кольца А должна лежать под прямым углом к плоскости кольца Б и весь катион в таком случае должен быть энантиоморфным.
Обратите внимание, что валентность азота в ионе аммония равна IV, так как он образует четыре ковалентные связи.
Согласно вычислениям Паулинга углы валентности азота и родственных ему элементов - фосфора и мышьяка - лежат между 90 и 109 28, причем величина угла тем меньше, чем больше атомный номер.
На основании относительных электроотрицательностей атомов валентность азота в аммиаке-3, фосфора в фосфине О (так как Р и Н имеют одинаковую электроотрицательность), а мышьяка в арсине 3, хотя связи во всех трех соединениях по преимуществу ковалентные. Кроме трех пар электронов, образующих связи, каждое соединение имеет еще одну неподеленную пару электронов.
Процесс образования соли сопровождается изменением валентности азота от 3 до 5, причем пятая связь полярна.
Процесс образования соли сопровождается изменением валентности азота от трех до пяти, причем пятивалентный атом становится полярным. Ион водорода присоединяется к паре электронов атома азота с образованием неполярной связи и, таким образом, содержащая азот группа приобретает положительный заряд. Ионный заряд связан со всей группой в целом, и все четыре валентности азота используются на образование неполярных связей, тогда как пятая - полярная.
В этих двух рядах химических соединений валентность азота и серы возрастает слева направо; в этом же направлении увеличивается и окислительная активность рассматриваемых веществ. В обратном направлении повышается их восстановительная активность, что обусловлено понижением валентности.
Гидроксиламин занимает промежуточное положение в шкале валентности азота. Это отражается на его пиролизе, при котором предполагается одновременное окисление и восстановление.
Напомним, что соединения, в которых валентность азота равна 4, содержат одну координационную связь. Подобным образом соединения серы, в которых валентность серы больше 2, имеют одну или две координационные связи.
В соединениях типа II и III все три валентности азота входят в циклическую систему. Структура II встречается в хинных алкалоидах в виде хинуклидинового (п т р 2) звена, и соединения этого вида относят к так называемой группе хинуклидина.
Такие циклические соединения довольно удобно классифицировать по числу валентностей азота, принимающих участие в построении циклов полностью насыщенной системы. Соединения типа I, из которых наиболее известен нортропан (п 2, т 3), построены таким образом, что в образовании кольца участвуют две валентности азота.
Образно говоря, валентность - это число "рук", которыми атом цепляется за другие атомы. Естественно, никаких "рук" у атомов нет; их роль играют т. н. валентные электроны.
Можно сказать иначе: валентность - это способность атома данного элемента присоединять определенное число других атомов.
Необходимо четко усвоить следующие принципы:
Существуют элементы с постоянной валентностью (их относительно немного) и элементы с переменной валентностью (коих большинство).
Элементы с постоянной валентностью необходимо запомнить:
Остальные элементы могут проявлять разную валентность.
Высшая валентность элемента в большинстве случаев совпадает с номером группы, в которой находится данный элемент.
Например, марганец находится в VII группе (побочная подгруппа), высшая валентность Mn равна семи. Кремний расположен в IV группе (главная подгруппа), его высшая валентность равна четырем.
Следует помнить, однако, что высшая валентность не всегда является единственно возможной. Например, высшая валентность хлора равна семи (убедитесь в этом!), но известны соединения, в которых этот элемент проявляет валентности VI, V, IV, III, II, I.
Важно запомнить несколько исключений : максимальная (и единственная) валентность фтора равна I (а не VII), кислорода - II (а не VI), азота - IV (способность азота проявлять валентность V - популярный миф, который встречается даже в некоторых школьных учебниках).
Валентность и степень окисления - это не тождественные понятия.
Эти понятия достаточно близки, но не следует их путать! Степень окисления имеет знак (+ или -), валентность - нет; степень окисления элемента в веществе может быть равна нулю, валентность равна нулю лишь в случае, если мы имеем дело с изолированным атомом; численное значение степени окисления может НЕ совпадать с валентностью. Например, валентность азота в N 2 равна III, а степень окисления = 0. Валентность углерода в муравьиной кислоте = IV, а степень окисления = +2.
Если известна валентность одного из элементов в бинарном соединении, можно найти валентность другого.
Делается это весьма просто. Запомните формальное правило: произведение числа атомов первого элемента в молекуле на его валентность должно быть равно аналогичному произведению для второго элемента .
Пример 1 . Найти валентности всех элементов в соединении NH 3 .
Решение . Валентность водорода нам известна - она постоянна и равна I. Умножаем валентность Н на число атомов водорода в молекуле аммиака: 1 3 = 3. Следовательно, для азота произведение 1 (число атомов N) на X (валентность азота) также должно быть равно 3. Очевидно, что Х = 3. Ответ: N(III), H(I).
Пример 2 . Найти валентности всех элементов в молекуле Cl 2 O 5 .
Решение . У кислорода валентность постоянна (II), в молекуле данного оксида пять атомов кислорода и два атома хлора. Пусть валентность хлора = Х. Составляем уравнение: 5 2 = 2 Х. Очевидно, что Х = 5. Ответ: Cl(V), O(II).
Пример 3 . Найти валентность хлора в молекуле SCl 2 , если известно, что валентность серы равна II.
Решение . Если бы авторы задачи не сообщили нам валентность серы, решить ее было бы невозможно. И S, и Cl - элементы с переменной валентностью. С учетом дополнительной информации, решение строится по схеме примеров 1 и 2. Ответ: Cl(I).
Зная валентности двух элементов, можно составить формулу бинарного соединения.
В примерах 1 - 3 мы по формуле определяли валентность, попробуем теперь проделать обратную процедуру.
Пример 4 . Составьте формулу соединения кальция с водородом.
Решение . Валентности кальция и водорода известны - II и I соответственно. Пусть формула искомого соединения - Ca x H y . Вновь составляем известное уравнение: 2 x = 1 у. В качестве одного из решений этого уравнения можно взять x = 1, y = 2. Ответ: CaH 2 .
"А почему именно CaH 2 ? - спросите вы. - Ведь варианты Ca 2 H 4 и Ca 4 H 8 и даже Ca 10 H 20 не противоречат нашему правилу!"
Ответ прост: берите минимально возможные значения х и у. В приведенном примере эти минимальные (натуральные!) значения как раз и равны 1 и 2.
"Значит, соединения типа N 2 O 4 или C 6 H 6 невозможны? - спросите вы. - Следует заменить эти формулы на NO 2 и CH?"
Нет, возможны. Более того, N 2 O 4 и NO 2 - это совершенно разные вещества. А вот формула СН вообще не соответствует никакому реальному устойчивому веществу (в отличие от С 6 Н 6).
Несмотря на все сказанное, в большинстве случаев можно руководствоваться правилом: берите наименьшие значения индексов.
Пример 5 . Составьте формулу соединения серы с фтором, если известно, что валентность серы равна шести.
Решение . Пусть формула соединения - S x F y . Валентность серы дана (VI), валентность фтора постоянна (I). Вновь составляем уравнение: 6 x = 1 y. Несложно понять, что наименьшие возможные значения переменных - это 1 и 6. Ответ: SF 6 .
Вот, собственно, и все основные моменты.
А теперь проверьте себя! Предлагаю пройти небольшой тест по теме "Валентность" .
- Имена мальчиков рожденных в январе Азербайджанские имена родившиеся в январе по гороскопу
- Суточный диурез у беременных женщин
- Как рассчитать налог на автомобиль по лошадиным силам Изменения по транспортному налогу в году
- Храм Солнца: Черная Пагода Конарака
- В Туве упал космический корабль «Прогресс» видео падения Борис Леконцев, заслуженный метеоролог РФ
- Тесты что лишает меня энергии
- Владимир Иванович Долгих: биография Долгих секретарь цк кпсс

 Live Journal
Live Journal Facebook
Facebook Twitter
Twitter