Савельев И.В. Курс общей физики, том I
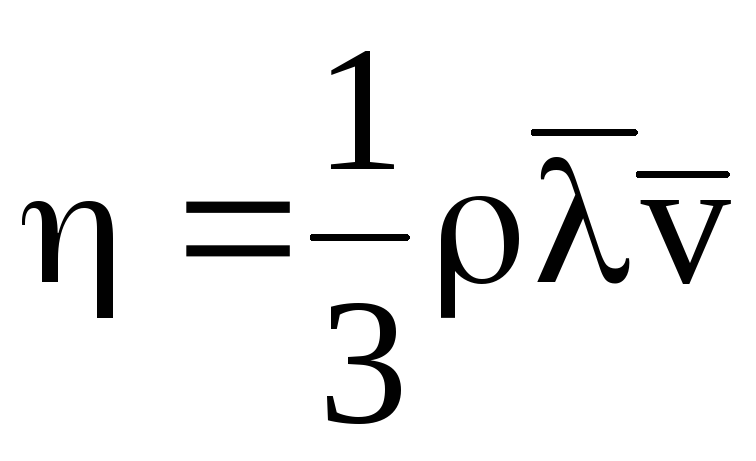
ЛАБОРАТОРНАЯ РАБОТА 115
ОПРЕДЕЛЕНИЕ СРЕДНЕЙ ДЛИНЫ СВОБОДНОГО ПРОБЕГА И ЭФФЕКТИВНОГО ДИАМЕТРА МОЛЕКУЛ ВОЗДУХА
Цель работы: определить среднюю длину свободного пробега и эффективный диаметр молекул воздуха по его коэффициенту внутреннего трения, плотности и средней квадратичной скорости молекул.
Приборы и принадлежности: экспериментальная установка, секундомер, мерный цилиндр, термометр, барометр.
Теория метода. В данной работе средняя длина свободного пробега и эффективный диаметр молекул определяются по коэффициенту внутреннего трения (вязкости) воздуха.
Из молекулярно-кинетической теории следует формула, связывающая вязкость η газа со средней длиной свободного пробега молекул:
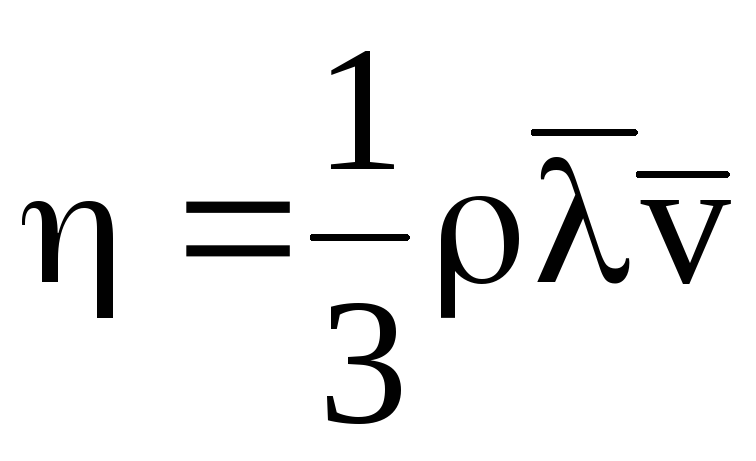 ,
, где ρ –
плотность газа. (1)
где ρ –
плотность газа. (1)
Таким
образом,
 ,
где
,
где
![]() -
средняя арифметическая скорость молекул
(2)
-
средняя арифметическая скорость молекул
(2)
Коэффициент вязкости можно найти по известной формуле Пуазейля для расчета объема V жидкости или газа, протекающего ламинарно через поперечное сечение капилляра радиуса r за время t при разности Δp давлений на концах капилляра длинойl:
 . (3)
. (3)
 . (4)
. (4)
Все величины, входящие в эту формулу, легко поддаются измерению.
Среднюю арифметическую скорость молекул газа, согласно молекулярно-кинетической теории, можно рассчитать по формуле:
 , (5)
, (5)
где R – молярная газовая постоянная, Т – абсолютная температура в Кельвинах, М – молярная масса воздуха.
Из уравнения Менделеева-Клапейрона можно выразить плотность газа через давление р и температуру Т:
 . (6)
. (6)
Подставляя выражения (4), (5), (6) в формулу (2), получим (в единицах СИ):
 (7)
(7)
Разность давлений Δp может быть найдена по формуле:
 ,(8)
,(8)
где h 1 и h 2 – высоты уровней воды в сосуде А (рис.1), g – ускорение свободного падения, ρ – плотность воды.
Для
определения эффективного диаметра d
молекулы воспользуемся формулой для
средней длины
 свободного пробега:
свободного пробега:
 , (9)
, (9)
связывающей
среднюю длину
 свободного пробега молекул с их числом
n в единице объема газа.
свободного пробега молекул с их числом
n в единице объема газа.
Молекулярную концентрацию n при условиях опыта можно найти из уравнения состояния идеального газа p = n*k*T:
 , (10)
, (10)
где n 0 = 2,69*10 25 м –3 – концентрация молекул (число Лошмидта) в нормальном состоянии (т.е. при Т н = 273,15 К и р н = 760 мм.рт.ст. = 1,013*10 5 Па)
Из выражений (9) и (10) получим формулу для расчета эффективного диаметра молекулы газа (в единицах СИ):
 , (11)
, (11)
Численное
значение
 нами было найдено ранее по формуле (7).
нами было найдено ранее по формуле (7).
ОПИСАНИЕ УСТАНОВКИ
Д ля
определения средней длины свободного
пробега и расчета эффективного диаметра
молекул воздуха используется установка,
состоящая из капилляра l, сосуда А с
краном К и мерного цилиндра В (рис. 1).
ля
определения средней длины свободного
пробега и расчета эффективного диаметра
молекул воздуха используется установка,
состоящая из капилляра l, сосуда А с
краном К и мерного цилиндра В (рис. 1).
Сосуд заполняется водой и закрывается притертой пробкой с капилляром l. Если открыть кран К, то вода сначала будет вытекать из сосуда непрерывной струей, а затем отдельными каплями. При этом в капилляре установится течение воздуха, обусловленное разностью давлений на его концах:
р атм – (р атм – p 1 gh 2) = p 1 gh 2 (12)
Сосуд снабжен шкалой, с помощью которой можно определить уровень воды в нем. Под сосудом устанавливается мерный цилиндр для определения объема вытекшей жидкости.
Очевидно, в установившемся режиме объем воздуха, поступившего через капилляр в сосуд воздуха равен объему вытекшей за то же время из сосуда воды.
ПОРЯДОК ВЫПОЛНЕНИЯ РАБОТЫ
1. Поставьте под сосуд химический стакан, закройте пальцем капилляр и откройте кран К. Дождавшись, когда вода перестанет вытекать из сосуда, уберите стакан и подставьте вместо него мерный цилиндр. Замерив по шкале начальную высоту уровня воды h 1 в сосуде, откройте капилляр и одновременно включите секундомер.
2. Через две минуты закройте кран и остановите секундомер.
3. Запишите время истечения жидкости t, конечную высоту уровня воды h 2 и объем вытекшей воды V.
4. Опыт проведите три раза.
5. Вычислите Δp по формуле 8, приняв за плотность воды ρ 1 = 10 3 кг/м 3 .
6. Определите температуру Т по комнатному термометру и атмосферное давление Р по барометру.
7.
Для каждого опыта по формуле (7) рассчитайте
среднюю длину
 свободного пробега молекул воздуха.
Значения радиуса r и длины l капилляра
приведены на установке.
свободного пробега молекул воздуха.
Значения радиуса r и длины l капилляра
приведены на установке.
8.
Найдите среднее арифметическое значение
результатов измерений:
 .
.
9.
Оцените ошибки измерений, окончательный
результат запишите в виде:
 ,
, при δ = 0,95 и N =
3.
при δ = 0,95 и N =
3.
Здесь
 ;t δ (N)
= 4,30 – коэффициент Стьюдента при
доверительной
вероятности
δ = 0,95 и числе измерений N = 3;
-средняя
квадратичная погрешность результата
измерений
;t δ (N)
= 4,30 – коэффициент Стьюдента при
доверительной
вероятности
δ = 0,95 и числе измерений N = 3;
-средняя
квадратичная погрешность результата
измерений
 .
.
10.
Используя найденное значение
 ,
по формуле (11) рассчитайте эффективный
диаметр d молекул воздуха.
,
по формуле (11) рассчитайте эффективный
диаметр d молекул воздуха.
11. Результаты измерений и расчетов запишите в таблицу.
ТАБЛИЦА
N |
V, м |
T, K |
P, Па | |||||
КОНТРОЛЬНЫЕ ВОПРОСЫ
Что называется средней длиной свободного пробега молекул газа? Как связаны между собой эти величины?
Зависит ли средняя длина свободного пробега молекул от температуры газа? давления? Почему?
Дайте определение следующих процессов: теплопроводности, диффузии, вязкости. Почему их называют явлениями переноса?
Запишите формулу Пуазейля для потока вязкой жидкости и газа.
Запишите уравнение состояния идеального газа.
Какие свойства теплового движения молекул газа отражает распределение Максвелла?
Запишите выражения для характерных тепловых скоростей молекул идеального газа в состоянии равновесия.
ЛИТЕРАТУРА
Савельев И.В. Курс общей физики. Т.1., М.: Наука, 1989, с. 140, 269, 274, 278.
Трофимова Т.И. Курс физики. М.: Высш. Школа, 1990, с. 55, 57, 81, 84.
Цель работы: изучение явлений переноса вгазах; экспериментальное определение коэффициента динамической вязкости, средней длины свободного пробега и эффективного диаметра молекул.
Основные понятия
Молекулы газов, совершающие тепловое движение, движутся по ломаным линиям, состоящим из отрезков прямых. Изломы траектории обусловлены столкновениями молекул друг с другом. Длиной свободного пробега молекулы называется путь, проходимый ею между двумя последовательными столкновениями. Эта величина меняется от столкновения к столкновению, поэтому говорят о средней длине свободного пробега <>.
Для определения <>
нужно разделить весь путь, пройденный
молекулой за1с и численно
равный ее среднеарифметической скорости,
на среднее число столкновений
Если считать молекулы упругими
шариками радиусаr,то минимальное расстояниеD,
на которое могут сблизиться их центры,
не может быть меньше 2r.
Расстояние Dназывается
эффективным диаметром молекулы. Будем
считать, что молекулы взаимодействуют
только при непосредственном
соприкосновении по законам столкновения
упругих шаров. Определим среднее число
соударений
участков гораздо больше диаметра: >>D.
За единицу времени рассматриваемая
молекула столкнется с молекулами,
лежащими внутри цилиндра, имеющего
высоту <>:
 (1)
(1)
Так как для идеального газа Р =nkT, эффективный диаметр молекул газа и соответствии с (1)можно находить по формуле:
 (2)
(2)
где k= 1,38*10 -23 Дж/К -постоянная Больцмана, Р -давление газа, Т -его температура.
Беспорядочность теплового движения молекул газа, непрерывные соударения между ними приводят к постоянному перемешиванию частиц и изменению их скоростей и энергии. Если в газе существует пространственная неоднородность плотности, температуры или скорости упорядоченного перемещения отдельных слоев газа, то движение молекул выравнивает эти неоднородности. При этом в газе происходят особые необратимые процессы, объединенные общим названием явлений переноса. Явление переноса массы называется диффузией, внутреннее трение -перенос количества движения. Перенос массы, энергии и количества движения всегда происходит в направлении, обратном их градиенту; система при этом приближается к состоянию термодинамического равновесия. Механизм указанных явлений одинаков; они описываются единым уравнением явлений переноса:
 (3)
(3)
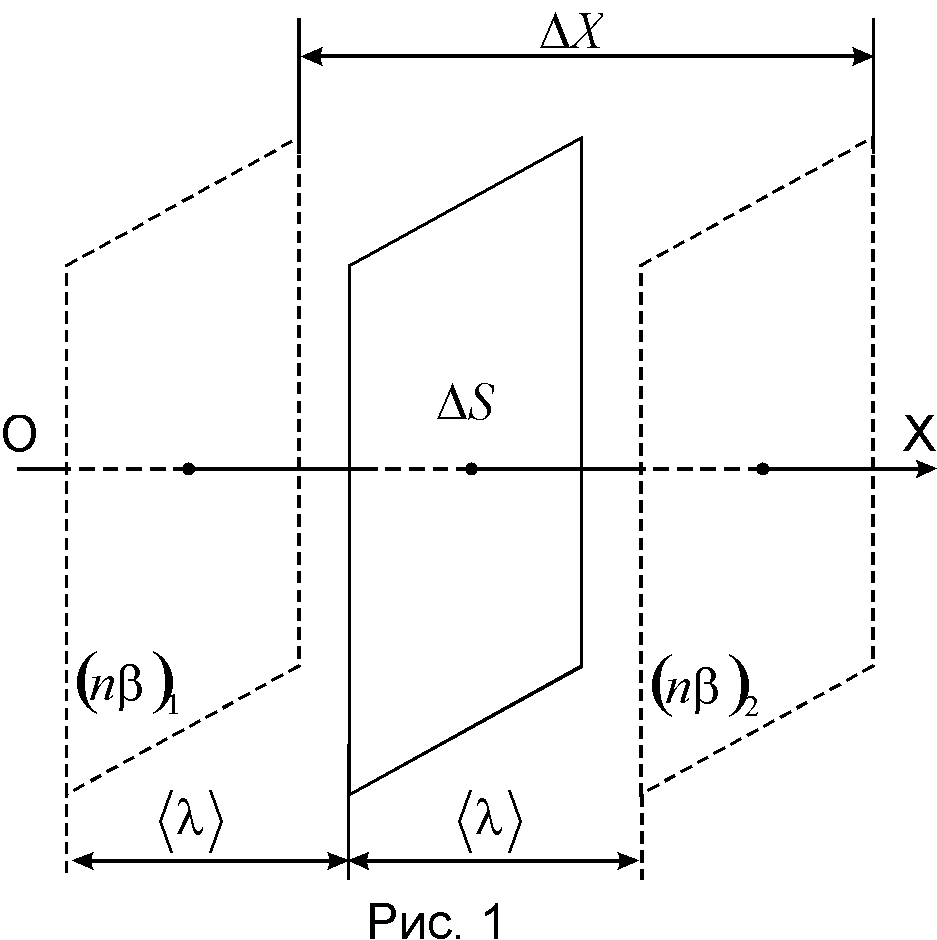
где -любая физическая характеристика, которую переносят молекулы,N -число молекул, участвующих в явлении,S- размер площадки, через которую происходит перенос,n -концентрация молекул.t -время переноса.
Отношение
 является модулем градиента величины
(n)
и характеризует быстроту изменения
этой величины на единицу длины в
направлении, перпендикулярном к
площадкеS.
На рис.1 количество (n)
убывает в положительном направлении
ОХ; оно равно (n) 1
слева от площадкиSи (n) 2 справа от неё. В этом случае преимущественный
перенос (n)
происходит слева направо. Знак "минус"
в уравнении(3)
выражает,
что перенос происходит в направлении,
противоположном направлению градиента.
является модулем градиента величины
(n)
и характеризует быстроту изменения
этой величины на единицу длины в
направлении, перпендикулярном к
площадкеS.
На рис.1 количество (n)
убывает в положительном направлении
ОХ; оно равно (n) 1
слева от площадкиSи (n) 2 справа от неё. В этом случае преимущественный
перенос (n)
происходит слева направо. Знак "минус"
в уравнении(3)
выражает,
что перенос происходит в направлении,
противоположном направлению градиента.
В случае диффузии переносимой физической характеристикой является масса и = m 0 - массе молекулы; для теплопроводности =,где- энергия теплового движения молекул.
Рассмотрим явление внутреннего трения. Пусть в потоке газа скорость течения убывает в направлении ОХ (рис.2). Рассмотрим воображаемую площадку S ,по которой соприкасаются два соседних слоя газа;
|
|
|
обозначим U 1 иU 2 скорости течения на расстояниях <>
от этой площадки. На хаотическое
движение молекул належится направленное
движение со скоростью потокаU,
вследствие чего молекулы верхнего слоя
будут обладать большим импульсом, чем
молекулы нижнего слоя:m 0 U 1 В случае внутреннего трения переносимой
физической величиной является импульс
молекулы
=m 0 U.
Поскольку концентрацияnмолекул одинакова во всем объеме газа,
можно записать: (n)=(nm 0 U)=nm 0 U,
где U=U 2 -U 1 К Динамическая вязкость равна силе внутреннего трения, действующей
на единицу площади поверхности слоя
при градиенте скорости, равном
единице. Молекулы газа, находясь в тепловом движении, непрерывно
сталкиваются друг с другом. Минимальное расстояние, на которое сближаются при
столкновении центры двух молекул, называется эффективным диаметром молекулы d
(рис. 248). Как мы увидим в дальнейшем (см. §117), эффективный диаметр
несколько уменьшается с увеличением скорости молекул, т. е. с повышением
температуры. Величина называется эффективным сечением молекулы. За время между двумя последовательными соударениями молекула
газа проходит некоторый путь l
, который называется
длиной свободного пробега. Длина свободного пробега - случайная величина. Иной
раз молекуле удается пролететь между соударениями довольно большой путь, в другой
раз этот путь может оказаться весьма малым. Как можно показать, вероятность w(l)
того, что молекула пролетит без столкновений путь l
,
определяется формулой (111
.1
) где - средний путь l
,
проходимый молекулой между двумя последовательными соударениями, называемый средней
длиной свободного пробега. В соответствии с (111.1) вероятность того, что
молекула пролетит без столкновений некоторый путь l
,
убывает экспоненциально с увеличением l
. За
секунду молекула проходит в среднем путь, равный средней скорости . Если за секунду она
претерпевает в среднем v
столкновений, то средняя длина свободного
пробега, очевидно, будет равна (111
.2) Для того чтобы подсчитать среднее число столкновений v
,
предположим вначале, что все молекулы кроме данной, застыли неподвижно на своих
местах. Проследим за движением выделенной нами молекулы. Ударившись об одну из неподвижных
молекул, она будет лететь прямолинейно до тех пор, пока не столкнется с
каком-либо другой неподвижной молекулой (рис. 249). Это соударение произойдет в
том случае, если центр неподвижной молекулы окажется от прямой, вдоль которой
летит молекула, на расстоянии, меньшем эффективного диаметра молекулы d. В
результате столкновения молекула изменит направление своего движения, после
чего некоторое время опять будет двигаться прямолинейно, пока на ее пути снова
не встретится молекула, центр которой будет находиться в пределах показа иного
на рис. 249, цилиндра радиуса d. За секунду молекул а пройдет путь, равный . Очевидно, что число
происходящих за это время соударений с неподвижными молекулами равно количеству
молекул, центры которых попадают внутрь коленчатого цилиндра длины и радиуса d, объем
которого равен .Умножив
этот объем на число молекул в единице объема n
, получим
среднее число столкновении за секунду движущейся молекулы с неподвижными: В действительности все молекулы движутся, вследствие чего
число соударений определяется средней скоростью движения молекул по отношению
друг к другу. Как показывает соответствующий расчет, средняя скорость
относительно движения молекул в раз больше скорости молекул относительно стенок
сосуда. Поэтому среднее число столкновений за секунду будет равно Заменив эффективным диаметр d эффективным сечением молекулы , получим следующую
формулу: Эффективный диаметр молекул, как уже отмечалось, убывает с
ростом температуры. Поэтому средняя длина свободного пробега с повышением
температуры растет. Зависимость от Т дается формулой Сёзерленда: (111
.7) где С-характерная для каждого газа
постоянная величина, имеющая размерность температуры и носящая название постоянной
Сёзерленда, -
средняя длина свободного пробега при . Из (111.7) следует, что при температуре Т=С значение составляет . На рис. 250 показана зависимость от температуры для кислорода
(С=125 0) Оценим по порядку величины среднюю длину свободного пробега
и среднее число столкновений в секунду. В §92 мы установили, что молекулы имеют
размеры порядка нескольких ангстрем. Примем эффективный радиус молекулы равным
1 А, т. е. 10 -10 м
. При нормальных условиях
n
равно числу Лошмидта, т. е. 2,68*10 25 м -3 .
Подставив эти данные в формулу (111.4), получим: При давлении 10 -3 мм
рт. ст. (что соответствует примерно 10
-6 ат) , будет порядка 10 см. Следовательно, если сосуд имеет линейные размеры порядка нескольких сантиметров, то при таком
давлении молекулы будут двигаться от стенки к стенке практически без
столкновений друг с другом. При давлении 10 -6 мм
рт. ст.
достигает величины
порядка десятков метров. В таблице 8. приведены значения при нормальных условиях и
эффективные диаметры молекул для некоторых газов. Таблица
8 М при 0 0 С и 760 мм. рт.ст. ЛАБОРАТОРНАЯ
РАБОТА 115
ОПРЕДЕЛЕНИЕ
СРЕДНЕЙ ДЛИНЫ СВОБОДНОГО ПРОБЕГА И
ЭФФЕКТИВНОГО ДИАМЕТРА МОЛЕКУЛ ВОЗДУХА
Цель
работы:
определить среднюю длину свободного
пробега и эффективный диаметр молекул
воздуха по его коэффициенту внутреннего
трения, плотности и средней квадратичной
скорости молекул. Приборы
и принадлежности:
экспериментальная установка, секундомер,
мерный цилиндр, термометр, барометр. Теория
метода.
В
данной работе средняя длина свободного
пробега и эффективный диаметр молекул
определяются по коэффициенту внутреннего
трения (вязкости) воздуха. Из
молекулярно-кинетической теории следует
формула, связывающая вязкость η газа
со средней длиной
свободного пробега молекул: Таким
образом,
Коэффициент
вязкости можно найти по известной
формуле Пуазейля для расчета объема V
жидкости или газа, протекающего ламинарно
через поперечное сечение капилляра
радиуса r за время t при разности Δp
давлений на концах капилляра длинойl: Все величины,
входящие в эту формулу, легко поддаются
измерению. Среднюю арифметическую
скорость молекул газа, согласно
молекулярно-кинетической теории, можно
рассчитать по формуле: где R – молярная
газовая постоянная, Т – абсолютная
температура в Кельвинах, М – молярная
масса воздуха. Из уравнения
Менделеева-Клапейрона можно выразить
плотность газа через давление р и
температуру Т: Подставляя
выражения (4), (5), (6) в формулу (2), получим
(в единицах СИ): Разность
давлений Δp может быть найдена по формуле: где
h 1
и h 2
– высоты уровней воды в сосуде А (рис.1),
g – ускорение свободного падения, ρ –
плотность воды. связывающей
среднюю длину
Молекулярную
концентрацию n при условиях опыта можно
найти из уравнения состояния идеального
газа p = n*k*T: где
n 0
= 2,69*10 25 м
–3
– концентрация молекул (число Лошмидта)
в нормальном состоянии (т.е. при Т н
= 273,15 К и р н
= 760 мм.рт.ст. = 1,013*10 5
Па) Из выражений (9) и
(10) получим формулу для расчета эффективного
диаметра молекулы газа (в единицах СИ): Численное
значение
Д Сосуд
заполняется водой и закрывается притертой
пробкой с капилляром l.
Если открыть кран К, то вода сначала
будет вытекать из сосуда непрерывной
струей, а затем отдельными каплями. При
этом в капилляре установится течение
воздуха, обусловленное разностью
давлений на его концах: р атм
– (р атм
– p 1 gh 2)
= p 1 gh 2 (12) Сосуд снабжен
шкалой, с помощью которой можно определить
уровень воды в нем. Под сосудом
устанавливается мерный цилиндр для
определения объема вытекшей жидкости. Очевидно, в
установившемся режиме объем воздуха,
поступившего через капилляр в сосуд
воздуха равен объему вытекшей за то же
время из сосуда воды. 1.
Поставьте под сосуд химический стакан,
закройте пальцем капилляр и откройте
кран К. Дождавшись, когда вода перестанет
вытекать из сосуда, уберите стакан и
подставьте вместо него мерный цилиндр.
Замерив по шкале начальную высоту уровня
воды h 1
в сосуде, откройте капилляр и одновременно
включите секундомер. 2. Через две минуты
закройте кран и остановите секундомер. 3.
Запишите время истечения жидкости t,
конечную высоту уровня воды h 2
и объем вытекшей воды V. 4. Опыт проведите
три раза. 5.
Вычислите Δp по формуле 8, приняв за
плотность воды ρ 1
= 10 3 кг/м 3 . 6. Определите
температуру Т по комнатному термометру
и атмосферное давление Р по барометру. 7.
Для каждого опыта по формуле (7) рассчитайте
среднюю длину
8.
Найдите среднее арифметическое значение
результатов измерений:
9.
Оцените ошибки измерений, окончательный
результат запишите в виде:
Здесь
10.
Используя найденное значение
11. Результаты
измерений и расчетов запишите в таблицу. КОНТРОЛЬНЫЕ
ВОПРОСЫ
Что
называется средней длиной свободного
пробега молекул газа? Как связаны между
собой эти величины? Зависит ли средняя
длина свободного пробега молекул от
температуры газа? давления? Почему? Дайте определение
следующих процессов: теплопроводности,
диффузии, вязкости. Почему их называют
явлениями переноса? Запишите формулу
Пуазейля для потока вязкой жидкости и
газа. Запишите уравнение
состояния идеального газа. Какие свойства
теплового движения молекул газа отражает
распределение Максвелла? Запишите выражения
для характерных тепловых скоростей
молекул идеального газа в состоянии
равновесия. ЛИТЕРАТУРА
Савельев
И.В. Курс общей физики. Т.1., М.: Наука,
1989, с. 140, 269, 274, 278. Трофимова Т.И.
Курс физики. М.: Высш. Школа, 1990, с. 55, 57,
81, 84.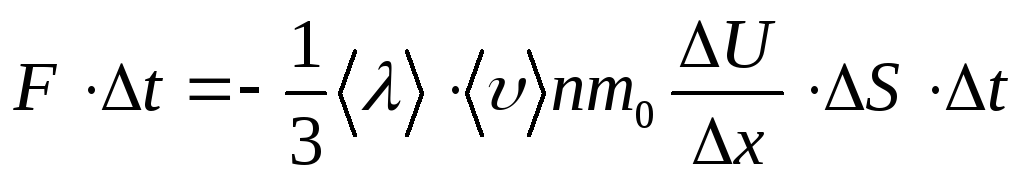
 роме
того, величина(N)=К
-это изменение импульса одного слоя
относительно другого за времяt.
Поскольку изменение импульса равно
импульсу действующей силы, тоК
= Ft
,гдеF -сила взаимодействия между слоями
газа, действующая в плоскости их
соприкосновения, т.е. сила внутреннего
трения. При учете полученных соотношений
уравнение переноса (3)примет вид:
Сократим это равенство
наtи учтем, чтоnm 0
=тогда
роме
того, величина(N)=К
-это изменение импульса одного слоя
относительно другого за времяt.
Поскольку изменение импульса равно
импульсу действующей силы, тоК
= Ft
,гдеF -сила взаимодействия между слоями
газа, действующая в плоскости их
соприкосновения, т.е. сила внутреннего
трения. При учете полученных соотношений
уравнение переноса (3)примет вид:
Сократим это равенство
наtи учтем, чтоnm 0
=тогда (4)
(4)


 Сравнивая эту формулу с эмпирически
полученным выражением для силы внутреннего
трения (законом Ньютона)
Сравнивая эту формулу с эмпирически
полученным выражением для силы внутреннего
трения (законом Ньютона) 

 (5)
(5)
 (6)
(6)
Молекулы газа, находясь в тепловом движении, непрерывно сталкиваются
друг с другом

![]()

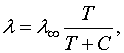
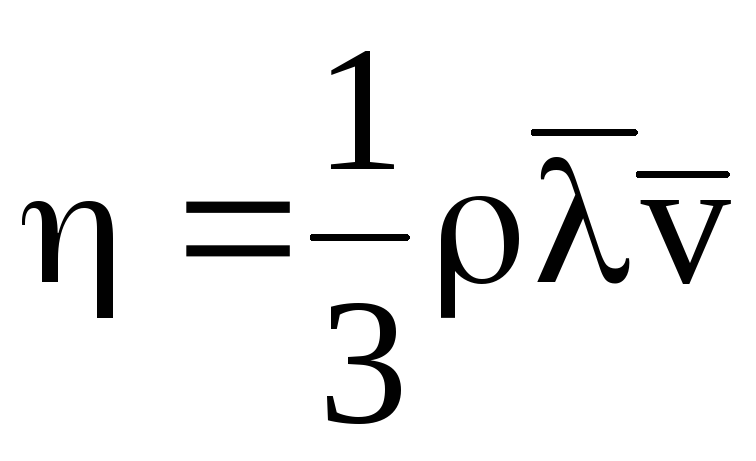 ,
, где ρ –
плотность газа. (1)
где ρ –
плотность газа. (1) ,
где
,
где
![]() -
средняя арифметическая скорость молекул
(2)
-
средняя арифметическая скорость молекул
(2) . (3)
. (3) . (4)
. (4) , (5)
, (5) . (6)
. (6) (7)
(7) ,(8)
,(8)Для
определения эффективного диаметра d
молекулы воспользуемся формулой для
средней длины
 свободного пробега:
свободного пробега: , (9)
, (9) свободного пробега молекул с их числом
n в единице объема газа.
свободного пробега молекул с их числом
n в единице объема газа. , (10)
, (10) , (11)
, (11) нами было найдено ранее по формуле (7).
нами было найдено ранее по формуле (7).ОПИСАНИЕ УСТАНОВКИ
 ля
определения средней длины свободного
пробега и расчета эффективного диаметра
молекул воздуха используется установка,
состоящая из капилляра l, сосуда А с
краном К и мерного цилиндра В (рис. 1).
ля
определения средней длины свободного
пробега и расчета эффективного диаметра
молекул воздуха используется установка,
состоящая из капилляра l, сосуда А с
краном К и мерного цилиндра В (рис. 1).ПОРЯДОК ВЫПОЛНЕНИЯ
РАБОТЫ
 свободного пробега молекул воздуха.
Значения радиуса r и длины l капилляра
приведены на установке.
свободного пробега молекул воздуха.
Значения радиуса r и длины l капилляра
приведены на установке. .
. ,
, при δ = 0,95 и N =
3.
при δ = 0,95 и N =
3. ;t δ (N)
= 4,30 – коэффициент Стьюдента при
доверительной
вероятности
δ = 0,95 и числе измерений N = 3;
-средняя
квадратичная погрешность результата
измерений
;t δ (N)
= 4,30 – коэффициент Стьюдента при
доверительной
вероятности
δ = 0,95 и числе измерений N = 3;
-средняя
квадратичная погрешность результата
измерений
 .
. ,
по формуле (11) рассчитайте эффективный
диаметр d молекул воздуха.
,
по формуле (11) рассчитайте эффективный
диаметр d молекул воздуха.ТАБЛИЦА
N
V, м
T, K
P,
Па
- Зависимость скорости ферментативной реакции от температуры, pH и времени инкубации Как влияет температура на рн
- Зависимость скорости ферментативной реакции от температуры, pH и времени инкубации Ph от температуры
- Святые богоотцы иоаким и анна Иоаким и анна когда почитание
- Храм святой великомученицы екатерины в риме
- Численность последователей основных религий и неверующих
- Абсолютные и относительные координаты Что называется абсолютными координатами точек
- Какие меры относились к политике военного коммунизма

 Live Journal
Live Journal Facebook
Facebook Twitter
Twitter