Химическая символика классификация неорганических соединений
И их производные. Все остальные вещества - неорганические.
Классификация неорганических веществ
Неорганические вещества по составу делят на простые и сложные.
Простые вещества состоят из атомов одного химического элемента и подразделяются на металлы, неметаллы, благородные газы. Сложные вещества состоят из атомов разных элементов, химически связанных друг с другом.
Сложные неорганические вещества по составу и свойствам распределяют по следующим важнейшим классам: оксиды, основания , кислоты, амфотерные гндроксиды, соли.
Содержание урока конспект урока опорный каркас презентация урока акселеративные методы интерактивные технологии Практика задачи и упражнения самопроверка практикумы, тренинги, кейсы, квесты домашние задания дискуссионные вопросы риторические вопросы от учеников Иллюстрации аудио-, видеоклипы и мультимедиа фотографии, картинки графики, таблицы, схемы юмор, анекдоты, приколы, комиксы притчи, поговорки, кроссворды, цитаты Дополнения рефераты статьи фишки для любознательных шпаргалки учебники основные и дополнительные словарь терминов прочие Совершенствование учебников и уроков исправление ошибок в учебнике обновление фрагмента в учебнике элементы новаторства на уроке замена устаревших знаний новыми Только для учителей идеальные уроки календарный план на год методические рекомендации программы обсуждения Интегрированные уроки2.1. Химическая символика
Любой химический символ имеет двойной смысл: 1) обозначает атом или молекулу; 2) обозначает атомную или молекулярную массу. Поэтому из химической формулы и из химического уравнения вытекает два вывода: качественный и количественный.
В химии принято атом (химический элемент) обозначать химическим знаком, молекулу – химической формулой, схему химического превращения одних веществ в другие – уравнения химических реакций.
Химический знак – обозначают первыми (одной или двумя) буквами латинского названия элемента.
П р и м е р: H – Hydrogenium – водород, N – Nytrogenium – азот, Au – Aurum – золото.
Известно более 120 химических элементов. Каждый элемент имеет знак и место в таблице – «клетку». «Клетка» имеет свой номер и, кроме того, соответствует определенному номеру вертикального столбца – группы и номеру горизонтального периода
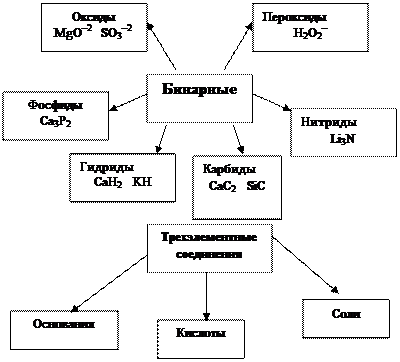
Классификация неорганических соединений по функциональным признакам и составу.
Химические вещества (по составу)
Простые Сложные
металлы бинарные трехатомные
неметаллы
амфотерные элмененты
Количество атомов в составе сложной молекулы указываются индексами (единица не записывается в составе молекулы)
LiH - 1 атом лития, 1 атом водорода
SO 3 – 1 атом серы, 3 атома кислорода
Если в молекуле имеются скобки, то количество атомов увеличивается.
Al 2 (SO 4) 3 – 2 атома алюминия, 2 атома серы, 12 атомов кислорода.
Значения индексов зависят от валентности элементов и групп, входящих в состав молекулы.
Классификация сложных неорганических веществ по составу:
 |
2. Оксиды. Классификация. Свойства. Получение.
Оксиды – сложные вещества, состоящие из двух элементов один из которых кислород (Валентность -II, степень окисления -2).
Существуют солеобразующие и несолеобразующие оксиды.
Номенклатура оксидов
Слово “оксид” + “название элемента” + валентность
SO 2 - оксид серы (IV) - (S IV O 2 II)
К несолеобразующим оксидам относят оксиды, которые не образуют солей (CO, NO).
Существуют 3 группы оксидов:
Основные
Кислотные
Амфотерные
Основные
К основным оксидам относят оксиды типичных металлов.
Получение
1) Окисление металлов (кроме металлов1-А гр.)
2Са+О 2 → 2СаО
2) Обжиг сульфидов
FeS + O 2 → t Fe 2 O 3 + SO 2
основной и кислотный оксиды
3) Разложение гидроксидов тяжелых металлов
Cu (OH)2 → t CuO + H 2 O
основной и амфотерный оксид
4) Разложение солей (особенно карбонатов и нитратов)
CaCO 3 – t CaO+CO 2
1.Основные оксиды взаимодействуют с кислотными оксидами
BaO+SiO 2 → BaSiO 3
2.Взаимодействуют с амфотерными оксидами
MgO+Al 2 O 3 → Mg(AlO 2) 2
3.Взаимодействуют с кислотами
CaO+H 2 SO 4 → CaSO 4 +H 2 O
4.Взаимодействуют с водой
CaO+H 2 O →Ca(OH) 2
5.Участвуют в ОВР
Fe +3 2 O -2 3 +Al 0 → Al +3 2 O -2 +Fe 0
Кислотные
Кислотные оксиды – оксиды неметаллов или переходных металлов в высшей степени валентности
Mn +2 Mn +4 Mn +7
основной амфотерный кислотный
Способы получения
а)окисление неметаллов
С+О 2 → t СО 2
б)смотри способы 2 и 4
Номенклатура
Наряду с современной номенклатурой для кислотных оксидов используется старинная система названий ангидридов кислот.
Ангидрид – продукт отщепления воды от соответствующей кислоты
Химические свойства
1.кислотные оксиды взаимодействуют с водой и образованиями кислот
SO 3 +H 2 O →H 2 SO 4
2.взаимодействуют с амфотерными оксидами
P 2 O 5 +Al 2 O 3 → 2AlPO 4
3.взаимодействуют с основаниями
CO 2 +Ca(OH) 2 →CaCO 3 +H 2 O
4.участвуют в ОВР
2SO 2 +O 2 → t 2SO 3
Амфотерные
Амфотерные оксиды сочетают свойства основных и кислотных оксидов.
Al 2 O 3 +6HCl →2AlCl 3 +3H 2 O
Al2O 3 +NaOH+H 2 O → Na
H 2 O – идеальный амфотерный оксид
По составу химические соединения бывают простыми и сложными. Простое вещество- это вещество, образованное путем сочетания атомов одного и того же элемента, и является формой существования химических элементов в свободном состоянии.
Химический элемент – это вид атомов, обозначенный определенными символами и имеющий определенную совокупность химических свойств.
В природе существует явление аллотропии. Аллотропия – это образование одним и тем же химическим элементом различных веществ. Это явление обусловлено различием числа атомов в молекулах вещества или иным типом решетки (например, кислород О 2 ; озон О 3).
В настоящее время известно более 110 химических элементов и около 400 простых веществ.
Все химические элементы делятся на металлы и неметаллы. Данный тип классификации сложился исторически на основе практического опыта. Металлы – это химические элементы, способные отдавать электроны. Неметаллы – это электроотрицательные элементы, способные присоединять электроны. В таблице Менделеева граница металлы –неметаллы условно идет по диагонали бор-астат (металлы расположены слева, а неметаллы –справа). Элементы вблизи диагонали имеют промежуточные свойства (например, полупроводники).
Сложные вещества – это вещества, состоящие из комбинаций простых веществ. Сложные вещества подразделяются на неорганические (300000 видов) и органические, которых еще больше. В свою очередь неорганические вещества бывают пяти классов:
Гидроксиды (содержат ОН);
Кислоты (содержат кислотный остаток, например, SO 4);
Амфотерные гидроксиды;
Оксиды – это соединения двух элементов, в которых атомы кислорода связаны с атомами другого элемента.
Гидроскиды (щелочи) – это вещества, которые в водном растворе диссоциируют с образование катионом металла, анионов гидроксила и не образуют других анионов.
Амфотерные гидроксиды – это гидроксиды, которые в водном растворе диссоциируют с образованием катионов водорода Н+ и анионов ОН-, т.е. проявляют свойства кислот и оснований.
Кислоты – это химические соединения, которые в водном растворе диссоциируют на катионы водорода и анионы кислотного остатка.
Соли – это химические соединения, которые в воде диссоциируют на катионы металла и анионы кислотного остатка. Все классы химических соединений неорганического типа находятся в генетической взаимосвязи, которая может быть представлена в виде схемы:
Металлы Неметаллы
Основные оксиды Кислотные оксиды
Гидроксиды Кислоты
Рис. 8.2.Схема генетической взаимосвязи неорганических соединений
При этом условном обозначении необходимо учитывать наличие обратных связей между сложными неорганическими веществами.
Органическими называют соединения углерода, атомы которого связаны с атомами других элементов, преимущественно малополярными связями. В природе эти соединения встречаются исключительно в организмах растений и животных и являются продуктами жизнедеятельности или распада этих организмов.
Для органических соединений характерен ряд отличительных признаков и свойств, которые составляют предмет для отдельной области химии – органической химии. В основном эти отличия обусловлены особенностями свойств углерода:
В периодической системе элементов углерод расположен между типичными металлами и неметаллами, проявляет ковалентность, равную 4, и способен соединяться со многими элементами;
Его атомы способны соединяться друг с другом, образуя прочные, иногда весьма длинные цепи: линейные, разветвленные, колцеобразные; связь в цепочках между атомами углерода может быть одинарной, двойной и тройной;
В типичных химических превращениях углеродная структура органической молекулы не нарушается, а в реакции принимают участие периферийные группы, которые носят название функциональных, или атомы, связанные кратными связями;
Молекулы органических соединений при одинаковом составе и равных молекулярных массах могут иметь различную структуру и различные свойства. Это явление называют изомерией, оно объясняет существование огромного числа органических соединений;
Огромное разнообразие органических соединений состоит из небольшого числа химических элементов: углерода, водорода, кислорода, фосфора, серы, галогенов. В отдельных случаях в состав органических соединений могут входить металлы;
Для углерода не характерны соединения с ионными связями. Подавляющее большинство органических молекул построены на основе ковалентных связей, поэтому органические вещества являются неэлектролитами и не диссоциируют в растворах. Реакции протекают в молекулярной форме с небольшой скорость;
Температура плавления органических соединений лежит в интервале 100-200 С, реже -300-400 С. В присутствии кислорода подавляющее большинство органических соединений полностью сгорает с образованием диоксида углерода и воды. При нагревании без доступа воздуха органические вещества преобразуются в вещества с другими свойствами вследствие структурной перестройки.
В биосфере органические вещества играют важную роль, участвуя во всех процессах растительных и животных организмов. В качестве отдельных групп органических соединений выступают ферменты, гормоны, витамины и т.п.
Теория химического строения органических соединений была предложена в 60-е годы XIX века русским химиком А.М. Бутлеровым. Дополненная современными представлениями о природе химической связи, пространственной структуре молекул, характере взаимного влияния атомов и молекул, эта теория составляет фундамент органической химии наших дней.
- Как приготовить классические вареники с творогом
- Как сделать тесто для яблочной шарлотки Как приготовить шарлотку с яблоками песочное тесто
- Отечественной войны 2 степени
- День полного освобождения Ленинграда от фашистской блокады
- Манная каша на молоке: пропорции и рецепты приготовления Манная каша 1 порция
- Суп-пюре из брокколи с сыром Рецепт крем супа из брокколи с сыром
- Гороскоп: характеристика Девы, рождённой в год Петуха

 Live Journal
Live Journal Facebook
Facebook Twitter
Twitter