Химия качественный и количественный состав. Аналитическая реакция. Аналитический сигнал. Дробный и систематический анализ. Что показывает состав количественный
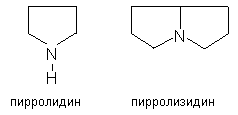
Сапонинов в лекарственном сырье.
1.1 Определение сапонинов.
1.2 Классификация.
1.3 Качественное и количественное определение.
Анализ эфирного масла.
2.2 Определение эфирных масел
2.3 Анализ.
Качественное и количественное определение антраценпроизводных в лекарственном растительном сырье
Качественное и количественное определение
Точность аналитического результата указывает на отклонение среднего арифметического анализа от «истинного значения» или от фактического содержания аналита в образце. Его часто называют точностью и относительно высокой, особенно в классических методах. С другой стороны, при анализе инструментальных трасс на результат часто влияет большое количество источников ошибок, поэтому ошибка иногда может достигать 50% от истинного значения, а в некоторых случаях даже выше. Воспроизводимость анализа приводит к повторному выполнению в тех же условиях, также называется точностью. Высокая воспроизводимость автоматически не означает, что результат анализа правильный. Если систематическая ошибка в анализе, то для нескольких определений получается почти такой же результат, но он далек от «истинного значения». Например, если соли тяжелых металлов не разрешены надлежащим образом в образце почвы, то вы можете выполнять множество измерений с высокой воспроизводимостью, вы всегда будете получать слишком малые значения анализа. Напротив, однако, нужна хорошая точность, чтобы получить лишь небольшую статистическую ошибку при нескольких определениях. В частности, в автоматизированных методах, таких как потенциометрическое титрование с полностью автоматической бюреткой, воспроизводимость относительно высока, поскольку искусственные ошибки практически невозможны. В анализе трассировки особая важность имеет предел обнаружения. Это относится к качественному анализу и указывает наименьшую массу или концентрацию вещества, которое может быть надежно обнаружено методом. Он может различаться на несколько порядков в зависимости от метода анализа. Кроме того, оба предела зависят от типа аналита, тестируемого образца и других аналитических параметров. В грубом приближении эмпирическое правило состоит в том, что предел количественной оценки в три раза превышает предел обнаружения. Селективность или специфичность указывают степень, в которой метод дает правильные и точные результаты для данного вещества в присутствии других веществ. Таким образом, комплексное титрование ионов свинца нарушается многими другими ионами тяжелых металлов. С другой стороны, если измерять пробой с помощью атомно-абсорбционной спектроскопии, возбуждаются только атомы свинца и селективность значительно выше. Чувствительность описывает, насколько сильно результат измерения реагирует на изменения концентрации. Чем больше это изменение, тем более чувствителен процесс анализа. Фальши, пределы обнаружения или количественной оценки часто приравниваются к чувствительности. Например, при фотометрии абсорбция определяется как функция концентрации аналита. До предела обнаружения измеренное значение не изменяется, измеряется только так называемое пустое значение. Надежное количественное определение возможно только в том случае, если измеренное значение значительно выше, чем пустое значение. Чувствительность метода соответствует увеличению кривой измерения. Это не имеет никакого отношения к пределу обнаружения и пределу количественной оценки. Вычисляя среднее из нескольких анализов, точность может быть улучшена. . Вычисление процентного состава важно для определения рентабельности добычи шахты.
Понятие антраценпроизводных и их свойства
Качественный анализ антрогликозидов
Количественное определение антрогликозидов
Качественное и количественное определение дубильных веществ в лекарственном растительном сырье.
Понятие о дубильных веществах и классификация
Качественный анализ дубильных веществ
Знание процентного состава вещества важно для принятия многих решений, связанных с химией. Процентный состав топлива важно знать, что топливо может потенциально производить энергию. Оценивая рентабельность добычи полезных ископаемых, ученые должны учитывать процентный состав руды. В химии имеются три разных типа расчетов, относящихся к процентному составу: процентный состав химической формулы, процентный состав экспериментальных данных и процентный состав гидрата.
Рассчитать процентный состав из химических формул
Один из самых простых способов расчета процентного состава - это химическая формула вещества, если известна химическая формула. Как и в любом проценте, процентный состав представляет собой массу части вещества, деленной на массу всего вещества, а затем умножается на Когда рассчитывается процентный состав химической формулы, вам понадобится химическая формула вещества и периодическая таблица. Вычислите массу части, умножив число этого конкретного атома на среднюю атомную массу этого атома. Разделите массу части молярной массой вещества.
Количественный анализ дубильных веществ
Качественное и количественное определение алкалоидов в лекарственном растительном сырье.
Понятие об алкалоидах и классификация
Качественное определение
Количественное определение суммы гликозидов
Список используемой литературы
Качественный анализ сапонинов в лекарственном растительном сырье.
Рассчитать процентный состав из экспериментальных данных
Молярная масса вещества возникает в результате добавления всех средних атомных масс отдельного атома. Этот ответ умножается на 100, чтобы преобразовать его в процент. Когда химическая формула вещества неизвестна, необходимо использовать данные, собранные экспериментально, для расчета процентного состава. Этот расчет производится путем деления массы экспериментально изолированной части на общую массу исходного образца.
Рассчитать процентный состав гидратов
Гидрат представляет собой ионное соединение, которое имеет определенное количество молекул воды, связанных с соединением. С гидратами водную часть гидрата можно рассчитать как процентную композицию. Чтобы рассчитать процентный состав воды в гидрате, когда известна химическая формула, добавьте массу водной части формулы и разделите ее на молярную массу всего вещества, включая молекулы воды. Умножьте результат на 100, чтобы ответ был в процентах. Если химическая формула неизвестна, процентный состав воды в гидрате может быть рассчитан по экспериментальным данным.
Для качественного анализа готовят водный настой 1:10, нагревая измельченное сырье с дистиллированной водой на водяной бане 10 минут. После охлаждения фильтруют. С фильтратом проводят качественные реакции.
1) К 2 мл водного настоя в пробирке прибавляют несколько капель раствора ацетата свинца. Образуется осадок. Причем тритерпеновые сапонины осаждаются средним ацетатом свинца, а стероидные – основным.
Сначала измеряют массу гидратированного вещества. Затем гидрат слегка нагревают, чтобы удалить воду гидратации. Затем массу безводного вещества измеряют и вычитают из гидратной массы. Это различие представляет собой массу воды. Разделите массу воды между массой гидрата и умножьте ее на 100 для расчета процентного состава.
Примеры проблем с процентным составом
Сначала умножьте среднюю атомную массу кислорода на 16 грамм на количество атомов кислорода. Процентный состав кислорода в углекислом газе составляет 32 грамма, деленный на 44 грамма, умноженный на 100, что равно 72, 7 процентного состава кислорода в двуокиси углерода.
2) Реакция Либермана – Бурхардта (на стероидное кольцо). Для проведения этой реакции испытываемое вещество растворяют в ледяной уксусной кислоте и добавляют смесь уксусного андидрида и концентрированной серной кислоты (50:1).
Через некоторое время развивается окраска от розовой до синей.
3) Реакция на пенообразование. Берут две пробирки, в одну приливают 5 мл 0,1 н раствора HCL , а в другую – 5 мл 0,1 н раствора. Затем в обе пробирки добавляют по 2 – 3 капли извлечения или раствора сапонинов в обеих пробирках образуется пена, равная по объему стойкости. Если содержатся сапонины стероидной группы (щелочная среда) – образуется более стойкая и мощная пена.
Экспериментально было обнаружено, что образец 25 г железной руды дал 17, 5 г железа. Процентная доля железа в образце составляет 17, 4 г железа, разделенного на 25 г образца, умноженного на 100, что составляет 69, 6% состава. Образец гидрата с начальным весом 50 г нагревают. Безводный образец весит 24, 9 грамма. Процентный состав воды рассчитывается путем деления массы воды на 25, 1 грамма, между массой всего образца, 50 грамм, а затем умножения ее на этот гидрат, составляет 50, 2% состава воды.
Известна наука, посвященная изучению состава, структуры, свойств и модификаций вещества. Согласно конкретному предмету исследования, существуют разные отрасли химии. Так вы можете поговорить и другие специальности. В случае, речь идет о дисциплине, ориентированной на анализ химического состава вещества через лабораторное исследование. Целью экспертов является создание более точных и быстрых методов развития.
Количественное определение сапонинов.
К 0,4 – 2,0 г. Крупного порошка испытуемого сырья добавляют 0,9 г хлористого натрия. Заливается 100 мл кипящей дистиллированной воды, взвешивается. Настаивается 15 минут на кипящей водяной бане, охлаждается. Затем колбу доводят до первоначального веса добавлением воды и фильтруют. В 10 пробирок градуированной пипеткой отмеряют испытуемый раствор в количествах, отраженных в таблице и доводят до объема, 0,9%- ым раствором хлорида натрия:
Аналитическая химия, таким образом, использует разнообразные для анализа вещества. Некоторые из устройств, которые могут быть использованы, - полярограф, спектроскоп, поляриметр и колориметр. В отличие от других подобных мер, полярография использует ртутный электроды. На графике, в котором ток и потенциал сталкиваются в аналитическом эксперименте химии, можно наблюдать, как ток колеблется в зависимости от падения капель ртути из капилляра.
Его применение сосредоточено на инструментах, работа которых включает в себя широкий спектр длин волн. Например, инструмент, известный как оптический спектрометр, используется для измерения свойств света в части определенного электромагнитного спектра. Среди переменных, которые участвуют в его действиях, - сила света и электромагнитная поляризация.
Анализ Эфирного масла.
2.1 Определение эфирных масел. Эфирные масла - прозрачные, бесцветные или слегка окрашенные (желтые, зеленые, коричневые, красноватые) жидкости, имеющие выраженный характерный аромат. Эфирные масла - маслянистые на вид жидкости, по своему химическому составу не относятся к классу жиров (масел). В состав эфирны х масел входят следующие группы химических соединений: терпены, спирты, кетоны, альдегиды, эфиры, фенолы.
Аналитическая реакция. Аналитический сигнал. Дробный и систематический анализ
Он начинается с луча света, который проходит через поляризационный фильтр и становится поляризованным лучом плоского света, который затем проходит через держатель образца, который имеет энантиомер в растворе, и именно тогда происходит отклонение. Согласно относительной ориентации, существующей между различными осями каждого поляризационного фильтра, определяется, проходит ли свет через вторую из них.
С другой стороны, учитывая решение, он также позволяет определить его поглощение. По этой причине колориметр позволяет узнать, какая концентрация известна для растворенного вещества. Этот инструмент основан на принципе, что существует пропорциональная зависимость между поглощением вещества и его концентрацией.
2.2 Анализ Эфирного масла. При исследовании эфирного масла определяют его подлинность, отсутствие примеси и числовые показатели – плотность, угол вращения, кислотное число и после ацетилирования.
Подлинность испытуемого масла устанавливают, определяя цвет, запах и вкус масла.
Цвет /прозрачность устанавливают поместив 10 мл масла в цилиндр из прозрачного бесцветного стекла диаметром 2-3 см, наблюдая в проходящем цвете.
В зависимости от типа анализируемого анализа аналитическая химия может быть разделена на качественную аналитическую химию и количественную аналитическую химию. С другой стороны, анализы могут быть разработаны из химических реакций или физических взаимодействий.
Гравиметрический анализ, например, направлен на определение уровня химического элемента в одном. Для этого он работает с молекулярными и атомными весами. С другой стороны, электроаналитический анализ анализирует аналит в соответствии с усилителями или вольтами в электрохимической ячейке.
Запах определяют следующим образом: 0,1 мл (2 капли) масла наносят на полоску фильтровой бумаги длинной около 12 см и шириной 5 см так, чтобы масло не смачивало края бумаги и сравнивают запах испытуемого образца через каждые 15 минут с запахом контрольного образца, нанесенного таким же образом на фильтровальную бумагу. В течение одного часа запах должен быть одинаков с запахом контрольного образаца.
Спектрометрические, объемные и хроматографические исследования - это другие анализы, которые разрабатываются в рамках аналитической химии. Поиск квалификации молекул привел ученых к предложению логических моделей анализа явлений природы. Химический анализ возникает в этом сценарии, предлагая ученым возможность анализа, что позволяет глубже понять их объекты исследования.
Схема возможных процедур аналитической химии. Эволюция технологии позволила методам количественного химического анализа также эволюционировать от чисто химических. Перед доменом и популяризацией электрической энергии количественные химические процедуры проводились гравиметрическим или титулометрическим путем, причем гравиметрия была процедурой, в которой наблюдается образование осадков в реакционной среде. Титриметрию можно определить как процедуру для определения концентрации вещества с использованием известного концентрационного вещества.
Вкус устанавливают, прикладывая к языку полоску фильтровальной бумаги с нанесенной на нее каплей масла или крупинку смеси 1 г сахарной пудры с одной каплей испытуемого масла.
Определение примесей :
А) Спирт этиловый. Несколько капель испытуемого масла наносят на воду налитую на часовое стекло и наблюдают на черном фоне; не должно быть заметного помутнения вокруг капли масла.
Б) Жирные и минеральные масла. 1 мл эфирного масла взбалтывают в пробке с 10 мл 90%- го этилового спирта; не должно появляться мути и жирных капель.
Числовые показатели:
А) Показатель преломления определяют в рефрактометре. Показатели преломления – отношение скорости распространения света в воздухе и скорости распространения света в испытуемом веществе. Показатель преломления зависит от природы вещества, температуры и длины волны света. Методика описана в ГФ Х с. 776.
Б) Кислотное число – это количество миллиграммов KOH, необходимое для нейтрализации свободных кислот в 1 г исследуемого в –ва. Обычно, количество кислот в эфирном масле незначительно, но при длительном хранении в результате окислительных процессов кол-во кислот увеличивается. Методика определения кислотного числа: пробу эфирного масла 0,2 -0,5 г, взятую с точностью до 0,01 г, растворяют в 5 мл 95% этилового спирта, предварительно нейтрализованного по фенолфталеину 0,1 н NaOH (если нужно, нагревают с обратным холодильником на водяной бане до полного растворения). Прибавляют 0,5 мл фенолфталеина и титруют при постоянном перемешивании 0,1 н NaOH до появления розового окрашивания, не исчезающего в течение 30 сек. 1 мл 0,1 н NaOH соответствует 5,61 мг KOH. Кислотное число вычисляют по формуле: , где V - объем 0,1 н NaOH, израсходованной на титрование, мл. m – маса навески эфирного масла, г.
Классификация.
Существует несколько классификаций дубильных веществ. Одна из них, наиболее старая, но не потерявшая своего значения и в настоящее время, основана на способности дубильных веществ разлагаться при нагревании.
Качественное определение.
1) 1, 0 крупного порошка растительного сырья залить 100 мл кипящей воды и настаивать на водяной бане (кипящей) в течение 15 минут, затем профильтровать не охлаждая через бумажный фильтр.
2) К 2-3 мл фильтрата прибавить 3 – 5 капель 1% ого раствора хлорида железа или железоаммонийных квасцов. Образуется черно – синее окрашивание при наличии дубильных веществ гидролизуемой группы или черно – зеленое окрашиваниеь (дубильные вещества конденсированной группы) , переходящие в осадки.
Количественное определение.
Около 2,0 (точная навеска) измельченного сырья, просеянного сквозь сито с диаметром отверстий 3 мм, помещают в коническую колбу вместимостью 500 мл, заливают 250 мл нагретой до кипения воды и кипятят с обратным холодильником на плитке с закрытой спиралью в течение 30 минут при периодическом помешивании. Жидкость охлаждают до комнатной температуры и процеживают около 100 мл в мерную колбу вместимостью 200 –250 мл через вату так, чтобы частицы сырья не попали в колбу. Затем пипеткой отбирают 25 мл полученного извлечения и переносят в другую колбу вместимостью 750 мл, прибавляют 500 мл воды, 25 мл раствора индигосульфокислоты и титруют при постоянном помешивании МЕДЛЕННО рпствором перманганата калия (0,-2 моль/л) до золотисто – желтого окрашивания, обусловленного образоанием изатина.
Параллельно проводят контрольный опыт. Берут 25 мл раствора индигосульфокислоты, добавляют 500 мл воды и медленно титруют раствором перманганата калия. (0Ю02 моль/л) до золотисто – желтого окрашивания. 1 мл раствора перманганата калия (0,02 моль /л) соответствует 0, 004157 г дубильных в-в в пересчете на танин. Содержание дубильных вкщкств (Х) в процентах (до второго знака 0,00%) в пересчете на абсолютно сухое сырье вычисляют по формуле:
Y – объем раствора перманганата калия, израсходованного на титрование извлечения, в мл.
Объем раствора перманганата калия, израсходованного на титрование в контрольном опыте, в мл
0,004157 – количество дубильных веществ, соответствующее 1 мл раствора перманганата калия (0,02 моль/л) в пересчете на танин, в граммах, а – масса сырья в граммах
В – потеря в массе при высушивании сырья в %(влажность)
250 – объем извлечения в мл
25 – объем извлечения, взятого для титрования в мл.
Результаты расчетов сравнить с требованиями ГФ и записать вывод: соответствует/не соответствует исследуемое сырье требованиями ГФ ХI издания.
Классификация
1. Алкалоиды с азотом в боковой цепи - эфедрин из различных видов эфедры, сферофизин из травы сферофизы солонцовой, колхицин и колхамин из клубнелуковиц безвременников.
2. Производные пирролидина и пирролизидина (платифиллин, саррацин, сенецифилллин из крестовника плосколистного и ромболистного).

3. Производные пиридина и пиперидина (анабазин, лобелин) из анабазиса безлистного и лобелии одутлой.
4. Алкалоиды с конденсированными пирролидиновыми и пиперидиновыми кольцами (производные тропана) - гиосциамин, атропин, скополамин из красавки, белены, дурмана.

5. Производные хинолизидина (пахикарпин, термопсин) - софора толстоплодная, термопсис.

6. Производные хинолина - хинин из хинной коры, эхинопсин из плодов мордовника.
7. Производные изохинолина - сальсолин из солянки Рихтера, морфин и папаверин из коробочек мака, алкалоиды чистотела, барбариса, мачка желтого.
8. Производные индола - алкалоиды спорыньи, барвинков, резерпин из корня раувольфии, стрихнин из семян чилибухи, катарантус розовый.
9. Производные пурина - кофеин из листьев чая и семян колы.
Качественное определение.
1,0 измельченного сырья заливают 25 мл 1% раствора HCl и нагревают в колбе на водяной бане (кипящей) 5 минут. Охлаждают, фильтруют. Фильтрат разливают в пробирки по 1 -2 мл и добавляют по каплям соответствующие реактивы. При наличии алкалоидов сразу или через некоторое время появляется муть или осадок, либо какое –нибудь окрашивание. Интенсивность проявления мути или осадка оценивается от одного до пяти знаков плюса.
Реактивы, осаждающие алкалоиды:
1) 1% раствор кремневольфрамовой кислоты.
2) 1-3% водный раствор фосфорномолибденовой кислоты.
3) 1-3% раствор фосфорновольфрамовой кислоты.
4) Реактив Вагнера (2,0 г К1 и 100 мл воды)
5) Реактив Майера (1,358 г двухлористой ртути в 60 мл воды + (5,0 г иодида калия в 10 мл воды разбавляют до 100 мл водой)
6) Реактив Драгендорфа (нитрат висмута основной, иодид калия, уксусная кислота, вода)
7) 10% раствор пикриновой кислоты
Реактивы, окрашивающие алкалоиды:
1. Серная и азотная кислоты: 10 капель разбавленой азотной кислоты (10 капель 30% азотной кислоты в 100 мл воды) смешивают с 20,0 г концентрированной серной кислоты. Используют смесь по 10 кап. Сильно разбавленной хлористоводородной кислоты и 20 мл конц. серной кислоты. Эти реактивы со многими алкалоидами образуют различное окрашивание: желтое, разные оттенки красного, голубого, фиолетового, зеленого.
2. Ванадин – серная кислота (ванадат аммония, 0,1 г конц. серная кислота 20,0 г. Окрашивает атропин в желто – красный цвет, аконитин – в светло – коричневый цвет, кониин – в зеленый. В рабочей тетради составить таблицу, в которой отметить знаком «плюс» (от одного до пяти) интенсивность образования мути или осадка с водными экстрактами исследуемых видов алкалоидного растительного сырья.
Качественное и количественное определение
Важнейшей характеристикой вещества является его состав: качественный и количественный. Качественный состав – это перечень всех образующих вещество химических элементов.
Количественный состав – это число атомов каждого элемента в составе мельчайшей частицы вещества – его молекулы.
Одним из основных законов химии является закон постоянства состава , который утверждает, что многие вещества, независимо от нахождения в природе или способа получения их в лаборатории, всегда имеют один и тот же состав .
§2. Химическая формула
В приборе для электролиза воды пропустим через воду электрический ток.
Под его действием молекулы воды разрушаются. Продукты протекающей химической реакции – два бесцветных газообразных вещества собираются в трубках прибора. Трубки прибора градуированы, и это позволяет определить, что объёмы газов относятся как 2:1. Если поднести тлеющую лучинку к трубке, содержащей меньший объём газа, и открыть кран, то лучинка ярко вспыхнет: один из неизвестных газов оказывается кислородом. При проверке другого газа горящей лучинкой раздается негромкий хлопок. Так сгорает водород. Следовательно, при разложении воды электрическим током образовались два газообразных вещества: водород и кислород, объемные отношения которых выражаются как 2:1.
Известно, что 1 литр водорода имеет массу, равную 0,089 г, а 1 литр кислорода – 1,429 г. Найдем соотношение масс образовавшихся в проведенном опыте веществ и получим соотношение 2:16. Известно, что масса атома кислорода равна 16, а масса атома водорода – 1. Следовательно, в молекуле воды на два атома водорода приходится один атом кислорода.
Эти расчеты подтверждают закон постоянства качественного и количественного состава вещества.
 Если мы захотим описать качественный и количественный состав молекулы воды, то нам нужно сделать такую запись: 2 атома водорода, 1 атом кислорода
. Эта запись не слишком удобна, ее лучше сделать при помощи химических знаков Н и О. Число атомов покажем при помощи индексов – чисел, которые записываются справа и снизу от химического знака, при этом число 1 не пишем. У нас получилась такая запись – Н 2 О. Данная запись и есть химическая формула.
Если мы захотим описать качественный и количественный состав молекулы воды, то нам нужно сделать такую запись: 2 атома водорода, 1 атом кислорода
. Эта запись не слишком удобна, ее лучше сделать при помощи химических знаков Н и О. Число атомов покажем при помощи индексов – чисел, которые записываются справа и снизу от химического знака, при этом число 1 не пишем. У нас получилась такая запись – Н 2 О. Данная запись и есть химическая формула.
Химическая формула – это условная запись состава вещества посредством химических знаков и индексов.
При прочтении химической формулы произносится обозначение и индексы.
Например, формула серной кислоты читается как H 2 SO 4 и обозначает, что молекула серной кислоты состоит из двух атомов водорода, одного атома серы и четырех атомов кислорода.
Формула углекислого газа – CO 2 , обозначает, что его молекула состоит из одного атома углерода и двух атомов кислорода.
Формула хлорида натрия NaCl читается так: натрий хлор. Хлорид натрия – это вещество немолекулярного строения и в нем на один атом натрия приходится один атом хлора.
§3. Описание качественного и количественного состава вещества при помощи химических формул
Чтобы получить вещество, которое называется сульфид железа, нужно смешать железо и серу в массовых отношениях 7:4. Если порошки железа и серы смешать в других массовых соотношениях, например 10 г железа смешать с 4 г серы, то реакция произойдет, но 3 г железа в реакцию не вступят.
Зная массы атомов железа (56) и серы (32), можно найти отношения чисел атомов этих элементов в сульфиде железа.
Для расчетов можно воспользоваться пропорцией: 7 массовых частей железа соединяются с 4 массовыми частями серы, а 56 массовых частей железа – с неизвестным числом массовых частей серы. 56 умножаем на 4 и делим результат на 7, получаем 32. Так как масса атома железа равна 56, а масса атома серы – 32, то в сульфиде железа на один атом железа приходится один атом серы.

Следовательно, химическая формула будет следующей – FeS .
Запись СО 2 имеет сразу два смысла: вещество углекислый газ и одна молекула углекислого газа. Иногда требуется сделать запись, обозначающую другое число молекул, тогда используют коэффициенты.
Коэффициент – это число, которое записывается перед формулой и обозначающее количество молекул, отдельных атомов или других частиц. Коэффициент 1, как и индекс 1, не записывается.
Например, запись 5 H 2 O обозначает пять молекул воды. Если нужно сделать выводы об общем количестве атомов, необходимо помнить, что коэффициент относится ко всей молекуле и в пяти молекулах воды содержится 10 атомов водорода и 5 атомов кислорода.
Запись 10 Cu обозначает 10 отдельных атомов меди, а запись 7 O 2 – 7 молекул простого вещества кислорода, содержащих 14 атомов кислорода.
Таким образом, качественный и количественный состав веществ можно описать при помощи химических формул посредством химических знаков и индексов. Число молекул, отдельных атомов или других частиц можно указать при помощи коэффициентов.
Литература:
Н.Е. Кузнецова. Химия. 8 класс. Учебник для общеобразовательных учреждений. – М. Вентана-Граф, 2012.
Для визуального оформления использовались источники:
- Отечественной войны 2 степени
- День полного освобождения Ленинграда от фашистской блокады
- Манная каша на молоке: пропорции и рецепты приготовления Манная каша 1 порция
- Суп-пюре из брокколи с сыром Рецепт крем супа из брокколи с сыром
- Гороскоп: характеристика Девы, рождённой в год Петуха
- Причины выброса токсичных веществ Несгораемые углеводороды и сажа
- Современный этап развития человечества

 Live Journal
Live Journal Facebook
Facebook Twitter
Twitter