Сколько атомов в веществе. Единицы измерения в химии. Скорость химической реакции
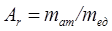
Так как массы атомов и молекул чрезвычайно малы (~10 –25 – 10 –27 кг), то их удобно измерять не в килограммах, а в специальных относительных единицах. В качестве единичной атомной массы m ед принимается двенадцатая часть массы изотопа углерода 12 С. Измерения этой величины дали следующее значение:
Относительной атомной единицей массы А r называется отношение массы данного атома m ат к атомной единице массы m ед , т. е.
В настоящее время знают: магические молекулы. Если атом увеличен до размера города, единственный протон в его ядре будет таким же большим, как мяч для гольфа. Число протонов определяет элемент, к которому принадлежит атом. Из девяностых элементов, существующих на земле, природа и человечество сформировали миллионы различных веществ, из которых существует наш мир. Периодическая система упорядочивает элементы по числу протонов в каждом атоме, хотя его создатель Дмитрий Минелеев, российский профессор химии в столетии, ничего не знал о протонах или порядковых числах.
![]() (В.2)
(В.2)
Величины А r находят экспериментально и для химических элементов приведены в таблице Менделеева.
Относительная молекулярная масса молекулы M r определяется по аналогичной формуле:
![]() (В.3)
(В.3)
Даже фактический атом еще не был обнаружен. В то время он должен был сделать 63 карты. Один для каждого из известных тогда элементов. Он не различал их по порядку, а по атомному весу. Он не очень много знал об атомах, но как он мог знать вес? Водород торчит, как и сейчас. Группы, как знал их Менделеев, теперь расположены в колонках. Есть металлы, которые взрываются в воде, как литий, натрий и калий. Кроме того, кальций и магний, которые также реагируют с водой. Большой блок посередине - это металлы, которые безопасны, например, никель, железо, цинк и золото.
Относительные молекулярные массы с достаточной точностью могут быть найдены в виде суммы относительных атомных масс, составляющих молекулу. Известно, что масса молекулы меньше составляющих её масс атомов на величину дефекта массы Δm, который определяется по формуле Эйнштейна Δm = ΔЕ /c 2 . где ΔЕ – суммарная энергия связи атомов в молекуле, а с – скорость света. Для молекул, содержащих небольшое число атомов ΔЕ ~ 10эВ = 1,6 ·10 -18 Дж. Этой энергии соответствует дефект массы Δm ~ 10 -35 кг, что в сто миллионов раз меньше масс молекул. Поэтому величиной дефекта массы пренебрегают. Зная M r для данной молекулы, легко найти её массу
Далее справа находятся металлы. Эти пробелы даны бором, углеродом и азотом. Вот некоторые проводящие элементы. Рядом с ним находятся летучие вещества, во главе с кислородом и фтором. Периодическая система принимает форму по свойствам элементов - таким, как относительный вес, проводимость и реактивность. Сегодня это похоже на время Менделеева. Между 63 элементами, известными в то время, Менделеев оставил пробелы - смелые предсказания для еще неоткрытых элементов. И когда они были наконец найдены, они полностью соответствовали его описаниям.
С момента его смерти были обнаружены десятки новых элементов. Включая целую группу, которая легко присоединяется к концу таблицы: благородные газы. Откуда берется термин «благородные газы»? Редокс-реакция состоит из двух частичных реакций, а именно окисления, а также восстановления.
![]() (В.4)
(В.4)
В системе единиц СИ количество вещества выражается в молях. Молем называют количество вещества, содержащее столько частиц (молекул, атомов, электронов, фотонов и т.д.), сколько атомов содержится в 12г изотопа углерода 12 C. Это число называют постоянной Авогадро N A . Согласно определению
Чтобы сформулировать окислительно-восстановительную реакцию, последовательно выполняются следующие этапы. Грубая формулировка реакции. Распределение окислительно-восстановительной реакции при окислении и восстановлении. Электромагнитный заряд. Пункт 2: Определение количества окисления.
Пункт 3: Распределение при окислении и восстановлении. Пункт 4: Число электронов при окислении и восстановлении. Пункты 5-6: Балансировка заряда электронов и корректировка стехиометрии с водой. Количество зарядов электронов должно быть одинаковым с левой и правой сторон реакционной стрелки. В восстановлении на правой стороне присутствует только нейтральная молекула, поэтому заряд 0 также должен появляться с левой стороны. Однако с левой стороны мы имеем 2 нитрации и 6 электронов.
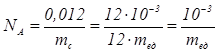 (В.5)
(В.5)
Учтя (В.1), получим
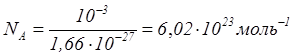 (В.6)
(В.6)
Массу одного моля называют молярной массой. Очевидно, что молярная масса
![]() (В.7)
(В.7)
1. Масса молекулы Средний размер атомов и молекул (за исключением органических соединений) не превосходит см (рис. 1). Очевидно, что тела с такими размерами не могут иметь большой массы.

Рис. 1. Атомная структура сплава золота под микроскопом
Масса молекулы обозначается и, как и любая другая масса, измеряется в кг. Несложно догадаться, что для нахождения описываемой величины необходимо измерить массу некой порции вещества и поделить её на количество молекул, входящих в эту порцию.
К примеру, в одном грамме воды содержится примерно молекул. Следовательно, по вышеуказанной формуле, масса молекулы воды составляет примерно кг. И опять-таки, если не принимать во внимание органические вещества, то массы молекул всех веществ соизмеримы по величине.
![]()
Так как всегда неудобно работать со слишком большими или слишком маленькими величинами, в физике и химии введены такие величины, как относительная атомная масса (ОАМ) и относительная молекулярная масса (ОММ).
2. Относительная молекулярная масса
Относительная атомная масса – отношения массы атома определённого химического элемента к одной двенадцатой массы атома углерода.
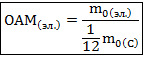
На данный момент все ОАМ известных элементов с довольно большой точностью рассчитаны и известны. Для нахождения относительной массы некой молекулы достаточно просто сложить относительные атомные массы тех элементов, которые входят в состав молекулы, причём столько раз, сколько штук атомов элемента входит в молекулу. На примере молекулы воды это выглядит:
Стоит добавить, что относительные атомные и молекулярные массы берутся из отношения к массе атома углерода, потому что углерод является одним из самых распространённых элементов в природе.
Некую порцию вещества (некое тело) иногда требуется описать не со стороны, какая масса этой порции, а какое количество частиц содержится в ней. И, как уже было сказано ранее, такими большими числами, коими описывается абсолютное количество молекул и атомов в веществе, пользоваться неудобно. Поэтому вводится такая величина, как количество вещества.
3. Количество вещества, число Авогадро Количество вещества – физическая величина, характеризующая количество молекул, входящих в некую порцию вещества. Обозначение – .
Единица измерения – моль .
1 моль – такое количество вещества, которое содержит столько же молекул (атомов), сколько 12 г углерода.
Здесь: - количество всех частиц в порции вещества; - количество частиц в одном моле, величина, обозначенная как число Авогадро.
Определение. Число Авогадро – посчитанное итальянским учёным Амедео Авогадро (рис. 2) количество атомов в 12 г углерода. Исходя из определения моля – количество молекул или атомов в 1 моле. Единица измерения - . Значение этой важной константы:
![]()
 Рис. 2. Амедео Авогадро
Рис. 2. Амедео Авогадро
Некая порция вещества в количестве 1 моля уже имеет как различимые глазом размеры (уже является макрообъектом), так и ощутимую массу. Поэтому имеет смысл ввести понятие молярной массы.
4. Молярная масса Молярная масса – масса одного моля вещества. Обозначение – . Единица измерения – . Для того чтобы вычислить эту величину, следует массу одной частицы умножить на количество частиц в 1 моле (число Авогадро). То есть:
Найти значение молярной массы для любого химического элемента можно в таблице Менделеева. В ячейке для нужного вам элемента молярная масса – это десятичная дробь. Например, для железа молярная масса 55,847 (Рис. 3).
 Рис. 3. Пример оформления элемента в таблице Менделеева
Рис. 3. Пример оформления элемента в таблице Менделеева
Следует помнить два правила работы с таблицей Менделеева. Во-первых, все значения следует округлять до целых по правилам математики. Исключение – хлор, его молярная масса = 35,5 . Во-вторых, все молярные массы даны в размерности , поэтому, чтобы перевести эту величину в единицу измерения СИ, необходимо округлённое число умножить на .
Для нахождения молярных масс сложных веществ нужно просто сложить молярные массы элементов, входящих в состав молекулы этого вещества.
Введя понятие молярной массы, мы можем теперь получить другую формулу для определения количества вещества:
Здесь: - масса порции вещества; - молярная масса вещества.
Масса m любого количества вещества равна произведению массы одной молекулы на число молекул в теле:
Оценка размеров молекул
Для полной уверенности в существовании молекул надо определить их размеры.
Проще всего это сделать, наблюдая расплывание капельки масла, например оливкового, по поверхности воды. Масло никогда не займет всю поверхность, если сосуд велик (рис.8.1
). Нельзя заставить капельку объемом 1 мм 3 расплыться так, чтобы она заняла площадь поверхности более 0,6 м 2 . Можно предположить, что при растекании масла по максимальной площади оно образует слой толщиной всего лишь в одну молекулу - «мономолекулярный слой». Толщину этого слоя нетрудно определить и тем самым оценить размеры молекулы оливкового масла.
Объем V слоя масла равен произведению его площади поверхности S на толщину d слоя, т. е. V=Sd . Следовательно, размер молекулы оливкового масла равен:
Перечислять сейчас всевозможные способы доказательства существования атомов и молекул нет необходимости. Современные приборы позволяют видеть изображения отдельных атомов и молекул. На рисунке 8.2 показана микрофотография поверхности кремниевой пластины, где бугорки - это отдельные атомы кремния. Подобные изображения впервые научились получать в 1981 г. с помощью не обычных оптических, а сложных туннельных микроскопов.

Размеры молекул, в том числе и оливкового масла, больше размеров атомов. Диаметр любого атома примерно равен 10 -8 см. Эти размеры так малы, что их трудно себе представить. В таких случаях прибегают к помощи сравнений.
Вот одно из них. Если пальцы сжать в кулак и увеличить его до размеров земного шара, то атом при том же увеличении станет размером с кулак.
6. Число молекул
При очень малых размерах молекул число их в любом макроскопическом теле огромно. Подсчитаем примерное число молекул в капле воды массой 1 г и, следовательно, объемом 1 см 3 .
Диаметр молекулы воды равен примерно 3 10 -8 см. Считая, что каждая молекула воды при плотной упаковке молекул занимает объем (3 10 -8 см) 3 , можно найти число молекул в капле, разделив объем капли (1 см 3) на объем, приходящийся на одну молекулу:
При каждом вдохе вы захватываете столько молекул, что если бы все они после выдоха равномерно распределились в атмосфере Земли, то каждый житель планеты при вдохе получил бы две-три молекулы, побывавшие в ваших легких.
Размеры атома малы: .
О трех основных положениях молекулярно-кинетической теории речь будет идти неоднократно.
7. Количество вещества и постоянная
Авогадро.
Количество вещества
наиболее естественно было бы измерять числом молекул или атомов в теле. Но число молекул в любом макроскопическом теле так велико, что в расчетах используют не абсолютное число молекул, а относительное их число.
В Международной системе единиц количество вещества выражают в молях
. Один моль - это количество вещества, в котором содержится столько же молекул или атомов, сколько атомов содержится в углероде массой 0,012 кг.
Значит, в 1 моль любого вещества содержится одно и то же число атомов или молекул. Это число атомов обозначают N A
и называют постоянной Авогадро
в честь итальянского ученого (XIX в.).
Для определения постоянной Авогадро надо найти массу одного атома углерода. Приближенная оценка массы может быть произведена так, как это было сделано выше для массы молекулы воды (наиболее точные методы основаны на отклонении пучков ионов электромагнитным полем).
Для массы атома углерода измерения дают: .
Постоянную Авогадро N A
можно определить, разделив массу углерода, взятого в количестве одного моля, на массу одного атома углерода:
Наименование моль -1 указывает на то, что N A - число атомов в 1 моле любого вещества. Если, например, количество вещества , то число молекул в теле . Отсюда видно, что количество вещества равно отношению числа молекул N в данном теле к постоянной Авогадро N A , т. е. к числу молекул в 1 моль вещества.
- Абсолютные и относительные координаты Что называется абсолютными координатами точек
- Какие меры относились к политике военного коммунизма
- Лунин, михаил сергеевич Лунин Николай Иванович: витамины
- Скончался академик борис сергеевич соколов Соколов, Борис Сергеевич Информацию О
- Рецепты варенья из кабачков с лимоном, с курагой и в ананасовом соке
- Как приготовить вкусные куриные сердечки с картофелем в мультиварке Куриные сердечки рецепт в мультиварке с картофелем
- Сырный суп с курицей и грибами Куриный суп с сыром и грибами

 Live Journal
Live Journal Facebook
Facebook Twitter
Twitter