Как определить степень окисления химических элементов. Как расставлять степени окисления в органических соединениях? Нужно помнить, что

В школе химия до сих пор занимает место одного из самых сложных предметов, который, ввиду того, что скрывает множество затруднений, вызывает у учеников (обычно это в период с 8 по 9 классы) больше ненависти и безразличия к изучению, чем интереса. Всё это снижает качество и количество знаний по предмету, хотя во многих сферах по сей день требуются специалисты в этой области. Да, сложных моментов и непонятных правил в химии иногда даже больше, чем кажется. Один из вопросов, которые волнуют большинство учеников, это что такое степень окисления и как определять степени окисления элементов.
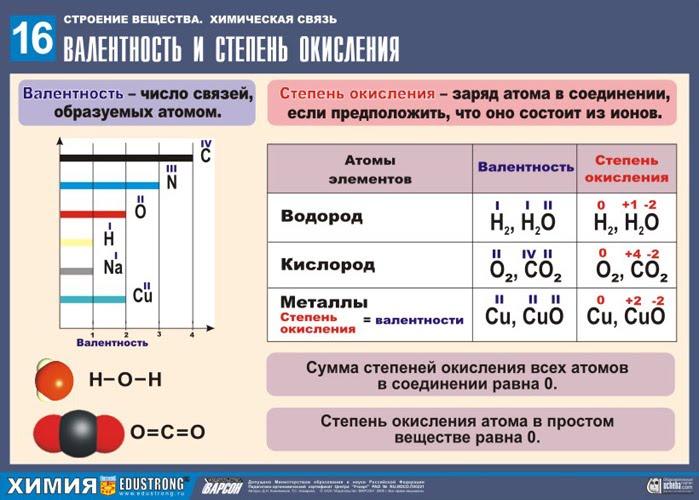
Валентность и степень окисления
Использование имен замещения и добавления требует определенного знания о соединениях и способах их соединения, поэтому они могут быть очень полезными, когда исследование специализируется, но не на начальных курсах и, что гораздо меньше, в первых контактных снимках с неорганической номенклатурой.
Простейшим типом названия композиции является стехиометрическое название, которое является лишь отражением эмпирической или молекулярной формулы соединения. Это говорит о том, что связь имеет ионный характер, что не всегда соответствует действительности. Когда пропорции элементов в формуле не совпадают, их можно указывать по-разному.
Важное правило — правило расстановки, алгоритмы
Здесь много говорится о таких соединениях, как оксиды. Для начала, любой ученик должен выучить определение оксидов - это сложные соединения из двух элементов, в их составе находится кислород. К классу бинарных соединений оксиды относят по той причине, что в алгоритме кислород стоит вторым по очереди. При определении показателя важно знать правила расстановки и рассчитать алгоритм.
Префикс моно - является избыточным и должен использоваться только в тех случаях, когда удобно отличить одно соединение от другого с теми же элементами, что и с окисью углерода и двуокисью углерода. Перемножая префиксы, чтобы указать количество атомов каждого элемента. . Таблица с префиксами множителей.
Указывая соответствующий номер окисления в скобках сразу после названия, не оставляя места. Указывая количество загрузок так же, как и предыдущее, но на арабских цифрах и с соответствующим знаком. Эти критерии обычно применяются во всех бинарных соединениях, хотя их исследование обычно классифицируется, поэтому рекомендуется обратить внимание на особенности каждого из них, поскольку в некоторых случаях рекомендуются другие названия или другие номенклатуры.
Алгоритмы для кислотных оксидов
Степени окисления - это численные выражения валентности элементов. К примеру, кислотные оксиды образованы по определённому алгоритму: сначала идут неметаллы или металлы (их валентность обычно от 4 до 7), а после идёт кислород, как и должно быть, вторым по порядку, его валентность равняется двум. Определяется она легко - по периодической таблице химических элементов Менделеева. Также важно знать то, что степень окисления элементов - это показатель, который предполагает либо положительное, либо отрицательное число .
Экспериментально установлено, что в каждом соединении элементы объединяются в определенной пропорции. Традиционно валентность элемента определяется как количество водородов, которые могут быть объединены с ним. В предыдущих примерах мы видим, что хлор связывается с водородом, в то время как кальций и кислород связываются с двумя водородами. Следовательно, валентность хлора равна 1, и как кальция, так и кислорода равна 2. Аналогично, можно сказать, что валентность азота равна 3 в аммиаке, а доля углерода в метане равна 4.
Учимся определять валентность и степень окисления
Эта связывающая способность характерна для каждого химического элемента и обусловливает то, как они соединяются с другими элементами, отличными от водорода. Представим себе на мгновение, что атомы похожи на кусочки лего, с разными размерами и формами для каждого химического элемента. Валентность будет указывать на количество выступов или полостей, которые каждый атом имеет, так что при образовании молекулы выступы одного должны входить в полости другого. Атом хлора связывается с атомом водорода, поскольку между ними существует только одна точка привязанности.
В начале алгоритма, как правило, неметалл, и его степень окисления - положительная. Неметалл кислород в оксидных соединениях имеет стабильное значение, которое равняется -2. Чтобы определить верность расстановки всех значений, нужно умножить все имеющиеся цифры на индексы у одного конкретного элемента, если произведение с учётом всех минусов и плюсов равняется 0, то расстановка достоверна.
Но у кислорода и кальция есть валентность два, т.е. они имеют две точки соединения, и в каждом из них встроен водород, так что в соответствующих соединениях в два раза больше атомов водорода, чем кислород или кальций. А что происходит, когда кальций связывается с кислородом? Ну, так как у обоих есть две точки соединения, для образования молекулы СаО требуется только одна из них. Что, если это азот, который связывается с кислородом? Поскольку азот имеет валентность 3 и кислородную валентность 2, мы оказались бы в ситуации, когда куски не подходят идеально, а предпочтительным вариантом для молекул является найти простейшую возможную атомную комбинацию, которая уравновешивает ситуацию, т.е. тот, в котором количество проекций совпадает с количеством полостей, чтобы гарантировать, что сформированная структура устойчива и устойчива.
Расстановка в кислотах, содержащих кислород
 Кислоты являются сложными веществами
, они связаны с каким-либо кислотным остатком и содержат в себе один или несколько атомов водорода. Здесь, для вычисления степени, требуются навыки в математике, так как показатели, необходимые для вычисления, цифровые. У водорода или протона он всегда одинаков — +1. У отрицательного иона кислорода отрицательная степень окисления -2.
Кислоты являются сложными веществами
, они связаны с каким-либо кислотным остатком и содержат в себе один или несколько атомов водорода. Здесь, для вычисления степени, требуются навыки в математике, так как показатели, необходимые для вычисления, цифровые. У водорода или протона он всегда одинаков — +1. У отрицательного иона кислорода отрицательная степень окисления -2.
На самом деле, в атомах нет проекций и полостей, но сочетание атомов объясняется захватом или приемом электронов в его внешнем слое, называемом валентным слоем. Поскольку наиболее устойчивой формой атома является то, в котором все его слои полны, можно дать две возможности.
Как определить степень окисления атома в псхэ?
Что атом имеет много электронов в своем последнем слое, поэтому самым простым вариантом является принятие необходимых электронов до тех пор, пока этот слой не будет завершен. Это характерно для неметаллических элементов, которые склонны принимать электроны и, таким образом, образуют анионы. То, что у атома мало электронов в его последнем слое, поэтому было бы трудно найти другие атомы настолько щедрыми, чтобы дать им все электроны, которые им нужны, чтобы заполнить их валентную оболочку, а самый простой вариант - избавиться от электронов, которые у них есть в нем, Эта ситуация характерна для металлических элементов, которые, когда они теряют электроны, легко образуют катионы. Таким образом, мы обнаруживаем, что в действительности валентность атомов связана с способностью принимать или давать электроны, и, как в этом процессе, они получают или теряют заряды, мы можем говорить о отрицательной валентности и положительной валентности соответственно.
После проведения всех этих действий можно определить степень окисления и центрального элемента формулы. Выражение для её вычисления представляет собой формулу в виде уравнения. Например, для серной кислоты уравнение будет с одним неизвестным.
Основные термины в ОВР
ОВР — это восстановительно-окислительные реакции .
Это то, что известно как число окисления. Число окисления - это число электронов, которое элемент дает или принимает, когда он сочетается с другим: если он их дает, его номер окисления имеет знак, и если он его принимает, его номер окисления имеет знак.
Случается, что атомы не всегда получают все электроны, в которых они нуждаются, или они не всегда находят другие атомы, которые принимают все те, которые они не хотят. Скажем, иногда они ведут переговоры между ними о промежуточных ситуациях, соответствующих ряду электронов между теми, кто имеет и тех, кто хочет иметь. Это означает, что атомы определенного элемента не всегда имеют одинаковое число окисления. Они могут фактически показывать несколько количеств окисления, предпочтительно один над другим.
- Степень окисления любого атома - характеризует способность этого атома присоединять или отдавать другим атомам электроны ионов (или атомов);
- Принято считать окислителями либо заряженные атомы, либо незаряженные ионы;
- Восстановителем в этом случае будут заряженные ионы или же, напротив, незаряженные атомы, которые теряют свои электроны в процессе химического взаимодействия;
- Окисление заключается в отдаче электронов.
Как расставлять степень окисления в солях
 Соли состоят из одного металла и одного или нескольких кислотных остатков. Методика определения такая же, как и в кислотосодержащих кислотах.
Соли состоят из одного металла и одного или нескольких кислотных остатков. Методика определения такая же, как и в кислотосодержащих кислотах.
Иногда, даже когда оба конкурируют за электрона, есть тот, который более настойчив и выигрывает, за счет другого, кто теряет его. Вот почему мы также находим элементы, которые могут не только иметь состояния окисления различной числовой величины, но также иметь их противоположный знак, в зависимости от химического элемента, с которым они связаны.
Тенденция к выходу или захвату электронов тесно связана с величиной, называемой электроотрицательностью. Очень электронегативные элементы имеют большую склонность к захвату электронов и образованию анионов; тогда как менее электроотрицательные обладают большей склонностью к образованию и образованию катионов. Простое правило знать порядок электроотрицательности элементов: чем выше, тем больше справа от периодической таблицы есть элемент, тем он более электроотрицателен; и, наоборот, ниже и дальше влево, тем меньше электроотрицательности.
Металл, который непосредственно образует соль, располагается в главной подгруппе, его степень будет равна номеру его группы, то есть всегда будет оставаться стабильным, положительным показателем.
В качестве примера можно рассмотреть расстановку степеней окисления в нитрате натрия. Соль образуется с помощью элемента главной подгруппы 1 группы, соответственно, степень окисления будет являться положительной и равна единице. В нитратах кислород имеет одного значение — -2. Для того чтобы получить численное значение, для начала составляется уравнение с одним неизвестным, учитывая все минусы и плюсы у значений: +1+Х-6=0. Решив уравнение, можно прийти к тому факту, что численный показатель положителен и равен + 5. Это показатель азота. Важный ключ чтобы высчитать степень окисления — таблица .
Этот порядок очень важен, так как, как правило, элементы в формуле упорядочены по порядку электрогативности. Имея это в виду, легко сделать вывод. Когда металл и неметалл объединяются, металл всегда дает электроны, а неметалл их принимает. Когда металл объединяется с водородом, металл является тем, который дает электрон водороду. Когда неметалл объединяется с водородом, возможны две ситуации: если это бора, углерода, кремния или любого из элементов азотной колонны, именно они приводят электрон к водороду; но если это элементы колонны кислорода или фтора, то это водород, который должен отказаться от своего электрона. Когда вы присоединяетесь к неметаллам вместе, вы можете перейти от всего: в этом случае поведение одного зависит от другого. Когда элемент соединен с фтором, именно побеждает фтор, потому что он является наиболее электроотрицательным элементом, поэтому он всегда принимает электрон. Как только они завершили свой последний слой, можно сказать, что их склонность к выходу или захвату электронов равна нулю, поэтому их число окисления - это название благородных газов, из-за их неприятия присоединиться к остальным смиренным и простолюдинам элементы. Итак, чтобы понять, как они сочетаются, мы должны иметь базовые знания о периодической таблице, валентах или числах окисления элементов и их атомной структуре.
Правило расстановки в основных оксидах
- Оксиды типичных металлов в любых соединениях имеют стабильный показатель окисления, он всегда не больше +1, или в других случаях +2;
- Цифровой показатель металла вычисляется при помощи периодической таблицы. Если элемент содержится в главной подгруппе 1 группы, то его значение будет +1;
- Значение оксидов, учитывая и их индексы, после умножения суммировано должны быть равны нулю, т.к. молекула в них нейтральна, частица, лишённая заряда;
- Металлы основной подгруппы 2 группы также имеют устойчивый положительный показатель, который равен +2.
Учимся определять валентность и степень окисления. И здесь студенты спрашивают: а вам нужно знать периодическую таблицу? И числа окисления? И это ответ, который студенты не ожидают услышать: ДА. Единственное утешение - это то, что все, что сказано, нет. Чтобы правильно использовать язык, вы должны сначала знать алфавит и некоторые орфографические и грамматические правила. Чтобы быть хорошими в математике, вам нужно узнать цифры и освоить основные операции. Ну, чтобы погрузиться в мир химии, вы должны знать его язык, номенклатуру и формулировку, и это невозможно, если мы не знаем его основных элементов. Практика показывает, что многие обучающиеся испытывают затруднения при определении валентности и степени окисления. Пособие направлено на овладение основополагающими химическими понятиями валентность и степень окисления, формирование умения давать количественные оценки и проводить расчеты валентности и степени окисления по химическим формулам в неорганических и органических соединениях, а также способствует подготовке студентов для сдачи ЕГЭ. Тем не менее, существует множество элементов, которые очень распространены и распространены как в химии, так и в повседневной жизни, и их следует запоминать, знать их символ и число окисления и знать, как их размещать в периодической таблице. Без этого было бы невозможно научиться называть и формулировать соединения. В качестве помощи вы можете загрузить следующую таблицу с наиболее важными металлическими и неметаллическими элементами, в которых указаны их обычные номера окисления. В настоящее время концепции окисления и восстановления были расширены, включая все процессы, в которых происходит перенос электронов.
Пособие направлено на формирование навыков самостоятельной работы с учебным материалом, осуществления поиска и использования информации, формирование и развитие творческого потенциала, повышение интереса к дисциплине. Валентность и степень окисления. Правила определения степеней окисления элементов I . Валентность В этих процессах мы можем различать. Реакция восстановления редукции: процесс, в котором вещество уменьшается, то есть оно получает электроны. Окислитель: вещество, вызывающее окисление другого, поскольку оно принимает электроны, которые происходят из окисляемого вещества. Редуктор: вещество, вызывающее уменьшение другого, потому что оно дает необходимые электроны, чтобы уменьшить другое вещество. Окислительная полуреакция: процесс окисления вещества, т.е. он теряет электроны. . Одновременно происходят процессы окисления и восстановления: восстанавливающие виды окисляются, в то время как окисляющие частицы уменьшаются. Валентность – это способность атомов присоединять к себе определенное число других атомов. Правила определения валентности 2) Атом металла стоит в формуле на первое место. 2) В формулах соединений атом неметалла, проявляющий низшую валентность, всегда стоит на втором месте, а название такого соединения оканчивается на «ид». Например, СаО – оксид кальция, NaCl – хлорид натрия, PbS – сульфид свинца. Теперь вы сами можете написать формулы любых соединений металлов с неметаллами. 3) Атом металла ставится в формуле на первое место. II . Степень окисления Степень окисления – это условный заряд, который получает атом в результате полной отдачи (принятия) электронов, исходя из условия, что все связи в соединении ионные. Рассмотрим строение атомов фтора и натрия: - Что можно сказать о завершённости внешнего уровня атомов фтора и натрия? - Какому атому легче принять, а какому легче отдать валентные электроны с целью завершения внешнего уровня? Оба атома имеют незавершённый внешний уровень? Атому натрия легче отдавать электроны, фтору – принять электроны до завершения внешнего уровня. F0 + 1ē → F-1 (нейтральный атом принимает один отрицательный электрон и приобретает степень окисления «-1», превращаясь в отрицательно заряженный ион - анион ) Na0 – 1ē → Na+1 (нейтральный атом отдаёт один отрицательный электрон и приобретает степень окисления «+1», превращаясь в положительно заряженный ион - катион )
Как определить степень окисления атома в ПСХЭ? Правила определения степени окисления атома в ПСХЭ: 1. Водород обычно проявляет степень окисления (СО) +1 (исключение, соединения с металлами (гидриды) – у водорода СО равна (-1) Me+nHn-1) 2. Кислород обычно проявляет СО -2 (исключения: О+2F2, H2O2-1 – перекись водорода) 3. Металлы проявляют только + n положительную СО 4. Фтор проявляет всегда СО равную -1 (F-1) 5. Для элементов главных подгрупп : Высшая СО (+) = номеру группыN группы Низшая СО (-) = N группы –8 Правила определения степени окисления атома в соединении: I. Степень окисления свободных атомов и атомов в молекулах простых веществ равнанулю - Na0, P40, O20 II. В сложном веществе алгебраическая сумма СО всех атомов с учётом их индексов равна нулю = 0 , а в сложном ионе его заряду. Например, H +1 N +5 O 3 -2 : (+1)*1+(+5)*1+(-2)*3 = 0 [ S +6 O 4 -2 ]2- : (+6)*1+(-2)*4 = -2 Задание 1 – определите степени окисления всех атомов в формуле серной кислоты H2SO4? 1. Проставим известные степени окисления у водорода и кислорода, а СО серы примем за «х» (+1)*1+(х)*1+(-2)*4=0 Х=6 или (+6), следовательно, у серы CО +6, т. е. S+6 Задание 2 – определите степени окисления всех атомов в формуле фосфорной кислоты H3PO4? 1. Проставим известные степени окисления у водорода и кислорода, а СО фосфора примем за «х» 2. Составим и решим уравнение, согласно правилу (II): (+1)*3+(х)*1+(-2)*4=0 Х=5 или (+5), следовательно, у фосфора CО +5, т. е. P+5 Задание 3 – определите степени окисления всех атомов в формуле иона аммония (NH4)+? 1. Проставим известную степень окисления у водорода, а СО азота примем за «х» 2. Составим и решим уравнение, согласно правилу (II): (х)*1+(+1)*4=+1 Х=-3, следовательно, у азота CО -3, т. е. N-3 Алгоритм составления формулы по степени окисления Составление названий бинарных соединений Сравним понятия «валентность» и «степень окисления»:
|
Запомни!
Валентность - - это способность атома образовывать определенное количество связей с другими атомами.
Правила определения валентности
1. В молекулах простых веществ: H2, F2, Cl2, Br2, I2 равна единице.
2. В молекулах простых веществ: O2, S8 равна двум.
3. В молекулах простых веществ: N2, P4 и CO - оксиде углерода (II) - равна трем.
4. В молекулах простых веществ, которые образует углерод (алмаз, графит), а также в органических соединениях, которые он образует, валентность углерода равна четырем.
5. В составе сложных веществ водород одновалентен, кислород, в основном, двухвалентен. Для определения валентности атомов других элементов в составе сложных веществ надо знать строение этих веществ.
Степень окисления – это условный заряд атомов химического элемента в соединении, вычисленный на основе предположения, что все соединения (с ионной и ковалентной полярной связью) состоят только из ионов.
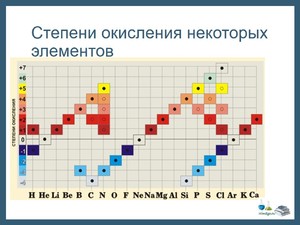
Высшая степень окисления элемента равна номеру группы.
Исключения:
фтор высшая степень окисления ноль в простом веществе F20
кислород высшая степень окисления +2 во фториде кислорода О+2F2
Низшая степень окисления элемента равна восемь минус номер группы (по числу электронов, которые атом элемента может принять до завершенного восьми электронного уровня)
Правила определения степени окисления (далее обозначим: ст. ок.)
Общее правило: Сумма всех степеней окисления элементов в молекуле с учетом количества атомов равна нулю (Молекула электронейтральна.), в ионе - равна заряду иона.
I. Степень окисления простых веществ равна нулю: Са 0 , O2 0 , Cl2 0
II. ст. ок. в бинарных c оединениях:
Менее электроотрицательный элемент ставится на первое место. (Исключения: С-4Н4+ метан и N-3H3+аммиак)
Нужно помнить, что
Ст. ок. металла всегда положительна
Ст. ок. металлов I, II, III групп главных подгрупп постоянна и равна номеру группы
Для остальных ст. ок. вычисляется по общему правилу.
Более электроотрицательный элемент ставится на второе место, его ст. ок. равна восемь минус номер группы (по числу электронов, которые он принимает до завершенного восьми электронного уровня).
Исключения: пероксиды, например, Н2+1О2-1, Ba+2O2-1 и др. ; карбиды металлов I и II групп Ag2+1C2-1,Ca+2C2-1 и др. (В школьном курсе встречается соединение FeS2 - пирит. Это дисульфид железа. Степень окисления серы в нем (-1) Fe+2S2-1). Это происходит потому, что в этих соединениях есть связи между одинаковыми атомами -О-О-, - S-S-, тройная связь в карбидах между атомами углерода. Степень окисления и валентность элементов в этих соединениях не совпадают: у углерода валентность IV, у кислорода и серы II.
III. Степень окисления в основаниях Ме + n (ОН) n равна количеству гидроксогрупп.
1. в гидроксогруппе ст. ок. кислорода -2, водорода +1, заряд гидроксогруппы 1-
2. ст. ок. металла равна количеству гидроксогрупп
IV. Степень окисления в кислотах:
1. ст. ок. водорода +1, кислорода -2
2. ст. ок. центрального атома вычисляется по общему правилу путем решения простого уравнения
Например, Н3+1РхО4-2
3∙(+1) + х + 4∙(-2) = 0
3 + х – 8 = 0
х = +5 (не забудьте знак +)
Можно запомнить, что у кислот с высшей степени окисления центрального элемента, соответствующего номеру группы, название будет заканчиваться на –ная:
Н2СО3 угольная Н2С+4О3
Н2SiО3 кремниевая (искл.) Н2Si+4О3
НNО3 азотная НN+5О3
Н3PО4 фосфорная Н3P+5О4
Н2SО4 серная Н2S+6О4
НСlО4 хлорная НCl+7О4
НMnО4 марганцовая НMn+7О4
Останется запомнить:
НNО2 азотистая НN+3О2
Н2SО3 сернистая Н2S+4О3
НСlО3 хлорноватая НCl+5О3
НСlО2 хлористая НCl+3О2
НСlОхлорноватистая НCl+1О
V. Степень окисления в солях
у центрального атома такая же, как в кислотном остатке. Достаточно помнить или определить ст. ок. элемента в кислоте.
VI. Степень окисления элемента в сложном ионе равна заряду иона.
Например, NH4+Cl- : записываем ион NхН4+1
х + 4∙(+1) = +1
ст. ок. азота -3
Например, определить ст. ок. элементов в гексацианоферрате(III) калия К3
У калия +1: К3+1, отсюда заряд иона 3-
У железа +3 (указано в названии) 3-, отсюда (CN)66-
У одной группы (CN)-
Более электроотрицательный азот: у него -3, отсюда (CхN-3)-
ст. ок. углерода +2
VII. Степень окисления углерода в органических соединениях разнообразна и вычисляется, исходя из учета того, что ст. ок. водорода равна +1, кислорода -2
Например, С3Н6
3∙х + 6∙1 = 0
ст. ок. углерода -2 (при этом валентность углерода равна IV)
Задание. Определить степень окисления и валентность фосфора в фосфорноватистой кислоте H3PO2.
Вычислим степень окисления фосфора.
Обозначим её за х. Подставим степень окисления водорода +1, а кислорода -2, умножив на соответствующее количество атомов: (+1) ∙ 3 + х + (-2) ∙ 2 = 0, отсюда х = +1.
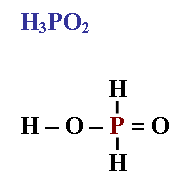
Определим валентность фосфора в этой кислоте.
Известно, что это - одноосновная кислота, поэтому только один атом водорода связан с атомом кислорода. Учитывая, что водород в соединениях одновалентен, а кислород - двухвалентен, получаем структурную формулу, из которой видно, что фосфор в этом соединении имеет валентность пять.
Графический метод определения степени окисления
в органических веществах
В органических веществах можно определять степени окисления элементов алгебраическим методом , при этом получается усредненное значение степени окисления . Этот метод наиболее применим в том случае, если все атомы углерода органического вещества по окончании реакции приобрели одинаковую степень окисления (реакции горения или полного окисления).
Рассмотрим такой случай:
Пример 1 . Обугливание дезоксирибозы серной концентрированной кислотой с дальнейшим окислением:
С5Н10О4 + H2SO4 ® CO2 + H2O + SO2
Найдём степень окисления углерода х в дезоксирибозе: 5х + 10 – 8 = 0; х = - 2/5
В электронном балансе учитываем все 5 атомов углерода:
- Хлеб по технологии в духовке на дрожжах
- Требования к главному бухгалтеру Нормативное регулирование бухгалтерского учета
- Биография. Базаров Т. Ю., Еремин - Управление персоналом Тахир базаров управление персоналом
- Михаил Светлов — Гренада: Стих Я хату покинул пошел воевать чтоб землю
- Колики у новорожденных, лечение в домашних условиях Народные средства против коликов у новорожденных
- Так делать или нет прививку от гриппа?
- Оформление спортивного уголка в доу своими руками

 Live Journal
Live Journal Facebook
Facebook Twitter
Twitter