Нейтроны входят в состав атома. Большая энциклопедия нефти и газа
В электронной оболочке любого атома столько электронов, сколько протонов в его ядре, поэтому атом в целом электронейтрален. Электроны в атоме заселяют ближайшие к ядру уровни и подуровни, потому что в этом случае их энергия меньше. На каждом уровне и подуровне может помещаться только определенное количество электронов.
Подуровни, в свою очередь, состоят из одинаковых по энергии орбиталей. Образно говоря, если электронное облако атома сравнить с городом или улицей, где "живут" все электроны данного атома, то уровень можно сравнить с домом, подуровень - с квартирой, а орбиталь - с комнатой для электронов. Все орбитали какого-нибудь подуровня имеют одинаковую энергию. На s-подуровне всего одна "комната"- орбиталь. На p-подуровне 3 орбитали, на d-подуровне 5, а на f-подуровне - целых 7 орбиталей. В каждой "комнате"-орбитали могут "жить" один или два электрона. Запрещение электронам находиться более чем по двое на одной орбитали называют запретом Паули - по имени ученого, который выяснил эту важную особенность строения атома. Каждый электрон в атоме имеет свой "адрес", который записывается набором четырех квантовых чисел. Главное квантовое число n в "адресе" электрона указывает номер уровня, на котором этот электрон находится. Электронная структура атома алюминия с n = 3 записывается следующим образом: 13 Al 1 s 2 2 s 2 2 p 6 3 s 2 3 p 1 .
Мы можем изменить количество нейтронов или электронов, и для протонов элемент не нужно менять. Если вы измените количество протонов, вы получите еще один элемент. Это углеродное ядро. И иногда вы увидите, что это записано так. И иногда также есть номер протона. И этот углерод по определению является атомным номером шесть, но мы можем только перезаписать его, чтобы мы его не забывали. Таким образом, в середине атома углерода у нас есть это ядро. А углерод 12 имеет шесть протонов и шесть нейтронов.
Другой вариант углерода, углерод 14, по-прежнему имеет шесть протонов, но имеет восемь нейтронов. И один из способов, который, пожалуй, самый важный способ задуматься о связи между электронами и ядром, заключается в том, что электроны, по-видимому, движутся вокруг этого ядра. Вы можете думать об этом, двигая электроны вокруг ядра, но это не совсем правильно. Они не двигаются, как планеты, вращающиеся вокруг Солнца. Но эта идея является хорошей отправной точкой. Другим углом зрения является идея подпрыгивания или летания электронов вокруг ядра.
Характеристика электронов внешнего энергетического уровня атома алюминия следующая:
Номер электрона Описание состояния электрона
N l me ms
11 3 0 0 – 1/2
13 3 1 – 1 – 1/2
Существует условное изображение электронных уровней и подуровней, называемое орбитальной диаграммой. На такой диаграмме орбитали условно изображаются квадратиками или черточками, а электроны - стрелочками. Если стрелочки направлены в разные стороны, это означает, что электроны различаются между собой особым свойством, которое называется спином электрона.
И это просто потому, что на этом уровне реальность различна. Давайте поговорим о квантовой физике, чтобы мы действительно могли понять, что делает электрон. Но первая модель в вашей голове состоит в том, что в середине этого атома углерода 12 у вас есть это ядро. И эти электроны подпрыгивают вокруг этого ядра. И причина, по которой эти электроны просто не убегают от этого ядра, почему они связаны с этим ядром и составляют часть этого атома, состоит в том, что протоны имеют положительный заряд. А электроны имеют отрицательный заряд.
И это одна характеристика этих элементарных частиц. Когда вы начнете думать о том, что на самом деле является обвинением, это будет довольно сложно. Но мы знаем, когда мы говорим об электромагнитной силе, которую привлекают противоположные заряды. Итак, как лучше всего думать об этом: протоны и электроны имеют разные заряды, и они притягивают друг друга. Нейтроны нейтральны, поэтому они просто сидят внутри ядра и влияют на свойства атомов определенных элементов. Но причина, по которой электроны не оставляют в покое, заключается в том, что их привлекают.
Данную систему можно назвать «гостиницей», в которую по одному «залетают» электроны и «поселяются» на определенный уровень n (1, 2, 3…), определенный подуровень (s, p, d, f). В одну «комнату» (орбиталь) может поселиться не более двух электронов (правило Паули). Поскольку s-комната (s-орбиталь) одна, то s-электронов максимум два (s 2); p-комнат (p-орбиталей) – три, то p-электронов максимум шесть (p 6); d-комнат (d-орбиталей) – пять, то d-электронов максимум десять (d 10); f-комнат (f-орбиталей) – семь, то f-электронов максимум четырнадцать (f 14). Заполнения электронов в пределах одного подуровня происходят согласно правилу Гунда - «сначала расселяем, а затем уплотняем». Согласно этому правилу электроны предпочитают расселяться на одинаковых по энергии орбиталях (например, на трех p-орбиталях) сначала по одиночке, и лишь когда в каждой такой орбитали уже находится по одному электрону, начинается заполнение этих орбиталей вторыми электронами. Когда орбиталь заселяется двумя электронами с противоположно направленными спинами, то такие электроны называют спаренными.
Их привлекают ядро. И они также двигаются невероятно быстро, это очень сложно для воображения, и снова мы начинаем касаться очень особенной части физики. Кислород будет определяться наличием восьми протонов. Но снова электроны могут взаимодействовать друг с другом. Они также могут быть приняты другими атомами. И это на самом деле составляет значительную часть нашего понимания химии. Он основан на том, сколько электронов имеет атом или определенный элемент.
И что эти электроны должны быть сконфигурированы, и какая конфигурация имеют электроны других элементов или, возможно, других атомов одного и того же элемента. Мы можем начать предвидеть, как атом одного элемента может реагировать с другим атомом одного и того же элемента. Или как атом элемента может реагировать или связывать или развязывать, привлекать или отталкивать другого атома другого элемента. Например, мы поговорим об этом позже. Возможно, что какой-то другой атом выведет электрон из углерода, просто потому, что мы почему-то говорим об определенных нейтральных атомах некоторых элементов, имеющих большее сродство к электрону, чем другие.
Во всех моделях атома электроны называют s-, p-, d- и f-электронами в зависимости от подуровня, на котором они находятся. Элементы, у которых внешние (то есть наиболее удаленные от ядра) электроны занимают только s-подуровень, принято называть s-элементами. Точно так же существуют p-элементы, d-элементы и f-элементы.
Как заполняются электронные уровни, подуровни и орбитали по мере усложнения атома.
Поэтому один из этих атомов выведет электрон из углерода, а затем этот углерод будет иметь меньше электронов, чем протоны, поэтому у нас будет 5 электронов и 6 протонов. И мы все будем говорить об этом по всей кривой химии. Мы уже знаем, как получить базовый строительный камень, называемый атомом. Что еще лучше, этот базовый строительный камень построен из еще более основных строительных блоков. И все это можно изменить, чтобы изменить свойства атома или даже тип всего атома. Ваш браузер не поддерживает аудио.
Тот факт, что ткань вокруг нас состоит из атомов, в наши дни никто никогда не сомневается. В конце концов, мы можем представить отдельные атомы, и у нас есть технические средства для их манипулирования и перемещения одного конкретного атома туда, где он нам нужен. Раннее предсказание Фейнмана о существовании времени, когда мы изучаем атомную технику, было заполнено точкой.
Если говорить более строго, то относительное расположение подуровней обусловлено не столько их большей или меньшей энергией, сколько требованием минимума полной энергии атома.
Распределение электронов по атомным орбиталям происходит, начиная с орбитали, имеющей наименьшую энергию (принцип минимума энергии), т.е. электрон садится на ближайшую к ядру орбиталь. Это значит, что сначала заполняются электронами те подуровни, для которых сумма значений квантовых чисел (n + l ) была минимальной. Так энергия электрона на 4s-подуровне меньше энергии электрона, находящегося на 3d-подуровне. Следовательно, заполнение электронами подуровней происходит в следующем порядке: 1 s < 2 s < 2 p < 3 s < 3 p < 4 s < 3 d < 4 p < 5 s < 4 d < 5 p < 6 s < 5 d ~ 4 f < 6 p < 7 s < 6 d ~ 5 f < 7 p .
Как выглядит атом, что он состоит и где его внутренняя структура продолжается? Это вопросы, к которым человечество постепенно ищет ответы. Первой моделью атома была так называемая модель пудинга, в которой ее автор, сэр Джозеф Томсон, среди прочего, электронный искатель, представлял атом как положительно заряженное вещество, в котором отрицательно заряженные электроны плавают, как изюм в пудинге. Эта первая атомная модель длилась недолго. Некоторые из них перевернулись из фильма в противоположную сторону.
Это было бы невозможно, если бы атом был заполнен непрерывно распределенной положительной массой. Стало ясно, что атом имеет небольшое положительное ядро и вокруг оболочки, в которой находятся электроны. Очень привлекательной была идея, что электроны циркулируют вокруг ядра, состоящего из положительных протонов, подобных планетам вокруг Солнца. Но квантовые законы мира малых размеров неумолимы и позволяют предсказать только вероятность появления электрона в атомной оболочке. В некоторых местах эта вероятность выше, а в других - ниже.
Исходя из этого требования, минимум энергии достигается у большинства атомов тогда, когда их подуровни заполняются в показанной выше последовательности. Но есть и исключения, которые вы можете найти в таблицах "Электронные конфигурации элементов", однако эти исключения редко приходится принимать во внимание при рассмотрении химических свойств элементов.
Идея электрона как циркулирующего шара совершенно неверна. В атомном ядре имеются положительно заряженные протоны, нейтральные нейтроны и отрицательные электроны в атомной оболочке. Если бы мы расширили атом так, чтобы его ядро достигло оранжевого, ближайший электрон находился бы в десяти километрах от ядра. Между ядром и электроном было бы пусто и пусто. Большинство атомов пустые. Так почему бы нам не бросить пол в глубины Земли? Атомные электронные упаковки взаимодействуют с электронами нашего тела и препятствуют прохождению пустых путешественников.
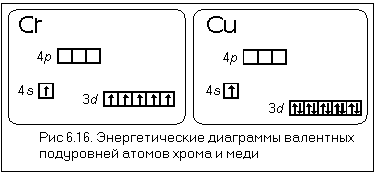
Атом хрома имеет электронную конфигурацию не 4s 2 3d 4 , a 4s 1 3d 5 . Это является примером того, как стабилизация состояний с параллельными спинами электронов преобладает над незначительной разницей энергетических состояний подуровней 3d и 4s (правила Гунда), то есть энергетически выгодными состояниями для d-подуровня являются d 5 и d 10 . Энергетические диаграммы валентных подуровней атомов хрома и меди представлены на рис.2.1.1.
Только призраки в сказках или частицы, которые не загружены, могут это сделать. Такое нейтрино проходит через Землю, не мешая ее атомам вообще. И для частиц темной материи, существование которых мы знаем только из их гравитационных эффектов, прохождение через атомы материи одинаково легко.
Количество известных элементарных частиц резко увеличилось, и в попытках их сортировки казалось, что для успешной классификации любая атомная часть ядра должна состоять из еще меньших частиц, которые мы называем сегодня кварками. Американские физики, Джордж Цвейг и Мюррей Гелл-Манн пришли к этому мнению независимо. Название кварка было выбрано Гелл-Манном по роману Джеймса Джойса «Похоронный праздник в честь Финнегана». Герой романа видит во сне енота, который во время полета за кораблем кричит: «Три кварка для мистера Марка».
Подобный переход одного электрона с s-подуровня на d-подуровень происходит еще у 8 элементов: Cu , Nb , Mo , Ru , Ag , Pt , Au . У атома Pd происходит переход двух s-электронов на d-подуровень: Pd 5s 0 4d 10 .

Рис.2.1.1. Энергетические диаграммы валентных подуровней атомов хрома и меди
Протон и нейтроны действительно представляют собой частицы, состоящие из трех кварков. В то время Гелл-Манн получил свою Нобелевскую премию по физике в Наважио Цвейга. Неудивительно, что он физически отсутствовал, и в последующие годы он был нейрохирургом, а затем работал финансовым консультантом.
Благодаря сильному взаимодействию кварки удерживаются внутри протона и нейтрона. Повсюду есть глюонное поле, мало чем отличающееся от любого клея, который захватывает кварки внутри нейтрона или протона. Также обнаружен ряд других частиц кварков. Конечно, возникает вопрос: не может ли электрон или кварк состоять из более, даже более элементарных частиц? У нас есть веские основания предполагать, что иерархия структуры структуры должна заканчиваться где-то. Если бы это было не так, то окончательный объем частицы должен был содержать бесконечную информацию о бесконечно вложенных структурах, что противоречит нашим современным представлениям.
Правила заполнения электронных оболочек:
1. Сначала выясняем, сколько всего электронов содержит атом интересующего нас элемента. Для этого достаточно знать заряд его ядра, который, всегда равен порядковому номеру элемента в Периодической таблице Д.И.Менделеева. Порядковый номер (число протонов в ядре) в точности равен и числу электронов во всем атоме.
Если бы они имели какую-либо структуру, то меньше этого предела. Возможно, все действительно элементарные частицы на самом деле являются маленькими, неделимыми вибрационными волокнами, так как это современная теория струн. И, возможно, кварки и электроны, представляем ли они их как вибрационные струны или иначе, действительно элементарные частицы, и в знании материи мы достигли конечного уровня. По крайней мере, в этот момент ничто не говорит о том, что структура ткани должна иметь последующее наблюдение.
История физики часто учила нас, что практически ничего не невозможно в природе. Вы не можете объяснить эту простую инерцию после Большого Взрыва. Последнее заключается в том, что это связано с антивеществом. В последние годы наиболее распространенным кандидатом на «драйв» Вселенной был так называемый. темная материя или антигравитация, неизвестная сила против силы тяжести, которая всхлипывает Вселенную.
2. Последовательно заполняем орбитали, начиная с 1s-орбитали, имеющимися электронами, учитывая принцип минимальной энергии. При этом нельзя располагать на каждой орбитали более двух электронов с противоположно направленными спинами (правило Паули).
3. Записываем электронную формулу элемента.
Атом – это сложная, динамически устойчивая микросистема взаимодействующих частиц: протонов р + , нейтронов n 0 и электронов е - .
Возможно, однако, темная энергия и темная материя, которые мы все еще знаем очень мало, не нужны, чтобы объяснить загадку. Новые исследования показывают, что это взаимодействие между веществом и антиматерией может быть причиной антигравитации и постоянно расширяющегося того, что есть.
Темная энергия темной энергии составляет более 90%. массы Вселенной. Они не излучают и не отражают свет, и их существование предает только гравитационные эффекты, которые они оказывают. Физики даже не знают, какова природа этих темных компонентов космоса. Попытки понять это делаются в Великом адронном коллайдере.

Рис.2.1.2. Заполнение энергетических уровней электронами элемента фосфора
Электронную структуру атома водорода (z=1) можно изобразить следующим образом:
+1 Н 1 s 1 , n = 1 , где квантовая ячейка (атомная орбиталь) обозначается в виде линии или квадрата, а электроны – в виде стрелок.
Антиматерия похожа на «нормальную» материю, но имеет противоположный заряд: антиэлектрон положительно заряжен там, и антипротон заряжается отрицательно. Таким образом, анти-водород является анти-электроном, который циркулирует вокруг антипротона. Антиматерия - лучший источник энергии во Вселенной. Водородные бомбы имеют только 1 процент. эффективность с точки зрения преобразования массы в энергию. Но когда антиматерия встречается с вопросом, 100 процентов. превращается в энергию.
Антиэлектроны производят в течение длительного времени. Они могут быть созданы радиоактивным распадом. Давайте теперь не будем бояться, что все взорвется. Ньютон не является человеком с анти-яблоком. Ученые уже давно исследуют, может ли гравитация от антиматерии быть «обратной». В конечном счете, хотя частицы, из которых они сделаны, имеют противоположные заряды, масса остается неизменной, всегда положительной. Таким образом, кажется, что мир, построенный только из антиматерии, будет иметь те же законы гравитации.
Каждый атом последующего химического элемента в периодической системе представляет собой многоэлектронный атом.
Атом лития, так же как и атом водорода и гелия, имеет электронную структуру s-элемента, т.к. последний электрон атома лития «садится» на s-подуровень:
+3 Li 1 s 2 2 s 1 2 p 0
В атоме бора появляется первый электрон в p-состоянии:
+5 В 1 s 2 2 s 2 2 p 1
Запись электронной формулы проще показать на конкретном примере. Допустим, нам надо выяснить электронную формулу элемента с порядковым номером 7. В атоме такого элемента должно быть 7 электронов. Заполним орбитали семью электронами, начиная с нижней 1s-орбитали.
Итак, 2 электрона расположатся на 1s-орбитали, еще 2 электрона - на 2s-орбитали, а оставшиеся 3 электрона смогут разместиться на трех 2p-орбиталях.
Электронная формула элемента с порядковым номером 7 (это элемент азот, имеющий символ “N”) выглядит так:
+7 N 1 s 2 2 s 2 2 p 3
Рассмотрим действие правила Гунда на примере атома азота: N 1 s 2 2 s 2 2 p 3 . На 2-м электронном уровне есть три одинаковых p-орбитали: 2px, 2py, 2pz. Электроны заселят их так, что на каждой из этих p-орбиталей окажется по одному электрону. Объясняют это тем, что в соседних ячейках электроны меньше отталкиваются друг от друга, как одноименно заряженные частицы. Полученная нами электронная формула азота несет очень важную информацию: 2-й (внешний) электронный уровень азота заполнен электронами не до конца (на нем 2 + 3 = 5 валентных электронов) и до полного заполнения не хватает трех электронов.
Внешним уровнем атома называется самый далекий от ядра уровень, на котором есть валентные электроны. Именно эта оболочка соприкасается при столкновении с внешними уровнями других атомов в химических реакциях. При взаимодействии с другими атомами азот способен принять 3 дополнительных электрона на свой внешний уровень. При этом атом азота получит завершенный, то есть максимально заполненный внешний электронный уровень, на котором расположатся 8 электронов.
![]()
Завершенный уровень энергетически выгоднее незавершенного, поэтому атом азота должен легко реагировать с любым другим атомом, способным предоставить ему 3 дополнительных электрона для завершения его внешнего уровня.

Рис.2.1.3. Заполнение энергетических уровней у s-, p-,d- и f- элементов электронами
Склонность атомов к отдаче и присоединению электронов.
Известно, что склонность атома отдавать свои и присоединять чужие электроны зависит от его энергетических характеристик (энергии ионизации и энергии сродства к электрону). Какие же атомы более склонны отдавать свои электроны, а какие – принимать чужие?
Энергией ионизации I называют минимальное значение энергии, необходимое для удаления электрона из атома А c образованием положительного иона (катиона):
А + I → А + + е -
Сродством к электрону F называется энергия, которая выделяется при присоединении к нейтральному атому А электрона с образованием отрицательного иона (аниона):
А + е - → A - + F
Характеристика, которая отражает способность атома в молекуле, оттягивать на себя электронную плотность других атомов называется электроотрицательностью атома (ЭО) . Она возрастает у атомов в периодической системе Д.И.Менделеева в периодах слева направо и в группах – снизу вверх.
4.1. Состав атомов
Слово " атом" переводится с древнегреческого языка как " неделимый" . Так и предполагалось почти до конца XIX века. В 1911 г. Э. Резерфорд обнаружил, что в атоме существует положительно заряженное ядро . Позже было доказано, что оно окружено электронной оболочкой .
Таким образом, атом представляет собой
материальную систему, состоящую из ядра и
электронной оболочки.
Атомы очень маленькие – так, по толщине
бумажного листа укладываются сотни тысяч атомов.
Размеры атомных ядер – еще в сто тысяч раз меньше
размеров атомов.
Ядра атомов заряжены положительно, но состоят
они не только из протонов. Ядра содержат еще и
нейтральные частицы, открытые в 1932 году и
названные нейтронами
. Протоны и нейтроны
вместе носят название нуклоны
– то есть
ядерные частицы.
Любой атом в целом электронейтрален, а это значит, что число электронов в электронной оболочке атома равно числу протонов в его ядре.
Таблица 11. Важнейшие характеристики электрона, протона и нейтрона
Характеристика |
Электрон |
||
| Год открытия | |||
| Первооткрыватель | Джозеф Джон Томсон |
Эрнест Резерфорд |
Джеймс Чедвик |
| Символ | |||
| Масса: обозначение значение |
m(e–) |
m(p +) |
m(n o) |
| Электрический заряд | –1,6 . 10 –19 Кл = –1е |
1,6 . 10 –19 Кл = +1е |
|
| Радиус |
- Название " электрон" происходит от греческого слова, означающего " янтарь" .
- Название " протон" происходит от греческого слова, означающего " первый" .
- Название " нейтрон" происходит от латинского слова, означающего " ни тот, ни другой" (имеется в виду его электрический заряд).
- Знаки " –" , " +" и " 0" в символах частиц занимают место правого верхнего индекса.
- Размер электрона столь мал, что в физике (в рамках современной теории) вообще считается некорректным говорить об измерении этой величины.
ЭЛЕКТРОН,
ПРОТОН, НЕЙТРОН, НУКЛОН, ЭЛЕКТРОННАЯ ОБОЛОЧКА.
1.Определите, насколько масса протона меньше
массы нейтрона. Какую часть от массы протона
составляет эта разница (выразите ее в виде
десятичной дроби и в процентах)?
2.Во сколько раз (приближенно) масса любого
нуклона больше массы электрона?
3.Определите, какую часть от массы атома составит
масса его электронов, если в состав атома входят 8
протонов и 8 нейтронов. 4.Как вы думаете, удобно ли
использовать единицы международной системы
единиц измерений (СИ) для измерений масс атомов?
4.2. Взаимодействия между частицами в атоме. Атомные ядра
Между всеми заряженными частицами атома
действуют электрические (электростатические)
силы: электроны атома притягиваются к ядру и
вместе с тем отталкиваются друг от друга.
Действие заряженных частиц друг на друга
передается электрическим полем
. 
Вам знакомо уже одно поле – гравитационное. Подробнее о том, что такое поля, и о некоторых их свойствах вы узнаете из курса физики.
Все протоны в ядре заряжены положительно и за счет электрических сил отталкиваются друг от друга. Но ядра же существуют! Следовательно, в ядре, кроме электростатических сил отталкивания, действует еще какое-то взаимодействие между нуклонами, за счет сил которого они притягиваются друг к другу, причем это взаимодействие – значительно сильнее электростатического. Эти силы называются ядерными силами , взаимодействие – сильным взаимодействием , а поле, передающее это взаимодействие – сильным полем .
В отличие от электростатического, сильное взаимодействие ощущается только на коротких расстояниях – порядка размеров ядер. Но силы притяжения, вызванные этим взаимодействием (F я). во много раз больше электростатических (F э). Отсюда – " прочность" ядер во много раз больше " прочности" атомов. Поэтому в химических явлениях изменяется только электронная оболочка, а ядра атомов остаются неизменными.
Общее число нуклонов в ядре называется массовым числом и обозначается буквой А . Число нейтронов в ядре обозначается буквой N , а число протонов – буквой Z . Эти числа связаны между собой простым соотношением:
Плотность вещества ядер огромна: она примерно равна 100 миллионам тонн на кубический сантиметр, что несоизмеримо с плотностью любого химического вещества.
ЭЛЕКТРОННАЯ ОБОЛОЧКА, АТОМНОЕ ЯДРО, МАССОВОЕ ЧИСЛО, ЧИСЛО ПРОТОНОВ, ЧИСЛО НЕЙТРОНОВ.
4.3. Нуклиды. Элементы. Изотопы
При химических peaкцияx атомы могут терять часть своих электронов, а могут и присоединять " лишние" . При этом из нейтральных атомов образуются заряженные частицы – ионы . Химическая сущность атомов при этом не меняется, то есть атом, например, хлора не превращается в атом азота или в атом какого-нибудь другого элемента. Физические воздействия довольно большой энергии могут вообще " сорвать" с атома всю электронную оболочку. Химическая сущность атома при этом также не изменится – отняв электроны у каких-нибудь других атомов, ядро снова превратится в атом или ион того же элемента. Атомы, ионы и ядра обобщенно называются нуклидами .
Для обозначения нуклидов используют символы элементов (вы помните, что они могут обозначать и один атом) с левыми индексами: верхний равен массовому числу, нижний – числу протонов. Примеры обозначения нуклидов:
В общем случае
Теперь мы можем сформулировать окончательное определение понятия " химический элемент" .
Так как заряд ядра определяется числом протонов, то химическим элементом можно назвать совокупность нуклидов с одинаковым числом протонов.Вспомнив сказанное в начале параграфа, мы можем уточнить один из важнейших химических законов.
При химических реакциях (и при физических взаимодействиях, не затрагивающих ядра) нуклиды не возникают, не исчезают и не превращаются друг в друга.
Итак, массовое число равно сумме числа протонов и числа нейтронов: А = Z + N . У нуклидов одного элемента заряд ядра одинаков (Z = const ), а число нейтронов N ? У нуклидов одного элемента число нейтронов в ядре может быть одинаковым, а может и отличаться. Поэтому и массовые числа нуклидов одного элемента могут быть разными. Примеры нуклидов одного элемента с разными массовыми числами – различные устойчивые нуклиды олова, характеристики которых приведены в табл. 12. У нуклидов с одинаковыми массовыми числами масса одинакова, а у нуклидов с разными массовыми числами – разная. Отсюда следует, что атомы одного элемента могут отличаться по массе.
Следовательно, у нуклидов одного изотопа одинаковое число протонов (так как это один элемент), одинаковое число нейтронов (так как это один изотоп) и, естественно, одинаковая масса. Такие нуклиды совершенно одинаковы и потому принципиально неразличимы. (В физике под словом "изотоп" иногда подразумевают и одинт нуклид данного изотопа)
Нуклиды разных изотопов одного элемента
отличаются массовыми числами, то есть числами
нейтронов, и массой.
Общее число известных ученым нуклидов
приближается к 2000. Из них устойчивы, то есть
существуют в природе, около 300. Элементов в
настоящее время, включая искусственно
полученные, известно 110.(Среди нуклидов физики
выделяют изобары
- нуклиды с одинаковой
массой(независимо от заряда))
Многие элементы имеют по одному природному
изотопу, например, Be, F, Nа, Al, P, Mn, Co, I, Au и некоторые
другие. Но большинство элементов имеют по два, по
три и более устойчивых изотопа.
Для описания состава атомных ядер иногда
рассчитывают доли
протонов или нейтронов в
этих ядрах.

где D i
– доля интересующих нас
объектов (например, седьмых),
N
1 – число первых объектов,
N
2 – число вторых объектов,
N
3 – число третьих объектов,
N i
– число интересующих нас объектов
(например, седьмых),
N n
– число последних по счету объектов.
Для сокращения записи формул в математике знаком обозначают сумму всех чисел N i , от первого (i = 1) до последнего (i = n ). В нашей формуле это означает, что суммируются числа всех объектов: от первого (N 1) до последнего (N n ).
Пример. В коробке лежат 5 зеленых карандашей, 3 красных и 2 синих; требуется определить долю красных карандашей.
N 1 = n з, N 2 = N к, N 3 = n c ;
![]()
Доля может выражаться простой или десятичной дробью, а также в процентах, например:
НУКЛИД, ИЗОТОП, ДОЛЯ
1.Определите долю протонов в ядре атома . .Определите долю
нейтронов в этом ядре.
2.Какова доля нейтронов в ядрах нуклидов
3.Массовое число нуклида равно 27. Доля протонов в
нем 48,2%. Нуклидом какого элемента является данный
нуклид?
4.В ядре нуклида доля нейтронов 0,582. Определите Z.
5.Во сколько раз масса атома тяжелого изотопа
урана 92 U, содержащего 148 нейтронов в ядре,
больше массы атома легкого изотопа урана,
содержащего в ядре 135 нейтронов?
4.4. Количественные характеристики атомов и химических элементов
Из количественных характеристик атома вам уже
знакомы массовое число, число нейтронов в ядре,
число протонов в ядре и заряд ядра.
Так как заряд протона равен элементарному
положительному заряду, то число протонов в ядре (Z
)
и заряд этого ядра (q
я), выраженный в
элементарных электрических зарядах, численно
равны. Поэтому, как и число протонов, заряд ядра
обычно обозначают буквой Z
.
Число протонов одинаково для всех нуклидов
какого-либо элемента, поэтому оно может
использоваться как характеристика этого
элемента. В этом случае оно называется атомным
номером.
Так как электрон "легче" любого из
нуклонов почти в 2000 раз, масса атома (m
o)
сосредоточена прежде всего в ядре. Ее можно
измерять в килограммах, но это очень неудобно.
Например, масса самого легкого атома – атома
водорода – равна 1,674 . 10– 27 кг, и даже
масса самого тяжелого из существующих на Земле
атомов – атома урана – равна всего лишь 3,952 . 10–
25 кг. Даже используя самую маленькую
десятичную долю грамма – аттограмм (аг), мы
получим значение массы атома водорода m
o (H)
= = 1,674 . 10– 9 аг. Действительно,
неудобно.
Поэтому в качестве единицы измерений масс атомов
используется специальная атомная единица массы,
для которой знаменитый американский химик
Лайнус Полинг (1901 – 1994) предложил название "
дальтон" .
Атомная единица массы с точностью, достаточной в химии, равна массе любого нуклона и близка к массе атома водорода, ядро которого состоит из одного протона. В 11-м классе из курса физики вы узнаете, почему она в действительности несколько меньше массы любой из этих частиц. Из соображений удобства измерений атомная единица массы определяется через массу нуклида самого распространенного изотопа углерода.
Обозначение атомной единицы массы – а.
е. м. или Дн.
1Дн = 1,6605655 . 10– 27 кг 1,66 . 10–
27 кг.
Если массу атома измеряют в дальтонах, то по традиции ее называют не " масса атома" , а атомная масса. Масса атома и атомная масса – одна и та же физическая величина. Так как речь идет о массе одного атома (нуклида), то ее называют атомной массой нуклида.
Обозначается атомная масса нуклида буквами А r
с указанием символа нуклида, например:
А r
(16 O) – атомная масса нуклида 16 O,
A r
(35 Cl) – атомная масса нуклида 35 Сl,
A r
(27 Аl) – атомная масса нуклида 27 Аl.
Если у элемента есть несколько изотопов, то этот элемент состоит из нуклидов с разной массой. В природе изотопный состав элементов обычно постоянен, поэтому для каждого элемента можно посчитать среднюю массу атомов этого элемента ():
где D
1 , D
2 , ..., D i
–
доля 1-го, 2-го, ...
, i
-го изотопа;
m
0 (1), m
0 (2), ..., m
0 (i
) –
масса нуклида 1-го, 2-го, ..., i-го изотопа;
n
– общее число изотопов данного элемента.
Если среднюю массу атомов элемента измеряют в
дальтонах, то в этом случае ее называют атомной
массой элемента.
Обозначается атомная масса элемента так же, как
и атомная масса нуклида, буквами А
r , но в
скобках указывается не символ нуклида, а символ
соответствующего элемента, например:
А
r (O) – атомная масса кислорода,
А
r (Сl) – атомная масса хлора,
А
r (Аl) - атомная масса алюминия.
Так как атомная масса элемента и средняя масса атома этого элемента – одна и та же физическая величина, выраженная в разных единицах измерений, то и формула для вычисления атомной массы элемента аналогична формуле для вычисления средней массы атомов этого элемента:
где D
1 , D
2 , ..., D n
–
доля 1-го, 2-го, ..., i
-того изотопа;
А r
(1), А r
(2), ..., A r
(i
)
– атомная масса 1-го, 2-го, ..., i
-го изотопа;
п –
общее число изотопов данного элемента.
АТОМНЫЙ НОМЕР ЭЛЕМЕНТА, МАССА АТОМА (НУКЛИДА),АТОМНАЯ МАССА НУКЛИДА, АТОМНАЯ ЕДИНИЦА МАССЫ, АТОМНАЯ МАССА ЭЛЕМЕНТА
 4)Какова доля а) атомов кислорода в
оксиде азота N 2 O 5 ; б) атомов серы в
серной кислоте? 5)Принимая атомную массу нуклида
численно равной массовому числу, рассчитайте
атомную массу бора, если природная смесь
изотопов бора содержит 19% изотопа 10 В и 81%
изотопа 11 В.
4)Какова доля а) атомов кислорода в
оксиде азота N 2 O 5 ; б) атомов серы в
серной кислоте? 5)Принимая атомную массу нуклида
численно равной массовому числу, рассчитайте
атомную массу бора, если природная смесь
изотопов бора содержит 19% изотопа 10 В и 81%
изотопа 11 В.
6)Принимая атомную массу нуклида численно
равной массовому числу, рассчитайте атомные
массы следующих элементов, если доли их изотопов
в природной смеси (изотопный состав) составляют:
а) 24 Mg – 0,796 25 Mg – 0,091 26 Mg – 0,113
б) 28 Si – 92,2 % 29 Si – 4,7 % 30 Si – 3,1 %
в) 63 Cu – 0,691 65 Cu – 0,309
7)Определите изотопный состав природного таллия (в долях соответствующих изотопов), если в природе встречаются изотопы таллий-207 и таллий-203, а атомная масса таллия равна 204,37 Дн.
8)Природный аргон состоит из трех изотопов. Доля нуклидов 36 Аr составляет 0,34%. Атомная масса аргона – 39,948 Дн. Определите, в каком соотношении встречаются в природе 38 Аr и 40 Аr.
9)Природный магний состоит из трех изотопов. Атомная масса магния – 24,305 Дн. Доля изотопа 25 Mg – 9,1%. Определите доли остальных двух изотопов магния с массовыми числами 24 и 26.
10)В земной коре (атмосфере, гидросфере и литосфере) атомы лития-7 встречаются примерно в 12,5 раз чаще, чем атомы лития-6. Определите атомную массу лития.
11)Атомная масса рубидия – 85,468 Дн. В природе встречаются 85 Rb и 87 Rb. Определите, во сколько раз легкого изотопа рубидия больше, чем тяжелого.
- Оформление спортивного уголка в доу своими руками
- Чему равен 1 год на меркурии
- Кто такой Николай Пейчев?
- Томас андерс - биография, фото, личная жизнь солиста дуэта "модерн токинг" Синглы Томаса Андерса
- Что показывает коэффициент обеспеченности финансовых обязательств активами Обеспеченность обязательств финансовыми активами в бюджетном учреждении
- Как приготовить классические вареники с творогом
- Как сделать тесто для яблочной шарлотки Как приготовить шарлотку с яблоками песочное тесто

 Live Journal
Live Journal Facebook
Facebook Twitter
Twitter