Какую форму имеют гибридные облака. Геометрия молекул. Понятие о теории гибридизации
Кратность ковалентной связи
Для ковалентной связи возможны случаи, когда два атома в молекуле связаны не одной связью, а двумя и более, то есть образуется не одна общая электронная пара, а несколько. Примером могут служить молекулы N 2 , O 2 , CH 2 =CH 2 (этилен), ацетилена. При образовании кратных связей одна из них будет σ, а другие π. В первую очередь образуется σ-связь, как более прочная связь.
Существование водородных связей между молекулами воды во льду объясняет низкую координацию этого и сильную связь молекул в кристаллической сети, определяющую исключительно высокую температуру плавления льда, по сравнению с остальными гидридов группы, в которых объединение молекул осуществляется силами Ван-дель-Ваальса. Низкая координация молекул воды во льду из-за водородных связей предполагает существование пустых пространств и, следовательно, относительно низкую плотность.
Низкую плотность воды можно объяснить из ее очень открытой тетраэдрической структуры. Кислоты связаны водородными связями. Водород расположен между указанными атомами кислорода. Пространство недостаточно используется, что объясняет аномально низкую плотность льда.
Часто атомы формируют свои связи за счет электронов различных подуровней. Рассмотрим пример образования молекулы BeCl 2 .
В нормальном состоянии бериллий не может принимать участие в образовании химических связей,в связи с отсутствием неспаренных электронов. Но, так как, у бериллия есть свободный p-подуровень, возможен переход атома в возбужденное состояние, которое характеризуется распариванием электронов и переходом одного их них с s- на p-подуровень.
Когда лед тает, тетраэдрическая структура разрушается из-за разрыва водородных мостиков. Это означает, что молекулы могут быть ближе друг к другу, и это приводит к увеличению плотности. В точке плавления лед менее плотный, чем жидкая вода; поэтому он плавает на этом. Это свойство является исключительным: в общем, твердые тела плотнее, чем расплавы.
Большая плотность жидкой воды заставляет задуматься об исчезновении, слиянии, существующих полостей в кристаллической сети этого. Однако было подсчитано, что если координация молекул равна 12, плотность жидкой воды будет 84, что намного выше фактического значения. Это указывает на то, что в жидкой воде по-прежнему наблюдается низкая координация; что, по-видимому, указывает на сохранение водородных связей, существующих во льду.
| s | p |
| ↓ |
4 Be:.. 2s 2 → Be * : 2s 1 2p 1
Имея два неспаренных электрона, атом бериллия способен к образованию двух связей по обменному механизму.
Образующиеся связи должны быть разными по энергии, так как электроны находятся на разных подуровнях. Однако, экспериментально доказано, что обе связи совершенно одинаковы. Следовательно, при образовании химических связей происходит выравнивание атомных орбиталей по энергии и форме. Этот процесс получил название – гибридизация , а «выровненные» орбитали называют гибридными.
В жидкой воде, вероятно, существуют группы молекул, связанные водородными связями, величина которых в статистических терминах уменьшается с ростом температуры; и есть также отдельные молекулы, которые частично занимают полости указанных группировок. При термическом перемешивании молекулы в жидкой воде постоянно отделяются и перегруппируются, так что указанная структура имеет динамический статистический характер.
Водородные связи в жидкой воде сохраняются, хотя и в уменьшающейся пропорции с температурой, вплоть до точки кипения; вот почему это, как и слияние, относительно велико. С 0 ° С плотность жидкой воды увеличивается с температурой, достигает максимума около 4 ° С, и из этой температуры плотность уменьшается.
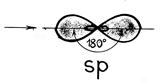
Случай гибридизации одной s- и одной p- орбитали называется sp-гибридизацией .
Для sp-гибридизации характерна линейная структура молекулы, валентный угол 180°.Такой вид гибридизации наблюдается у элементов II группы.
Например: молекула хлорида бериллия BeCl 2 - атом бериллия для образования двух связей с атомами хлора переходит в возбужденное состояние (как показано выше). В результате электронные облака одного s -(сферической форы) и одного р -электрона (имеющего фору объемной восьмерки) подвергаются sр -гибридизации, в результате которой образуются два гибридных облака, располагающихся в пространстве под углом 180 0:
Первое объясняется частичной занятостью молекул воды в полостях структуры, образованных водородными связями, аналогичными тем, что у льда. Второе явление подчиняется более сложным причинам. Когда температура увеличивается с нуля, возникают два факта, действие которых противоположно.
Как и во всех веществах, увеличение кинетической энергии молекул приводит к увеличению среднего расстояния между ними; т.е. происходит дилатация с последующим уменьшением плотности. С другой стороны, тепловая энергия заставляет связи разрушаться водородными мостиками, которые все еще существуют, и которые ответственны за тетраэдрическую, открытую структуру, а вместе с ней и низкую плотность воды. поэтому повышение температуры в этом аспекте вызывает увеличение плотности. Химическая гибридизация - это когда атом смешивает несколько атомных орбиталей с образованием новых гибридных орбиталей.


У каждого из двух атомов хлора не происходит гибридизации, так как имеется по одному необходимому неспаренному электрону (так как электрон находится на р-подуровне, форма его электронного облака - объемная восьмерка) для образования связи с бериллием:
Гибридные орбитали объясняют, как электроны расположены в образовании связей в рамках теории валентных связей и оправдывают геометрию молекул. Он состоит из атомного ядра, в котором сосредоточена почти вся его масса, окруженная облаком электронов. Атомная орбиталь: атомная орбиталь - это определенная волновая функция, пространственная и не зависящая от времени уравнение Шредингера для случая электронного орбитального гибрида: гибридная орбиталь обладает способностью смешиваться с другой, когда один из ее электронов описывает орбиты как внутри поля, принадлежащего орбите и другой орбите.
| s | p |
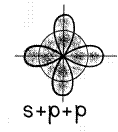
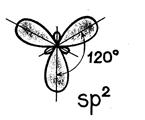
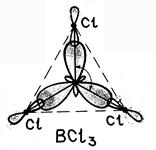
В sp 3 -гибридизация участвуют одна s- и три p- орбитали, в результате образуются четыре гибридные орбитали. Данный тип гибридизации характерен для элементов IV группы.
Электрон: электроны окружают ядро, состоящее только из протонов и нейтронов, образуя атомные орбитали, расположенные в последовательных слоях. Теория валентных связей. Теория валентных связей объясняет природу химической связи в молекуле в терминах атомных валентностей.
Теория валентной связи суммирует правило о том, что центральный атом в молекуле стремится к образуют электронные пары в соответствии с геометрическими ограничениями, как определено правилом октета. Теория валентных связей тесно связана с теорией молекулярных орбиталей. Для образования двух гибридных орбиталей. полярность. и т.д. это тип гибридной связи. как реакционная способность. биологическая активность. Геометрия молекул: молекулярная геометрия или молекулярная структура относится к трехмерному расположению атомов, которые составляют молекулу.
Например: молекула метана CH 4 6 C: 2s 2 2p 2 → С * :2s 1 2p 3
При образовании связи между двумя атомами с одинаковой электроотрицательностью (см. приложение) общая электронная пара располагается симметрично - неполярная связь.
Например: Cl 2 , Н 2 , О 2 и т.д.
Если связь неполярная, то и молекула будет неполярной.
Они представляли собой гибридизацию элементов, и мы наблюдали геометрические формы и углы. Это, в свою очередь, увеличивает необходимость заполнения оставшихся орбиталей. Мы также могли видеть некоторые изображения. Ароматические кольца могут быть гомоциклическими или гетероциклическими.
Число атомов в кольце также может меняться, считая ароматические кольца, которые, помимо всех необходимых характеристик, имеют от 4 атомов в цикле. Вкратце, для циклического соединения, которое следует считать ароматическим, требуются следующие характеристики.
Смещение электронного облака называется поляризацией и обуславливает свойство, называемое поляризуемостью.
Полярная ковалентная связь возникает при соединении атомов с различной электроотрицательностью.
Например: молекулу HCl образуют атом хлора с элетроотрицательностью, равной 3, и атом водорода с электроотрицательностью 2,1(см. приложение) – полярная связь. Происходит смещение электронного облака ближе к атому с наибольшей электроотрицательностью и молекула приобретает два полюса. Часть молекулы, куда смещается электронное облако, заряжается отрицательно, а другая положительно. В этом случае образуется диполь. Такая система, имеющая одинаковые по величине, но противоположные по знаку заряды, находящиеся на некотором расстоянии друг от друга, называется диполем. Чем сильнее поляризация, тем длина диполя больше.
Двойное переменное соединение: Представлено тире, соединения варьируются от одного до двух. Плоская структура: способность соединений представлять их в одной плоскости. . Форма молекулярных орбит определяется геометрией перекрывающихся атомных орбит. Таким образом, -перекрытие происходит за пределами линии, соединяющей ядра атомов. При образовании ковалентных связей в органических соединениях общая электронная пара устанавливает обязательную молекулярную орбиту с наименьшей энергией. Такое перекрытие происходит в линии, соединяющей ядра атомов.
Полярность молекулы определяется дипольным моментом, который равен μ = δ ℓ, где δ - заряд, измеренный в единицах заряда электрона, ℓ – длина диполя. Единицей измерения дипольного момента являются кулон·метр (Кл·м) или Дебай (D).
1D = 4,8·10 -18 эл. ст. ед.·см. = 0,33 ·10 -29 Кл·м
По величине дипольного момента можно судить о степени поляризуемости. В настоящий момент для большинства молекул величина дипольного момента известна.
Между атомами, уже связанными с -звенью, образуется связь. Разная структура - и -молекулярных орбит определяет характеристики - и -звеньев. Вращение -соединения невозможно, не нарушая его! Электроны из -МО расположены вне межъядерного пространства. Поэтому они имеют большую подвижность, чем -электроны и, следовательно, дают большую поляризацию -линии, чем -звено. ГИБРИДИЗАЦИЯ АТОМНЫХ ОРБИТАЛОВ.
Для объяснения фактов, когда атом образует большее число звеньев, чем число одиночных электронов в основном состоянии, используется идея гибридизации близких к атомным орбитам энергии. Гибридизация АО происходит при образовании ковалентной связи, если она достигает более эффективного перекрытия орбиты.
Например: HF→1,22D; HCl→1,07D; HBr→ 0,79D; HI→0,38D.
В многоатомных молекулах дипольный момент μ определяем числом полярных связей и их направленностью. Для этого находим векторную сумму отдельных связей по правилу параллелограмма. Вектором обозначим смещение электронной плотности.
Например: в молекуле H 2 O
Суммарный вектор не равен 0, значит, молекула H 2 O полярна и существует в виде диполя.
В случае sp, sp 2 , sp 3 гибридизации образуются чаще всего симметричные неполярные молекулы.
Ионная связь
Ионная связь образуется между атомами металлов с малой электроотрицательностью(см. приложение) и неметаллов с большой электроотрицательностью за счет электростатического притяжения.
Например: молекула хлорида натрия образована атомом натрия с электроотрицательностью 0,9 и атомом хлора с электроотрицательностью 3,0. Ввиду большой разницы в электроотрицательности атом натрия при образовании связи отдает один электрон (превращаясь в положительно заряженный ион), а атом хлора его принимает (превращаясь в отрицательно заряженный ион).
Для этой связи характерны ненаправленность и ненасыщаемость. У молекул с ионной связью, как правило, кристаллическая структура. В одной и той же молекуле может находиться n количество связей. Молекулы с ионной связью – гигантские молекулы.
Металлическая связь
Металлическая связь характерна для металлов. Она осуществляется за счет обобществленных электронов, свободно перемещающихся в пространстве между положительно заряженными центрами в металлах. Наличие электростатического притяжения между положительно заряженными центрами и делокализованными (подвижными) электронами обуславливает устойчивость металлической решетки. Металлическая связь в металлах объясняет такие их свойства, как электропроводность, пластичность, теплопроводность.
- Зависимость скорости ферментативной реакции от температуры, pH и времени инкубации Как влияет температура на рн
- Зависимость скорости ферментативной реакции от температуры, pH и времени инкубации Ph от температуры
- Святые богоотцы иоаким и анна Иоаким и анна когда почитание
- Храм святой великомученицы екатерины в риме
- Численность последователей основных религий и неверующих
- Абсолютные и относительные координаты Что называется абсолютными координатами точек
- Какие меры относились к политике военного коммунизма

 Live Journal
Live Journal Facebook
Facebook Twitter
Twitter