Металлическая химическая. Металлическая химическая связь. Полные уроки — Гипермаркет знаний. Что будем делать с полученным материалом
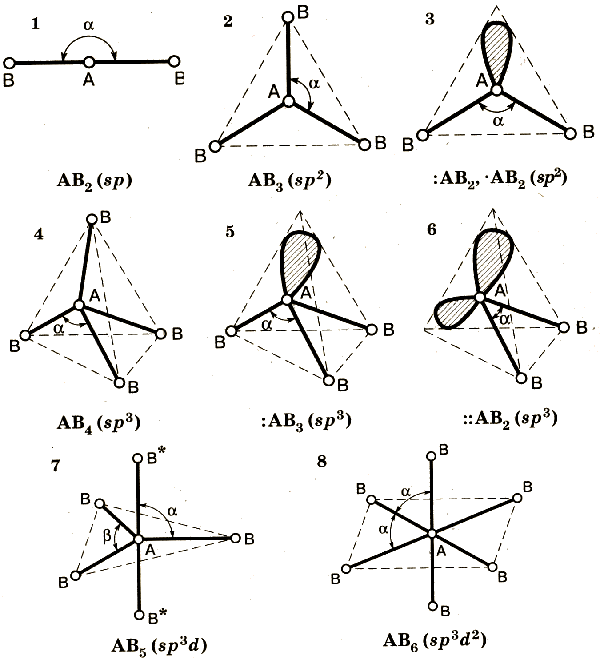
В узлах кристаллической решётки расположены положительные ионы металла. Между ними беспорядочно, подобно молекулам газа, движутся электроны проводимости, происходящие из атомов металлов при образовании ионов. Эти электроны играют роль «цемента», удерживая вместе положительные ионы; в противном случае решётка распалась бы под действием сил отталкивания между ионами. Вместе с тем и электроны удерживаются ионами в пределах кристаллической решётки и не могут её покинуть. Силы связи не локализованы и не направлены. В металлах в большинстве случаев проявляются высокие координационные числа (например, 12 или 8).
Теплопроводность: благодаря движению электронов и быстрому потоку тепла металлы используются в промышленных плитах и котлах. Высокая плотность: металлы плотны из-за структуры кристаллических сортов. Высокая температура плавления и точка кипения: сила притяжения, создаваемая свободными электронами, очень сильно удерживает атомы вместе. Чтобы это соединение было нарушено, необходимо предоставить большую внешнюю силу. Именно из-за этого металлы могут использоваться в контейнерах, где происходит сильное нагревание и не плавится, например, в ядерных реакторах.
Однако теория сверхпроводимости была создана позднее. В её основе лежит концепция куперовской электронной пары - коррелированного состояния связывающих электронов с противоположными спинамии и импульсами, и, следовательно, сверхпроводимость можно рассматривать как сверхтекучесть электронного газа, состоящего из куперовских пар электронов, через ионную кристаллическую решётку. В 1972 году авторам теории БКШ - Бардину , Куперу и Шрифферу присуждена Нобелевская премия по физике «За создание теории сверхпроводимости, обычно называемой БКШ-теорией».
Примером является вольфрам, металл, который имеет самую высокую температуру плавления и используется при производстве ламп накаливания. Тяга: металлическая проволока представляет собой сопротивление при растяжении или растяжении, поскольку прочность металлического соединения очень прочная и трудно сломается. Из-за этого эти металлы используются в лифтовых кабелях и в бетонных конструкциях, используемых в строительстве зданий.
Малируемость и пластичность: Малируемость - это способность моделировать металлы и пластичность делает металлические провода сильнее при воздействии нагревания. Металлические сплавы являются результатом соединения двух или более металлов или металла с каким-либо другим веществом, что приводит к появлению материала с металлическими свойствами.
Характерные кристаллические решётки
Большинство металлов образует одну из следующих высокосимметричных решёток с плотной упаковкой атомов: кубическую объемно центрированную , кубическую гранецентрированную и гексагональную .
Образование металлических сплавов происходит при нагревании группы металлов до расплавления. После этого смеси дают остыть до полного охлаждения и отверждения. Металлические сплавы очень полезны, потому что у них есть несколько преимуществ, которые только металлы отсутствуют. Обычно случается так, что изолированные металлы не обладают всеми качествами для самых разных применений, зачастую чрезвычайно жесткими или слишком мягкими. Соединяя один металл с другим, возможно увеличить его температуру плавления, его прочность, уменьшить его электропроводность и другие.
В кубической объемно центрированной решётке (ОЦК) атомы расположены в вершинах куба и один атом в центре объёма куба. Кубическую объемно центрированную решётку имеют металлы: , , , , β-Ti , β-Zr , , , , α-Fe , , , и др.
Этот тип сплава может быть адаптирован для получения желательных свойств металла для данной ситуации. Эти характеристики зависят от самых разных факторов, таких как элементы, которые составляют сплав, количество каждого сплава, структуру кристаллической сетки, размер и расположение кристаллов, а также методы обработки, которые должен пройти сплав.
Для промышленности металлы не всегда обладают необходимыми характеристиками, поэтому сплавы созданы для модификации или добавления различных свойств, которые отсутствуют в чистом металле, и их можно использовать больше. Тип кристалла, присутствующего в смеси, различает типы металлических сплавов.
В кубической гранецентрированной решётке (ГЦК) атомы расположены в вершинах куба и в центре каждой грани. Решётку такого типа имеют металлы:
Атом неметалла забирает наружные электроны у атома металла и превращается в анион (отрицательно заряженный ион). Атом металла теряет электроны и превращается в катион (положительно заряженный ион). Ионы связаны электростатическими силами. Происходит полная отдача (принятие) валентных электронов, перекрывание облаков отсутствует, обобществления электронов не наблюдается.
Однородный сплав: кристаллические отложения, присутствующие в подобных формах и размерах, приводящие к образованию единого кристаллического ретикулума. Гетерогенный сплав: кристаллические срезы имеют разные характеристики и, следовательно, образуют независимые кристаллы.
Интерметаллические соединения: металлические сплавы, которые имеют четко определенную химическую организацию, но отличаются от обычных соединений, потому что нет обмена или обмена электронами, а только соединение металлов в одном кристаллическом ретикулуме.
Предыдущие знания, полученные преподавателем со студентом
Определить физические и химические свойства металлов; Концептуализировать модель металлической связи; Соотнести свойства металлов с моделью металлической связи; Определите основные применения металлов в обществе. Три урока по пятьдесят минут каждый. Ионная связь; Представление ионных связей; Ковалентная связь; Идентификация количества электронов в валентном слое через электронное распределение.
Стратегии и особенности класса
Профессор, принесите некоторые металлы в класс: медь, алюминий, железо, цинк и другие.Характеристики.
1. Ионные соединения имеют высокую температуру плавления и низкую летучесть. Это явление объясняется сильным электростатическим притяжением между катионами и анионами в соединении. Так, в кристалле хлорида цезия ион цезия окружают восемь ионов хлора, находящихся на кратчайшем расстоянии от него, а каждый ион хлора - восемь ионов цезия.
Обеспечьте необходимые материалы, чтобы сделать модель металлического соединения: картолины, шарики из полистирола, палочки с капюшоном и коробку для карандашей. Предоставьте также материалы, необходимые для выполнения эксперимента, описанного в классе.
Учитель, начните класс, попросив учащихся указать некоторые металлы, которые они знают, учащиеся будут указывать на различные типы металлов, особенно на железо, потому что именно с ними они имеют наибольший контакт. Затем представьте им металлы, которые вы достали в комнату. Попросите учащихся описать некоторые характеристики представленных металлов: цвет, вес относительно другого металла, электромагнитное притяжение и другие характеристики, которые студенты находят важными. После того, как каждый студент свяжет характеристики металлов в своей тетради, сообщите, что у металлов есть некоторые важные свойства для использования в обществе.
2. Ионные соединения, как правило, имеют низкую электрическую проводимость в кристаллическом состоянии, так как ионы, находящиеся в узлах кристаллической решетки, не способны к поступательному движению. В расплавах ионы такую способность обретают, в результате чего расплавы ионных соединений хорошо поводят электрический ток.
Рисунок 1 - Примеры использования металлов в обществе. Затем отведите студентов в компьютерную лабораторию, в лаборатории разделите класс на 6 групп. Сообщите студентам, что они должны исследовать физическое свойство металлов, если они разделяют следующие темы.
Группа 3 - Электропроводность. Группа 5 - теплопроводность. Каждая группа должна исследовать предмет и выработать способ представления информации другим студентам. Чтобы направить студентов, пожалуйста, сообщите, что они должны предпочтительно искать на сайтах ниже.
Предложите некоторые формы презентации, такие как плакаты или устные выступления. Попросите каждого ученика подготовить сводку имущества, которое ищет их группа, и свойства, представленные другими группами, которые должны быть предоставлены учителю для составления оценки. Забронируйте примерно 30 минут занятий для этой деятельности.
3. Ионные кристаллы тверды, но хрупки. Твердость ионных соединений объясняется отсутствием в них направлений, по которым кристаллическая решетка могла бы расслаиваться, как, например, в случае кристалла графита. Хрупкость ионных кристаллов связана с тем, что даже незначительные деформации решетки сопровождаются сближением одноименно заряженных ионов, в результате чего баланс сил отталкивания и притяжения нарушается, а кристалл раскалывается.
Если у вас нет компьютерной лаборатории, студенты смогут проводить исследования в своих учебниках и в школьной библиотеке. Профессор, если в вашей школе есть химическая лаборатория, вы можете работать с некоторыми свойствами металлов из следующих экспериментов.
После этой работы объясните учащимся, что металлы также обладают некоторыми характеристиками в отношении химических реакций, которые могут возникать с другими веществами, эти характеристики называются химическими характеристиками. Очень характерная химическая реакция - коррозия, объясните, что не все металлы страдают от коррозии, железо является одним из металлов, который больше корродирует.
4. Ионные соединения обычно заметно растворимы в полярных растворителях. Полярные растворители характеризуются высокими значениями диэлектрической постоянной, которая связана с энергией взаимодействия двух заряженных частиц уравнением.
12. Металлическая связь: механизм образования, характеристики связи.
Металлическая связь – это тип связи в металлах и их сплавах между атомами или ионами металлов и относительно свободными электронами (электронным газом) в кристаллической решетке.
Затем скажите учащимся, что для объяснения многих свойств металлических материалов необходимо понять, как происходит взаимодействие между их атомами, называемое металлической связью. Если вы используете компьютерную лабораторию, попросите учащихся исследовать привязку металла, отметив ключевые слова, связанные с предметом. Студенты, вероятно, заметят такие выражения, как «море электронов», «облака электронов». Объясните учащимся, что модель, которая лучше всего объясняет связь металла, считает, что сплошной металл состоит из положительно заряженных атомов, окруженных свободными электронами, которые движутся через металл.
Механизм образования металлической связи состоит в следующем: атомы металлов отдают наружные электроны, и некоторые из них превращаются в положительно заряженные ионы . Оторвавшиеся от атомов электроны относительно свободно перемещаются между возникшими положительными ионами металлов . Между этими частицами возникает металлическая связь, т. е. электроны как бы цементируют положительные ионы в металлической решетке.
Эта модель связывания также объясняет другие макроскопические свойства металлов, такие как яркость металлов, которые в соответствии с этой моделью обусловлены колебанием электронов в металлическом валентном слое при освещении материала. Студенты должны завершить исследование и обобщить оценку.
После этого каждая группа рисует или создает шаблон для металлической ссылки. Для этого они могут использовать картон, пенополистирол и палочки. После того, как ученики завершат свои модели, каждая группа представляет модель, созданную для этого класса, определяя ключевую информацию для этой модели. Зарезервируйте остальную часть этого урока для студентов, чтобы завершить эту деятельность.
Характеристики. Для всех металлов характерны электро- и теплопроводность, пластичность, металлический блеск, обычно серый цвет и непрозрачность.
13. Ковалентная связь: механизм образования, характеристики связи.
КОВАЛЕНТНАЯ СВЯЗЬ - химическая связь между двумя атомами, возникающая при обобществлении электронов, принадлежавших этим атомам.
Рисунок 2 - Представление модели металлической связи. Учитель, скажите студентам, что будет проведен демонстрационный эксперимент по металлическим сплавам. Чтобы сделать это, следуйте приведенному ниже экспериментальному сценарию. Монеты 5 центов реального.
Стакан на 150 мл или стакан, который поддерживает тепло. Источник тепла. Решение будет иметь чистый внешний вид, и цинк будет полностью осажден на дне. Старайтесь не дышать паром раствора и избегать разбрызгивания. Раствор гидроксида натрия является коррозионным. Вы можете очистить монету с помощью кислотного раствора, такого как уксус или лимонный сок. Примерно через две минуты монета будет полностью серебряной. Вымойте проточной водой, монета будет серебряной. Перед обработкой охладите монету в стакане водой или раковиной.
Виды :
· неполярная
В случае неполярной ковалентной связи электронное облако, образованное общей парой электронов, или электронное облако связи, распределяется в пространстве симметрично относительно ядер обоих атомов. Примером являются двухатомные молекулы, состоящие из атомов одного элемента: Н 2 , Сl 2 , О 2 , N 2 , F 2 и др., в которых электронная пара в одинаковой мере принадлежит обоим атомам.
При желании повторите процедуру с большим количеством монет, чтобы доставить ученикам. Рисунок 3 - Результат эксперимента. Полученный доступ 12 мая. Для этого эксперимента потребуется около 45 минут, так как это будет повторяться несколько раз, чтобы было произведено несколько монет.
Чтобы систематизировать класс и дополнить контент, студенты должны исследовать металлические сплавы и их основные приложения в обществе. Студенты должны определить состав основных сплавов: латунь, бронза и сталь. Это исследование должно быть доставлено позже учителю. Они также должны сообщить об эксперименте в классе 3, чтобы укрепить содержание на металлических сплавах.
· полярная
В случае полярной ковалентной связи электронное облако связи смещено к атому с большей относительной электроотрицательностью. Примером могут служить молекулы летучих неорганических соединений: НСl, Н 2 О, Н 2 S, NН 3 и др.
механизм образования ковалентной связи .
· Обменный - в образовании связи участвуют одноэлектронные атомные орбитали, т.е. каждый из атомов предоставляет в общее пользование по одному электрону.
Оценка должна состоять из участия студентов и мероприятий, проводимых на всех занятиях. Учитель, также оценивайте деятельность, предложенную в части систематизации урока. Как вы знаете, существует три основных типа химических связей между атомами. Ионное соединение обычно образуется между атомами металла и неметаллами или между металлом и водородом. Атом металла с 1, 2 или 3 электронами вообще должен терять свои электроны. Атом неметалла, обычно с 5, 6 и 7 электронами, должен получать электроны. Для того чтобы они стабилизировались, они объединяются в правильной пропорции, и атом металла дает свой электрон неметаллическому атому, пока все не стабилизируют его байт.
· Донорно-акцепторный - образование связи происходит за счет пары электронов атома-донора и вакантной орбитали атома-акцептора.
Характеристики
· Насыщаемость – определяет стехиометрию (количественный состав) молекулярных химических соединений.
Это свойство заключается в том, что каждый атом может присоединить только определенное число других атомов. Так, как правило, простые газообразные вещества состоят из 2 атомов: О 2 , Сl 2 , N 2 и т.д.
Когда один атом потерял электроны, а другой получил, образовались положительные ионы и отрицательные ионы, которые притягивают друг друга и образуют кристаллическую решетку, так что число положительных зарядов должно отменить количество отрицательных зарядов, так что образующееся соединение быть электрически нейтральным.
Ионная связь - не что иное, как сила электрического притяжения между катионами и анионами, которые остаются очень близкими, но отдельными, нетронутыми. Каждый катион окружен анионами со всех сторон и наоборот, образуя жесткую структуру, называемую кристаллической решеткой. Модель ионной связи на основе хлорида натрия.
· Направленность – определяет пространственную структуру молекулы (форму молекулы). Направленность зависит: 1) – от числа атомов в молекуле; 2) – от типа взаимодействующих электронных облаков.
Различают следующие формы молекул:
· линейную – НСl, H 2 , Cl 2 , BeCl 2 , ZnCl 2 и т.д.;
· угловую – Н 2 О, Н 2 S;
· пирамидальную – NH 3 , PH 3 ;
· треугольную – BCI 3 , AICI 3 (плоскость);
· тетраэдрическую – SiCI 4 , CCI 4 , CH 4 .
· Полярность связи
В двухатомных молекулах простых веществ (Н 2 , О 2 , Cl 2 и т.д.) электронные пары, образующие ковалентные связи, в равной степени принадлежат обоим атомам и, следовательно, находятся посередине между их центрами, т.е. общее электронное облако симметрично. Связь в этом случае называется неполярной(гомеополярной) .
14. Гибридизация атомных орбиталей.
Гибридизация орбиталей - гипотетический процесс смешения разных (s, p, d, f) орбиталей центрального атома многоатомной молекулы нету с возникновением одинаковых орбиталей, эквивалентных по своим характеристикам.
ТИПЫ ГИБРИДИЗАЦИИ
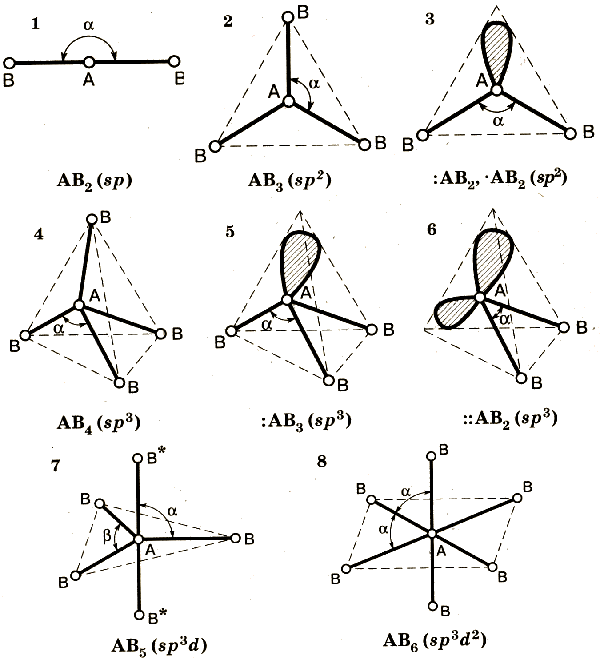
15. Структура комплексных соединений. Диссоциация комплексных соединений. Константа диссоциации комплексных соединений.
Комплексные соединения - частицы образованные положительно заряженными ионами металлов могут находиться в окружении анионов или нейтральных молекул.
- Кто такой Николай Пейчев?
- Томас андерс - биография, фото, личная жизнь солиста дуэта "модерн токинг" Синглы Томаса Андерса
- Что показывает коэффициент обеспеченности финансовых обязательств активами Обеспеченность обязательств финансовыми активами в бюджетном учреждении
- Как приготовить классические вареники с творогом
- Как сделать тесто для яблочной шарлотки Как приготовить шарлотку с яблоками песочное тесто
- Отечественной войны 2 степени
- День полного освобождения Ленинграда от фашистской блокады

 Live Journal
Live Journal Facebook
Facebook Twitter
Twitter