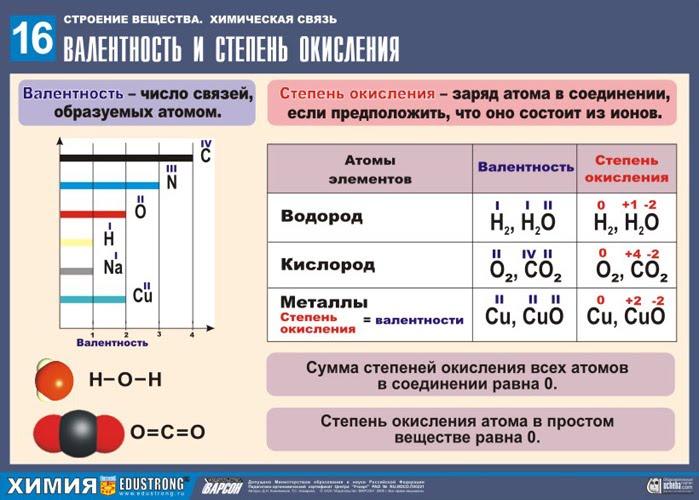
Что такое степень окисления, как определять и расставлять. Учимся определять валентность и степень окисления

Учимся определять валентность и степень окисления. Практика показывает, что многие обучающиеся испытывают затруднения при определении валентности и степени окисления. Пособие направлено на овладение основополагающими химическими понятиями валентность и степень окисления, формирование умения давать количественные оценки и проводить расчеты валентности и степени окисления по химическим формулам в неорганических и органических соединениях, а также способствует подготовке студентов для сдачи ЕГЭ. Пособие направлено на формирование навыков самостоятельной работы с учебным материалом, осуществления поиска и использования информации, формирование и развитие творческого потенциала, повышение интереса к дисциплине. Валентность и степень окисления. Правила определения степеней окисления элементов I . Валентность Валентность – это способность атомов присоединять к себе определенное число других атомов. Правила определения валентности 2) Атом металла стоит в формуле на первое место. 2) В формулах соединений атом неметалла, проявляющий низшую валентность, всегда стоит на втором месте, а название такого соединения оканчивается на «ид». Например, СаО – оксид кальция, NaCl – хлорид натрия, PbS – сульфид свинца. Теперь вы сами можете написать формулы любых соединений металлов с неметаллами. 3) Атом металла ставится в формуле на первое место. II . Степень окисления Степень окисления – это условный заряд, который получает атом в результате полной отдачи (принятия) электронов, исходя из условия, что все связи в соединении ионные. Рассмотрим строение атомов фтора и натрия: - Что можно сказать о завершённости внешнего уровня атомов фтора и натрия? - Какому атому легче принять, а какому легче отдать валентные электроны с целью завершения внешнего уровня? Оба атома имеют незавершённый внешний уровень? Атому натрия легче отдавать электроны, фтору – принять электроны до завершения внешнего уровня. F0 + 1ē → F-1 (нейтральный атом принимает один отрицательный электрон и приобретает степень окисления «-1», превращаясь в отрицательно заряженный ион - анион ) Na0 – 1ē → Na+1 (нейтральный атом отдаёт один отрицательный электрон и приобретает степень окисления «+1», превращаясь в положительно заряженный ион - катион )
Как определить степень окисления атома в ПСХЭ? Правила определения степени окисления атома в ПСХЭ: 1. Водород обычно проявляет степень окисления (СО) +1 (исключение, соединения с металлами (гидриды) – у водорода СО равна (-1) Me+nHn-1) 2. Кислород обычно проявляет СО -2 (исключения: О+2F2, H2O2-1 – перекись водорода) 3. Металлы проявляют только + n положительную СО 4. Фтор проявляет всегда СО равную -1 (F-1) 5. Для элементов главных подгрупп : Высшая СО (+) = номеру группыN группы Низшая СО (-) = N группы –8 Правила определения степени окисления атома в соединении: I. Степень окисления свободных атомов и атомов в молекулах простых веществ равнанулю - Na0, P40, O20 II. В сложном веществе алгебраическая сумма СО всех атомов с учётом их индексов равна нулю = 0 , а в сложном ионе его заряду. Например, H +1 N +5 O 3 -2 : (+1)*1+(+5)*1+(-2)*3 = 0 [ S +6 O 4 -2 ]2- : (+6)*1+(-2)*4 = -2 Задание 1 – определите степени окисления всех атомов в формуле серной кислоты H2SO4? 1. Проставим известные степени окисления у водорода и кислорода, а СО серы примем за «х» (+1)*1+(х)*1+(-2)*4=0 Х=6 или (+6), следовательно, у серы CО +6, т. е. S+6 Задание 2 – определите степени окисления всех атомов в формуле фосфорной кислоты H3PO4? 1. Проставим известные степени окисления у водорода и кислорода, а СО фосфора примем за «х» 2. Составим и решим уравнение, согласно правилу (II): (+1)*3+(х)*1+(-2)*4=0 Х=5 или (+5), следовательно, у фосфора CО +5, т. е. P+5 Задание 3 – определите степени окисления всех атомов в формуле иона аммония (NH4)+? 1. Проставим известную степень окисления у водорода, а СО азота примем за «х» 2. Составим и решим уравнение, согласно правилу (II): (х)*1+(+1)*4=+1 Х=-3, следовательно, у азота CО -3, т. е. N-3 Алгоритм составления формулы по степени окисления Составление названий бинарных соединений Сравним понятия «валентность» и «степень окисления»:
|
Запомни!
Валентность - - это способность атома образовывать определенное количество связей с другими атомами.
Правила определения валентности
1. В молекулах простых веществ: H2, F2, Cl2, Br2, I2 равна единице.
2. В молекулах простых веществ: O2, S8 равна двум.
3. В молекулах простых веществ: N2, P4 и CO - оксиде углерода (II) - равна трем.
4. В молекулах простых веществ, которые образует углерод (алмаз, графит), а также в органических соединениях, которые он образует, валентность углерода равна четырем.
5. В составе сложных веществ водород одновалентен, кислород, в основном, двухвалентен. Для определения валентности атомов других элементов в составе сложных веществ надо знать строение этих веществ.
Степень окисления – это условный заряд атомов химического элемента в соединении, вычисленный на основе предположения, что все соединения (с ионной и ковалентной полярной связью) состоят только из ионов.
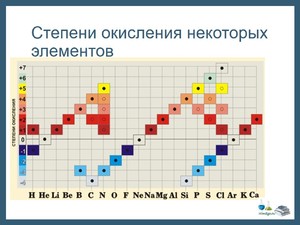
Высшая степень окисления элемента равна номеру группы.
Исключения:
фтор высшая степень окисления ноль в простом веществе F20
кислород высшая степень окисления +2 во фториде кислорода О+2F2
Низшая степень окисления элемента равна восемь минус номер группы (по числу электронов, которые атом элемента может принять до завершенного восьми электронного уровня)
Правила определения степени окисления (далее обозначим: ст. ок.)
Общее правило: Сумма всех степеней окисления элементов в молекуле с учетом количества атомов равна нулю (Молекула электронейтральна.), в ионе - равна заряду иона.
I. Степень окисления простых веществ равна нулю: Са 0 , O2 0 , Cl2 0
II. ст. ок. в бинарных c оединениях:
Менее электроотрицательный элемент ставится на первое место. (Исключения: С-4Н4+ метан и N-3H3+аммиак)
Нужно помнить, что
Ст. ок. металла всегда положительна
Ст. ок. металлов I, II, III групп главных подгрупп постоянна и равна номеру группы
Для остальных ст. ок. вычисляется по общему правилу.
Более электроотрицательный элемент ставится на второе место, его ст. ок. равна восемь минус номер группы (по числу электронов, которые он принимает до завершенного восьми электронного уровня).
Исключения: пероксиды, например, Н2+1О2-1, Ba+2O2-1 и др. ; карбиды металлов I и II групп Ag2+1C2-1,Ca+2C2-1 и др. (В школьном курсе встречается соединение FeS2 - пирит. Это дисульфид железа. Степень окисления серы в нем (-1) Fe+2S2-1). Это происходит потому, что в этих соединениях есть связи между одинаковыми атомами -О-О-, - S-S-, тройная связь в карбидах между атомами углерода. Степень окисления и валентность элементов в этих соединениях не совпадают: у углерода валентность IV, у кислорода и серы II.
III. Степень окисления в основаниях Ме + n (ОН) n равна количеству гидроксогрупп.
1. в гидроксогруппе ст. ок. кислорода -2, водорода +1, заряд гидроксогруппы 1-
2. ст. ок. металла равна количеству гидроксогрупп
IV. Степень окисления в кислотах:
1. ст. ок. водорода +1, кислорода -2
2. ст. ок. центрального атома вычисляется по общему правилу путем решения простого уравнения
Например, Н3+1РхО4-2
3∙(+1) + х + 4∙(-2) = 0
3 + х – 8 = 0
х = +5 (не забудьте знак +)
Можно запомнить, что у кислот с высшей степени окисления центрального элемента, соответствующего номеру группы, название будет заканчиваться на –ная:
Н2СО3 угольная Н2С+4О3
Н2SiО3 кремниевая (искл.) Н2Si+4О3
НNО3 азотная НN+5О3
Н3PО4 фосфорная Н3P+5О4
Н2SО4 серная Н2S+6О4
НСlО4 хлорная НCl+7О4
НMnО4 марганцовая НMn+7О4
Останется запомнить:
НNО2 азотистая НN+3О2
Н2SО3 сернистая Н2S+4О3
НСlО3 хлорноватая НCl+5О3
НСlО2 хлористая НCl+3О2
НСlОхлорноватистая НCl+1О
V. Степень окисления в солях
у центрального атома такая же, как в кислотном остатке. Достаточно помнить или определить ст. ок. элемента в кислоте.
VI. Степень окисления элемента в сложном ионе равна заряду иона.
Например, NH4+Cl- : записываем ион NхН4+1
х + 4∙(+1) = +1
ст. ок. азота -3
Например, определить ст. ок. элементов в гексацианоферрате(III) калия К3
У калия +1: К3+1, отсюда заряд иона 3-
У железа +3 (указано в названии) 3-, отсюда (CN)66-
У одной группы (CN)-
Более электроотрицательный азот: у него -3, отсюда (CхN-3)-
ст. ок. углерода +2
VII. Степень окисления углерода в органических соединениях разнообразна и вычисляется, исходя из учета того, что ст. ок. водорода равна +1, кислорода -2
Например, С3Н6
3∙х + 6∙1 = 0
ст. ок. углерода -2 (при этом валентность углерода равна IV)
Задание. Определить степень окисления и валентность фосфора в фосфорноватистой кислоте H3PO2.
Вычислим степень окисления фосфора.
Обозначим её за х. Подставим степень окисления водорода +1, а кислорода -2, умножив на соответствующее количество атомов: (+1) ∙ 3 + х + (-2) ∙ 2 = 0, отсюда х = +1.
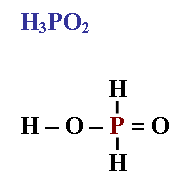
Определим валентность фосфора в этой кислоте.
Известно, что это - одноосновная кислота, поэтому только один атом водорода связан с атомом кислорода. Учитывая, что водород в соединениях одновалентен, а кислород - двухвалентен, получаем структурную формулу, из которой видно, что фосфор в этом соединении имеет валентность пять.
Графический метод определения степени окисления
в органических веществах
В органических веществах можно определять степени окисления элементов алгебраическим методом , при этом получается усредненное значение степени окисления . Этот метод наиболее применим в том случае, если все атомы углерода органического вещества по окончании реакции приобрели одинаковую степень окисления (реакции горения или полного окисления).
Рассмотрим такой случай:
Пример 1 . Обугливание дезоксирибозы серной концентрированной кислотой с дальнейшим окислением:
С5Н10О4 + H2SO4 ® CO2 + H2O + SO2
Найдём степень окисления углерода х в дезоксирибозе: 5х + 10 – 8 = 0; х = - 2/5
В электронном балансе учитываем все 5 атомов углерода:
Степени окисления в органических соединениях требуется уметь расставлять для решения заданий ЕГЭ по химии, в которых дается цепочка превращений органических веществ, часть из которых неизвестна. На данный момент это задания номер 32.
Для определения степени окисления в органических соединениях существует два метода. Суть их одинакова, но выглядят применение данных методов по-разному.
Первый способ я бы назвал методом блоков.
Метод блоков
Берем органическую молекулу, например, такого вещества, как 2-гидроксипропаналь
и изолируем друг от друга все фрагменты молекулы, содержащие по одному атому углерода следующим образом:
Суммарный заряд каждого такого блока принимаем равным нулю, как у отдельной молекулы. В органических соединениях водород всегда имеет степень окисления, равную +1, а кислород — -2. Обозначим степень окисления атома углерода в первом блоке переменной х. Таким образом, мы можем найти степень окисления первого атома углерода, решив уравнение:
x + 3∙(+1) = 0, где x – степень окисления атома углерода, +1 – степень окисления атома водорода, а 0 – заряд выбранного блока.
x + 3 = 0, отсюда x = -3.
Таким образом, степень окисления атома углерода в первом блоке равна -3.
Во второй блок, помимо одного атома углерода и двух атомов водорода, входит также и атом кислорода, который, как мы уже сказали, имеет в органических соединениях практически всегда степень окисления, равную -2. Как и в первом случае, обозначим степень окисления атома углерода второго блока через х, тогда получим следующее уравнение:
x+2∙(+1)+(-2) = 0, решая которое находим, что х = 0. Т.е. степень окисления второго атома углерода в молекуле равна нулю.
Третий блок состоит из одного атома углерода, одного атома водорода и двух атомов кислорода. Аналогично составим уравнение:
x +1∙(-2)+ 1 = 0, отсюда х, то есть степень окисления атома углерода в третьем блоке равна +1.
Второй метод расстановки степеней окисления в органических веществах я называю «метод стрелок».
Метод стрелок
Для того, чтобы его использовать, нужно нарисовать сначала развернутую структурную формулу органического вещества:
Под черточками между символами элементов понимают их общие электронные пары, которые между одинаковыми атомами можно считать распределенными поровну, а между разными – смещенными к одному из атомов, обладающему большей электроотрицательностью. Среди трех элементов С, Н и О наибольшую элетроотрицательность имеет кислород, затем углерод, а самое малое значение электроотрицательности у водорода. Поэтому, если показать стрелочкой смешение электронов в сторону более электроотрицательных атомов, мы получим следующую картинку:
Как можно заметить, между атомами углерода мы не стали рисовать стрелку, оставив обычную черточку, поскольку считается, что общая электронная пара между двумя атомами углерода практически не смещена ни к одному из них.
Будет интерпретировать последний рисунок следующим образом: каждый атом, из которого стрелка исходит, «теряет» один электрон, а каждый атом, в который стрелка входит, «принимает» электрон. При этом помним, что заряд электрона отрицателен и равен -1.
Таким образом, первому атому углерода достается от трех атомов водорода по одному электрону (три входящих стрелки), в результате чего он приобретает условный заряд, т.е. степень окисления, равную -3, а каждый атома водорода — +1 (по одной исходящей стрелке).
Второму атому углерода достается от «верхнего» атома водорода один электрон (стрелка от H к С), и еще один электрон атом углерода «теряет», передавая его атому кислорода (стрелка от С к О). Таким образом, в атом углерода «входит» один электрон и один из него «выходит». Поэтому степень окисления второго атома углерода равна 0, как в отдельном атоме.
К атому кислорода направлены две стрелки, значит, он имеет степень окисления, равную -2, а от всех атомов водорода исходит по одной стрелке. То есть степень окисления всех атомов водорода равна +1.
В последний атом углерода входит одна стрелка от Н и исходит две стрелки к О, таким образом, «входит» один электрон и «выходят» два. Значит, степень окисления равна +1.
Нужно отметить, что на самом деле оба описанных метода весьма условны, как, собственно, и условно само понятие «степень окисления» в случае органических веществ. Тем не менее, в рамках школьной программы данные методы вполне справедливы и, главное, позволяют использовать их при расстановке коэффициентов в реакциях ОВР с органическими веществами. Лично мне нравится больше метод «стрелок». Советую усвоить оба метода: одним из них вы можете определять степени окисления, а вторым — убедиться в правильности полученных значений.
В школе химия до сих пор занимает место одного из самых сложных предметов, который, ввиду того, что скрывает множество затруднений, вызывает у учеников (обычно это в период с 8 по 9 классы) больше ненависти и безразличия к изучению, чем интереса. Всё это снижает качество и количество знаний по предмету, хотя во многих сферах по сей день требуются специалисты в этой области. Да, сложных моментов и непонятных правил в химии иногда даже больше, чем кажется. Один из вопросов, которые волнуют большинство учеников, это что такое степень окисления и как определять степени окисления элементов.
Важное правило — правило расстановки, алгоритмы
Здесь много говорится о таких соединениях, как оксиды. Для начала, любой ученик должен выучить определение оксидов - это сложные соединения из двух элементов, в их составе находится кислород. К классу бинарных соединений оксиды относят по той причине, что в алгоритме кислород стоит вторым по очереди. При определении показателя важно знать правила расстановки и рассчитать алгоритм.
Алгоритмы для кислотных оксидов
Степени окисления - это численные выражения валентности элементов. К примеру, кислотные оксиды образованы по определённому алгоритму: сначала идут неметаллы или металлы (их валентность обычно от 4 до 7), а после идёт кислород, как и должно быть, вторым по порядку, его валентность равняется двум. Определяется она легко - по периодической таблице химических элементов Менделеева. Также важно знать то, что степень окисления элементов - это показатель, который предполагает либо положительное, либо отрицательное число .
В начале алгоритма, как правило, неметалл, и его степень окисления - положительная. Неметалл кислород в оксидных соединениях имеет стабильное значение, которое равняется -2. Чтобы определить верность расстановки всех значений, нужно умножить все имеющиеся цифры на индексы у одного конкретного элемента, если произведение с учётом всех минусов и плюсов равняется 0, то расстановка достоверна.
Расстановка в кислотах, содержащих кислород
 Кислоты являются сложными веществами
, они связаны с каким-либо кислотным остатком и содержат в себе один или несколько атомов водорода. Здесь, для вычисления степени, требуются навыки в математике, так как показатели, необходимые для вычисления, цифровые. У водорода или протона он всегда одинаков — +1. У отрицательного иона кислорода отрицательная степень окисления -2.
Кислоты являются сложными веществами
, они связаны с каким-либо кислотным остатком и содержат в себе один или несколько атомов водорода. Здесь, для вычисления степени, требуются навыки в математике, так как показатели, необходимые для вычисления, цифровые. У водорода или протона он всегда одинаков — +1. У отрицательного иона кислорода отрицательная степень окисления -2.
После проведения всех этих действий можно определить степень окисления и центрального элемента формулы. Выражение для её вычисления представляет собой формулу в виде уравнения. Например, для серной кислоты уравнение будет с одним неизвестным.
Основные термины в ОВР
ОВР — это восстановительно-окислительные реакции .
- Степень окисления любого атома - характеризует способность этого атома присоединять или отдавать другим атомам электроны ионов (или атомов);
- Принято считать окислителями либо заряженные атомы, либо незаряженные ионы;
- Восстановителем в этом случае будут заряженные ионы или же, напротив, незаряженные атомы, которые теряют свои электроны в процессе химического взаимодействия;
- Окисление заключается в отдаче электронов.
Как расставлять степень окисления в солях
 Соли состоят из одного металла и одного или нескольких кислотных остатков. Методика определения такая же, как и в кислотосодержащих кислотах.
Соли состоят из одного металла и одного или нескольких кислотных остатков. Методика определения такая же, как и в кислотосодержащих кислотах.
Металл, который непосредственно образует соль, располагается в главной подгруппе, его степень будет равна номеру его группы, то есть всегда будет оставаться стабильным, положительным показателем.
В качестве примера можно рассмотреть расстановку степеней окисления в нитрате натрия. Соль образуется с помощью элемента главной подгруппы 1 группы, соответственно, степень окисления будет являться положительной и равна единице. В нитратах кислород имеет одного значение — -2. Для того чтобы получить численное значение, для начала составляется уравнение с одним неизвестным, учитывая все минусы и плюсы у значений: +1+Х-6=0. Решив уравнение, можно прийти к тому факту, что численный показатель положителен и равен + 5. Это показатель азота. Важный ключ чтобы высчитать степень окисления — таблица .
Правило расстановки в основных оксидах
- Оксиды типичных металлов в любых соединениях имеют стабильный показатель окисления, он всегда не больше +1, или в других случаях +2;
- Цифровой показатель металла вычисляется при помощи периодической таблицы. Если элемент содержится в главной подгруппе 1 группы, то его значение будет +1;
- Значение оксидов, учитывая и их индексы, после умножения суммировано должны быть равны нулю, т.к. молекула в них нейтральна, частица, лишённая заряда;
- Металлы основной подгруппы 2 группы также имеют устойчивый положительный показатель, который равен +2.
- Четверка монет таро значение
- Что такое договор найма служебного жилого помещения?
- Хлеб по технологии в духовке на дрожжах
- Требования к главному бухгалтеру Нормативное регулирование бухгалтерского учета
- Биография. Базаров Т. Ю., Еремин - Управление персоналом Тахир базаров управление персоналом
- Михаил Светлов — Гренада: Стих Я хату покинул пошел воевать чтоб землю
- Колики у новорожденных, лечение в домашних условиях Народные средства против коликов у новорожденных

 Live Journal
Live Journal Facebook
Facebook Twitter
Twitter