Какой тип гибридизации в молекулах алканов. Алканы — предельные углеводороды, их химические свойства. Рациональная номенклатура предельных углеводородов

Углеводороды представляют собой простейшие органические соединения. Их составляют углерод и водород. Соединения этих двух элементов называются предельными углеводородами или алканами. Их состав выражается общей для алканов формулой CnH2n+2, где n - количество атомов углерода.
Алканы - международное наименование данных соединений . Также эти соединения называют парафинами и насыщенными углеводородами. Связь в молекулах алканов простая (или одинарная). Остальные валентности насыщены атомами водорода. Все алканы насыщены водородом до предела, его атомы находятся в состоянии sp3-гибридизации.
Алкены представляют собой углеводороды, которые имеют углерод-углеродную двойную связь. Слово олефин часто используется синонимом, но предпочтительным термином является алкен. Алкенес изобилует природой. Например, этилен является растительным гормоном, который вызывает созревание плодов. Это оранжевый пигмент, который производит цвет моркови и ценный диетический источник витамина А; Считается также, что он обеспечивает некоторую защиту от некоторых видов рака. Если это соотношение известно, то можно перейти от молекулярной формулы к вычислить степень ненасыщенности, которая представляет собой количество колец, несколько ссылок или их обоих.
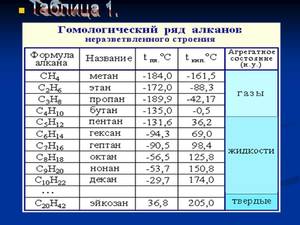
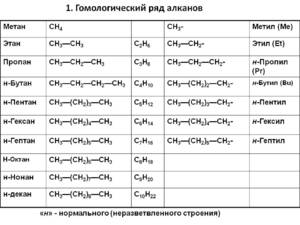
Гомологический ряд предельных углеводородов
 Первым в гомологическом ряду насыщенных углеводородов стоит метан. Его формула CH4. Окончание -ан в наименовании предельных углеводородов являет отличительным признаком. Далее в соответствии с приведенной формулой в гомологическом ряду располагаются этан - C2H6, пропан C3H8, бутан - C4H10.
Первым в гомологическом ряду насыщенных углеводородов стоит метан. Его формула CH4. Окончание -ан в наименовании предельных углеводородов являет отличительным признаком. Далее в соответствии с приведенной формулой в гомологическом ряду располагаются этан - C2H6, пропан C3H8, бутан - C4H10.
На языке молекулярных орбиталей взаимодействие р-орбиталей вызывает р-связь и антисвязывающую молекулярную орбиталь. Отсутствие вращения вокруг углерод-углеродной связи дает больше интереса, чем теоретический; он также имеет химические последствия. Представьте себе случай дизамещенного алкена, такого как 2-бутен. Две метильные группы 2-бутена могут находиться на одной стороне двойной связи или на противоположных сторонах.
Поскольку двойная связь не может вращаться, два 2-бутена не могут взаимно конвертироваться спонтанно; они представляют собой различные соединения, которые могут быть выделены. Как и в случае дизамещенных циклоалканов, эти соединения называются цис-транс-стереоизомерами.
С пятого алкана в гомологическом ряду названия соединений образуются следующим образом: греческое число, указывающее число атомов углеводорода в молекуле + окончание -ан. Так, по-гречески число 5 - пэндэ, соответственно за бутаном идет пентан - C5H12. Далее - гексан C6H14. гептан - C7H16, октан - C8H18, нонан - C9H20, декан - C10H22 и т. д.
Физические свойства алканов заметно изменяются в гомологическом ряду: увеличивается температура плавления, кипения, увеличивается плотность. Метан, этан, пропан, бутан при обычных условиях, т. е. при температуре равной примерно 22 градуса тепла по Цельсию, являются газами, с пентана по гексадекан включительно - жидкостями, с гептадекана - твердыми веществами. Начиная с бутана, у алканов есть изомеры.
Цис-транс-изомер не ограничивается дизамещенными алкенами. Это может происходить в любом алкене, имеющем два атома углерода двойной связи, прикрепленных к двум различным группам. Однако, если один из атомов двойной связи связывается с двумя идентичными группами, невозможно, чтобы существовала цис-транс-изомерия.
Цис-алкены менее стабильны, чем их транс-изомеры, из-за стерического напряжения между двумя объемными заместителями на одной и той же стороне двойной связи. В двойных связках размещаются кольца всех размеров. Разумеется, циклобутен имеет более низкое угловое напряжение, чем циклопропен, а угловое напряжение циклопентена, циклогексена и высших циклоалкенов незначительно. Участвующие электроны представлены стрелками.
Существуют таблицы, отражающие изменения в гомологическом ряду алканов , которые наглядно отражают их физические свойства.
Номенклатура насыщенных углеводородов, их производные
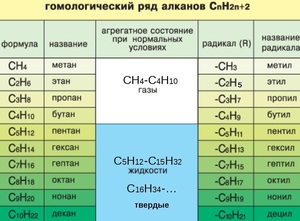 Если происходит отрыв атома водорода от молекулы углеводорода, то образуются одновалентные частицы, которые называют радикалами (R). Название радикалу дает то углеводород, из которого этот радикал произведен, при этом окончание -ан меняется на окончание -ил. Например, из метана при отрыве атома водорода образуется радикал метил, из этана - этил, из пропана - пропил и т. д.
Если происходит отрыв атома водорода от молекулы углеводорода, то образуются одновалентные частицы, которые называют радикалами (R). Название радикалу дает то углеводород, из которого этот радикал произведен, при этом окончание -ан меняется на окончание -ил. Например, из метана при отрыве атома водорода образуется радикал метил, из этана - этил, из пропана - пропил и т. д.
Все гибридные орбитали, принадлежащие обоим атомам углерода, являются компланарными. Комбинация этих двух гибридных орбиталей, производимых углеродом, производит, как мы видели, две молекулярные орбитали: σ-склеивание и склеивание соответственно, как показано на рисунке №.
Связывающая молекулярная орбиталь. Рисунок № 2 выше. Позже мы подробно рассмотрим эту тему номенклатуры. В качестве общего метода он состоит в определении и применении некоторых правил, которые дополняют те, которые мы уже видели для алканов. На рисунке № 1 основная цепь, очевидно, является цепочкой из восьми атомов углерода. Несмотря на то, что самая длинная цепь - это 10 атомов, однако она не удовлетворяет условию, содержащему наибольшее количество установок.
Радикалы также образуются и неорганическими соединениям. Например, отняв у азотной кислоты гидроксильную группу ОН, можно получить одновалентный радикал -NO2, который называется нитрогруппой.
При отрыве от молекулы алкана двух атомов водорода образуется двухвалентные радикалы, названия которых также образуются из названия соответствующих углеводородов, но окончание меняется на:
Рациональная номенклатура предельных углеводородов
Это префикс к названию основной цепи, которая, в свою очередь, происходит от названия алкана с таким же количеством атомов углерода, которое было заменено на алифатический аннофикс алкеном. Структура № 4. Смысл двойной связи, до полного покрытия кольца. Следует иметь в виду случай, когда один из атомов углерода двойной связи имеет заместитель. Этот углерод всегда следует рассматривать как углеродный, как показано в некоторых из приведенных ниже примеров.
В дополнение к тому, что было заявлено, всегда следует иметь в виду, что нумерация в цикле должна иметь смысл давать наименьшее число возможных заместителям. Что может быть проиллюстрировано со структурой № 5, потому что, если она пронумерована в другом направлении к показанному, неправильное название будет похоже на 4, 6 диметилциклогексена. То есть этот углерод, который присоединен к основной цепи молекулы. Здесь предполагается, что основная цепь, выбранная для соединения, содержит большее количество установок, чем у заместителя.
- илиен, в том случае, если атомы водорода оторваны от одного атома углерода,
- илен, в том случае, если от двух атомы водорода оторваны от двух соседних атомов углерода.
Алканы: химические свойства
Рассмотрим реакции, характерные для алканов. Всем алканам присущи общие химические свойства. Данные вещества являются малоактивными.
На ненасыщенность должна указываться числовой префикс в основной цепочке заместителя, который будет указывать на положение двойной связи внутри него. Двойная связь между двумя атомами углерода вводит такую жесткость в молекуле, что она полностью предотвращает, в отличие от простой связи, свободное вращение между ними. Это ограничение имеет важные последствия в том, как мы наблюдаем пространственное распределение атомов молекулы, а также в физических свойствах этого.
Они называются пространственными или конфигурационными изомерами. Эти физические и структурные различия должны отражаться на названиях соединений. В приведенном выше примере легко определить его конфигурацию с теми знаниями, которые мы приобрели до сих пор. Однако вещь становится немного сложной, когда есть три или четыре различные группы заместителей, связанные с двойной связью.
Все известные реакции с участием углеводородов подразделяются на два вида:
- разрыв связи С-Н (примером может служить реакция замещения);
- разрыв связи С-С (крекинг, образование отдельных частей).
Очень активны в момент образования радикалы. Сами по себе они существуют доли секунды. Радикалы легко вступают в реакции между собой. Их неспаренные электроны образуют новую ковалентную связь. Пример: CH3 + CH3 → C2H6
Например, какова конфигурация молекул и? Таким образом, этот атом, имеющий больший атомный номер, будет иметь преимущество над другим. Наконец, затем, объединяя оба атома углерода двойной связи, вы можете видеть, находятся ли предпочтения на одной стороне двойной связи или. Противоположные стороны двойной связи. В случае изотопов мы должны взять ту, которая имеет самую высокую атомную массу. В соответствии с этим атом с наивысшим приоритетом будет йодом и, приближаясь к наименьшему приоритету, мы придем к последнему, что является водородом.
Радикалы легко вступают в реакции с молекулами органических веществ. Они либо присоединяются к ним, либо отрывают от них атом с неспаренным электроном, в результате чего появляются новые радикалы, которые, в свою очередь, могут вступать в реакции с другими молекулами. При такой цепной реакции получаются макромолекулы, которые перестают расти только тогда, когда оборвется цепь (пример: соединение двух радикалов)
Гомологический ряд предельных углеводородов
Развивая свои структуры и сравнивая атомы, связанные вдоль цепи, мы можем найти первое различие, которое позволит нам определить, какая группа будет иметь приоритет. Хотя углерод метильной группы связан только с тремя водородами, пропильная группа имеет углерод, связанный с двумя атомами водорода и углеродом. Поскольку углерод имеет больший атомный номер, чем водород, это различие дает преимущество перед пропильной группой метил.
Из левого углерода мы уже знаем, что пропильная группа имеет приоритет относительно правого углерода двойной связи, которую мы можем развить таким же образом и изучить его структуру. При поиске первой разницы мы обнаруживаем, что это атомный номер кислорода больше, чем атом водорода.
Реакции свободных радикалов объясняют многие важные химические процессы, такие как:
- Взрывы;
- Окисления;
- Крекинг нефти;
- Полимеризацию непредельных соединений.
 Подробно можно рассмотреть химические свойства
насыщенных углеводородов на примере метана. Выше мы уже рассматривали строение молекулы алкана. Атомы углерода находятся в молекуле метана в состоянии sp3-гибридизации, и образуется достаточно прочная связь. Метан представляет собой газ баз запаха и цвета. Он легче воздуха. В воде малорастворим.
Подробно можно рассмотреть химические свойства
насыщенных углеводородов на примере метана. Выше мы уже рассматривали строение молекулы алкана. Атомы углерода находятся в молекуле метана в состоянии sp3-гибридизации, и образуется достаточно прочная связь. Метан представляет собой газ баз запаха и цвета. Он легче воздуха. В воде малорастворим.
Поскольку обе основные группы находятся на одной стороне двойной связи. Если эти три правила правильно применяются к алкенам, то в назначении конфигурации не должно быть двусмысленностей. Этот способ использует сильную неорганическую кислоту, такую как концентрированная серная кислота в качестве катализатора. Спирт нагревают до кипения с обратным холодильником в этой смеси, и алкен-продукт затем перегоняют.
Номенклатура насыщенных углеводородов, их производные
Реакция протекает в несколько этапов, с образованием карбокатиона в качестве промежуточного продукта на медленной стадии. Скорость реакции будет зависеть от стабильности образующейся карбоциации. Чем стабильнее, тем быстрее будет реакция обезвоживания. Это свойство связано с электролитирующим действием алкильных групп. Типичный донорный эффект этих групп способствует дисперсии положительного заряда, расположенного в центральном углероде, что приводит к большей устойчивости к промежуточным видам.
Алканы могут гореть. Горит метан синеватым бледным пламенем. При этом результатом реакции будут оксид углерода и вода. При смешивании с воздухом, а также в смеси с кислородом, особенно если соотношение объемов будет 1:2, данные углеводород образует взрывчатые смеси, из-за чего он крайне опасен для применения в быту и шахтах. Если метан сгорает не полностью, то образуется сажа. В промышленности ее таким образом и получают.
Алканы: химические свойства
Ожидается, что чем больше число алкильных групп, тем выше стабильность. Эта реакция протекает в присутствии сильного основания, такого как гидроксид калия, в этаноле или других основаниях, таких как этоксид натрия в этаноле или алкоксиде в их соответствующем спирте. Использование небольших оснований дает более замещенные алкены, тогда как использование громоздких оснований, таких как трет-бутоксид натрия в трет-бутаноле, предпочтительно приводит к образованию другого алкена, отличного от более замещенного.
Из метана получают формальдегид и метиловый спирт путем его окисления в присутствии катализаторов. Если же метан сильно нагреть, то он распадается по формуле CH4 → C + 2H2
Распад метана можно осуществить до промежуточного продукта в специально оборудованных печах. Промежуточным продуктом будет ацетилен. Формула реакции 2CH4 → C2H2 + 3H2. Выделение ацетилена из метана сокращает расходы производства почти в два раза.
Некоторые реакции синтеза алкенов проходят через формирование стабилизированного промежуточного соединения, чтобы быть наиболее замещенным, или он был стабилизирован путем переупорядочения, чтобы сформировать более стабильную карбокатион. Следующим шагом является удаление протона для получения алкена. Многие из этих посредников обладают более чем одним типом водорода, прилегающим к углеродному носителю положительного заряда, который может быть устранен, тем самым генерируя более одного алкена. Иногда образуются смеси алкенов, однако в других случаях образуется только один из изомеров.
Также из метана получают водород, производя конверсию метана с водяным паром. Характерными для метана являются реакции замещения. Так, при обычной температуре, на свету галогены (Cl, Br) по стадиям вытесняют водород из молекулы метана. Таким образом образуются вещества, называемые галогенопроизводными. Атомы хлора , замещая в молекуле углеводорода атомы водорода, образуют смесь разных соединений.
Формирование наиболее замещенного алкена является ключевым в этом типе исключений. Механизм, называемый гиперконъюгацией, и поэтому правило Сайдзеффа говорит, что в этих условиях преобладающий продукт будет наиболее замененным. Это сравнение позволяет нам заметить, что чем больше замещение алкена, тем больше стабильность.
Понятно, что монозамещенный алкен является тем, который обеспечивает наибольшее количество энергии, чтобы стать 2-метилбутаном, который является стабильным продуктом, общим для трех изомерных алкенов. С другой стороны, для тризамещенного алкена количество возвращаемой энергии намного ниже, что свидетельствует о его большей стабильности.
В такой смеси присутствуют хлорметан (CH3 Cl или хлористый метил), дихлорметан (CH2Cl2или хлористый метилен), трихлорметан (CHCl3 или хлороформ), тетрахлорметан (CCl4 или четыреххлористый углерод).
Любое из этих соединений может быть выделено из смеси. В производстве важное значение отводится хлороформу и тетрахлорметану, в силу того, что они являются растворителями органических соединений (жиров, смол, каучука). Галогенопроизводные метана образуются по цепному свободнорадикальному механизму.
Эффект замещения на стабильность алкенов может быть четко виден, чем он более замещен, тем он более стабилен и чем меньше энергия, которую он доставляет. Гидрирование алкинов: использование различных катализаторов при гидрировании алкинов позволяет вести его для получения различных продуктов. Таким образом, линдлярский катализатор используют для селективного гидрирования алкина в цис-алкене. Катализатор состоит из металлического палладия, нанесенного на неорганический носитель или носитель, такой как карбонат натрия.
В этой реакции происходит перенос электронов между алкином и литием и протонами между растворителем и алкином. Это добавление осуществляется в два этапа. Механизм в главе о алкинах. Роль нуклеофила представлена трифенилфосфином, а субстрат представляет собой первичный или вторичный алкилгалогенид. В это время следует отметить, что как илид, так и карбонильное соединение могут иметь широкий диапазон заместителей, что делает эту реакцию чрезвычайно важной. Бетаин очень реакционноспособен и перегруппирован в основной продукт алкена и трифенилфосфиноксид в качестве вторичного или побочного продукта.
Свет воздействует на молекулы хлора, вследствие чего они распадаются на неорганические радикалы, которые отрывают атом водорода с одним электроном от молекулы метана. При этом образуется HCl и метил. Метил реагирует с молекулой хлора, в результате чего получается галогенопроизводное и радикал хлора. Далее радикал хлора продолжает цепную реакцию.
При обычной температуре метан обладает достаточной стойкостью к щелочам, кислотам, многим окислителям. Исключение - азотная кислота. В реакции с ней образуется нитрометан и вода.
Реакции присоединения для метана не характерны, т. к. все валентности в его молекуле насыщены.
Реакции, в которых участвуют углеводороды могут проходить не только с расщеплением связи С-Н, но и с разрывом связи С-С. Такие превращения происходят при наличии высоких температур и катализаторов. К таким реакциям относятся дегидрогенизация и крекинг.
Из насыщенных углеводородов путем окисления получают кислоты - уксусную (из бутана), жирные кислоты (из парафина).
Получение метана
 В природе метан
распространен достаточно широко. Он - главная составная часть большинства горючих природных и искусственных газов. Он выделяется из каменноугольных пластов в рудниках, со дна болот. Природные газы (что очень заметно в попутных газах нефтяных месторождений) содержат не только метан, но и другие алканы. Применение этих веществ разнообразно. Они используются как топливо, на различных производствах, в медицине и технике.
В природе метан
распространен достаточно широко. Он - главная составная часть большинства горючих природных и искусственных газов. Он выделяется из каменноугольных пластов в рудниках, со дна болот. Природные газы (что очень заметно в попутных газах нефтяных месторождений) содержат не только метан, но и другие алканы. Применение этих веществ разнообразно. Они используются как топливо, на различных производствах, в медицине и технике.
В условиях лаборатории данный газ выделяют при нагревании смеси ацетат натрия + гидроксид натрия, а также реакцией карбида алюминия и воды. Также метан получают из простых веществ. Для этого обязательными условиями являются нагрев и катализатор. Промышленное значение имеет получение метана синтезом на основе водяного пара.
Метан и его гомологи могут быть получены при прокаливании солей соответствующих органических кислот с щелочами. Еще одним способом получения алканов является реакция Вюрца, при которой нагреваются моногалогенопроизводные с металлическим натрием.
Этап 1. Ответить на вопросы: 1. Общая формула алканов. 2. Общая формула алкенов. 3. Тип гибридизации алканов. 4. Тип гибридизации алкенов. 5. Характер связей алканов. 6. Характер связей алкенов. 7. Характерный тип реакций алканов, 8. Характерный тип реакций алкенов.

Этап 2. Написать уравнения реакций между веществами, указать условия, назвать вещества 1) пропана с хлором 2) пропена с хлором 3) бутена-1 с бромоводородом 4) гидратация бутена - 1 5) полимеризация бутена - 2 Написать уравнения реакций между веществами, указать условия, назвать вещества 1)бутана с бромом 2) бутена-1 с бромом 3) пентена–1 с хлороводордом 4)гидратация пентена-1 5) гидрирование пентена - 1

Этап 3. Составить полуструктурные формулы веществ. 1) 2 – метилпентен-1 2) 2, 3- диметилбутен- 1 3) пентадиен – 1, 3 4) 2-метилпентен – 2 5) 2–метилбутадиен -1,3 1) 3-метилпентен-1 2) 3 –этилпентен-1 3)2,3-диметилгексен-1 4)гексадиен – 1, 4 5)3-метилпентадиен 1,2.

Этап 4. Решить задачу. Задача. Массовая доля углерода в углеводороде 83,3%, относительная плотность по водороду 36. Найти молекулярную формулу. Задача. Массовая доля углерода в углеводороде 85,7%, плотность паров по водороду 28.Найти молекулярную формулу


- Численность последователей основных религий и неверующих
- Абсолютные и относительные координаты Что называется абсолютными координатами точек
- Какие меры относились к политике военного коммунизма
- Лунин, михаил сергеевич Лунин Николай Иванович: витамины
- Скончался академик борис сергеевич соколов Соколов, Борис Сергеевич Информацию О
- Рецепты варенья из кабачков с лимоном, с курагой и в ананасовом соке
- Как приготовить вкусные куриные сердечки с картофелем в мультиварке Куриные сердечки рецепт в мультиварке с картофелем

 Live Journal
Live Journal Facebook
Facebook Twitter
Twitter