Химия в строительстве
Естественные и научные основы строительства
Современное строительство использует великое множество самых разнообразных строительных материалов, из которых при помощи определенных строительных технологий и строится здание или сооружение.
Так же как и в остальных отраслях жизнедеятельности человека, в строительстве основой являются физические, химические и электрические законы природы.
Поэтому при возведении здания учитываются самые разнообразные химические и физические процессы, которые проистекают в материалах при строительстве, сразу же после него или в процессе эксплуатации здания. Строительный проект будущего здания или сооружения должен быть ориентирован, в том числе и на использование материалов, наиболее подходящих для данного климата, для данной местности, а также максимально ориентированного на экологическую чистоту и безопасность.
Обеспечить это сочетание качества строительства и высокого уровня безопасности и долговечности можно, только принимая во внимание основные химически свойства различных строительных материалов, что невозможно сделать без хорошего знания этих предметов.
Химические основы строительства
Химические процессы играют важную роль в современном строительстве. Это состав, приготовление, а также преобразования веществ и происходящие при этом процессы.
Каждое тело, будь оно твердым, жидким или даже газообразным, занимает определенное пространство и вытесняет из него другие вещества. Каждое тело состоит из вещества, материи. В свою очередь вещество, занимая определенное пространство, также является телом. Свойства тел включают в себя форму агрегатного состояния, объем и энергетическое состояние.
Свойства веществ включают в себя способность реакции с другими веществами, запах, вкус, устойчивость к коррозии, устойчивость к теплу и холоду. Строительная химия занимается составом и химическими свойствами веществ, а также изменениями этих свойств при химических процессах.
Химические и физические процессы в строительстве
Химический процесс подразумевает соединение нескольких веществ с целью получения нового вещества, по своим химическим свойствам отличного из химических свойств каждого отдельного исходного компонента, который входит в состав. Таким образом, при помощи химических процессов возникает новое вещество, обладающее заданными свойствами.
При физических процессах новых веществ не образуется, но изменяется одно из физических свойств вещества – агрегатное состояние, положение или размер. Как правило, при физическом изменении вещества его химический состав остается без изменений.
Виды материалов
По своему составу вещества делятся на несколько видов. Это основные вещества, смеси, химические соединения и элементы.
Смеси состоят из совокупности различных веществ и отдельных материалов. Также смеси позволяют при помощи физико-механической технологии разложить себя на отдельные вещества. Физико-механические методы разделения смесей – это дистилляция, выпаривание, фильтрование и отстаиваниеХимические соединения состоят как минимум из двух разных основных веществ или химических элементов. Химическое соединение не может быть разложено на составляющие вещества при помощи физико-механических процессов, как, например, смеси. Такое разложение возможно только лишь при помощи химических процессов.
Химические элементы – это основные вещества, которые не могут быть разложены на составляющие в принципе, ни при помощи физико-механических методов, ни посредством химической реакции.
Химические элементы
В природе существует 92 химических элемента. Из этих элементов в различных пропорциях и состоят все вещества на нашей планете. Семнадцать элементов из них получены искусственным путем, то есть не встречаются в природе в чистом виде. Природные элементы состоят из 66 металлов, 16 неметаллов и 6 полуметаллов. Металлы имеют выраженный металлический блеск, хорошо проводят электрический ток и тепло. Неметаллы, среди которых преобладают газообразные и летучие элементы, преимущественно не проводят электрический ток, то есть являются диэлектриками.
Также неметаллы, как правило, плохо проводят тепло. Полуметаллы могут обладать как металлическими, так и не металлическими свойствами. Яркий пример таких элементов – это селен и кремний. Элементы обозначают, помимо их названий на разных языках, Буквенными сокращениями от названия элемента на греческом или латинском языках.
Чаще всего для
определения удельной массы, плотности и других свойств вещества пользуются периодической таблицей элементов, где химические элементы размещены в порядке возрастания физических и химических свойств и разделяются на группы и подгруппы. Химические элементы состоят из атомов. Определенные атомы определенных элементов имеют сходное или идентичное строение.
Атомы
Атом, как известно из школьного курса химии, является наименьшей частицей вещества. Увидеть атом невооруженным глазом невозможно, да и для оптического созерцания атомов понадобится довольно мощный микроскоп. Поэтому вид, структуру атомов и происходящие с ними процессы чаще всего представляют при помощи моделей. Разработал модели атомов датский химик и естествоиспытатель Нильс Бор (1885-1962). Согласно общепринятой модели, атом состоит из оболочки и атомного ядра и имеет круглую форму. Диаметр атомной оболочки составляет 0,0000001 мм. Диаметр атомного ядра – 0,000000001 мм.
Атомное ядро, как следует из его названия, расположено в центре атома. Масса атомного ядра составляет практически всю массу атома. Состав атомного ядра – так называемые нуклоны, или кирпичики атомного ядра. Нуклоны в свободном виде не встречаются в природе и существуют только в составе атома. Нуклоны не однородны, а подразделяются между собой на протоны, положительно заряженные частицы, и нейтроны, которые остаются нейтральными.
Ядро атома может состоять из нескольких протонов и нескольких нейтронов. Именно количество и соотношение протонов и электронов определяют физические и химические качества элемента, состоящего из данных атомов.
Некоторые же физические законы неизменны во всех ядрах атомов. Так, массовое число или число нуклонов равняется массовому числу суммы нейтронов и протонов в атоме, порядковое число или величина заряда ядра равны числу протонов в атомном ядре.
Оболочка атома образована электронами.
Они вращаются с большой скоростью в шарообразной области вокруг атомного ядра. Эту область называют электронной оболочкой атома. Электроны имеют отрицательный электрический заряд и обладают очень малой массой.
Отрицательный заряд электронов соответствует по величине положительному заряду протонов в ядре атома.
Число протонов и нейтронов в атоме одинаково, поэтому атом является электрически нейтральным к окружающей среде. Благодаря разности потенциалов электроны удерживаются на своих орбитах. Электроны группируются в электронные оболочки, которых вокруг ядра может быть до семи. Они находятся на определенном расстоянии от ядра. Число электронов в каждой оболочке ограничено определенным количеством.
Атомная масса – это масса атомного ядра. При определении атомной массы малая масса оболочки не учитывается. Атомная масса атома водорода равна массе протона, в численном выражении это 1,008. Другие атомные массы во много раз больше этого числа. Поэтому эту массу называют относительной атомной массой. Например, относительная атомная масса атома кислорода составляет 15,999 или 16.
Атомы некоторых элементов имеют одинаковое число протонов. Однако, несмотря на это, чисто нейтронов может быть разным. Атомы одного и того же элемента с разным количеством нейтронов называют изотопами. Изотопы имеют одинаковые химические свойства, но разную массу. Изотопы образуют все элементы, но количество их у всех элементов разное и большей частью ограниченное.
Радиоактивность
Изотопы некоторых элементов излучают энергию. Атомные ядра при этом распадаются. Это свойство называют радиоактивностью. Различают альфа, бета и гамма лучи. Альфа-лучи состоят из ядер гелия. Бета-лучи состоят из электронов и пронизывают даже свинцовые пластины толщиной до 1 мм. Гамма-лучи имеют очень малую длину волны и возникают в основном при превращениях ядра. Они способны проникать через метровые бетонные стены и могут задерживаться только очень толстым слоем свинца. Самые опасные для человека, гамма-лучи приводят к разрушению тканей и поражению внутренних органов.
Несмотря на опасность, применение радиоактивных материалов постоянно развивается, поскольку они являются самой дешевым и долговечным источником энергии.
Применение радиоактивных материалов в строительной технике очень широко. Их используют, например, для контроля толщины материалов при изготовлении бумаги, фольги, пленки и листовых металлических материалов.
Периодическая система элементов
Ученые давно обратили внимание на тот факт, что если исследовать свойства элементов в порядке их атомных зарядов, то окажется, что почти одинаковые свойства периодически повторяются через каждые восемь элементов. При этом получается всего семь периодов. Третий период, например, объединяет элементы от натрия до аргона. Если расположить семь периодов так, чтобы элементы с одинаковыми свойствами стояли один над другим, то получится восемь вертикальных колонок или групп. Составленная таким образом периодическая таблица элементов очень удобна и проста. Своим рождением она обязана русскому ученому Д.И. Менделееву.
Химические соединения
Различные атомы и элементы могут связываться между собой. Полученное в результате таких соединений химическое вещество называют химическим соединением. Новое вещество, образованное в результате соединения, имеет отличные от элементов, из которых оно образовалось, свойства. Яркий пример такого соединения – вода, состоящая из одного атома кислорода и двух атомов водорода. Соответственно вода имеет отличные от кислорода и водорода свойства.
Молекула – это частица химического соединения. Молекулы в соединении всегда одинаковы. Такие молекулы называются элементарными молекулами. Состав молекулы определяет состав соединения. В случае воды это три атома, молекула серы – шесть. Исключение составляют лишь инертные газы, которые состоят из свободных атомов. Система обозначения состава молекул химического соединения проста и удобна – нижний индекс после обозначения элемента означает, сколько атомов его содержится в соединении. Например, H2O, C2H5OH.
Электронные пары
Некоторые химические элементы, атомы которых укомплектованы на электронных орбитах 8 электронами, не склонны вступать в соединения с другими элементами. Как правило, они находятся в стабильном состоянии. Те же химические элементы, которые имеют меньше или больше восьми электронов на атомной орбите, стремятся перейти в стабильное состояние, поэтому они активны в реакциях с другими элементами.
Ионная связь
Атомы, которые теряют электроны, становятся положительно заряженными, а те атомы, которые приобретают электроны, становятся электрически отрицательными. Возникшие при потере или приеме электронов частицы называют ионами. Так, ионы различных элементов в случае разных потенциалов могут соединяться в связи. Такие связи называют ионными связями. В основном ионные связи имеют место в соединениях солей и металлов. Силы притяжения между ионами действуют по всем направлениям, поэтому ионы находятся в постоянном поиске связей. Чаще всего такая связь приводит к образованию прочной трехмерной решетки, образуя кристаллы.
Соединения металлов
В большинстве случаев атомы металлов имеют небольшое количество электронов на своих орбитах. При тесном контакте электроны отделяются от атомов и начинают выстраивать ионные связи в виде шарообразных частиц. За счет электрического сцепления атомы металлов очень прочно сцепляются между собой, образуя прочное тело. Поскольку силы притяжения ионов действуют в трехмерном направлении, то ионы металлов создают кристаллическую решетку.
Валентность
Из любой химической формулы можно легко понять, какие именно химические соединения были получены и из каких именно элементов. При этом сами формулы делятся на структурные и суммарные. Суммарные формулы оказывают соединения элементов одно за другим. В структурных формулах каждый атом представлен отдельно, поэтому структурная формула, кроме общего состава, дает представление о порядке связи атомов в соединении. Количество свободных электронов или возможность принять электроны определяет то, в каком числовом соотношении атомы могут вступать в химические соединения. Это число называется валентностью химического элемента, а электроны, участвующие в обмене между атомами – валентными электронами. В структурных химических формулах валентность обозначается штрихами валентности.
Анализ и синтез веществ
Под синтезом в химии понимают создание химического соединения. Получение синтетических материалов, например, пластиков, как раз и является основной задачей и основной деятельностью химической индустрии. Современные технологии позволяют синтезировать такие вещества, что строительные материалы, производимые на их основе,
Анализ – это разложение химического соединения на составляющие компоненты.
Смеси
Некоторые материалы можно смешивать. При этом они не будут вступать в реакции друг с другом, а лишь находиться в перемешанном состоянии. Получаемая путем смешивания смесь не является новым веществом, поскольку возможно ее разделение на составляющие на исходные материалы при помощи физически-механических процессов. Примеры смесей – растворы, дисперсии и легирования.
Растворы
Многие твердые, жидкие и газообразные материалы и вещества могут так тонко распределяться в жидкостях, что будут существовать в них только лишь в виде отдельных молекул. В этом случае вещество находится в воде или другой жидкости в растворенном состоянии, то есть жидкость, содержащая молекулы некоего вещества, является раствором. Жидкость, в которой содержатся молекулы вещества, называют растворителем. Любое вещество растворяется в любой жидкости до определенного предела. При наступлении критической точки предела растворяемости раствор называется концентрированным. Температура растворителя влияет на верхний порог растворяемости.
При повышении температуры растворителя порог растворяемости повышается. Раствор, далекий от насыщения веществом, называется разбавленным. Процесс растворения ускоряется при нагревании, помешивании и измельчении вещества. Выделение из раствора происходит при охлаждении в случае сильно концентрированных растворов и выпаривании растворителя. Яркий пример выпаривания растворителя в строительстве – обмазка битумной мастикой, Покраска дисперсными красками на водной основе и застывание бетона и растворов.
Разделение двух смешанных друг с другом жидкостей можно производить с помощью перегонки, или дистилляции.
Раствор жидкостей доводится до кипения, и легче испаряемая жидкость выпаривается. Затем, собранный пар охлаждается и вновь переходит в жидкое состояние. Жидкость, которая испаряется медленнее, остается в сосуде. Растворение нескольких растворенных друг в друге жидкостей производится при помощи многократной дистилляции, которую называют фракционной дистилляцией. Пример такой фракционной дистилляции – разделение сырой нефти на фракции – бензины, мазуты, смазочные материалы и битумы.
Дисперсии
Процесс, когда частицы вещества распределяются в жидкости в виде очень тонких фрагментов, не растворяясь в ней, называется дисперсией. Жидкость с распределенным в ней веществом называют дисперсионной. В случае, если тонко распределенное вещество является твердым по первоначальной структуре, такую дисперсию называют суспензией.
Если распределенное вещество является жидкостью, такую дисперсию называют эмульсией. В любой дисперсии частицы распределенного вещества со временем оседают, и образуется частичное расслоение. Поэтому перед употреблением дисперсии требуется тщательно перемешивать. Примеры дисперсий в строительстве – дисперсионные клеи и краски, сверлильные эмульсии на основе нефтепродуктов и воды для обработки металлов.
Легирование
Многие металлы в расплавленном состоянии растворяются друг в друге. После затвердевания получаемый сплав называют легированным. Свойства легированного металла зачастую значительно отличаются от свойств исходных металлов и могут превосходить их по твердости, прочности или температуре плавления. Посредством легирования создают материалы с заданными свойствами, например, сталь с присадками хрома и никеля становится устойчивой к коррозии и называется нержавеющей сталью.
Важнейшие строительные материалы и их соединения
Большинство строительных материалов представляют собой смеси разнообразных химических соединений, которые, в свою очередь, состоят из химических элементов. Одновременно с элементами углеродом, водородом, кислородом строительные материалы содержат калий, кальций, кремний, алюминий и железо. Синтетические материалы содержат хлор и азот.
Кислород
Кислород (О) – это газ без вкуса, цвета и запаха, тяжелее воздуха. Кислород необходим для дыхания человека и животных, не горюч, но поддерживает горение. В среде чистого кислорода могут гореть и сгорать даже негорючие материалы, например, многие металлы.
Воздух содержит около 21% кислорода. Также кислород содержится в земной коре в связанном состоянии, а также выделяется растениями при помощи фотосинтеза из углекислого газа.
В строительстве кислород применяется при сварке и резке металла, для производства стали и в качестве кислородного разделителя бетона и заполнителя.
Кислород является природным окислителем многих элементов. Молекулы вещества соединяются с молекулами кислорода, образуя оксиды. Такой процесс называют окислением. Для получения вещества из оксида применяют тепло, при котором молекулы кислорода покидают соединение. Этот процесс называют раскислением, или восстановлением.
Водород
Водород (Н) – это бесцветный газ без запаха. Водород – самое легкое вещество среди химических элементов. Смесь водорода и кислорода в пропорции 2:1 очень взрывоопасна.
В природе водород практически не встречается в чистом виде, однако в избытке содержится в химически связанном состоянии в воде и в ископаемых горючих веществах. Промышленность получает водород в основном из нефти или природного газа.
Водород применяют в химической промышленности и сварочной технике.
Углерод
Углерод в чистом виде встречается в природе в виде графита и алмазов. В химически связанном виде углерод присутствует в земных недрах, например, в виде известняка, в растительных окаменелостях, в каменном угле, торфе и природном газе. Вместе с этим углерод является частью биомассы растений и животных. В воздухе углерод присутствует в виде углекислого газа.
Графит – это мягкое красящее вещество черного цвета. Алмаз бесцветен, стекловиден, хрупок, но очень крепок.
Углерод применяется в промышленности как кокс для получения железа, в виде сажи для наполнителя при производстве резины, в качестве углеродных волокон для армирования пластмасс, и в качестве алмазов для режущих и полировальных инструментов.
Различают органические и неорганические соединения углерода. Неорганическое соединения – это угарный газ, углекислый газ, углекислота и ее соли, а также карбиды.
Угарный газ (СО) получается при сжигании углеродосодержащий веществ при недостаточном снабжении кислородом. Угарный газ бесцветен и не имеет запаха. Горит угарный газ синеватым пламенем и очень ядовит. В химической промышленности угарный газ применяют для производства пластмасс и растворителей.
Углекислый газ (СО2) получается при сжигании углеродосодержащих веществ. Углекислый газ не горюч, не имеет запаха. Он абсолютно не ядовит. Единственная опасность углекислого газа состоит в том, что будучи существенно тяжелее воздуха, он может скапливаться в низких недостаточно проветриваемых местах и вытесняет кислород.
Углекислый газ выделяется в атмосферу при сжигании топлива и существенно влияет на климат земли. Повышенная концентрация углекислого газа ведет к нагреванию атмосферы, и как следствие к парниковому эффекту.
Органические соединения углерода – углеводороды. По строению молекул различают цепные, кольцеобразные, а также разветвленные углеводороды. В цепных углеводородах атомы углерода располагаются в ряд друг за другом, а свободные валентности заняты атомами кислорода. Цепи углерода, содержащие до пяти атомов, являются газообразными. Цепи, в которых содержится от 6 до 12 атомов – жидкие, те из них, что содержат от 12 до 15 атомов – пастообразные, например, стеарин.
Бензин представляет собой смесь жидких углеводородов, где атомы углерода соединяются между собой посредством 2 или 3 валентностей. Такие соединения называют ненасыщенными. Ненасыщенные углеводороды также – это газы ацетилен и этилен.
Простейшим кольцеобразным соединением углеводородов является бензол. Производная от бензола – фенол. Кольцеобразные ненасыщенные углеводороды являются важным исходным материалом для химической промышленности, для производства пластмасс. Другие органические соединения углерода, содержащие наряду с водородом химические элементы кислород, хлор и азот, являются алканолы (спирты), альдегиды (алканалы), органические кислоты (спиртовые кислоты) и хлорированные углеводороды.
Кислоты
При растворении оксидов неметаллов в воде образуются кислоты. Например, при растворении хлора и водорода образуются соляная и фтористая кислота.
Образование ионов
Молекулы кислот в водных растворах могут полностью или частично расщепляться на водородные ионы и остаточные ионы кислот. Поэтому кислотно-водные растворы проводят электрический ток. Кислородные ионы носят название катионы, а кислородного остатка называют анионами.
Свойства кислот определяются отколовшимися ионами водорода. Поэтому кислоты действуют только в водных растворах. Сила действия любой кислоты зависит от количества отделившихся ионов.
Наиболее сильными кислотами являются соляная, азотная и серная кислоты. Средними кислотами считаются фосфорная и фтористая кислоты. Слабые кислоты – это угольная и синильная кислота.
Важнейшие кислоты
Соляная кислота разлагает известняк, при отделении двуокиси азота. Разбавленная соляная кислота применяется для очистки кирпичной кладки и удаления известковых отложений с поверхности.
Серная кислота как составляющая кислотных дождей образует вместе с нерастворимыми в воде известняками водорастворимый сульфат кальция, который либо уносится с водой, либо приводит к повреждениям строительных конструкций за счет кристаллизации и связанным с этим явлением увеличением объема и отслоениями материала. Серная кислота гигроскопична, то есть притягивает воду. Поэтому одно из основных правил разбавления серной кислоты требует вливать ее в воду, а не наоборот.
Угольная кислота образуется в основном соединениями дымовых газов, содержащих СО2 с содержащейся в воздухе влагой. Вода, содержащая угольную кислоту, разрушает содержащие известь вяжущие вещества.
Азотная кислота состоит из аммиака, который получается при разложении органических материалов, например, в канализационных стоках. Соединяясь с содержащими известь материалами образуется водорастворимый сульфат кальция, который может повредить строительные конструкции. Азотная кислота является сильным окислителем, поэтому при соединении с органическими веществами, тканью или древесиной может вызвать возгорание.
Щелочи
Реакции щелочных металлов, таких как натрий или растворимых окислов металлов с водой образуют щелочи. При выпаривании воды получают твердую бесцветную массу гидрата окиси металла, называемую основанием. Щелочное действие наступает только при соединении с водой.
Молекулы щелочи распадаются в водном растворе частично или полностью на положительно заряженные ионы металла, например на ионы (катионы) или отрицательно заряженные ионы (анионы).
Щелочи проводят электрический ток, поэтому называются электролитами.
Сильными щелочами является натриевая щелочь, калиевая щелочь и кальциевая щелочь. Слабой щелочью считается водный раствор аммиака, называемый нашатырем.
Гашеная известь – это натриевая щелочь. Она применяется для приготовления различных строительных растворов.
Величины РН
Зачастую перед применением того или иного вещества следует проверить, насколько сильным является оно как кислота или щелочь. Мерой для этого является величина РН. Величина РН определяется по шкале от 1 до 14. нейтральным значением является величина 7, такую величину имеет дистиллированная вода.
Растворы с величинами от 0 до 7 являются кислыми, чем меньше величина, тем выше кислотность раствора, а растворы с величинами от 7 до 14 – щелочные, чем выше значение величины, тем более щелочным является раствор. Замер величины РН происходит при помощи индикаторной (лакмусовой) бумаги, которая изменяет свой цвет в зависимости от величины РН раствора. Наряду с индикаторной бумагой применяются также и индикаторные жидкости, и электронные приборы для замеров уровня РН.
Соли
Соль – это совокупность металла и кислотного остатка. Соли, как и щелочи и кислоты, распадаются в воде на ионы и проводят электрический ток. Соли получаются при нейтрализации кислот и щелочей, а также при реакции кислот с металлами или окислами металлов. Химическое название солей указывает на их происхождение, то есть на кислоту и металл, которые участвовали в получении данной соли. В химических процессах более сильная кислота всегда вытесняет более слабую кислоту из ее соли и образует новую соль. Растворимость солей в воде различается.
Силикаты, например, нерастворимы или трудно растворимы в воде, тогда как нитраты весьма легко растворяются. Растворенные в воде соли после выпаривания воды образуют кристаллы. Например, сульфат кальция, который называют гипсом, нитрат кальция (стеновая селитра), притягивают воду с увеличением собственного объема.
Соли, используемые в строительстве
Карбонат кальция не растворим в воде, и является основой всех природных камней, в частности известняка и мрамора.
Сульфат кальция, или гипс, и сульфат магния являются прекрасными вяжущими веществами. Однако при контакте с кислотами они превращаются в легко растворимые в воде соли, что может привести к существенным проблемам, таким как откалывание или намывание материала.
Силикат кальция не растворяется в воде и получается при твердении известей и цементов. Силикат калия, силикат магния, силикат кальция, силикат алюминия являются важными компонентами многих строительных материалов.
Силикат натрия используется для строительства средств пожаротушения.
Нитрат кальция, или стеновая селитра, образуется при гниении органических веществ и может разрушать строительные конструкции.
Кислоты, соли и щелочи действуют только в присутствии воды. Поэтому тщательная гидроизоляция строительных конструкций препятствует проникновению и транспортировке разрушающих веществ в здание, а, следовательно, защищает сооружения от разрушения.
Вода
Круговорот воды в природе – необходимое для поддержания жизни условие. Вода испаряется с поверхности земли, в виде водяного пара поднимается к стратосфере и при достаточном охлаждении выпадает в виде осадков.
Природная вода всегда насыщена различными веществами – минеральными солями и прочими примесями и никогда не является чистой. Содержание солей определяет жесткость воды. Основные соли, влияющие на жесткость воды – это соли кальция.
Вода из озер, рек и источников насыщена солями кальция и магния. Дождевая вода, испаряясь и находясь в воздухе в виде дистиллированной воды, выпадая в виде осадков, соприкасается с воздухом и получает из него частицы пыли и грязи, а также углерод и двуокись серы, становясь слабокислой.
Таким образом, достаточно загрязненный воздух может создать предпосылки к выпадению так называемых «кислотных дождей». Кислоты, образующиеся в результате загрязнения воздуха, попадают в дождевую воду, а оттуда — на поверхность строительных конструкций, разрушая их. Также кислоты проникают в почву и с грунтовыми водами попадают в подземные водоносные слои, частично разлагаясь, соединяясь с щелочными отложениями.
Грунтовая вода, просачиваясь после осадков на значительные глубины, заполняет пустоты в земной коре. Во время просачивания слои почвы выполняют функцию природных фильтров, очищая воду от примесей, а залежи различных ископаемых насыщают воду минеральными веществами. Вода, пройдя сквозь фильтрующие и дренирующие слои, скапливается над непроходимыми подошвами.
Под действием естественной силы тяжести вода стекает в естественные подземные резервуары, где накапливается. Такие грунтовые воды могут выходить на поверхность в виде ключей, ручьев или колодцев. Давление воды в подземном резервуаре порой достигает такой силы, что, пробурив скважину в такой водоем, можно получить артезианский источник, в котором вода будет подниматься на поверхность без помощи насосов.
Вода в природе может находиться в трех состояниях – жидком, твердом и газообразном. Температура замерзания воды составляет 0 градусов Цельсия, превращаясь в лед. Необходимо 335 кДж энергии, чтобы вновь превратить лед в воду. Испаряется вода при температуре сто градусов. Для испарения одного кг воды необходимо затратить 2250 кДж тепла.
Водяной пар превращается в конденсат при охлаждении ниже 100°С, что является точкой конденсации водяного пара.
Наибольшую плотность вода имеет при температуре +4°С.
Вода, превращаясь в лед, расширяется, увеличиваясь в объеме. Расширение воды составляет примерно 10% от ее объема в жидком состоянии. Такое свойство встречается только у воды, и является аномалией среди физических и химических свойств веществ.
Вода довольно широко применяется в строительной технике, например как вода затворения для приготовления бетона и раствора, в качестве текучего транспортирующего средства, например, при укладке бетона и его твердении, при уходе за бетоном в процессе застывания, в качестве растворителя для приготовления клеев и красок, для очистки поверхностей и для многого другого.
Однако, наряду с пользой, вода также может наносить и вред, а именно:
При дожде из воздуха на поверхность строительных конструкций могут транспортироваться вредные вещества, разрушающие конструкции
При высоком содержании вредных веществ в грунтовых водах они могут транспортироваться в конструкции путем капиллярной транспортировки
Водяной пар, попадая в конструкции, ослабляет защитные, теплоизоляционные и звукопоглощающие их свойства
Замерзая, вода увеличивается в объеме, и, попадая в жидком виде в трещины конструкций и покрытий, превращаясь в лед, разрывает их.
Защита окружающей среды от загрязнений
Загрязнение окружающей среды – это загрязнение воздуха, воды и земли вредными или токсичными веществами неестественного происхождения. Шум и излучения также являются загрязнениями окружающей среды. Загрязнение окружающей среды, помимо вреда здоровью человека, животным и растениям, наносит ущерб строительным конструкциям.
При сгорании твердого и жидкого топлива образуются вредные вещества, например двуокись углерода, двуокись серы, оксид азота, угарный газ.
Эти вещества являются причиной «кислотных дождей». Растворяясь, углероды, которые находятся в составе жидкого топлива и разбавителей, а также татрахлоруглерод, который находится в составе растворителей и чистящих средств, попадают в воздух.
Отдельные из этих веществ являются причиной все усиливающегося парникового эффекта и общего потепления климата Земли. Также отдельные вредные вещества вступают в реакции с озоновым слоем планеты, уничтожая его, что ведет к усилению ультрафиолетового излучения, вредного для здоровья живых организмов и растений. Озоновый слой служит фильтром для защиты поверхности Земли от избыточного ультрафиолетового излучения. Влияние вредных промышленных и бытовых выбросов в атмосферу влечет за собой необратимый процесс разрушения озонового слоя, что является основной опасностью для человечества в настоящее время.
Отходы нефтехимии обладают канцерогенными свойствами. При небрежном к ним отношении они попадают в коллекторы и канализационные сети, накапливаются там либо со стоками уходят в грунтовые и поверхностные воды, уничтожая все живое в водоемах. Сильно загрязненный водоем, лишенный растительности и живых существ, скоро теряет свою ценность и как источник питьевой воды.
В связи с этим при проведении строительных работ требуется обязательное соблюдение правил по защите от загрязнения окружающей среды, а именно:
Экономия энергии за счет ограничения потребления топлива и улучшения теплоизоляции зданий и сооружений
Очистка выхлопных газов посредством установки фильтров
Использование возобновляемых источников энергии и природной энергии, таких как ветровая, солнечная энергия, энергия морских и океанских приливов, гидроэлектростанции и прочее.
Вода, которая используется в строительстве, как правило, отводится после использования прямо в стоки и канализационные сети. Однако существуют некоторые вещества, которые не должны попадать в канализацию. К ним относятся:
Строительный мусор, вяжущие вещества и раствор, которые могут привести к засорениям коллекторов
Пожароопасные вещества, которые могут привести к пожару внутри коллектора, достигнув определенной концентрации
Взрывоопасные вещества
Ядовитые вещества
Кислоты, щелочи и средства защиты древесины
Особенно вредное для окружающей среды загрязнение наносится сливом в канализационные сети и коллекторы старых отработанных масел, мазута, остатков растворов для защиты древесины. Слив этих веществ в канализационные сети приводит к отравлению грунтовых вод и естественных водоемов. Такие вещества необходимо утилизировать при помощи специальных лицензированных организаций, которые перерабатывают их, не загрязняя окружающую среду.
Различные отходы производства необходимо утилизировать как ценные материалы или специальные отходы. Вторично используемые материалы, такие как дерево, цветные и черные металлы, стекло, картон, собранные и сданные на переработку, не только сохранят окружающую среду, но и сократят бюджет строительства. Кроме того, использование безотходных технологий, например, строительство из готовых блоков, благотворно влияет на общую экологию района, что положительно сказывается и на стоимости будущей недвижимости.
Производственные отходы, не пригодные к переработке и повторному использованию, сжигаются на специальных предприятиях, оборудованных согласно требованиям защиты окружающей среды. Печи для сжигания отходов на таких предприятиях оборудуют защитой и фильтрами, практически полностью исключающими выбросы вредных продуктов сгорания в атмосферу.
Те из негодных к переработки отходы, которые не горят, должны утилизироваться в специально отведенных местах, которые находятся в специально отведенных районах и представляют собой хорошо укрепленные и изолированные от контакта с грунтовыми водами котлованы или площадки, где складируются непригодные к переработке или сжиганию отходы.
Внимание! Данная статья написана эксклюзивно для сайта www.сайт. Полная или частичная перепечатка материалов возможна только при условии размещения прямой (индексируемой поисковыми системами) ссылки на источник (например: ).
Химическое соединение - это вещество, состоящее из двух или нескольких типов атомов или ионов, соединенных в молекулу; поэтому его можно разложить на два или несколько более простых веществ. Различные химические элементы в данном соединении всегда находятся в определенном весовом соотношении между собой. Это обусловлено тем, что атомы соединены друг с другом химическими связями совершенно определенным образом.
Группу атомов, соединенных химическими связями, называют молекулой. Молекула - это наименьшая частица вещества, сохраняющая те же химические свойства и состав, что и большее количество данного соединения. Молекула состоит не менее чем из двух атомов, которые могут быть одинаковыми (как, например, в молекуле кислорода или азота) или различными. Если молекула данного вещества состоит из двух или большего числа разных атомов, то мы имеем дело с химическим соединением.
Обычно свойства химического соединения совершенно отличны от свойств составляющих его элементов. Каждая молекула воды содержит два атома водорода и один атом кислорода, а вода по своим химическим свойствам совсем не похожа ни на водород, ни на кислород. Состав воды отражен в ее химической формуле - Н 2 0. Таким образом, химическая формула кратко фиксирует, какие типы атомов и в каком относительном количестве входят в состав молекулы.
Значительную часть вещества каждой клетки составляет вода. У человека содержание воды в различных тканях варьирует от 20% (в кости) до 85% (в ткани головного мозга). Около двух третей общей массы организма человека составляет вода; в организме медузы вода составляет 95%. Вода выполняет в живых системах ряд важных функций. В ней растворено большинство других веществ, для которых водная среда является необходимым условием для вступления в реакцию друг с другом. Вода растворяет "отходы" метаболизма и помогает выведению их из клетки и из организма.
Вода обладает большой теплоемкостью, т. е. способностью поглощать тепло при минимальном изменении своей собственной температуры. Это обусловлено тем, что расположенные рядом молекулы воды, находящейся в жидком или в твердом состоянии (лед), удерживаются вместе водородными связями (рис. 1) и определенное количество тепла расходуется на разрыв этих связей. Таким образом, вода предохраняет клетку от резких изменений температуры.
Вода обладает способностью поглощать большое количество тепла при переходе из жидкого состояния в газообразное, что позволяет организму освобождаться от избытка тепла путем испарения воды. Например, футболист, весящий 100 кг, может потерять за час игры 2 кг воды, испаряющейся при потоотделении. Теплота испарения воды равна 574 ккал/кг, отсюда 574 X 2 = 1148 ккал. Если бы вода не испарялась и все образующееся во время игры тепло сохранялось в организме, температура тела футболиста повысилась бы на 11,5 °С. Характерная для воды высокая теплопроводность создает возможность равномерного распределения тепла между тканями тела. Наконец, вода служит смазочным материалом, необходимым везде, где один орган трется о поверхность другого, а также в суставах.
В отличие от чистых химических соединений (например, воды) механическая смесь состоит из двух или большего числа типов атомов или молекул, которые могут сочетаться в самых различных пропорциях. Воду можно смешать со спиртом в любом соотношении, а воздух представляет собой смесь варьирующих количеств кислорода и азота с небольшой примесью водяного пара, углекислого газа, аргона и других газов. Из этого следует, что каждое химическое соединение должно обладать вполне определенными химическими и физическими свойствами, тогда как свойства смеси меняются в зависимости от относительных количеств ее компонентов.

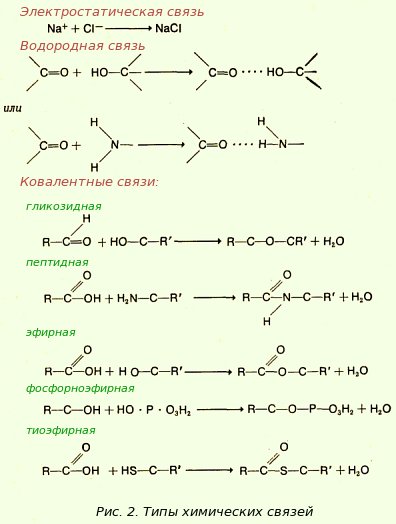
Атомы, составляющие молекулы, соединены между собой химическими связями (рис. 2). В веществах биологического происхождения важную роль играют
- электростатические связи (или ионные)
[показать]
Электростатические связи обусловлены взаимным притяжением частиц с разноименными зарядами; например, заряженные положительно ионы натрия могут соединяться с отрицательно заряженными ионами хлора, образуя кристаллический хлористый натрий (поваренную соль). Этот тип связи относительно непрочный и легко разрывается.
- водородные связи
[показать]
Водородные связи - это очень слабые связи, образующиеся в тех случаях, когда атом водорода находится между двумя атомами, одним из которых обычно является атом кислорода. Они легко образуются между любым водородным атомом, соединенным ковалентной связью с кислородом или азотом, и любым сильно электроотрицательным атомом (обычно кислородом или азотом), находящимся в другой молекуле или в другой части той же молекулы.
Водородные связи имеют определенную длину и определенное направление, т. е. образуют совершенно точные геометрические конфигурации, что очень важно в связи с их ролью в формировании структуры таких макромолекул, как белки и нуклеиновые кислоты. Молекулы воды, находящейся в жидком состоянии, удерживаются вместе отчасти благодаря образованию водородных связей. Это объясняется тем, что атом кислорода и два атома водорода расположены в молекуле воды асимметрично, образуя треугольник. Электроны, принадлежащие атомам водорода, сильнее притягиваются к ядру кислорода, чем к ядрам водорода, и поэтому располагаются ближе к кислородному атому. Вследствие этого молекула воды, будучи в целом электронейтральной, имеет небольшой локальный положительный заряд у двух атомов водорода и такой же отрицательный заряд у атома кислорода.
Молекулы с положительным зарядом на одном конце и отрицательным на другом называют полярными . Вещества, построенные из таких молекул, обычно растворимы в воде, так как в результате электростатического притяжения электрически заряженные частицы растворенного вещества окружаются молекулами воды, обращенными к частице теми своими концами, которые несут противоположный электрический заряд. Когда положительно заряженный водородный атом одной молекулы воды оказывается рядом с электроотрицательным атомом (кислородом) другой такой же молекулы, в результате притяжения между ними образуется водородная связь.
- ковалентные связи
[показать]
Ковалентные связи - отличаются прочностью, их образование требует затраты энергии. Как образование, так и расщепление этих связей в живых клетках происходит при участии ферментов.
Ковалентная связь возникает в том случае, когда каждый из двух соседних атомов передает по одному электрону "в общее пользование", так что эта пара электронов принадлежит одновременно обоим атомам. В отличие от этого при электростатической (ионной) связи один атом отдает электрон другому. Например, при образовании молекулы хлористого натрия атом натрия отдает электрон атому хлора.
Каждый атом водорода, как мы уже знаем, состоит из ядра и одного электрона. Когда два таких атома, соединяясь, образуют молекулу водорода, их электроны "обобществляются", так что первая электронная орбиталь каждого атома оказывается в известном смысле заполненной двумя электронами. В этом случае оба электрона принадлежат в равной степени обоим атомам и вероятность того, что они окажутся ближе к одному ядру, чем к другому, невелика. Такую связь называют неполярной ковалентной связью .
В молекуле воды, в которой два атома водорода ковалентно связаны с атомом кислорода, обобществляются электроны всех трех атомов и таким образом внешняя орбиталь кислорода оказывается заполненной 8 электронами, а первая орбиталь каждого из водородных атомов - двумя электронами. Эта ковалентная связь несколько отличается от ковалентной связи между двумя атомами водорода: при образовании такой связи между атомами двух различных элементов "обобществленные" электроны притягиваются к ним с неодинаковой силой. Такую связь называют полярной ковалентной связью .
В молекуле воды электроны располагаются ближе к ядру кислорода, чем к ядру водорода, так что атом кислорода приобретает некоторый отрицательный заряд, а атом водорода - положительный. Ковалентные связи могут обладать любой степенью полярности - от "нулевой", когда обобществленные электроны находятся на одинаковых расстояниях от обоих атомных ядер (как в молекуле водорода), до максимальной, когда эти электроны находятся значительно ближе к одному из атомов и поэтому полярность связи выражена очень сильно. Электростатическая связь в известном смысле представляет собой крайний случай полярной связи, когда электроны полностью переходят от одного атома к другому.
Поскольку электроны не фиксированы в пространстве, а непрерывно движутся, эта связь может резонировать. В один момент времени она может быть по существу ковалентной, а в другой - электростатической. Поэтому соединение, которое в основном является ковалентным, способно тем не менее к некоторой ионизации.
Из ковалентных связей большое значение имеют ангидридные связи , образующиеся при соединении двух молекул с одновременным выделением молекулы воды (при этом от одной молекулы отщепляется гидроксильная, или ОН-группа, а от другой - атом водорода). В биосинтетических реакциях такая связь часто образуется не в результате действительного отщепления молекулы воды, а путем замещения ОН-группы в одной молекуле фосфатной группой с последующим удалением этой фосфатной группы и атома водорода от другой молекулы; при этом освобождается неорганический фосфат и образуется ангидридная связь.
Ангидридные связи углеводов, или гликозидные связи, образуются при отщеплении атома водорода от спиртовой группы одной молекулы сахара и гидроксила от альдегидной группы другой молекулы (рис. 2). Ангидридные связи белков, или пептидные связи, образуются в результате отщепления ОН от карбоксильной группы (-СООН) одной аминокислоты и водорода от аминогруппы (-NН 2) другой аминокислоты. Ангидридные связи жиров, или эфирные связи, возникают при отщеплении группы ОН от карбоксильной группы жирной кислоты и водорода от спиртовой группы глицерина.
Из других эфирных связей большое биологическое значение имеют фосфорноэфирные связи , образующиеся при отщеплении Н от фосфорной кислоты и ОН-группы от сахара, а также тиоэфирные связи, при образовании которых ОН отщепляется от карбоксильной группы кислоты, а водород - от SН-группы. В нуклеотидах сахар соединен с пурином или пиримидином гликозидной связью, а с фосфатом - фосфорноэфирной. Кофермент А образует с целым рядом веществ тиоэфиры; например, ацетилко-фермент А представляет собой тиоэфир уксусной кислоты и кофермента А.
Кроме того еще выделяют два типа слабых связей - вандерваальсовы силы и гидрофобные связи, которые играют особенно важную роль в структуре белковых молекул.
Ясное представление о химических связях и их полярности позволяют более четко понимать свойства молекул в живых системах.
В химии принято называть соединения, содержащие углерод (за исключением карбонатов), органическими соединениями, а все остальные вещества - неорганическими. Однако неорганические соединения тоже играют важную роль в физиологии живых организмов.
На внешней орбитали атома углерода находятся четыре электрона, которые могут быть различным образом поделены между этим и соседними атомами. Поэтому углерод может образовывать больше различных соединений, чем любой другой элемент. Некогда полагали, что органические соединения - это вещества совсем особого рода, синтез которых возможен только в живых организмах. Это представление было опровергнуто в 1828 году, когда Вёлер впервые синтезировал мочевину (один из органических продуктов обмена, содержащийся в моче многих животных и человека) из неорганических соединений - сернокислого аммония и цианистого калия. Впоследствии были синтезированы многие тысячи органических веществ, в том числе сложные соединения, имеющие большое биологическое значение, например некоторые витамины, гормоны, антибиотики и лекарственные вещества.
Из неорганических соединений в живых организмах содержатся вода, углекислота, различные кислоты, основания и соли. Кислота - это соединение, при диссоциации которого в воде освобождаются ионы водорода (Н +). Кислоты изменяют цвет синей лакмусовой бумаги на красный и имеют кислый вкус. Соляная (НСl) и серная (Н 2 S0 4) кислоты относятся к неорганическим кислотам; молочная кислота (содержится в кислом молоке) и уксусная кислота (содержится в уксусе) - две из наиболее обычных органических кислот. Основанием называется соединение, при диссоциации которого в воде освобождаются гидроксильные группы (ОН -). Основания изменяют цвет красной лакмусовой бумаги на синий. К наиболее обычным неорганическим основаниям (щелочам) относятся гидрат окиси натрия, или едкий натр NаОН), и гидрат окиси аммония, или гидроокись аммония (NН 4 ОН).
Для удобства степень кислотности или щелочности той или иной жидкости, т.е. концентрацию в ней ионов водорода, можно выражать величиной рН (логарифм концентрации ионов водорода, взятый с обратным знаком). Протоплазма большинства животных и растительных клеток не дает ни сильнокислой, ни сильнощелочной реакции; она содержит почти нейтральную смесь веществ кислого и основного характера. Концентрация в ней водородных ионов (как и в чистой воде) составляет около 10 -7 М, а величина рН равна, следовательно, 7,0. При рН 7,0 концентрации свободных ионов Н + и ОН - равны друг другу. Сколько-нибудь значительное изменение рН протоплазмы несовместимо с жизнью. Так как шкала рН является логарифмической, то в растворе, имеющем рН 6, концентрация ионов водорода в 10 раз выше, чем в растворе с рН 7.
При смешивании кислоты и основания водородный ион кислоты соединяется с гидроксильным ионом основания и образуется молекула воды (Н 2 0). Остаток кислоты (анион) соединяется с остатком основания (катионом), образуя соль. Например, соляная кислота реагирует с гидратом окиси натрия с образованием воды и хлористого натрия, т. е. обыкновенной поваренной соли: Н + С1 - + Na + ОН --> Н 2 О + Nа + Сl - .
Соль можно определить как соединение, получающееся при замещении водородного атома кислоты каким-нибудь металлом.
При растворении солей, кислот или оснований в воде их молекулы разделяются на составляющие их ионы. Растворы, содержащие эти заряженные частицы, способны проводить электрический ток; поэтому эти вещества называются электролитами. Сахара, спирты и многие другие вещества, которые при растворении не распадаются на заряженные частицы и растворы которых поэтому не проводят электрического тока, называются неэлектролитами.
Клетки и внеклеточные жидкости содержат множество различных минеральных солей; при этом важнейшими катионами (положительно заряженными ионами) являются натрий, калий, кальций и магний, а главными анионами (отрицательно заряженными ионами) - хлорид-, бикарбонат-, фосфат- и сульфат-ионы. Жидкости тела наземных животных по общему содержанию солей значительно отличаются от морской воды, однако по составу солей и по их относительным концентрациям они в общем близки к ней (табл. 1). Общая концентрация солей в жидкостях тела большинства морских животных равна концентрации их в морской воде (примерно 3,4%). У наземных, пресноводных и морских позвоночных содержание солей в жидкостях тела составляет около 1%, а у наземных и пресноводных беспозвоночных - от 0,3 до 0,7%. Для нормального протекания жизненных процессов необходимо наличие в организме определенных солей, причем их относительные концентрации не должны выходить за определенные границы.
| Таблица 1. Ионный состав морской воды и жидкостей тела различных животных (содержание натрия принято за 100) | |||||||
| Объект | Группа | Na | К | Са | Мg | Сl | SО 4 |
| Морская вода | 100 | 2,74 | 2,79 | 13,94 | 136,8 | 7,10 | |
| Медуза | Кишечнополостные | 100 | 2,90 | 2,15 | 10,18 | 113,1 | 5,15 |
| Морской еж | Иглокожие | 100 | 2,30 | 2,28 | 11,21 | 116,1 | 5,71 |
| Phascolosoma | Сипункулиды | 100 | 10,07 | 2,78 | - | 114,1 | - |
| Uenus | Моллюски | 100 | 1,66 | 2,17 | 5,70 | 117,3 | 5,84 |
| Carcinus | Ракообразные | 100 | 2,32 | 2,51 | 3,70 | 105,2 | 3,90 |
| Водолюб | Насекомые | 100 | 11,10 | 0,92 | 16,8 | 33,6 | 0,12 |
| Морской черт | Рыбы | 100 | 2,85 | 1,01 | 1,61 | 71,9 | - |
| Лягушка | Земноводные | 100 | 2,40 | 1,92 | 1,15 | 71,4 | - |
| Человек | Млекопитающие | 100 | 3,99 | 1,78 | 0,66 | 84,0 | 1,73 |
Кровь человека и наземных позвоночных отличается от морской воды относительно большим содержанием калия и меньшим - магния и хлора. Жизнь, вероятно, возникла в море, и клетки первых организмов были приспособлены к тем солям и тем их относительным концентрациям, которые были характерны для моря в то время (хотя концентрация солей в первичном океане, вероятно, была ниже, чем в современном). В процессе эволюции жидкости тела животных стали в общем сходными по относительной концентрации солей, так как всякое значительное отличие в солевом составе привело бы к подавлению тех или иных клеточных ферментов и поставило бы таких животных в невыгодные условия в борьбе за существование.
У некоторых животных развились почки и другие органы выделения, позволяющие избирательно задерживать в организме или, наоборот, выводить из него те или иные ионы. Поэтому жидкости тела в известной мере различаются по относительным концентрациям солей, поскольку концентрация ионов каждого типа определяется относительной скоростью поглощения и выделения их из организма.
В нормальных условиях содержание различных солей чрезвычайно постоянно, и всякое значительное отклонение от нормы приводит к серьезным последствиям, а иногда и к смерти. Понижение концентрации ионов кальция в крови у млекопитающих вызывает судороги и смерть. Сердечная мышца может нормально сокращаться только при наличии соответствующего баланса ионов натрия, калия и кальция. Если изолировать сердце лягушки и поместить его в чистый раствор хлористого натрия, то оно вскоре перестанет сокращаться, остановившись в расслабленном состоянии; если поместить его в раствор хлористого калия или в смешанный раствор хлоридов натрия и кальция, оно остановится в состоянии сокращения. Если же поместить сердце в раствор этих трех солей взятых в надлежащем соотношении, оно будет продолжать сокращаться. Эта проба с сердцем лягушки настолько чувствительна, что ее можно использовать для измерения концентрации ионов кальция в растворах.
Помимо этого специфического действия на определенные клеточные функции, минеральные соли играют важную роль в поддержании осмотических отношений между клеткой и окружающей ее средой.
Все вещества можно разделить на простые (состоящие из атомов одного химического элемента) и сложные (состоящие из атомов разных химических элементов). Простые вещества делятся на металлы и неметаллы .
Металлы обладают характерным “металлическим” блеском, ковкостью, тягучестью, могут прокатываться в листы или вытягиваться в проволоку, обладают хорошей теплопроводностью и электрической проводимостью. При комнатной температуре все металлы, кроме ртути, находятся в твердом состоянии.
Неметаллы не обладают блеском, хрупки, плохо проводят теплоту и электричество. При комнатной температуре некоторые неметаллы находятся в газообразном состоянии.
Сложные вещества делят на органические и неорганические.
Органическими соединениями принято называть соединения углерода. Органические соединения входят в состав биологических тканей и являются основой жизни на Земле.
Все остальные соединения называются неорганическими (реже минеральными). Простые соединения углерода (СО, СО 2 и ряд других) принято относить к неорганическим соединениям, их обычно рассматривают в курсе неорганической химии.
Классификация неорганических соединений
Неорганические вещества делят на классы либо по составу (бинарные и многоэлементные; кислородосодержащие, азотсодержащие и т.п.), либо по функциональным признакам.
К важнейшим классам неорганических соединений, выделяемых по функциональным признакам, относятся соли, кислоты, основания и оксиды.
Соли – это соединения, которые в растворе диссоциируют на катионы металла и кислотные остатки. Примерами солей могут служить, например, сульфат бария BaSO 4 и хлорид цинка ZnCl 2 .
Кислоты – вещества, диссоциирующие в растворах с образованием ионов водорода. Примерами неорганических кислот могут служить соляная (НCl), серная (H 2 SO 4), азотная (HNO 3), фосфорная (H 3 PO 4) кислоты. Наиболее характерное химическое свойство кислот – их способность реагировать с основаниями с образованием солей. По степени диссоциации в разбавленных растворах кислоты подразделяются на сильные кислоты, кислоты средней силы и слабые кислоты. По окислительно–восстановительной способности различают кислоты–окислители (HNO 3) и кислоты–восстановители (HI, H 2 S). Кислоты реагируют с основаниями, амфотерными оксидами и гидроксидами с образованием солей.
Основания – вещества, диссоциирующие в растворах с образованием только гидроксид-анионов (OH 1-). Растворимые в воде основания называют щелочами (КОН, NaOH). Характерное свойство оснований – взаимодействие с кислотами с образованием соли и воды.
Оксиды – это соединения двух элементов, один из которых кислород. Различают оксиды основные, кислотные и амфотерные. Основные оксиды образованы только металлами (CaO, K 2 O), им соответствуют основания (Ca(OH) 2 , KOH). Кислотные оксиды образуются неметаллами (SO 3 , P 2 O 5) и металлами, проявляющими высокую степень окисления (Mn 2 O 7), им соответствуют кислоты (H 2 SO 4 , H 3 PO 4 , HMnO 4). Амфотерные оксиды в зависимости от условий проявляют кислотные и основные свойства, взаимодействуют с кислотами и основаниями. К ним относятся Al 2 O 3 , ZnO, Cr 2 O 3 и ряд других. Существуют оксиды, не проявляющие ни основных, ни кислотных свойств. Такие оксиды называются безразличными (N 2 O, CO и др.)
Классификация органических соединений
Углерод в органических соединениях, как правило, образует устойчивые структуры, в основе которых лежат углерод-углеродные связи. В способности образовывать такие структуры углерод не имеет себе равных среди других элементов. Большинство органических молекул состоит из двух частей: фрагмента, который в ходе реакции остаётся без изменения, и группы, подвергающейся при этом превращениям. В связи с этим определяется принадлежность органических веществ к тому или иному классу и ряду соединений.
Неизменный фрагмент молекулы органического соединения принято рассматривать в качестве остова молекулы. Он может иметь углеводородную или гетероциклическую природу. В связи с этим можно условно выделить четыре больших ряда соединений: ароматический, гетероциклический, алициклический и ациклический.
В органической химии также выделяют дополнительные ряды: углеводороды, азотсодержащие соединения, кислородосодержащие соединения, серосодержащие соединения, галогеносодержащие соединения, металлоорганические соединения, кремнийорганические соединения.
В результате комбинации этих основополагающих рядов образуются составные ряды, например: "Ациклические углеводороды", "Ароматические азотсодержащие соединения".
Наличие тех или иных функциональных групп либо атомов элементов определяет принадлежность соединения к соответствующему классу. Среди основных классов органических соединений выделяют алканы, бензолы, нитро- и нитрозосоединения, спирты, фенолы, фураны, эфиры и большое количество других.
Типы химических связей
Химическая связь – это взаимодействие, удерживающее два или несколько атомов, молекул или любую комбинацию из них. По своей природе химическая связь представляет собой электрическую силу притяжения между отрицательно заряженными электронами и положительно заряженными атомными ядрами. Величина этой силы притяжения зависит главным образом от электронной конфигурации внешней оболочки атомов.
Способность атома образовывать химические связи характеризуется его валентностью. Электроны, участвующие в образовании химической связи, называются валентными.
Различают несколько типов химических связей: ковалентную, ионную, водородную, металлическую.
При образовании ковалентной связи происходит частичное перекрывание электронных облаков взаимодействующих атомов, образуются электронные пары. Ковалентная связь оказывается тем прочнее, чем в большей степени перекрываются взаимодействующие электронные облака.
Различают полярную и неполярную ковалентные связи.
Если двухатомная молекула состоит из одинаковых атомов (H 2 , N 2), то электронное облако распределяется в пространстве симметрично относительно обоих атомов. Такая ковалентная связь называется неполярной (гомеополярной). Если же двухатомная молекула состоит из разных атомов, то электронное облако смещено к атому с большей относительной электроотрицательностью. Такая ковалентная связь называется полярной (гетерополярной). Примерами соединений с такой связью могут служить HCl, HBr, HJ.
В рассмотренных примерах каждый из атомов обладает одним неспаренным электроном; при взаимодействии двух таких атомов создается общая электронная пара – возникает ковалентная связь. В невозбужденном атоме азота имеется три неспаренных электрона, за счет этих электронов азот может участвовать в образовании трех ковалентных связей (NH 3). Атом углерода может образовать 4 ковалентных связи.
Перекрывание электронных облаков возможно только при их определенной взаимной ориентации, при этом область перекрывания располагается в определенном направлении по отношению к взаимодействующим атомам. Другими словами, ковалентная связь обладает направленностью.
Энергия ковалентных связей находится в пределах 150–400 кДж/моль.
Химическая связь между ионами, осуществляемая электростатическим притяжением, называется ионной связью . Ионную связь можно рассматривать как предел полярной ковалентной связи. В отличие от ковалентной связи ионная связь не обладает направленностью и насыщаемостью.
Важным типом химической связи является связь электронов в металле. Металлы состоят из положительных ионов, которые удерживаются в узлах кристаллической решетки, и свободных электронов. При образовании кристаллической решетки валентные орбитали соседних атомов перекрываются и электроны свободно перемещаются из одной орбитали в другую. Эти электроны уже не принадлежат определенному атому металла, они находятся на гигантских орбиталях, которые простираются по всей кристаллической решетке. Химическая связь, осуществляемая в результате связывания положительных ионов решетки металла свободными электронами, называется металлической.
Между молекулами (атомами) веществ могут осуществляться слабые связи. Одна из самых важных – водородная связь , которая может быть межмолекулярной и внутримолекулярной . Водородная связь возникает между атомом водорода молекулы (он заряжен частично положительно) и сильно электроотрицательным элементом молекулы (фтор, кислород и т.п.).
Энергия водородной связи значительно меньше энергии ковалентной связи и не превышает 10 кДж/моль. Однако этой энергии оказывается достаточно для создания ассоциаций молекул, затрудняющих отрыв молекул друг от друга. Водородные связи играют важную роль в биологических молекулах (белках и нуклеиновых кислотах), во многом определяют свойства воды.
Силы Ван-дер-Ваальса также относятся к слабым связям. Они обусловлены тем, что любые две нейтральных молекулы (атома) на очень близких расстояниях слабо притягиваются из-за электромагнитных взаимодействий электронов и ядер одной молекулы с электронами и ядрами другой.
Химическое соединение
Для химического соединения характерны следующие отличительные особенности:
1) Кристаллическая решетка отличается от решеток компонентов, образующих соединение.
2) В соединении всегда сохраняется простое кратное соотношение его компонентов. Это позволяет выразить их состав простой формулой A m B n , где А и В – соответствующие элементы, n и m – простые числа.
3) Свойства соединения резко отличаются от свойств образующих его компонентов.
4) Температура плавления (диссоциации) постоянная.
5) Образование химического соединения сопровождается значительным тепловым эффектом.
Химические соединения образуются между компонентами, имеющими большое различие в электронном строении атомов и кристаллических решеток.
В качестве примера типичных химических соединений можно назвать такие, как соединения магния с элементами IV-VI групп периодической системы: Mg 2 Sn, Mg 2 Pb, Mg 2 P, Mg 3 Sb, MgS и другие.
Соединения одних металлов с другими носят общее название интерметаллических соединений, или интерметаллидов.
Соединения металла с неметаллом (нитриды, оксиды, карбиды и др.) могут иметь как металлическую, так и ионную связь. Соединения, имеющие металлическую связь, называют металлическими соединениями.
Большое число химических соединений, образующихся в металлических сплавах, отличается от типичных химических соединений, так как не подчиняется законам валентности и не имеет постоянного состава. Рассмотрим наиболее важные химические соединения, образующиеся в сплавах.
7.2.1.Фазы внедрения . Переходные металлы (Fe, Mn, Cr, Mo и др.) образуют с углеродом, азотом, бором и водородом, т.е. с элементами, имеющими малый атомный радиус, соединения: карбиды, нитриды, бориды и гидриды. Они имеют общность строения и свойств и часто называются фазами внедрения.
Фазы внедрения имеют формулу М 4 Х (Fe 4 N, Mn 4 N и др.), M 2 X (W 2 C, Fe 2 N и др.), MX (WC, TiC,TiN и др.).
Кристаллическая структура фаз внедрения определяется соотношением атомных радиусов неметалла (R x) и металла (R M). Если R x / R M <59, то атомы в этих фазах расположены по типу одной из кристаллических решеток: кубической или гексагональной, в которую внедряются атомы неметалла, занимая в ней определенные поры.
Фазы внедрения являются фазами переменного состава. Карбиды и Нитриды обладают высокой твердостью. Кристаллическая решетка фаз внедрения отличается от решетки металла.
7.2.2. Электронные соединения (фазы Юм-Розери). Эти соединения чаще образуются между одновалентными (Cu, Ag, Au, Li, Na) металлами или металлами переходных групп (Fe, Mn, Co и др.), с одной стороны, и с простыми металлами с валентностью от 2 до 5 (Be,
Mg, Zn, Cd, Al и др.), с другой стороны. Соединения этого типа имеют определенное соотношение числа валентных электронов к числу атомов, т.е. определенную электронную концентрацию. Эти соотношения, как показал английский металлофизик Юм-Розери, могут быть 3/2, 21/13 и 7/4, причем каждому соотношению соответствует определенная кристаллическая решетка: объемно центрированная кубическая или гексагональная решетка, сложная кубическая решетка и гранецентрированная кубическая решетка, соответственно.
7.2.3.Фазы Лавеса . Эти фазы имеют формулу АВ 2 и образуются между элементами, атомные диаметры которых находятся примерно в соотношении 1: 1,2. Например, MgZn 2 , TiCr 2 и др. Фазы Лавеса встречаются как упрочняющие интерметаллиды в жаропрочных сплавах.
Твердые растворы
Твердыми растворами называют фазы, в которых один из компонентов сплава сохраняет свою кристаллическую решетку, а атомы других (или другого) компонентов располагаются в решетке первого компонента (растворителя), изменяя ее размеры. Таким образом, твердый раствор, состоящий из нескольких компонентов, имеет один тип решетки и представляет собой одну фазу. Кроме того, твердый раствор существует не при определенном соотношении компонентов (как в химическом соединении), а в интервале концентраций.
Различают твердые растворы .
При образовании твердых растворов замещения атомы растворенного компонента замещают часть атомов растворителя в его кристаллической решетке (рис.26, б ).
При образовании твердого раствора внедрения (рис.26, в ) атомы растворенного компонента располагаются в межузлиях (пустотах) кристаллической решетки растворителя.
Рис.26. Кристаллическая решетка ОЦК: а - чистый металл, б - твердый раствор замещения, в - твердый раствор внедрения; А - атомы основного металла, В – атомы замещения, С – атомы внедрения.
Металлы могут в той или иной степени взаимно растворяться друг в друге в твердом состоянии, образуя твердые растворы замещения с ограниченной или неограниченной растворимостью. Твердые растворы с неограниченной растворимостью образуются при следующих условиях:
1) Компоненты должны обладать одинаковыми по типу (изоморфными) кристаллическими решетками.
2) Различие в атомных размерах компонентов должно быть незначительным и не превышать 10-15%.
3) Компоненты должны принадлежать к одной и той же (или родственной) группе периодической системы элементов.
В некоторых сплавах (например, Cu-Au, Fe-Al), образующих при высоких температурах растворы замещения (с неупорядоченным чередованием атомов компонентов), при медленном охлаждении или длительном нагреве при определенных температурах протекает процесс перераспределения атомов. Твердые растворы, устойчивые при сравнительно низких температурах, получили название упорядоченных твердых растворов, или сверхструктур . Упорядоченные твердые растворы можно рассматривать как промежуточные фазы между твердыми растворами и химическими соединениями. В отличие от химических соединений кристаллическая решетка упорядоченных твердых растворов представляет собой решетку растворителя. Образование упорядоченных твердых растворов сопровождается изменением физических и механических свойств. Прочность обычно возрастает, а пластичность падает.
Способность к образованию твердых растворов присуща не только чистым элементам, но и химическим соединениям. В этих случаях сохраняется кристаллическая решетка химического соединения, но избыточное количество атомов одного из компонентов может заменять какое-то количество атомов другого компонента. Кроме того, при этом в отдельных узлах могут появляться незанятые места – пустоты. Твердые растворы на базе химических соединений, образование которых сопровождается появлением пустых мест в узлах решетки, называются растворами вычитания.
РЕЗЮМЕ
Под сплавом подразумевают вещество, полученное сплавлением двух или более элементов.
Совокупность фаз, находящихся в состоянии равновесия, называют системой . Фазой называют однородные составные части системы, имеющие одинаковый состав, кристаллическое строение и свойства, одно и то же агрегатное состояние и отделенные от составных частей поверхности раздела. Под структурой понимают форму, размеры и характер взаимного расположения фаз в металлах и сплавах. Компоненты в сплаве могут образовывать механические смеси, химические соединения или твердые растворы.
Механическая смесь двух компонентов образуется тогда, когда они не способны к взаимному растворению в твердом состоянии и не вступают в химическую реакцию с образованием соединения.
Химические соединения образуются между компонентами, имеющими большое различие в электронном строении атомов и кристаллических решеток. Строение и свойства химического соединения отличаются от строения и свойств создавших его компонентов.
Наиболее важные химические соединения, образующиеся в сплавах:
Фазы внедрения
Электронные соединения (фазы Юм-Розери)
Фазы Лавеса
Твердыми растворами называют фазы, в которых один из компонентов сплава сохраняет свою кристаллическую решетку, а атомы других (или другого) компонентов располагаются в решетке первого компонента (растворителя), изменяя ее размеры.
Различают твердые растворы замещения, внедрения и вычитания .
Вопросы для повторения
1. Что такое сплав?
2. Дать определение терминам «фаза», «система», «структура».
3. Когда в сплаве образуется механическая смесь компонентов, а когда - химическое соединение?
4. Что такое твердые растворы? Какие виды твердых растворов Вы знаете?
8. ДИАГРАММЫ СОСТОЯНИЯ
Диаграмма состояния представляет собой графическое изображение состояния сплава. Диаграммы состояния строят для условий равновесия или условий, достаточно близких к ним. Поэтому диаграмма состояния может также называться диаграммой равновесия.
Равновесное состояние соответствует минимальному значению свободной энергии. Этого состояния можно достичь при отсутствии перегрева или переохлаждения сплава. Диаграмма состояния представляет собой теоретический случай, т.к. равновесные превращения (без переохлаждения или перегрева) на практике не могут совершать-
ся. Обычно на практике используются превращения, происходящие при малых скоростях нагрева или охлаждения.
Общие закономерности сосуществования устойчивых фаз могут быть выражены в математической форме в виде правила фаз или закона Гиббса.
Правило фаз дает количественную зависимость между степенью свободы системы и количеством фаз компонентов.
Под числом степеней свободы (вариантностью) системы понимают число внешних и внутренних факторов (температура, давление, концентрация), которое можно изменять без изменения числа фаз в системе.
Правило фаз .
С= k - f + 2
С - число степеней свободы, k - число компонентов, f – число фаз, 2 – число внешних факторов.
Правило фаз справедливо только для равновесного состояния.
Независимыми переменными в уравнении правила фаз являются концентрация, температура и давление. Если принять, что все превращения в металле происходят при постоянном давлении, то число переменных уменьшится на единицу.
С= k - f + 1
Пример. Посмотрим, как изменяется степень свободы однокомпонентной системы (k=1 ) для случая кристаллизации чистого металла. Когда металл находится в жидком состоянии, т.е. f =1 (одна фаза - жидкость), число степеней свободы равно 1. Температура в данном случае может изменяться, не изменяя агрегатного состояния. В момент кристаллизации f =2 (две фазы – твердая и жидкая), С=0 . Это значит, что две фазы находятся в равновесии при строго определенной температуре (температура плавления), и она не может быть изменена до тех пор, пока одна фаза не исчезнет, т.е. система не станет моновариантной (C=1 ).
ХИМИЯ ОРГАНИЧЕСКАЯ. КЛАССЫ СОЕДИНЕНИЙ
Органические соединения (углеводороды и их производные) можно разделить на два типа: ациклические (или алифатические, т.е. с открытой углеродной цепью) и циклические; последние в свою очередь подразделяются на алициклические, в молекулах которых содержатся углеродные кольца неароматического характера; ароматические, проявляющие свойства, характерные для бензола; гетероциклические, в которых один или несколько атомов в кольце представляют собой атомы неметаллов, отличные от углерода. Внутри каждого из этих типов возможна дальнейшая дифференциация на классы по присутствующим в них реакционным центрам - функциональным группам. Например, органические соединения, имеющие карбоксильную группу -СООН, являются кислотами и вступают в реакции, характерные для кислот (нейтрализация оснований, образование эфиров со спиртами и т.д.). Реакции таких групп несколько изменяются при изменении структуры молекулы, в которой они находятся; на них могут влиять и другие группы в молекуле, хотя это влияние обычно мало. Ниже перечислены типичные функциональные группы с примерами наиболее значимых и интересных представителей каждого класса, затем рассматриваются реакции функциональных групп (разд. IV. "Реакции органических соединений").
А. УГЛЕВОДОРОДЫ
Углеводороды являются соединениями углерода и водорода. (Простейший углеводород - метан СН4.) Алифатические и алициклические углеводороды могут содержать прямые (неразветвленные), разветвленные или замкнутые в кольца цепи углеродных атомов. Если четыре углеродных атома соединены один с другим только простыми (одинарными) связями, образуется углеводород бутан C4H10 с открытой (неразветвленной) цепью:
Здесь черточки изображают ковалентные связи между углеродными атомами в плоскости страницы, пунктирные линии - связи с атомами водорода ниже, а жирные клинообразные линии - с атомами водорода выше этой плоскости. Углы между углерод-углеродными связями 109°. Эта молекула может свободно вращаться вокруг простых связей (что вообще справедливо для простых связей).
Структурную формулу бутана можно написать как

либо проще, CH3-CH2-CH2-CH3 или CH3CH2CH2CH3. Для четырех углеродных атомов, связанных простыми связями, возможна также структура с разветвленной цепью:

Эта формула изображает другое соединение - изобутан, у которого иные свойства, чем у бутана (например, более низкие температуры кипения и замерзания). Заметим, что и бутан, и изобутан имеют один и тот же состав: C4H10. Такие соединения, с одинаковыми брутто-формулами, называются "изомерами". Изомерия - обычное явление в органической химии, для сложных формул возможны миллиарды изомеров. Существуют два циклических четырехуглеродных (C4) углеводорода, содержащих только простые связи: циклобутан и метилциклопропан, оба имеют брутто-формулу C4H8:

Насыщенные и ненасыщенные углеводороды.
Насыщенные (предельные) углеводороды - алканы (парафины) - содержат только простые (одинарные) связи между атомами углерода (например, метан, бутан, изобутан и циклобутан). Если в молекуле присутствует кратная (двойная, тройная) связь, соединение называют ненасыщенным (или непредельным) - это алкены (олефины) и алкины (ацетилены). Алканы обычно химически инертны, поскольку все валентные электроны углерода и водорода прочно связаны в сильных ковалентных связях. Метан, бутан и изобутан представляют собой алканы. Циклоалканы, представителями которых являются циклобутан и метилциклопропан, - алканы, содержащие кольцо из углеродных атомов. У ненасыщенных углеводородов реакционный центр находится по месту кратной связи. Они вступают в разнообразные химические реакции гораздо легче, чем насыщенные углеводороды. Простейший из алкенов - этилен:

Все атомы этой молекулы лежат в одной плоскости. Вращение вокруг двойных связей невозможно, поэтому если два олефина одинакового состава различаются расположением групп относительно двойной связи, то они не идентичны и называются цис-транс-изомерами. У цис-изомеров одинаковые группы, соседние с двойной связью, расположены по одну сторону двойной связи, тогда как в транс-изомерах - по разные стороны.

Ацетилен H-CєC-H является простейшим алкином. Все его атомы лежат на прямой линии, поэтому цис-транс-изомерия невозможна, хотя атомы, связанные тройной связью, не могут вращаться друг относительно друга. Молекула бутина-2 H3C-CєC-CH3 также линейна. Ароматические углеводороды содержат шестичленные кольца условно с тремя двойными связями, чередующимися с тремя простыми. Простейшим соединением этого типа является бензол, имеющий структуру

Свойства.
Углеводороды представляют собой наименее полярные из органических молекул, поскольку связи C-H почти полностью ковалентны. В результате они имеют относительно низкие температуры кипения (т. кип.) и плавления (т. пл.) по сравнению с другими органическими соединениями. Углеводороды, содержащие в цепи до четырех атомов углерода включительно, при атмосферном давлении и комнатной температуре газообразны; к ним относятся топливные газы метан CH4, этан C2H6, пропан C3H8 и бутан C4H10 (последние два обычно продают в баллонах под давлением). Насыщенные неразветвленные углеводороды становятся твердыми при комнатной температуре, начиная с углеводорода C16. Разветвленные и ненасыщенные углеводороды являются более низкоплавкими соединениями; например, углеводород с прямой цепью гексадекан CH3(CH2)14CH3, или C16H34, плавится при 20° С, а разветвленный углеводород тетрамер 2-метилпропена (C4H8)4, или C16H32, затвердевает при -139° С, тогда как ненасыщенный углеводород гексадецин-2 CH3(CH2)12CєCCH3, или C16H30, имеет т. пл. -25° С. Циклическим соединениям свойственны более высокие температуры плавления, чем алифатическим (с открытой углеродной цепью) соединениям той же молекулярной массы; например, у 1,3-диметилциклогексана C6H10(CH3)2 т. пл. -85° С, т.е. на 19° С выше, чем у неразветвленного углеводорода октена C8H16, который имеет ту же брутто-формулу (и поэтому ту же молекулярную массу), но плавится при -104° С. Все углеводороды горят, образуя углекислый газ и воду. Химические реакции насыщенных, ненасыщенных и ароматических соединений совершенно отличны друг от друга.
Практически важные углеводороды.
Ниже перечислены некоторые имеющие большое практическое значение углеводороды, их свойства и применения. Метан CH4 - бесцветный, не имеющий запаха газ с т. кип. -162° С. Он является главным компонентом природного газа, широко используемого как топливо. Сырая нефть - сложная смесь углеводородов (и некоторых следовых соединений) вплоть до С40. Перегонка и химическая переработка нефти дают множество промышленных углеводородов и очищенных смесей углеводородов. К продуктам, получаемым перегонкой нефти, относятся (в порядке повышения т. кип.) разбавители для красок, бензин, керосин, минеральные масла, смазочные масла и асфальт
(см.
НЕФТЕХИМИЧЕСКИЕ ПРОДУКТЫ ;
ХИМИЯ И МЕТОДЫ ПЕРЕРАБОТКИ НЕФТИ). Циклопропан - бесцветный горючий газ с т. кип. -33° С. Его используют в органическом синтезе и медицине (как анестетик). Этилен H2C=CH2, бесцветный газ с т. кип. -102° С. Исходный материал для синтеза ряда химических продуктов, в том числе этилового спирта и полиэтилена (см. ПЛАСТМАССЫ). Пропилен H3C-CH=CH2, бесцветный газ с т. кип. -48° С. Мономер полипропилена.
Бутадиен и стирол.
Бутадиен H2C=CH-CH=CH2, бесцветный горючий газ без запаха с т. кип. -4,5° С. Стирол C6H5CH=CH2, бесцветная жидкость со специфическим запахом ароматических соединений, т. кип. 146° С. Эти углеводороды служат исходными мономерами для получения ряда пластмасс и каучуков. Бензол C6H6, прозрачная, бесцветная, горючая жидкость с характерным запахом, т. кип. 80° С. Бензол широко используется как растворитель и исходный материал для синтеза многих органических соединений, включая взрывчатые вещества, красители и медицинские препараты. Нафталин C10H8 с молекулярной структурой в виде двух конденсированных колец (см. табл. 4). Это белые кристаллические пластинки с т. пл. 80° С, вещество летуче. Общеизвестно его применение в виде шариков для отпугивания моли; сырье в производстве красителей. Ацетилен HCєCH, бесцветный газ с т. кип. -83° С. Его применяют как горючее в ацетиленовых горелках для резки и сварки металлов, а также для синтеза многих других органических соединений.
Б. ОРГАНИЧЕСКИЕ ГАЛОГЕНИДЫ
Органические галогениды имеют общую формулу R-X, где R - стандартное обозначение для углеводородных групп, а X - атом галогена (фтора, хлора, брома или иода). Органические галогениды очень важны как исходные реагенты органического синтеза и растворители. Так же, как и углеводороды, они не очень полярны, и многие из них являются жидкостями. Некоторые из них ядовиты (например, тетрахлорид углерода), другие совершенно нетоксичны (например, фреоны, используемые в холодильниках для хранения пищевых продуктов). Хлориды гораздо дешевле бромидов и иодидов и потому находят более широкое применение в качестве растворителей. Практически важные органические галогениды. Тетрахлорид углерода CCl4, бесцветная негорючая жидкость, т. кип. 77° С. Его широко используют в качестве растворителя жиров и для выведения пятен, но он довольно ядовит и вдыхание заметных количеств его паров вызывает серьезное повреждение печени. Раньше его применяли для пожаротушения, но от этого пришлось отказаться, так как при высоких температурах из него может образоваться смертельно опасный газ фосген COCl2. Хлороформ (трихлорметан) CHCl3, жидкость со сладковатым запахом, т. кип. 61° С. Его широко применяли как анестетик, но поскольку он ядовит, были разработаны заменяющие его анестезирующие средства. Однако его еще используют для гуманного умерщвления животных. Как и тетрахлорид углерода, хлороформ является прекрасным растворителем. Трихлорэтилен ClCH=CCl2, стабильная, тяжелая, ядовитая жидкость, т. кип. 87° С. Широко применяется как растворитель для химической чистки наряду с другими сходными хлорсодержащими растворителями; все они дешевы, не слишком летучи и менее токсичны, чем тетрахлорид углерода. Дихлордифторметан CCl2F2, бесцветный инертный газ без запаха, т. кип. -30° С. Один из низкомолекулярных хлорфторуглеводородов, называемых фреонами или хладонами, которые использовались как хладагенты и пропелленты в аэрозолях для распыления красок, инсектицидов и т.д. К фреонам относятся также хлордифторметан и хлортрифторметан. Все фреоны нетоксичны и не вызывают коррозии, но в настоящее время международные экологические соглашения предусматривают постепенную замену их другими соединениями с аналогичными физическими свойствами, поскольку фреоны, попадая в стратосферу, способствуют разрушению защитного озонового слоя Земли. См. также ХОЛОДИЛЬНАЯ ТЕХНИКА . Тетрафторэтилен F2C=CF2, бесцветный газ с т. кип. -78,4° С, который полимеризуется, образуя тефлон, химически инертный полимер со структурой F(CF2)nF. Хлоропрен H2C=CCl-CH=CH2, бесцветная жидкость, т. кип. 59,4° С. Его используют преимущественно для производства хлоропренового (неопренового) каучука.
См. также КАУЧУК И РЕЗИНА . Винилхлорид H2C=CHCl, легко ожижаемый газ, т. кип. -13,9° С. Его применяют как хладагент и в производстве пластмасс. Метилбромид (бромметан) CH3Br, ядовитый газ, т. кип. 5° С. Используется для стерилизации почвы, так как в высоких концентрациях убивает все живые организмы; он безвреден для человека в низких концентрациях при кратковременном контакте.
В. СПИРТЫ
Спирты имеют общую структурную формулу ROH. Группа -OH высокополярна, и поэтому спирты гораздо более растворимы в воде и других полярных растворителях, чем углеводороды, галогениды или простые эфиры. Простые спирты, содержащие менее четырех атомов углерода, смешиваются с водой во всех соотношениях. Благодаря полярному характеру спиртов, их точки кипения также относительно высоки. Так, пропан C3H8, метилхлорид CH3Cl и этиловый спирт C2H5OH имеют приблизительно одинаковые молекулярные массы, но их т. кип. лежат соответственно при -24° С, -42° С и +78° С. Первые два соединения почти полностью нерастворимы в воде, тогда как этиловый спирт смешивается с ней в любых пропорциях. Спирты вступают в многочисленные и разнообразные реакции и поэтому имеют большое значение в качестве промежуточных соединений в синтезах. Они также являются важными промышленными растворителями.
Практически важные спирты.
Метиловый спирт (метанол) CH3OH, бесцветная растворимая в воде жидкость, т. кип. 65° С. Когда-то его получали сухой перегонкой дерева и потому его иногда называют "древесный спирт". Теперь его производят в наибольших количествах из нефти. Метиловый спирт - это смертельный яд, и его потребление внутрь может привести к слепоте или смерти. Он представляет собой важный растворитель для полярных соединений и используется в больших количествах как антифриз. Для последней цели его летучесть является серьезным недостатком, так как требует долива по мере испарения. Этиловый спирт (этанол) C2H5OH, бесцветная жидкость, т. кип. 78° С, полностью растворима в воде. Именно этиловый спирт содержится в спиртных напитках и приготавливается для этой цели сбраживанием крахмала, сахара или зерна. Он также находит широкое применение как промышленный растворитель и для приготовления настоек, которые являются просто растворами в спирте. Большие количества этилового спирта получают из этилена (продукта нефтяной промышленности). Этиловый спирт служит исходным материалом для приготовления длинного списка продуктов химической промышленности: уксусной кислоты, сложных эфиров и многих других низкомолекулярных соединений. Пищевой спирт идет на изготовление алкогольных напитков, но технический этиловый спирт выпускается также в виде т.н. денатурата, непригодного для питья, но подходящего для многих других целей. Денатурирование достигается прибавлением нескольких процентов постороннего трудно удаляемого вещества. Поступающий в продажу этиловый спирт содержит около пяти процентов воды, которую нельзя удалить простой перегонкой водно-спиртовой смеси. От последних следов воды можно избавиться перегонкой с небольшим количеством бензола или другими способами, дающими безводный "абсолютный" спирт. Изопропиловый спирт (изопропанол) (CH3)2CH-OH, бесцветная жидкость, т. кип. 82° С. Изопропиловый спирт используется как растворитель и как промежуточное вещество для получения сложных эфиров и других продуктов химической промышленности. Бутиловый спирт (бутанол) CH3CH2CH2CH2OH, бесцветная, частично растворимая в воде жидкость, т. кип. 118° С. В промышленности его получают сбраживанием крахмала (зерна) или сахаров при помощи особого штамма микроорганизмов, которые продуцируют бутиловый спирт и ацетон, а не этиловый спирт. н-Бутанол (нормальный бутиловый спирт, т.е. с неразветвленной углеродной цепью) находит широкое применение в производстве растворителей для лаков. Сивушное масло является смесью C5-спиртов, образующихся в качестве побочного продукта при получении других спиртов посредством брожения. Более обычный способ получения C5-спиртов, используемых в качестве растворителей и для приготовления эфиров, состоит в гидролизе C5-хлоридов, продуктов хлорирования соответствующей нефтяной фракции. Этиленгликоль HOCH2CH2OH, прозрачная, бесцветная, сиропообразная жидкость, т. кип. 198° С. Этиленгликоль находит широкое применение как антифриз, поскольку он полностью растворим в воде, дешев, нелетуч и сильно снижает точку замерзания водных растворов (60%-ный раствор этиленгликоля в воде замерзает при -40° С). Этиленгликоль умеренно ядовит. Глицерин HOCH2CH(OH)CH2OH, прозрачная, сладкая на вкус, бесцветная или желтоватая сиропообразная жидкость, полностью растворимая в воде, т. кип. 290° С. Легко перевариваемый и нетоксичный, глицерин находит применение как увлажняющий и текстурирующий агент в пищевых продуктах, в косметике (кремы для рук) и некоторых медицинских препаратах. В связанном виде глицерин присутствует во всех жирах и получается в больших количествах как побочный продукт при производстве мыла. Однако этого источника недостаточно для полного удовлетворения спроса на глицерин, и потому его синтезируют из продуктов переработки нефти. Одно из его главных промышленных применений - получение взрывчатого вещества нитроглицерина O2NOCH2CH(ONO2)CH2ONO2 при обработке азотной кислотой. Динамит является смесью нитроглицерина с наполнителем (см. также ГЛИЦЕРИН). Ментол, относительно летучее твердое вещество, т. пл. 43° С, является главным компонентом масла перечной мяты. Он обладает приятным запахом, и в малых количествах, будучи примешан к сигаретному дыму, каплям от кашля, жевательной резинке и другим продуктам, вызывает ощущение "холода" во рту. Его структурная формула

Гераниол C10H17OH и цитронеллол C10H19OH являются главными компонентами розового масла, которому они придают приятный запах. Они используются для приготовления духов. Существуют два изомера гераниола, отличающихся только положением наиболее удаленной от ОН-группы двойной связи. Один из этих изомеров изображается формулой

Цитронеллол отличается только отсутствием ближайшей к ОН двойной связи. Стерины (стеролы) - общее название твердых кристаллических спиртов стероидного ряда (см. также СТЕРОИДЫ), которые содержат ОН-группу при С-3 и алифатическую боковую цепь при С-17 в пергидроциклопентанофенантреновом скелете. Примерами стеринов являются холестерин, ситостерин и эргостерин. Стерины найдены как в растительных, так и животных тканях, где входят в состав клеточных липидных мембран. У животных холестерин служит исходным веществом для биосинтеза стероидных гормонов.

Г. ФЕНОЛЫ
Фенолы - это ароматические спирты общей формулы R-OH, где группа R является остатком ароматического углеводорода (т.е. бензола, нафталина или родственного им циклического соединения). Фенолы - слабые кислоты. Практически важные фенолы. Фенол (карбоновая кислота), кристаллическое вещество, т. пл. 42° С. Обычно фенол используют в водном растворе, причем небольшое количество воды служит для "разжижения" большого количества фенола. Он имеет сильный характерный запах и представляет собой эффективный антисептик. Во время Первой мировой войны фенол широко использовался в виде разбавленного раствора для обеззараживания ран, но в современной практике его вытеснили более действенные и менее едкие дезинфицирующие средства.

Среди промышленных продуктов, производимых из фенола, заслуживает упоминания пикриновая кислота - желтое красящее и взрывчатое вещество, применявшееся в больших количествах в Первой мировой войне, и различные другие красители. Креозот, используемый для предохранения и защиты древесины, содержит фенол и другие соединения, которые задерживают рост бактерий и отпугивают насекомых. Метилфенолы (крезолы) являются наиболее значимыми среди других фенольных соединений; их применяют в производстве феноло-формальдегидных смол, дезинфицирующих средств, фунгицидов, гербицидов, азокрасителей и т.д.
Нафтолы.
a-Нафтол, бесцветное или желтоватое твердое вещество с неприятным запахом, применяется в производстве красителей и синтетических душистых соединений, т. кип. 278° С. b-Нафтол, имеющий ту же брутто-формулу C10H7OH, белое блестящее твердое вещество, т. кип. 285° С; его используют как дезинфектант и в производстве красителей, медикаментов и синтетических душистых соединений.

Гидрохинон (1,4-дигидроксибензол) C6H4(OH)2, водорастворимое твердое вещество, т. кип. 285° С. Его применяют как фотографический проявитель для восстановления активированных солей серебра в черное мелкодисперсное металлическое серебро.
Эвгенол и тимол.
Эвгенол, бесцветная или желтоватая маслянистая жидкость, т. кип. 254° С; тимол, белое кристаллическое вещество с "ароматическим" запахом, т. кип. 233° С, и некоторые другие родственные фенолы широко распространены в эфирных маслах, например, масле гвоздики (эвгенол) и тимьяна.

Ванилин, белое кристаллическое вещество, т. кип. 285° С; слегка растворим в воде. Он является основным душистым компонентом ванили. По этой причине его широко применяют в искусственных отдушках, причем лишь небольшой концентрации достаточно, чтобы обеспечить сильный ванильный запах. Для его синтеза имеется несколько путей.

Заметим, что ванилин содержит наравне с фенольной простую эфирную и альдегидную группы.
Д. КАРБОНОВЫЕ КИСЛОТЫ
Карбоновые кислоты имеют общую формулу R-COOH. Они являются кислотами средней силы, будучи сильнее, чем фенолы, но слабее, чем такие минеральные кислоты, как соляная, азотная или серная; как все кислоты, они имеют характерный кислый вкус. Поскольку эти кислоты высокополярны, они кипят при температурах даже более высоких, чем спирты, а простейшие кислоты (содержащие до пяти атомов углерода в цепи) растворимы в воде. Низшие кислоты - жидкие вещества, но с увеличением длины углеродной цепи повышаются и температуры плавления. Карбоновые кислоты вступают во многие важные химические реакции, а получаемые из них разнообразные продукты находят широкое применение. Многие кислоты, содержащие С=О, -OH или несколько групп -COOH, играют существенную роль в биологическом обмене веществ (см. БИОХИМИЯ). Когда кислоты реагируют с основаниями, образуются ионные соли общей формулы RCOOM, где M - ион металла. Соли жирных кислот (алифатических карбоновых кислот с длинной цепью) называются мылами. Практически важные карбоновые кислоты. Муравьиная кислота HCOOH, простейшая из карбоновых кислот. Это водорастворимая жидкость, т. кип. 100,8° С. У многих жалящих насекомых муравьиная кислота служит раздражающим компонентом яда. Уксусная кислота CH3COOH, бесцветная прозрачная жидкость, т. кип. 118° С, важный промышленный продукт, получаемый путем сбраживания сахаров (или этилового спирта) или синтетически из нефтепродуктов либо ацетилена. Уксус представляет собой разбавленный раствор уксусной кислоты, получаемой брожением, причем его кислый вкус - это вкус уксусной кислоты. Она используется в производстве ряда пластмасс, волокон, синтетических покрытий и является хорошим растворителем. Масляная кислота CH3CH2CH2COOH, т. кип. 163° С, жидкость с отвратительным запахом, обусловливающая в значительной степени неприятный запах прогорклого масла. Она находит некоторое промышленное применение как растворитель и при приготовлении бутиратов. Стеариновая кислота CH3(CH2)16COOH, воскообразное вещество, т. пл. 70° С. Она широко распространена в связанной форме как компонент жиров и используется вместе с парафином в производстве свечей для улучшения их горючих свойств, в приготовлении натриевой соли для производства мыла и кальциевой соли для детских присыпок, в производстве резины, смазок и для многих других целей. Жирные кислоты - карбоновые кислоты алифатического ряда. Алифатические кислоты с числом углеродных атомов в молекуле больше 6 называют высшими жирными кислотами (ВЖК). ВЖК могут быть природными и синтетическими. Природные ВЖК - обычные одноосновные (содержат одну карбоксильную группу в молекуле), нормального строения (неразветвленные), могут быть насыщенными или ненасыщенными. Жирные кислоты с четным числом углеродных атомов, содержащие от двух до двадцати четырех атомов углерода, можно получить из природных жиров. Компонентами этих жиров являются многочисленные ненасыщенные кислоты, наиболее обычной среди которых является олеиновая CH3-(CH2)7-CH=CH-(CH2)7-COOH, содержащая подобно стеариновой 18 атомов углерода, но имеющая одну цис-углерод-углеродную двойную связь. Как и у других ненасыщенных кислот, ее точка плавления (16° С) значительно ниже, чем у соответствующих насыщенных кислот. Адипиновая кислота HOOC(CH2)4COOH, как все кислоты с двумя и более группами -COOH, представляет собой твердое вещество. Она используется в многотоннажном производстве найлона. Молочная кислота CH3CH(OH)COOH, легко растворимое в воде вещество, плавящееся при комнатной температуре (18° С) и имеющее большое значение в биологических системах. Это она придает кислый вкус прокисшему молоку. Лимонная кислота HOOC-C(OH)(CH2COOH)2, водорастворимое твердое вещество без запаха, содержится в плодах всех цитрусовых. Водный раствор кислоты очень похож по вкусу на сок лимона, и потому лимонная кислота используется в разнообразных напитках из-за ее характерного приятного кислого привкуса. Она играет существенную роль в превращениях сахаров в организме. Винная кислота HOOCCH(OH)CH(OH)COOH, существует в трех стереоизомерных формах, называемых D-, L- и мезо-. Она присутствует в винограде и может осаждаться в виде соли в винных бочках во время брожения. Эта соль, тартрат калия-натрия, обычно известна как винный камень.
Е. АЛЬДЕГИДЫ И КЕТОНЫ
Альдегиды и кетоны имеют общие формулы R-CH=O и R-CO-R соответственно. Карбонильная группа С=О высокореакционноспособна, и поэтому альдегиды и кетоны занимают необычайно важное место в органическом синтезе многочисленных и разнообразных соединений. Некоторые члены этого класса используются в качестве ароматических добавок и душистых веществ и частично обусловливают характерные запахи некоторых растительных экстрактов и эссенций.
Практически важные альдегиды и кетоны.
Формальдегид CH2=O, газ, т. кип. -21° С, обычно используется в виде водного раствора под названием "формалин". Газообразный формальдегид полимеризуется в твердый параформ H(OCH2)nOH, из которого регенерируется при нагревании. Как и другие низкомолекулярные альдегиды, формальдегид имеет острый запах. Формалин используют для консервации биологических материалов, а формальдегид применяют в многотоннажных процессах производства синтетических волокон и пластмасс. Ацетон CH3COCH3, т. кип. 56° С, приятно пахнущая жидкость с высокой растворяющей способностью для таких материалов, как нитроцеллюлоза (используемая во взрывчатых веществах и лаках) и пластмассы. Ацетон применяется как растворитель и как разбавитель для лаков. Его также используют в синтезе более сложных органических соединений. Акролеин CH2=CH-CH=O, т. кип. 56° С; его пары обладают раздражающим действием на слизистую. Он образуется при пиролизе ("перегреве") жиров.
Бензохинон.
Желтое легко возгоняющееся твердое вещество, бензохинон является простейшим членом класса соединений, известных как "хиноны", которые содержат подобную циклическую систему. Некоторые хиноны представляют собой важные красители, другие являются пигментами растений и насекомых.

Камфора (камфара) представляет собой твердый летучий кетон с характерным приятным запахом. Из камфарного дерева получают L-форму, а D,L-форму производят в промышленных масштабах путем синтеза из других природных продуктов.
Ж. ПРОСТЫЕ ЭФИРЫ
Простые эфиры имеют общую структуру R-O-R", в которой R и R" представляют собой углеводородные группы. Низшие члены ряда являются жидкостями, полярность их молекул низка (как и в случае углеводородов и органических галогенидов).
Практически важные простые эфиры.
Диэтиловый эфир C2H5OC2H5, обычно называемый просто "эфир", - прозрачная, бесцветная жидкость с характерным запахом, кипящая при 35° С. Эфир используют как анестетик для наркоза, как растворитель для различных органических веществ и для химической чистки одежды. Этиленоксид, т. кип. 11° С, высокореакционноспособный газ, применяемый в ряде органических синтезов, в том числе при получении этиленгликоля (первичный компонент большинства антифризов) и в производстве важного класса растворителей, известных под общим названием "целлозольвов" (R-O-CH2CH2-OH).
З. СЛОЖНЫЕ ЭФИРЫ
Сложные эфиры R-COOR" рассматриваются как производные карбоновых кислот, поскольку их можно получить отщеплением молекулы воды от кислоты и спирта: R-COOH + R"-OH -> R-COOR" + H2O Летучие эфиры - жидкости с приятным фруктовым ароматом, прекрасные растворители для органических веществ. Некоторые эфиры обусловливают аромат душистых растений.
Практически важные сложные эфиры.
Этилацетат CH3COOC2H5, т. кип. 77° С, находит свое главное применение как растворитель. Он образуется в реакции между этиловым спиртом и уксусной кислотой в присутствии катализатора. Амилацетат CH3COOCH2CH2CH2CH2CH3, т. кип. 148° С, иногда называют "банановым маслом" (которое он напоминает по запаху). Он образуется в реакции между амиловым спиртом (часто - сивушным маслом) и уксусной кислотой в присутствии катализатора. Амилацетат широко применяется как растворитель для лаков, поскольку он испаряется медленнее, чем этилацетат.
Фруктовые эфиры.
Характер многих фруктовых запахов, таких, как запахи малины, вишни, винограда и рома, отчасти обусловлен летучими эфирами, например этиловым и изоамиловым эфирами муравьиной, уксусной, масляной и валериановой кислот. Имеющиеся в продаже эссенции, имитирующие эти запахи, содержат подобные эфиры. Винилацетат CH2=CHOOCCH3, образуется при взаимодействии уксусной кислоты с ацетиленом в присутствии катализатора. Это важный мономер для приготовления поливинилацетатных смол, клеев и красок. Среди других сложных эфиров большое практическое значение имеют жиры, которые являются триэфирами глицерина и жирных кислот, а также воски - эфиры высокомолекулярных спиртов и высших жирных кислот.
И. АМИНЫ
Аминами называются производные аммиака NH3, получаемые путем замещения в нем атома H на органическую группу R; в зависимости от числа замещенных атомов водорода они могут быть первичными (RNH2), вторичными (R2NH) и третичными (R3N). (Присоединение четвертой группы R дает ряд ионных солей R4N+X-, напоминающих по структуре соли аммония, которые в противоположность аминам являются нелетучими твердыми веществами без запаха или с очень слабым запахом.) Амины представляют собой самую важную группу органических оснований: они имеют большое биологическое значение и применяются для получения разнообразных производных, включая красители и медицинские препараты.
Практически важные амины.
Триметиламин (CH3)3N, подобно другим низкомолекулярным аминам, является газом с аммиачным, или "рыбным" запахом. Он образуется при разложении рыбы. Его получают взаимодействием метилового спирта или диметилового эфира с аммиаком; используют для производства бактерицидов, флотореагентов, кормовых добавок. Анилин C6H5NH2, т. кип. 184° С, бесцветная маслянистая жидкость, которая быстро становится бурой при контакте с воздухом и светом. Является исходным материалом для получения ряда анилиновых красителей, лекарственных средств (сульфамидных препаратов, ацетанилида и др.), взрывчатых веществ, анилино-формальдегидных смол, антиоксидантов, фотоматериалов и т.д. Адреналин, амфетамин (бензедрин) и эфедрин. Адреналин - гормон, выделяемый надпочечниками, который вызывает сужение капиллярных сосудов и тем способствует повышению давления крови. Секреция этого гормона увеличивается в моменты стресса, помогая организму адекватно реагировать на опасность. Амфетамин (бензедрин, синтетический препарат) и эфедрин имеют сходное действие.

Аминокислоты содержат как амино-, так и кислотную карбоксильную группу. Аминокислоты играют большую роль в химии живых систем. Из них особенно важны a-аминокислоты общей структуры R-CH(NH2)-COOH, которые являются строительными блоками белков.
К. ДРУГИЕ ФУНКЦИОНАЛЬНЫЕ ГРУППЫ
Азотсодержащие группы.
Кроме аминов, азот содержат различные другие функциональные группы. Амиды имеют общую структуру RC(O)NR"R ", где R" и R " - органическая группа или H; почти все они являются твердыми веществами. Нитросоединения R-NO2 представляют собой важные промежуточные соединения в органическом синтезе и взрывчатые вещества - тринитротолуол, тринитрофенол (пикриновая кислота), нитроглицерин. В нитрилах азот связан с углеродом тройной связью R-CєN; азосоединения содержат группу -N=N-, которая придает окраску многим синтетическим красителям.
Соединения серы.
Наиболее важными типами сернистых соединений являются меркаптаны (тиолы) R-SH и сульфокислоты R-SO3H, представляющие собой сильные кислоты. Низшие меркаптаны - газы или жидкости с неприятным запахом. Метилмеркаптан CH3SH - газ, используемый для придания легко распознаваемого неприятного запаха топливному газу, который сам по себе почти лишен запаха, с целью обнаружения утечек газа. Бутилмеркаптан CH3CH2CH2CH2SH - жидкость, обнаруженная в пахучих железах скунса. Соли сульфокислот с длинной углеводородной цепью используют как моющие средства; сульфаниламидные лекарственные препараты и сахарин - также производные сульфокислот.

Другая классификация.
Чтобы подчеркнуть общий источник, функции или сложные структурные особенности, органические соединения часто классифицируют по другим признакам, чем их функциональные группы.
См. также
- Рецепты варенья из кабачков с лимоном, с курагой и в ананасовом соке
- Как приготовить вкусные куриные сердечки с картофелем в мультиварке Куриные сердечки рецепт в мультиварке с картофелем
- Сырный суп с курицей и грибами Куриный суп с сыром и грибами
- Четверка монет таро значение
- Что такое договор найма служебного жилого помещения?
- Хлеб по технологии в духовке на дрожжах
- Требования к главному бухгалтеру Нормативное регулирование бухгалтерского учета

 Live Journal
Live Journal Facebook
Facebook Twitter
Twitter