Как определить степень окисления. Что такое степень окисления, как определять и расставлять. Правило расстановки в основных оксидах

Учимся определять валентность и степень окисления. Практика показывает, что многие обучающиеся испытывают затруднения при определении валентности и степени окисления. Пособие направлено на овладение основополагающими химическими понятиями валентность и степень окисления, формирование умения давать количественные оценки и проводить расчеты валентности и степени окисления по химическим формулам в неорганических и органических соединениях, а также способствует подготовке студентов для сдачи ЕГЭ. Что подразумевается под термином «устойчивость к окислению» и почему это важно? Стабильность окисления представляет собой химическую реакцию, которая возникает при сочетании смазочного масла и кислорода. Скорость окисления ускоряется высокими температурами, водой, кислотами и катализаторами, такими как медь. Скорость окисления возрастает со временем. Срок службы смазки также снижается при повышении температуры. Окисление приведет к увеличению вязкости нефти и отложений лака и шлама. Скорость окисления зависит от качества и типа базового масла, а также от используемой добавки. Некоторые синтетические материалы, такие как полиальфаолефины, обладают по своей природе лучшей окислительной стабильностью, чем минеральные масла. Эта концепция основана на правиле нормы Аррениуса, которое названо в честь шведского химика 19-го века Сванте Аррениуса. Существует небольшое противоречие относительно стабильности окисления природных минеральных базовых масел, как это определено методом очистки. Пособие направлено на формирование навыков самостоятельной работы с учебным материалом, осуществления поиска и использования информации, формирование и развитие творческого потенциала, повышение интереса к дисциплине. Валентность и степень окисления. Правила определения степеней окисления элементов I . Валентность Существует одна школа мысли, которая предполагает, что гидроочищенные базовые запасы обладают превосходной стойкостью к окислению и термической стабильностью, чем базовое масло, очищенное растворителем. Это основано на неправильном понимании того, что, поскольку гидроочистка удаляет все потенциально нежелательные соединения, базовое масло имеет тенденцию автоматически уменьшать тенденции формирования депозитов и тем самым лучше сопротивляться окислению. Однако удаление всех соединений, считающихся нежелательными, может нанести ущерб. Валентность – это способность атомов присоединять к себе определенное число других атомов. Правила определения валентности 2) Атом металла стоит в формуле на первое место. 2) В формулах соединений атом неметалла, проявляющий низшую валентность, всегда стоит на втором месте, а название такого соединения оканчивается на «ид». Рафинирование растворителя приводит к получению базовых масел, которые сохраняют некоторые соединения серы, которые являются естественными антиоксидантами. Эти базовые масла сохраняют естественную способность предотвращать окисление, в то время как гидроочищенные базовые масла должны быть дополнительно обогащены антиоксидантами, чтобы поддерживать термическую и окислительную стабильность. Когда антиоксиданты ослаблены или истощены, окисление некоторых гидроочищенных масел может происходить очень быстро. Сердечно гидроочищенные базовые масла также имеют слабые характеристики растворимости. Без правильной рецептуры добавки не могут оставаться приостановленными, и может произойти отложение некоторых добавок. Для определения или оценки стабильности окисления масла можно использовать несколько методов, которые обычно рассматриваются как количество часов до тех пор, пока не будет отмечено заданное увеличение вязкости или пока не будет задано увеличение кислотного числа. Например, СаО – оксид кальция, NaCl – хлорид натрия, PbS – сульфид свинца. Теперь вы сами можете написать формулы любых соединений металлов с неметаллами. 3) Атом металла ставится в формуле на первое место. II . Степень окисления Степень окисления – это условный заряд, который получает атом в результате полной отдачи (принятия) электронов, исходя из условия, что все связи в соединении ионные. Стенограмма Как определить числа окисления?Определение количества окисления. Возможно, с вами случилось, что вы оставили инструмент железа на открытом воздухе. Через некоторое время это железо начало ржаветь, и вы не могли использовать инструмент, когда он был слишком длинным снаружи. Но почему это и какая химическая реакция происходит там? Этот процесс, который имеет место, является окислительно-восстановительной реакцией. Это означает, что электроны поглощаются и высвобождаются. Чтобы иметь возможность создать окислительно-восстановительную реакцию, вы теперь узнаете, что такое числа окисления и как их определить. Рассмотрим строение атомов фтора и натрия: - Что можно сказать о завершённости внешнего уровня атомов фтора и натрия? - Какому атому легче принять, а какому легче отдать валентные электроны с целью завершения внешнего уровня? Оба атома имеют незавершённый внешний уровень? Атому натрия легче отдавать электроны, фтору – принять электроны до завершения внешнего уровня. Важное правило — правило расстановки, алгоритмыНомера окисления необходимы для определения того, сколько электронов поглощается и выделяется во время окислительно-восстановительной реакции. Если число окисления уменьшается, это потребление электрона, то есть уменьшение. Если число окисления становится больше, вам приходится иметь дело с электронной эмиссией, то есть с окислением. Электроотрицательность элемента указывает, насколько сильно этот элемент стремится привлечь связывающие электроны. Если вы посмотрите на значения электроотрицательности в периодической системе элементов, вы заметите, что значения увеличиваются слева направо в пределах периодов и уменьшаются сверху вниз внутри группы. F0 + 1ē → F-1 (нейтральный атом принимает один отрицательный электрон и приобретает степень окисления «-1», превращаясь в отрицательно заряженный ион - анион ) Na0 – 1ē → Na+1 (нейтральный атом отдаёт один отрицательный электрон и приобретает степень окисления «+1», превращаясь в положительно заряженный ион - катион ) Таким образом, вы можете оценить, является ли один элемент более электроотрицательным, чем другой. Число окисления теперь представляет собой формальный заряд, который имеет атом в соединении, которое создается из ионов. Связывающие электроны формально назначаются более электроотрицательному элементу. Числа окисления часто записываются как римские цифры и со знаком над соответствующим атомом в формуле. Важно, чтобы количество окисления всегда давалось только для одного атома одного и того же типа, даже если у вас несколько молекул в молекуле. То есть над водородом вы пишете «плюс один» и выше кислорода «минус два».
Как определить степень окисления атома в ПСХЭ? Правила определения степени окисления атома в ПСХЭ: 1. Водород обычно проявляет степень окисления (СО) +1 (исключение, соединения с металлами (гидриды) – у водорода СО равна (-1) Me+nHn-1) Затем мы рассмотрим молекулу кислорода. Здесь вы видите, что оба атома имеют одинаковую электроотрицательность. Таким образом, вы не можете назначать связующие электроны для любого партнера, поскольку оба они одинаково разрешены. Теперь мы рассмотрим некоторые примеры того, как определять числа окисления, когда вы даете структурную формулу молекулы и какие правила вы должны соблюдать. Правила определения степеней окисления элементовПервый пример - вода. Здесь кислород соединен посредством одинарных связей с водородом. Теперь вы знаете, что кислород является более электроотрицательным элементом, и вы формально связываете связанные электроны с кислородом. Таким образом, кислород дополнительно получает два электрона и, следовательно, вдвойне отрицательно заряжен. Так как электроны водорода формально отнесены к кислороду, электрон отбирается из каждого водорода. 2. Кислород обычно проявляет СО -2 (исключения: О+2F2, H2O2-1 – перекись водорода) 3. Металлы проявляют только + n положительную СО 4. Фтор проявляет всегда СО равную -1 (F-1) 5. Для элементов главных подгрупп : Высшая СО (+) = номеру группыN группы Важно, чтобы количество окисления всегда давалось для одного атома одного и того же типа, даже если у вас несколько молекул в молекуле. Поэтому это соединение получает номер окисления. Как правило, вы можете помнить, что чистые элементы всегда получают номер окисления 0. Теперь мы определяем количество окисления углекислого газа. Вы можете сделать это, как в предыдущих примерах. Таким образом, вы упорядочиваете электроны связи с более электроотрицательным партнером, в этом случае кислородом. Наконец, давайте посмотрим на молекулу аммиака и определим числа окисления. Здесь вы можете видеть, что азот образует три связи с одним атомом водорода каждый. Поскольку азот является более электроотрицательным, чем водород, ему назначаются электроны связывания. Низшая СО (-) = N группы –8 Правила определения степени окисления атома в соединении: I. Степень окисления свободных атомов и атомов в молекулах простых веществ равнанулю - Na0, P40, O20 II. В сложном веществе алгебраическая сумма СО всех атомов с учётом их индексов равна нулю = 0 , а в сложном ионе его заряду. Таким образом, можно определить числа окисления в соединениях. Если у вас есть ионы, такие как катион натрия или анион хлорида, то число окисления является ионным зарядом. Таким образом, ион натрия получает число окисления «плюс один», а хлоридный ион - число окисления «минус один». Как мы представляем соединения?Их можно комбинировать по-разному с образованием различных соединений. Простейшими комбинациями являются те, в которых участвуют только два разных элемента: бинарные соединения. Среди них, например, можно назвать воду, поваренную соль или бензол. Каждое соединение характеризуется тем соотношением, которое существует между атомами его составляющих элементов, которое представлено его химической формулой. Например, H +1 N +5 O 3 -2 : (+1)*1+(+5)*1+(-2)*3 = 0 [ S +6 O 4 -2 ]2- : (+6)*1+(-2)*4 = -2 Задание 1 – определите степени окисления всех атомов в формуле серной кислоты H2SO4? 1. Проставим известные степени окисления у водорода и кислорода, а СО серы примем за «х» Эмпирические формулы предлагают простейшее соотношение, в котором атомы находятся в соединении. Молекулярные формулы указывают количество атомов, которые являются частью каждой молекулы. Структурные формулы информируют о распределении атомов и связях, которые установлены между ними. Давайте проанализируем различия между ними. Основные термины в ОВРПоскольку вода состоит из дискретных молекул, каждая из которых содержит два атома водорода и один атом кислорода, его молекулярная формула совпадает с предыдущей. Ковалентные связи между водородом и кислородом очевидны в его структурной формуле. Это не молекулярное соединение, т.е. нельзя сказать, что на самом деле существуют отдельные молекулы натрия и хлора, но эти атомы укладываются упорядоченным образом, образуя гораздо большую структуру, известную как кристаллическая решетка. Атомы углерода соединены вместе, образуя кольцо гексагонально, и каждый из них связан с водородом, который появляется в его структурной формуле. Структурная формула дает гораздо больше информации, которая особенно полезна в органических молекулах или сложной структуре. (+1)*1+(х)*1+(-2)*4=0 Х=6 или (+6), следовательно, у серы CО +6, т. е. S+6 Задание 2 – определите степени окисления всех атомов в формуле фосфорной кислоты H3PO4? 1. Проставим известные степени окисления у водорода и кислорода, а СО фосфора примем за «х» 2. Составим и решим уравнение, согласно правилу (II): (+1)*3+(х)*1+(-2)*4=0 Х=5 или (+5), следовательно, у фосфора CО +5, т. е. P+5 Как мы получаем формулу соединения?Но это не относится к нам сейчас, поэтому достаточно знать молекулярную формулу соединения, чтобы иметь возможность ее назвать или идентифицировать. В формуле соединения представлены элементы, которые образуют его по их соответствию, и количество атомов каждого из них с помощью индекса. Чтобы сформулировать бинарное соединение, мы должны в корне учитывать две вещи.
Задание 3 – определите степени окисления всех атомов в формуле иона аммония (NH4)+? 1. Проставим известную степень окисления у водорода, а СО азота примем за «х» 2. Составим и решим уравнение, согласно правилу (II): (х)*1+(+1)*4=+1 Х=-3, следовательно, у азота CО -3, т. е. N-3 Хотя грубая электроотрицательность изменяется таким образом, это не точное совпадение. Только водород имеет уникальное положение. Это означает, что кислород, который ранее пользовался особым статусом, теперь получает то же самое внимание, что и другие элементы, и появляется в последовательности, соответствующей ей по своей ситуации в периодической таблице. Что касается второго вопроса, чтобы присвоить соответствующие индексы каждому элементу, мы должны учесть, что сумма чисел окисления в нейтральном веществе всегда равна нулю. В бинарном соединении число окисления наиболее электроотрицательного элемента должно быть компенсировано числом окисления самого электроположительного элемента. Если оба они равны, но имеют противоположный знак, нет проблем, и в формуле будет появляться только один атом каждого элемента. Однако, когда числа окисления не совпадают, мы должны компенсировать это, варьируя количество атомов до тех пор, пока значение обоих атомов не станет равным. Алгоритм составления формулы по степени окисления Составление названий бинарных соединений Сравним понятия «валентность» и «степень окисления»:
|
Запомни!
Как называется соединение из его формулы?
Общая стратегия состоит в том, чтобы добавить столько атомов одного элемента, сколько указывает номер окисления другого.
- Бинарная комбинация кальция и серы.
- Бинарная комбинация алюминия и кислорода.
В молекулах простых веществ: O2, S8 равна двум
Названия композиции указывают только на количество атомов каждого элемента в соединении. Названия замещений основаны на имени исходного соединения, в котором некоторые атомы были заменены другими. Вдохновленные органической номенклатурой, они дают много информации о структуре молекулы. Имена сложения формируются из названия центрального атома, к которому добавляются атомы, к которым он связан.
- Они дают мало информации о том, как атомы распределены в молекуле.
- Это дает много информации о структуре молекулы.
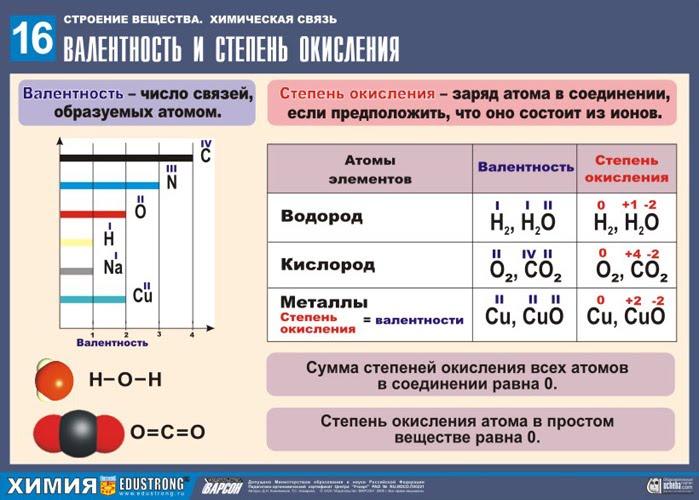
Валентность - - это способность атома образовывать определенное количество связей с другими атомами.
Правила определения валентности
1. В молекулах простых веществ: H2, F2, Cl2, Br2, I2 равна единице.
2. В молекулах простых веществ: O2, S8 равна двум.
3. В молекулах простых веществ: N2, P4 и CO - оксиде углерода (II) - равна трем.
4. В молекулах простых веществ, которые образует углерод (алмаз, графит), а также в органических соединениях, которые он образует, валентность углерода равна четырем.
5. В составе сложных веществ водород одновалентен, кислород, в основном, двухвалентен. Для определения валентности атомов других элементов в составе сложных веществ надо знать строение этих веществ.
Степень окисления – это условный заряд атомов химического элемента в соединении, вычисленный на основе предположения, что все соединения (с ионной и ковалентной полярной связью) состоят только из ионов.
Высшая степень окисления элемента равна номеру группы.
Исключения:
фтор высшая степень окисления ноль в простом веществе F20
кислород высшая степень окисления +2 во фториде кислорода О+2F2
Низшая степень окисления элемента равна восемь минус номер группы (по числу электронов, которые атом элемента может принять до завершенного восьми электронного уровня)
Правила определения степени окисления (далее обозначим: ст. ок.)
Общее правило: Сумма всех степеней окисления элементов в молекуле с учетом количества атомов равна нулю (Молекула электронейтральна.), в ионе - равна заряду иона.
I. Степень окисления простых веществ равна нулю: Са 0 , O2 0 , Cl2 0
II. ст. ок. в бинарных c оединениях:
Менее электроотрицательный элемент ставится на первое место. (Исключения: С-4Н4+ метан и N-3H3+аммиак)
Нужно помнить, что
Ст. ок. металла всегда положительна
Ст. ок. металлов I, II, III групп главных подгрупп постоянна и равна номеру группы
Для остальных ст. ок. вычисляется по общему правилу.
Более электроотрицательный элемент ставится на второе место, его ст. ок. равна восемь минус номер группы (по числу электронов, которые он принимает до завершенного восьми электронного уровня).
Исключения: пероксиды, например, Н2+1О2-1, Ba+2O2-1 и др. ; карбиды металлов I и II групп Ag2+1C2-1,Ca+2C2-1 и др. (В школьном курсе встречается соединение FeS2 - пирит. Это дисульфид железа. Степень окисления серы в нем (-1) Fe+2S2-1). Это происходит потому, что в этих соединениях есть связи между одинаковыми атомами -О-О-, - S-S-, тройная связь в карбидах между атомами углерода. Степень окисления и валентность элементов в этих соединениях не совпадают: у углерода валентность IV, у кислорода и серы II.
III. Степень окисления в основаниях Ме + n (ОН) n равна количеству гидроксогрупп.
1. в гидроксогруппе ст. ок. кислорода -2, водорода +1, заряд гидроксогруппы 1-
2. ст. ок. металла равна количеству гидроксогрупп
IV. Степень окисления в кислотах:
1. ст. ок. водорода +1, кислорода -2
2. ст. ок. центрального атома вычисляется по общему правилу путем решения простого уравнения
Например, Н3+1РхО4-2
3∙(+1) + х + 4∙(-2) = 0
3 + х – 8 = 0
х = +5 (не забудьте знак +)
Можно запомнить, что у кислот с высшей степени окисления центрального элемента, соответствующего номеру группы, название будет заканчиваться на –ная:
Н2СО3 угольная Н2С+4О3
Н2SiО3 кремниевая (искл.) Н2Si+4О3
НNО3 азотная НN+5О3
Н3PО4 фосфорная Н3P+5О4
Н2SО4 серная Н2S+6О4
НСlО4 хлорная НCl+7О4
НMnО4 марганцовая НMn+7О4
Останется запомнить:
НNО2 азотистая НN+3О2
Н2SО3 сернистая Н2S+4О3
НСlО3 хлорноватая НCl+5О3
НСlО2 хлористая НCl+3О2
НСlОхлорноватистая НCl+1О
V. Степень окисления в солях
у центрального атома такая же, как в кислотном остатке. Достаточно помнить или определить ст. ок. элемента в кислоте.
VI. Степень окисления элемента в сложном ионе равна заряду иона.
Например, NH4+Cl- : записываем ион NхН4+1
х + 4∙(+1) = +1
ст. ок. азота -3
Например, определить ст. ок. элементов в гексацианоферрате(III) калия К3
У калия +1: К3+1, отсюда заряд иона 3-
У железа +3 (указано в названии) 3-, отсюда (CN)66-
У одной группы (CN)-
Более электроотрицательный азот: у него -3, отсюда (CхN-3)-
ст. ок. углерода +2
VII. Степень окисления углерода в органических соединениях разнообразна и вычисляется, исходя из учета того, что ст. ок. водорода равна +1, кислорода -2
Например, С3Н6
3∙х + 6∙1 = 0
ст. ок. углерода -2 (при этом валентность углерода равна IV)
Задание. Определить степень окисления и валентность фосфора в фосфорноватистой кислоте H3PO2.
Вычислим степень окисления фосфора.
Обозначим её за х. Подставим степень окисления водорода +1, а кислорода -2, умножив на соответствующее количество атомов: (+1) ∙ 3 + х + (-2) ∙ 2 = 0, отсюда х = +1.
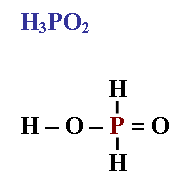
Определим валентность фосфора в этой кислоте.
Известно, что это - одноосновная кислота, поэтому только один атом водорода связан с атомом кислорода. Учитывая, что водород в соединениях одновалентен, а кислород - двухвалентен, получаем структурную формулу, из которой видно, что фосфор в этом соединении имеет валентность пять.
Графический метод определения степени окисления
в органических веществах
В органических веществах можно определять степени окисления элементов алгебраическим методом , при этом получается усредненное значение степени окисления . Этот метод наиболее применим в том случае, если все атомы углерода органического вещества по окончании реакции приобрели одинаковую степень окисления (реакции горения или полного окисления).
Рассмотрим такой случай:
Пример 1 . Обугливание дезоксирибозы серной концентрированной кислотой с дальнейшим окислением:
С5Н10О4 + H2SO4 ® CO2 + H2O + SO2
Найдём степень окисления углерода х в дезоксирибозе: 5х + 10 – 8 = 0; х = - 2/5
В электронном балансе учитываем все 5 атомов углерода:
Степени окисления в органических соединениях требуется уметь расставлять для решения заданий ЕГЭ по химии, в которых дается цепочка превращений органических веществ, часть из которых неизвестна. На данный момент это задания номер 32.
Для определения степени окисления в органических соединениях существует два метода. Суть их одинакова, но выглядят применение данных методов по-разному.
Первый способ я бы назвал методом блоков.
Метод блоков
Берем органическую молекулу, например, такого вещества, как 2-гидроксипропаналь
и изолируем друг от друга все фрагменты молекулы, содержащие по одному атому углерода следующим образом:
Суммарный заряд каждого такого блока принимаем равным нулю, как у отдельной молекулы. В органических соединениях водород всегда имеет степень окисления, равную +1, а кислород — -2. Обозначим степень окисления атома углерода в первом блоке переменной х. Таким образом, мы можем найти степень окисления первого атома углерода, решив уравнение:
x + 3∙(+1) = 0, где x – степень окисления атома углерода, +1 – степень окисления атома водорода, а 0 – заряд выбранного блока.
x + 3 = 0, отсюда x = -3.
Таким образом, степень окисления атома углерода в первом блоке равна -3.
Во второй блок, помимо одного атома углерода и двух атомов водорода, входит также и атом кислорода, который, как мы уже сказали, имеет в органических соединениях практически всегда степень окисления, равную -2. Как и в первом случае, обозначим степень окисления атома углерода второго блока через х, тогда получим следующее уравнение:
x+2∙(+1)+(-2) = 0, решая которое находим, что х = 0. Т.е. степень окисления второго атома углерода в молекуле равна нулю.
Третий блок состоит из одного атома углерода, одного атома водорода и двух атомов кислорода. Аналогично составим уравнение:
x +1∙(-2)+ 1 = 0, отсюда х, то есть степень окисления атома углерода в третьем блоке равна +1.
Второй метод расстановки степеней окисления в органических веществах я называю «метод стрелок».
Метод стрелок
Для того, чтобы его использовать, нужно нарисовать сначала развернутую структурную формулу органического вещества:
Под черточками между символами элементов понимают их общие электронные пары, которые между одинаковыми атомами можно считать распределенными поровну, а между разными – смещенными к одному из атомов, обладающему большей электроотрицательностью. Среди трех элементов С, Н и О наибольшую элетроотрицательность имеет кислород, затем углерод, а самое малое значение электроотрицательности у водорода. Поэтому, если показать стрелочкой смешение электронов в сторону более электроотрицательных атомов, мы получим следующую картинку:
Как можно заметить, между атомами углерода мы не стали рисовать стрелку, оставив обычную черточку, поскольку считается, что общая электронная пара между двумя атомами углерода практически не смещена ни к одному из них.
Будет интерпретировать последний рисунок следующим образом: каждый атом, из которого стрелка исходит, «теряет» один электрон, а каждый атом, в который стрелка входит, «принимает» электрон. При этом помним, что заряд электрона отрицателен и равен -1.
Таким образом, первому атому углерода достается от трех атомов водорода по одному электрону (три входящих стрелки), в результате чего он приобретает условный заряд, т.е. степень окисления, равную -3, а каждый атома водорода — +1 (по одной исходящей стрелке).
Второму атому углерода достается от «верхнего» атома водорода один электрон (стрелка от H к С), и еще один электрон атом углерода «теряет», передавая его атому кислорода (стрелка от С к О). Таким образом, в атом углерода «входит» один электрон и один из него «выходит». Поэтому степень окисления второго атома углерода равна 0, как в отдельном атоме.
К атому кислорода направлены две стрелки, значит, он имеет степень окисления, равную -2, а от всех атомов водорода исходит по одной стрелке. То есть степень окисления всех атомов водорода равна +1.
В последний атом углерода входит одна стрелка от Н и исходит две стрелки к О, таким образом, «входит» один электрон и «выходят» два. Значит, степень окисления равна +1.
Нужно отметить, что на самом деле оба описанных метода весьма условны, как, собственно, и условно само понятие «степень окисления» в случае органических веществ. Тем не менее, в рамках школьной программы данные методы вполне справедливы и, главное, позволяют использовать их при расстановке коэффициентов в реакциях ОВР с органическими веществами. Лично мне нравится больше метод «стрелок». Советую усвоить оба метода: одним из них вы можете определять степени окисления, а вторым — убедиться в правильности полученных значений.
- Лунин, михаил сергеевич Лунин Николай Иванович: витамины
- Скончался академик борис сергеевич соколов Соколов, Борис Сергеевич Информацию О
- Рецепты варенья из кабачков с лимоном, с курагой и в ананасовом соке
- Как приготовить вкусные куриные сердечки с картофелем в мультиварке Куриные сердечки рецепт в мультиварке с картофелем
- Сырный суп с курицей и грибами Куриный суп с сыром и грибами
- Четверка монет таро значение
- Что такое договор найма служебного жилого помещения?

 Live Journal
Live Journal Facebook
Facebook Twitter
Twitter