Как определить связь между элементами. Типы межатомных связей

Как известно, атомы могут соединяться друг с другом с образованием как простых, так и сложных веществ. При этом образуются различного типа химические связи: ионная, ковалентная (неполярная и полярная), металлическая и водородная. Одно из наиболее существенных свойств атомов элементов, определяющих, какая связь образуется между ними – ионная или ковалентная, – это электроотрицательность, т.е. способность атомов в соединении притягивать к себе электроны.
Например, для бензола две канонические структуры Кекуле, которые могут быть написаны. Что касается этого примера, общая энергия резонанса ароматического соединения обычно определяется как разность между фактической энергией молекулы и энергией одной из эквивалентных структур канонов, которая может быть сформулирована с помощью классической химии органической химии.
Поэтому резонансная энергия равна -3 × 2 = 2β и, как мы ее видим, зависит только от параметра β. Аналогичные результаты для ряда ароматических молекул собраны на вкладке. Как мы видим, соглашение вполне удовлетворительное и частично оправдывает в прошлом сделанные приближения.
Условную количественную оценку электроотрицательности дает шкала относительных электроотрицательностей.
В периодах наблюдается общая тенденция роста электроотрицательности элементов, а в группах – их падения. Элементы по электроотрицательностям располагают в ряд, на основании которого можно сравнить электроотрицательности элементов, находящихся в разных периодах.
Из-за его полуэмпирического характера можно ожидать, что теория Хюккеля также должна быть использована для изучения ароматических молекул, содержащих гетероатомы. По этой причине достаточно указать соответствующие значения параметрам α и β для характеристики элементов приближенной матрицы Фока относительно атомных орбиталей π гетероатома. Это обобщение широко применяется многими исследователями; однако результаты не следует считать столь же хорошими, как и те, которые теория обеспечивает для нормальных ароматических молекул.
Теория Хюккеля поддается всесторонней эксплуатации для получения многочисленных других сведений о молекулярных свойствах. Из-за нехватки места мы не можем много останавливаться на этих аспектах теории; однако некоторые из них нельзя упомянуть. Вспоминая, что орбитальная энергия орбиты π задается.
Тип химической связи зависит от того, насколько велика разность значений электроотрицательностей соединяющихся атомов элементов. Чем больше отличаются по электроотрицательности атомы элементов, образующих связь, тем химическая связь полярнее. Провести резкую границу между типами химических связей нельзя. В большинстве соединений тип химической связи оказывается промежуточным; например, сильнополярная ковалентная химическая связь близка к ионной связи. В зависимости от того, к какому из предельных случаев ближе по своему характеру химическая связь, ее относят либо к ионной, либо к ковалентной полярной связи.
Следовательно, порядок связывания может быть использован для предсказания расстояний и силовых констант связи. Аналогичная зависимость относится к предсказанию постоянной силы, связанной с углерод-углеродной связью, имеющей промежуточные характеристики между простыми связями и двойными связями.
Как вы можете видеть, соглашение вполне удовлетворительное, учитывая тезис, лежащий в основе теории. Например, для молекулы пиридина был рассчитан следующий пробой заряда π. Поэтому можно ожидать, что электрофильное присоединение для реакции замещения атома водорода предпочтительно имеет место в положении 3; Опыт подтверждает это и другие многочисленные прогнозы, основанные на этом методе. Чтобы понять значение этой величины, рассмотрим молекулу бутадиена, для которой следующий разброс отношений двойной связи.
Ионная связь
Ионная связь образуется при взаимодействии атомов, которые резко отличаются друг от друга по электроотрицательности. Например, типичные металлы литий (Li), натрий (Na), калий (K), кальций (Ca), стронций(Sr), барий(Ba) образуют ионную связь с типичными неметаллами, в основном с галогенами.
Кроме галогенидов щелочных металлов, ионная связь также образуется в таких соединениях, как щелочи и соли. Например, в гидроксиде натрия (NaOH) и сульфате натрия(Na 2 SO 4) ионные связи существуют только между атомами натрия и кислорода (остальные связи – ковалентные полярные).
Пренебречь суммой, поскольку она содержит трикальные целые числа; оставшийся член считается пропорциональным перекрытию с постоянной пропорциональностью, зависящей только от пары атомов А и В, так что. Используя все эти приближения, матричные элементы Фока принимают следующий вид.
Полная энергия, наконец, вычисляется по выражению. С помощью этого метода были получены приближенные волновые функции для значительного числа молекул малого и среднего размера с результатами, которые, учитывая шероховатость введенных приближений, можно считать достаточно удовлетворительными. Этот метод был незаметен для первого подхода к проблеме прогнозирования самой стабильной молекулярной геометрии.
Ковалентная неполярная связь
При взаимодействии атомов с одинаковой электроотрицательностью образуются молекулы с ковалентной неполярной связью. Такая связь существует в молекулах следующих простых веществ: H 2 , F 2 , Cl 2 , O 2 , N 2 . Химические связи в этих газах образованы посредством общих электронных пар, т.е. при перекрывании соответствующих электронных облаков, обусловленном электронно-ядерным взаимодействием, которые осуществляет при сближении атомов.
Открытые вопросы и выводы. То, что здесь кратко показано, показывает, что теория химической связи в принципе достигла целей, упомянутых на первых страницах, хотя ее применение оказалось эффективным только для малых молекул до сих пор. Мы видели, что этот дефект связан с неадекватностью монодетерминантных волновых функций, которые не позволяют учитывать электронную корреляционную энергию, этот дефект не очень серьезен, когда мы хотим сравнить энергетические величины в рядах подобных молекул, но например, когда необходимо знать такие свойства, как энергии диссоциации связей или энергии активации в задачах химической реактивности.
Составляя электронные формулы веществ, следует помнить, что каждая общая электронная пара – это условное изображение повышенной электронной плотности, возникающей в результате перекрывания соответствующих электронных облаков.
Ковалентная полярная связь
При взаимодействии атомов, значение электроотрецательностей которых отличаются, но не резко, происходит смещение общей электронной пары к более электроотрицательному атому. Это наиболее распространенный тип химической связи, которой встречается как в неорганических, так и органических соединениях.
Поэтому главу, которая все еще полностью открыта, состоит в том, чтобы найти подходящую методологию для изучения энергии корреляции. В последние несколько лет было сделано много попыток в этом направлении, но результаты, полученные до сих пор, не очень обнадеживают ввиду их применения к молекулярным проблемам некоторой сложности. Однако в последнее время Мальчики и Хэнди предложили очень интересную математическую технику и что открывает новые перспективы для решения проблемы.
Легко видеть, что энергия, обеспечиваемая этим уравнением, выражается формулой. Чтобы свести к минимуму эту форму энергии, необходимо использовать специальную вычислительную технику, которая была названа «бивариантной» авторами. Можно показать, что оптимизация моноэлектронных факторов. Еще одно преимущество метода, о чем свидетельствуют авторы, состоит в том, что интегральные компоненты, необходимые для расчета, не имеют размера больше 6. Другой основной проблемой, которая тесно связана с наличием точных волновых функций, является предсказание механизмов и кинетики химических реакций.
К ковалентным связям в полной мере относятся и те связи, которые образованы по донорно-акцепторному механизму, например в ионах гидроксония и амония.
Металлическая связь
Связь, которая образуется в результате взаимодействия относительно свободных электронов с ионами металлов, называются металлической связью. Этот тип связи характерен для простых веществ – металлов.
В этом случае тоже в значительной степени открытая глава, хотя теоретические основы для интерпретации сложных явлений динамики химических реакций давно известны. Доказано, что постоянная скорости х задается соотношением. В то же время энергия активация рассчитывается как разность между энергией активированного комплекса и энергией бесконечных дистанционных реагентов одна от другой. Хюккель, Э. Квантовые теоретические вклады в проблему ароматических и ненасыщенных соединений.
Собака, Ф. для интерпретации молекулярных спектров. Химическая связь, которая образуется между объединением атомов от взаимного разделения одного или пара электронов, называется ковалентной связью. Соединение, образованное этой связью, называется ковалентным соединением.
Сущность процесса образования металлической связи состоит в следующем: атомы металлов легко отдают валентные электроны и превращаются в положительные заряженные ионы. Относительно свободные электроны, оторвавшиеся от атома, перемещаются между положительными ионами металлов. Между ними возникает металлическая связь, т. е. Электроны как бы цементируют положительные ионы кристаллической решетки металлов.
Объяснение примеров ковалентной связи
Неметаллические атомы обычно имеют 5, 6 или 7 электронов в их внешней оболочке. Атомы этих элементов не в пользу потери их электронов из-за соображений высокой энергии, и, следовательно, передача электронов невозможна. Поэтому атомы могут завершить свой октет, взаимно разделяя одну или несколько пар электронов. Каждый атом вносит равное количество электронов. Таким образом, всякий раз, когда неметалл, объединенный с другим неметаллическим, происходит разделение электронов между атомами и ковалентная связь.
Водородная связь
Связь, которая образуется между атомов водорода одной молекулы и атомом сильно электроотрицательного элемента (O, N, F) другой молекулы, называется водородной связью.
Может возникнуть вопрос: почему именно водород образует такую специфическую химическую связь?
Это объясняется тем, что атомный радиус водорода очень мал. Кроме того, при смещении или полной отдаче своего единственного электрона водород приобретает сравнительно высокий положительный заряд, за счет которого водород одной молекулы взаимодействует с атомами электроотрицательных элементов, имеющих частичный отрицательный заряд, выходящий в состав других молекул (HF, H 2 O, NH 3).
Вышеприведенное объяснение применимо ко всем примерам. Например, водород неметаллический, а хлор также неметаллический. Когда водород объединяется с хлором с образованием хлористого водорода, происходит разделение электронов между атомами водорода и хлора и образуется ковалентная связь. Другой пример Например, два атома хлора объединяются вместе с электронным обменом для образования молекулы хлора, и между двумя атомами хлора образуется ковалентная связь. Прежде чем перейти к примерам, нужно знать статус соединения.
Состояние формирования облигации
Поскольку атомы должны иметь высокое сродство к электрону. Поскольку атомы должны обладать высокой ионизирующей энергией. Поскольку атомы должны обладать высокой электроотрицательностью. Неметалл в сочетании с другим неметаллическим. Это необходимые условия для установления отношений.
Рассмотрим некоторые примеры. Обычно мы изображаем состав воды химической формулой H 2 O. Однако это не совсем точно. Правильнее было бы состав воды обозначать формулой (H 2 O)n, где n = 2,3,4 и т. д. Это объясняется тем, что отдельные молекулы воды связаны между собой посредством водородных связей.
Водородную связь принято обозначать точками. Она гораздо более слабая, чем ионная или ковалентная связь, но более сильная, чем обычное межмолекулярное взаимодействие.
Важные примеры ковалентной связи
Атом водорода имеет электрон только оболочку. Ей нужен еще один электрон для достижения дуплетов. Чтобы удовлетворить эту потребность, атом водорода разделяет электроны с другим атомом водорода. Таким образом, каждый электрон вносил вклад в два атома водорода, и полученная пара электронов взаимно разделялась двумя атомами с образованием молекулы водорода.
Образование молекулы водорода. В этом случае два атома хлора, равный 7 валентным электронам и короче одного электрона. Они разделяют электронную пару, которая является электроном, импортируется двумя атомами для достижения самой близкой без газовой конфигурации.
Наличие водородных связей объясняет увеличения объема воды при понижении температуры. Это связано с тем, что при понижении температуры происходит укрепление молекул и поэтому уменьшается плотность их “упаковки”.
При изучении органической химии возникал и такой вопрос: почему температуры кипения спиртов гораздо выше, чем соответствующих углеводородов? Объясняется это тем, что между молекулами спиртов тоже образуются водородные связи.
Для достижения стабильной электронной конфигурации ближайшего благородного газа водород нуждается в электроне, а кислород нуждается в двух электронах. В случае молекулы воды каждый из двух атомов водорода имеет электронную пару с атомом кислорода, так что водород приобретает конфигурацию дуплетов и октет кислорода, что приводит к образованию двух отдельных ковалентных связей.
В науке двадцатого века доминировали две великие теории: теория относительности и квантовая физика. На протяжении многих десятилетий многие профессионалы искали эту теорию, которая бы гармонично сочетала их, но пока без особого успеха. Она внесла огромный вклад в ядерную физику.
Повышение температуры кипения спиртов происходит также вследствие укрупнения их молекул.
Водородная связь характерна и для многих других органических соединений (фенолов, карбоновых кислот и др.). Из курсов органической химии и общей биологии вам известно, что наличием водородной связи объясняется вторичная структура белков, строение двойной спирали ДНК, т. е. явление комплиментарности.
Для женщины с той эпохи ее карьера была настолько уникальной. Его вклад в изучение внутренней структуры материи оставил прочный след в этой долгой истории, которая уже была занята мыслителями античности. Вопрос, в частности, в том, является ли вопрос бесконечно делимым, так как, например, вода проявляет себя как вопрос идеальной непрерывности. Аристотель думал, что да. Но, в конце концов, Демокрит утверждал, что материя состояла из элементарных частиц, которые он называл «атомами», что означает «неделимый».
Эти атомы по-разному объединяются в зависимости от материалов, и это объясняет различные состояния материи. Средство в то время не позволяло, конечно, проверять это интуитивное и, как оказалось, истинное утверждение. Спор будет охватывать этот вопрос более двух тысячелетий без значительного прогресса. Только работа химиков восемнадцатого и девятнадцатого века приведет к серьезным аргументам, подтверждающим атомный тезис. Тот факт, что в химических реакциях существует простая связь - например, путем объединения двух объемов водорода и одного объема кислорода, вода может быть создана - предполагает, что молекулы связываются друг с другом.
Для облегчения понимания межатомного взаимодействия мы будем рассматривать типы химической связи в несколько упрощенном виде, а именно, рассмотрим: а) гомеополярную, или ковалентную связь, б) гетерополярную, или ионную связь, в) металлическую связь и г) поляризационную связь, или связь Ван-дер-Ваальса.
Объединение атомов в молекулы вещества, а также объединение атомов или ионов в твердое тело происходит под действием химических связей. Объединение молекул в вещество, находящееся в жидком или газообразном состоянии осуществляется под действием сил межмолекулярного взаимодействия, называемыми силами Ван-дер-Ваальса. Природа химических и молекулярных связей единая – электрическая. Различают несколько типов химической связи, основные из них – это ковалентная и ионная.
Например, Джон Далтон, горячий сторонник атомной теории, полагался на такие аргументы. Периодическая таблица элементов, разработанная Дмитрием Менделеевым, может быть объяснена гипотезой о существовании разных типов атомов. Другим сторонником атомной теории был Людвиг Больцманн, который дал статистическое объяснение принципов термодинамики. Кроме того, анализ катодных лучей доказывает существование разрывной структуры. Это приведет к обнаружению рентгеновских лучей Вильгельма Рентгена.
Но на пластине был отчетливый мазок, негативный контур маленького металлического мальтийского креста, который был помещен между плитой и солями урана. Поэтому дело дошло до открытия совершенно неизвестного явления - радиоактивности. Через год Петр Кюри женился на своей молодой ученице Марии из Польши. Питер, физик, известный своей работой, особенно пьезоэлектрический, говорит, что ее интересует радиация, которую только что открыл Беккерель.
Ковалентная связь осуществляется за счет образования одной или нескольких общих пар электронов, ранее принадлежавших разным атомам. Ковалентная связь может быть одинарной (водород, хлор) или многократной (например, азот – 3). Ковалентная связь образуется между атомами одного или нескольких химических элементов с близкими ионизационными потенциалами. В чистом виде ковалентная связь реализуется при взаимодействии элементов с наполовину заполненными электронными оболочками.
Рассмотрим схематическое строение атома и молекулы водорода, рис.1. Электроны при движении по орбитам чаще находятся между ядрами, что способствует сближению атомов. Радиус атома водорода равен 0,53 ангстрема, а расстояния между ядрами атомов в молекуле водорода равняется всего лишь 0,74 ангстрема.
Появление между положительно заряженными ионами пары отрицательно заряженных электронов приводит к тому, что оба иона притягиваются к обобществленным электронам и, тем самым, притягиваются друг к другу. Каждый атом взаимодействует с ограниченным числом соседей, причем число соседей равно числу валентных электронов атома. Следовательно, ковалентная связь насыщенна. Кроме того, атом взаимодействует только с теми соседями, с которыми он обменялся электронами, то есть ковалентная связь направлена.
Отношение размера положительно заряженного ядра к размеру валентной электронной оболочки чрезвычайно мало, поэтому при анализе силы притяжения можно считать, что взаимодействуют точечные заряды, то есть сила притяжения описывается простейшим видом кулоновского закона: сила притяжения обратно пропорциональна квадрату расстояния между зарядами. При сближении атомов начинается взаимное отталкивание внутренних электронных оболочек, и отталкивание атомов описывается более сложным законом: сила отталкивания обратно пропорциональна расстоянию между атомами в степени n, где n >2.
Увеличение порядкового номера элемента ведет к росту количества электронных оболочек, экранирующих взаимодействие положительно заряженных ядер с валентными электронами. Поэтому снижается сила взаимного притяжения и уменьшается глубина потенциальной ямы. В результате, с ростом порядкового номера элемента падает температура плавления, растет коэффициент теплового расширения, уменьшается модуль упругости.
Если молекула состоит из атомов одного и того же химического элемента, то в ней центры расположения положительных и отрицательных зарядов совпадают. Собственный электрический дипольный момент μ такой молекулы равен нулю. Диэлектрик, образованный такими неполярными молекулами также является неполярным.
 Если молекула состоит из атомов различных химических элементов, то электронная пара сместится в сторону одного из атомов, обладающего большей электроотрицательностью
. В результате произойдет поляризация молекулы. Полярной или дипольной станет и сама молекула. Электрический дипольный момент μ
такой молекулы будет равен
Если молекула состоит из атомов различных химических элементов, то электронная пара сместится в сторону одного из атомов, обладающего большей электроотрицательностью
. В результате произойдет поляризация молекулы. Полярной или дипольной станет и сама молекула. Электрический дипольный момент μ
такой молекулы будет равен
μ = q * l , Кл*м
где q – абсолютное значение заряда диполя, l – плечо диполя, расстояние между центрами разноименных зарядов. Дипольный момент часто измеряют в дебаях(D). 1D = 3.33∙10 -30 Кл∙м. Молекула воды является полярной, так как электронные пары между кислородом и водородом смещены в сторону атома кислорода (рис. 2).
При наличии полярных ковалентных связей могут образовываться и неполярные молекулы, если дипольные моменты этих связей уравновешивают друг друга. Такое явление характерно для сложных органических молекул. Например, полиэтилен, трансформаторное масло, парафин являются неполярными веществами, хотя связь «углерод-водород» является полярной.
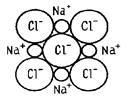
Ионная связь возникает между атомами, имеющими очень большую разность электроотрицательности. В этом случае электронная пара настолько сильно смещается в сторону одного из атомов, что тот фактически становится отрицательным ионом. Таким образом, ионная связь образуется за счет перехода электрона от одного атома молекулы к другому. Типичный пример такой связи – поваренная соль:
 NaCl = Na+ + Cl-.
NaCl = Na+ + Cl-.
Границ между полярной ковалентной и ионной связью весьма условна, принципиального различия в механизме образования этих связей нет. Но эти связи сильно отличаются между собой по величине энергии, которую нужно затратить на разрыв такой связи.
Ионная связь образуется при взаимодействии атомов с малым количеством валентных электронов и атомов с большим количеством электронов на валентных оболочках. При этом наружные электроны атомов с низкими потенциалами ионизации переходят на валентные оболочки атомов с высокими ионизационными потенциалами. В результате образуются положительно и отрицательно заряженные ионы, взаимно притягивающиеся электростатическими силами. Ионная связь ненасыщенна, поскольку каждый из отрицательно заряженных ионов притягивает к себе положительно заряженные, а каждый из положительно заряженных ионов притягивает к себе все отрицательно заряженные. Однако ионная связь направлена, поскольку ион притягивает к себе разноименно заряженные ионы и отталкивает одноименно заряженные.
Уменьшение размера иона и увеличение его заряда ведет к росту энергии связи, а следовательно, к росту температуру плавления материала, уменьшению коэффициента теплового расширения и к увеличению модуля упругости.
Металлическая связь образуется между атомами одного или нескольких химических элементов, у которых валентные электронные оболочки застроены меньше чем на половину. Поскольку энергия иона минимальна при полностью заполненной внешней оболочке, атомы отдают внешние валентные электроны и превращаются в положительно заряженные ионы, между которыми находятся свободные электроны (электронный газ).
Каждый из положительно заряженных ионов притягивается к свободным электронам, и, тем самым, ионы притягиваются друг к другу. Металлическая связь ненаправлена и ненасыщена, и число ближайших соседей у иона определяется в основном геометрическим и энергетическими факторами. Следовательно, кристаллические решетки металлов упакованы плотно. Под действием электрического поля не связанные с ионами электроны перемещаются, то есть металлы обладают высокой электропроводностью. Свободные электроны могут легко ускоряться и замедляться, то есть менять свою кинетическую энергию. Вследствие этого металлические материалы поглощают кванты электромагнитного поля любой энергии, то есть металлы непрозрачны для радио- и световых волн в широком диапазоне частот. Поглотив квант электромагнитного поля, свободный электрон возбуждается, и, переходя в стационарное состояние, испускает аналогичный квант. Иначе говоря, металлические материалы отражают радио- и световые волны.
Поляризационная связь, или связь Ван-дер-Ваальса. Образуется при сближении молекул или атомов инертных газов. Рассмотрим возникновение поляризационной связи на примере инертных атомов.
У одиночного атома электронная оболочка симметрична. При сближении двух атомов их электронные оболочки электрически взаимодействуют и деформируются (см. рис. 6). В итоге атомы превращаются в диполи, которые взаимно притягиваются. Чем больше порядковый номер атома, тем больше у него электронных оболочек, а следовательно, связь валентных электронов с ядром ослабевает, и деформировать ее становится легче. Следовательно, возрастает дипольный момент атома и увеличивается энергия связи между атомами. Поэтому температура кипения тяжелых инертных газов заметно выше температуры кипения легких газов.
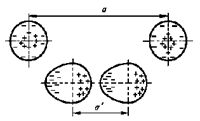 Аналогичные процессы происходят и при сближении электрически нейтральных молекул. Причем чем выше молекулярный вес, тем больший дипольный момент молекул и выше энергия связи. Поэтому вещества с низким молекулярным весом при комнатной температуре являются газами, вещества с большим молекулярным весом - жидкостями, а вещества с еще большим молекулярным весом - твердыми телами.
Аналогичные процессы происходят и при сближении электрически нейтральных молекул. Причем чем выше молекулярный вес, тем больший дипольный момент молекул и выше энергия связи. Поэтому вещества с низким молекулярным весом при комнатной температуре являются газами, вещества с большим молекулярным весом - жидкостями, а вещества с еще большим молекулярным весом - твердыми телами.
Важно иметь в виду, что в одном и том же материале одновременно могут реализовываться несколько типов химических связей. Так, внутри молекулы полиэтилена связь ковалентная, а между молекулами поляризационная. В алмазе атомы углерода связаны ковалентной связью, а у графита три электрона образуют ковалентную связь, один электрон идет на образование металлической связи, и образующиеся плоские молекулы связаны поляризационной связью.
В ряде случаев наблюдается изменение типа связи при изменении внешних условий. Так, олово является элементом четвертой группы, и в нем должна реализовываться ковалентная связь, но у олова пять электронных оболочек, и валентные электроны слабо связаны с ядром. Поэтому при термическом возбуждении электроны отрываются от атомов, и связь становится металлической. До температуры 13*С межатомная связь в олове ковалентная, и он является типичным полупроводником «серое» олово. Выше 13*С связь становится металлической, и олово ведет себя как типичный металл – «белое» олово. Важно отметить, что превращение белого олова в серое олово не может произойти строго при 13*С. Это вызвано существенным различием в плотности упаковки атомов. При перестройке кристаллических решеток в материале появляются упругие напряжения, которые повышают энергию системы. Поэтому превращение начинается при существенном переохлаждении. Упругие напряжения, возникающие при превращении, разрушают материал, поэтому серое олово существует в виде порошка. Превращение белого олова в серое было причиной гибели экспедиции Роберта Скотта. Поскольку канистры с горючим были пропаяны оловом, то при охлаждении белое олово превратилось в серое и горючее вытекло.
- Зависимость скорости ферментативной реакции от температуры, pH и времени инкубации Как влияет температура на рн
- Зависимость скорости ферментативной реакции от температуры, pH и времени инкубации Ph от температуры
- Святые богоотцы иоаким и анна Иоаким и анна когда почитание
- Храм святой великомученицы екатерины в риме
- Численность последователей основных религий и неверующих
- Абсолютные и относительные координаты Что называется абсолютными координатами точек
- Какие меры относились к политике военного коммунизма

 Live Journal
Live Journal Facebook
Facebook Twitter
Twitter