§ iii.1. взаимодействие между молекулами
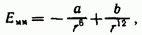
В первых двух главах были рассмотрены электронное строение атомов и молекул, взаимодействия атомов и характеристики атомов и молекул. Однако обычно человек имеет дело не с конкретными атомами и молекулами, а с веществом в одном из агрегатных состояний. В настоящей главе будут выяснены причина нахождения и свойства веществ в различных состояниях.
§ III.1. ВЗАИМОДЕЙСТВИЕ МЕЖДУ МОЛЕКУЛАМИ
Молекула представляет собой частицу, способную к самостоятельному существованию. Это устойчивое электрически нейтральное образование. Однако химическая устойчивость отдельных молекул относительна и проявляется лишь в системах, где расстояния между молекулами значительно больше их собственных размеров.
Уже на расстоянии одного или нескольких нанометров между соседними молекулами возникают заметные силы притяжения (вандерваальсовы силы). При вандерваальсовом взаимодействии электронные облака соседних молекул не перекрываются и химические связи не образуются. При достаточном сближении некоторых молекул может происходить перекрывание электронных облаков и образование новых молекул. Возникающие при этом химические связи могут иметь различную прочность. Относительно малую прочность имеют водородные связи.
При взаимодействии молекул по донорно-акцепторному механизму возникают прочные ковалентные связи.
Вандерваальсовы силы.
Слабые взаимодействия между нейтральными молекулами, проявляющиеся на расстояниях, превосходящих размеры частиц, были впервые обнаружены голландским ученым Ван-дер-Ваальсом. В связи с этим силы, вызывающие подобного рода взаимодействия, называют вандерваальсовыми силами. Силам Ван-дер-Ваальса приписывают электростатическую природу. Обычно в зависимости от природы системы выделяют три составляющие вандерваальсовых сил: ориентационную, индукционную и дисперсионную.
Ориентационная составляющая (или диполь-дипольная) сил Ван-дер-Ваальса представляет собой электростатическое взаимодействие соответствующим образом ориентированных диполей. Энергия ориентационного взаимодействия резко возрастает с увеличением электрического момента диполя молекул и уменьшается с ростом температуры, так как при этом тепловое движение нарушает ориентацию молекул.
В смесях, содержащих полярные и неполярные молекулы, возникает взаимодействие между молекулами, обусловленное электростатическим притяжением между диполями полярных молекул и наведенными (индуцированными) диполями неполярных молекул. Последние возникают в результате поляризации под действием электрических полей диполей, окружающих данную полярную молекулу. Этот эффект называется индукционной составляющей сил Ван-дер-Ваальса. Энергия индукционного взаимодействия Еинй возрастает с увеличением электрического момента диполя и не зависит от температуры, так как наведение диполей определяется напряженностью всего поля и происходит при любой пространственной ориентации молекул.
Межмолекулярное притяжение не исчерпывается ориентационными и индукционными взаимодействиями. Известно большое число веществ, таких, как, например, благородные газы, молекулы которых неполярны и относительно мало поляризуются. И тем не менее эти вещества получены как в жидком, так и в твердом состояниях. Возникновение при этом взаимодействий было впервые объяснено Ф. Лондоном. Он показал, что электростатическое отталкивание между электронами двух каких-либо атомов или молекул уменьшается, если движение электронов происходит таким образом, что они все время оказываются максимально удаленными друг от друга. При таком согласованном движении электронов каждый из атомов можно рассматривать как «мгновенный» электрический диполь, положительный полюс которого расположен в ядре атома, а отрицательный - в точке нахождения данного электрона. При согласованном движении электронов такие мгновенные диполи ориентируются друг к другу противоположно заряженными концами, в результате чего происходит их электростатическое притяжение.
Модель Лондона позволяет определить среднее статистическое
ское всех таких взаимодействий, получившее название дисперсионной составляющей сил Ван-дер-Ваальса.
Дисперсионные силы действуют между любыми атомами или молекулами независимо от их строения. Энергия их взаимодействия возрастает с увеличением эффективных радиусов взаимодействующих микрочастиц, так как при этом растет величина поляризуемости последних.
Все составляющие вандерваальсовых сил притяжения обратно пропорциональны расстоянию в шестой степени между взаимодействующими частицами. На малых расстояниях между молекулами, когда электростатическое отталкивание их ядер и электронов становится больше взаимного притяжения, проявляется действие сил отталкивания. На существование этих сил указывают многие факты, в частности малая сжимаемость жидкостей и твердых тел. Лондон установил, что силы отталкивания обратно пропорциональны расстоянию в двенадцатой степени между частицами.
Таким образом, полную энергию межмолекулярного взаимодействия можно представить как алгебраическую сумму двух слагаемых:
![]()
где а и - константы, характеризующие энергию притяжения и отталкивания.
Вандерваальсовым взаимодействиям свойственна небольшая энергия (табл. III.1), соизмеримая с энергией теплового движения частиц и примерно на порядок меньшая энергии химической связи. Эти силы отличаются от ковалентных сил отсутствием направленности и насыщаемости, а также тем, что они проявляются на значительно больших расстояниях.
Таблица III.1 Ориентационная, индукционная и дисперсионная составляющие вандерваальсовых сил некоторых веществ

Водородная связь.
Промежуточный характер между межмолекулярным взаимодействием и ковалентной связью имеет водородная связь. Она возникает между положительно поляризованным атомом водорода и отрицательно поляризованным атомом с большой электроотрицательностью, например атомом фтора, кислорода или азота. Положительно поляризованный атом водорода
обладает уникальными свойствами: очень малым размером и отсутствием внутренних электронных слоев, поэтому он может проникать в электронную оболочку отрицательно поляризованного атома соседней молекулы. Между двумя молекулами возникает взаимодействие, которое имеет электростатический и частично донорно-акцепторный характер. Водородную связь условно записывают как где X и Y - атомы или (точками обозначается собственно водородная связь).
Рассмотрим возникновение водородной связи при взаимодействии двух молекул фторида водорода. В молекуле HF электронная пара смещена к атому фтора, т. е. атом водорода поляризован положительно, а атом фтора - отрицательно. Между положительно поляризованным атомом водорода одной молекулы HF и отрицательно поляризованным атомом фтора второй молекулы возникает водородная связь

Каждый атом водорода в полученном димере связан с двумя атомами фтора одной ковалентной связью и одной водородной связью.
Энергия и длина водородной связи в значительной мере определяются электрическим моментом диполя связи и размерами атома. Длина связи уменьшается, а энергия водородной связи возрастает с увеличением разности атомов X и Y и соответственно электрического момента диполя связи и с уменьшением размера атома Например, у молекул воды, у которых разница кислорода и водорода равна 0,5, длины связи в триаде равны 0,096 нм для и 0,204 нм для энергия водородной связи составляет . У молекул которых разница ЭО фтора с водородом равна 1,9, длины связей и одинаковы и равны 0,113 нм, энергия водородной связи составляет т. е. соизмерима с энергией ковалентной связи.
Обычно же энергия водородной связи лежит в пределах , т. е. она больше энергии межмолекулярного взаимодействия, но значительно меньше энергии ковалентной связи. Водородная связь имеет весьма широкое распространение. Она встречается в неорганических и органических соединениях. Водородная связь иногда определяет структуру вещества и заметно влияет на физико-химические свойства. Важную роль играет водородная связь в процессах кристаллизации и растворения веществ, образования кристаллогидратов, ассоциации молекул и др. Примером полимерных ассоциатов может служить фторид водорода:

Вследствие ассоциации фтороводородная кислота более слабая кислота по сравнению с другими галогеноводородными кислотами. В результате ассоциации температура кипения HF значительно выше температуры кипения Способностью к ассоциации обладают вода, аммиак, спирты и другие соединения.
Кроме межмолекулярной водородной связи наблюдается внутримолекулярная связь, объединяющая атомы одной и той же молекулы. Ниже приведены две молекулы с внутримолекулярной водородной связью:

При образовании внутримолекулярной водородной связи теряется способность к ассоциации молекул. Поэтому изомеры с внутримолекулярной водородной связью более летучи, хорошо растворяются в органических растворителях и менее реакционноспособны.
Донорно-акцепторное взаимодействие молекул.
При наличии у атомов одной из молекул свободной орбитали, а у атомов другой молекулы - электронной пары между этими молекулами может возникнуть взаимодействие по донорно-акцепторному механизму. Донорно-акцепторное взаимодействие возможно как между одинаковыми, так и между разными молекулами. В первом случае возникают полимерные молекулы, например и др. Например, в молекуле
Энергия межмолекулярного донорно-акцепторного взаимодействия зависит от природы взаимодействующих молекул и изменяется в широких пределах: от значений, характерных для вандерваальсовых сил, до значений, отвечающих обычным межатомным ковалентным связям. Например, энергия межмолекулярной донорно-акцепторной связи в комплексе равна а в комплексе
ФИЗИКА. 11 класс. Задание № 49
Тема: Взаимодействие молекул. Строение твердых, жидких и газообразных тел
I уровень. Познакомимся с параграфом
1. Взаимодействие молекул
Наблюдения показывают, что между молекулами одновременно действуют и силы притяжения, и силы отталкивания. Силы взаимодействия молекул являются короткодействующими, их действие проявляется лишь на расстояниях, не превышающих нескольких собственных размеров молекулы. Область пространства, в которой проявляется действие молекулярных сил, называют сферой молекулярного действия. Радиус этой сферы равен примерно .
 Силы молекулярного взаимодействия зависят от расстояния между молекулами. При этом характер зависимости от расстояния у сил притяжения и сил отталкивания различен. При увеличении расстояния между молекулами силы отталкивания убывают быстрее, чем силы притяжения, а при уменьшении этого расстояния возрастают быстрее, чем силы притяжения.
Силы молекулярного взаимодействия зависят от расстояния между молекулами. При этом характер зависимости от расстояния у сил притяжения и сил отталкивания различен. При увеличении расстояния между молекулами силы отталкивания убывают быстрее, чем силы притяжения, а при уменьшении этого расстояния возрастают быстрее, чем силы притяжения.
Установлено, что силы взаимодействия молекул обратно пропорциональны -й степени расстояния г между центрами масс молекул. Для сил притяжения , а для сил отталкивания принимает значения от до . (Например, для молекулы воды , а .)
Сила отталкивания считается положительной, а сила притяжения отрицательной. На рисунке изображены графики зависимостей от расстояния между молекулами силы отталкивания, силы притяжения и результирующей этих сил.
Существует такое расстояние между молекулами , на котором сила притяжения равна силе отталкивания, т. е. их результирующая сила равна нулю. Это расстояние называется равновесным. Если расстояние между молекулами , преобладают силы их взаимного притяжения, если же , преобладают силы отталкивания. Таким образом, результирующая сил молекулярного взаимодействия на больших расстояниях является силой притяжения, а на малых – силой отталкивания. Следовательно, – это такое равновесное расстояние между молекулами, на котором они находились бы, если бы тепловое движение молекул не нарушало этого равновесия.
Описанный характер зависимости сил взаимодействия молекул от их расстояния друг от друга объясняет появление силы упругости при деформации тел. Если под действием внешних сил тело сжимается, расстояние между молекулами становится меньше, чем , и появляется сила, препятствующая взаимному сближению молекул. Если же под действием внешних сил тело растягивается, то расстояние становится больше, чем , и появляется сила, препятствующая взаимному удалению молекул. Вблизи точки на графике участок кривой является почти прямолинейным, так как при небольшом смещении молекул из положения равновесия силы притяжения или отталкивания между ними возрастают линейно с увеличением смещения. Именно по этой причине при малых деформациях тела (т. е. в пределах его упругости) выполняется закон Гука.
2. Строение газообразных, твердых и жидких тел
Характер теплового движения молекул, атомов и ионов зависит от агрегатного состояния вещества и определяется силами межмолекулярного взаимодействия.
Если минимальная потенциальная энергия молекул вещества много меньше средней кинетической энергии их теплового движения , то вещество находится в газообразном состоянии. Если , то вещество находится в жидком состоянии. Если же , то вещество находится в твердом состоянии.
Рассмотрим, какой характер имеет движение молекул в газах, жидкостях и твердых телах.
a) В газах при не высоких давлениях и не низких температурах молекулы находятся друг от друга на расстояниях, во много раз превышающих их размеры. В таких условиях молекулы газа не связаны между собой межмолекулярными силами притяжения. Они хаотически поступательно движутся по всему объему, занимаемому газом. Взаимодействие молекул газа происходит только при их столкновении между собой и со стенками сосуда, в котором газ находится. Передача импульса при этих столкновениях обуславливает давление, производимое газом.
§ Расстояние, которое молекула проходит между двумя последовательными столкновениями, называют длиной свободного пробега молекул.
Длина свободного пробега зависит от давления и температуры. В газах при нормальных условиях средняя длина свободного пробега молекул составляет приближенно .
Если молекулы газа состоят из двух или нескольких атомов, то при столкновении они приобретают вращательное движение.
Таким образом, в газах молекулы совершают преимущественно поступательное и вращательное движение.
б. В жидкостях расстояние между молекулами сравнимо с их эффективным диаметром. Силы взаимодействия молекул друг с другом достаточно велики. Молекулы жидкости колеблются около временных положений равновесия. Однако в жидкостях , поэтому, получив в результате хаотических столкновений избыток кинетической энергии, отдельные молекулы преодолевают притяжение соседних молекул и переходят в новые положение равновесия, вокруг которых вновь совершают колебательное движение.
Я. Френкель создал теорию жидкого состояния, согласно которой время колебаний молекул жидкости возле положения равновесия очень мало (порядка ), после чего молекулы совершают переход в новые положения. Следовательно, молекулы жидкости совершают колебательное движение вокруг временных центров равновесия и скачкообразно перемещаются из одних положений равновесия в другие.
Таким образом, в жидкостях молекулы совершают в основном колебательное и поступательное движения.
Возможность свободного перемещения молекул относительно друг друга обуславливает свойство текучести жидкости. Тело в жидком состоянии как и газообразном, не имеет постоянной формы. Форма жидкого тела определяется формой сосуда, в котором находится жидкость, действием внешних сил и сил поверхностного натяжения.
в. В твердых телах расстояние между молекулами еще меньше, чем в жидкостях. Силы взаимодействия молекул твердых тел между собой настолько велики, что молекулы удерживаются относительно друг друга в определенных положениях и колеблются около постоянных центров равновесия.
Для кристаллических тел характерны так называемые кристаллические решетки – упорядоченное и периодически повторяющееся в пространстве расположение молекул, атомов или ионов. В твердых телах молекулы совершают преимущественно колебательное движение (хотя имеются отдельные молекулы, движущиеся поступательно, о чем свидетельствует явление диффузии).
II уровень. Вспомним основные положения теории
1. Что называют сферой молекулярного взаимодействия? Каков радиус этой сферы?
2. Как силы взаимодействия между молекулами зависят от расстояния между ними?
3. Что такое равновесное расстояние?
4. Какова природа межмолекулярных сил?
5. Опишите характер движения молекул в газах, жидкостях и твердых телах.
Для начала неплохо. Попытайтесь ответить на вопросы
1. Какие опытные факты указывают на существование сил взаимодействия между молекулами?
2. Какими свойствами обладают силы молекулярного взаимодействия?
3. Около какой точки происходят колебания молекул твердого и жидкого тела, если оно находится в недеформированном состоянии?
4. Как объяснить с молекулярной точки зрения появление силы упругости, существование закона Гука и ограниченность области его применения?
5. Чем различаются газ, жидкость и твердое тело?
III уровень. Попробуйте выполнить задания
1. Между молекулами вещества действуют …
А. … только силы притяжения;
Б. … силы отталкивания;
В. … нет взаимодействия;
Г. … силы притяжения и отталкивания.
2. Если расстояние между центрами молекул меньше диаметра молекулы, то:
А. Сила притяжения молекул больше силы отталкивания;
Б. Сила отталкивания молекул больше силы притяжения;
В. Сила отталкивания молекул равна силе притяжения;
Г. Молекулы только притягиваются;
 Д. Молекулы только отталкиваются.
Д. Молекулы только отталкиваются.
3. На рисунке представлен график зависимости потенциальной энергии
Г. Это расстояние соответствует минимуму кинетической энергии атомов в молекуле;
Д. Это расстояние, на котором молекула разрушается.
4.  Установите соответствие:
Установите соответствие:
1. Частицы движутся хаотически …
2. Частицы колеблются около определенных положений равновесия …
3. Частицы совершают хаотические колебания вокруг центров, положения которых в пространстве скачкообразно изменяются, время от времени частицы движутся поступательно …
5. Вещество находится в газообразном состоянии, если …
А. … средняя кинетическая энергия его молекул много меньше средней потенциальной энергии их взаимодействия;
Б. … средняя кинетическая энергия его молекул приближенно равна средней потенциальной энергии их взаимодействия;
В. … средняя кинетическая энергия его молекул много больше средней потенциальной энергии их взаимодействия;
Г. … средняя кинетическая энергия его молекул равна нулю.
IV уровень. Проверьте, все ли Вы усвоили
- Как изменилось бы давление в сосуде с газом, если бы внезапно исчезли силы притяжения между его молекулами?
V уровень. Это сложная задача, однако, если Вы ее решите, то сделаете заметный шаг в познании физики, у Вас будут все основания относиться к себе с большим уважением, чем прежде
Если молекулы существуют и движутся, то между ними обязательно должны действовать силы. Без такого взаимодействия не было бы ни жидких, ни твердых тел.
Молекулярные силы
Доказать существование значительных сил взаимодействия между атомами или молекулами несложно. Попробуйте- ка сломать толстую палку! А ведь она состоит из молекул.
Существование сил притяжения между атомами может доказать такой наглядный опыт. Надо взять два свинцовых бруска и острым ножом срезать тонкие слои с их торцов. При до-статочном навыке срезы получаются гладкими и чистыми, свободными от оксидов свинца. Если плотно прижать бруски друг к другу свежими срезами, то они слипнутся. После этого можно один из брусков нагрузить гирей в несколько килограммов, но разрыва брусков не произойдет. Силы притяжения между атомами оказываются достаточными, чтобы предотвратить разрыв.
Если бы между молекулами не существовало сил притяжения, то вещество при любых условиях находилось бы в газообразном состоянии. Только благодаря силам притяжения молекулы могут удерживаться около друг друга и образовывать жидкие и твердые тела.
Но кроме сил притяжения между молекулами должны действовать силы отталкивания. В том, что между атомами или молекулами при непосредственном их сближении появляются силы отталкивания, убедиться очень просто. Если бы таких сил не существовало, то вы свободно могли бы проткнуть пальцем толстую стальную плиту. Более того, без появления сил отталкивания на очень малых расстояниях между молекулами вещество не могло бы существовать. Молекулы проникли бы друг в друга, и весь кусок вещества сжался бы до объема одной молекулы.
Представления о существенной роли межмолекулярных сил для описания свойств газов впервые ввел нидерландский физик Я. Д. Ван-дер-Ваальс (1837-1923). Он не пытался ус-тановить точную зависимость сил от расстояния. Ван-дер-Ва- альс считал, что на малых расстояниях между молекулами действуют силы отталкивания, которые с увеличением расстояния сменяются силами притяжения, сравнительно медленно убывающими при дальнейшем увеличении расстояния. Силы межмолекулярного взаимодействия часто называют ван- дер-ваальсовыми силами.
Электромагнитная природа молекулярных сил
Приступить к теоретическому исследованию молекулярных сил до начала XX в. было почти невозможно. Простые и хорошо изученные гравитационные силы при взаимодействии столь малых тел, как молекулы, явно не могли играть заметной роли. Оставалось предположить, что молекулярные силы имеют электромагнитную природу.
Любой атом и тем более молекула - это сложная система, состоящая из большого числа заряженных частиц: электронов и атомных ядер. Хотя в целом молекулы электрически нейтральны, между ними действуют значительные электрические силы: происходит взаимодействие между электронами и ядра- ми соседних молекул. Описание движения частиц внутри атомов и молекул - очень сложная задача. Ее рассматривают в атомной физике и решают с помощью законов квантовой механики. Мы ограничимся качественным рассмотрением межмолекулярных сил различных типов и потом приведем конечный результат: примерную зависимость сил взаимодействия двух молекул от расстояния между ними.
Ориентационные силы
У многих молекул, например у молекулы воды, распреде-ление положительных и отрицательных зарядов таково, что в среднем центры этих зарядов не совпадают. Такую молекулу приближенно можно рассматривать как совокупность двух точечных зарядов +q и -q на небольшом расстоянии I друг от друга (рис. 2.7). Эта система зарядов называется электрическим диполе м. Электрические свойства такой молекулы характеризуются дипольным моментом
p = ql, (2.4.1)
где q-абсолютное значение заряда. +q -q
Рассчитывать значения дипольных моментов молекул на первых порах не умели. До создания квантовой механики это вообще было невозможно.
Но если считать дипольные моменты и р2 двух молекул известными, то за-висимость силы взаимодействия между ними от расстояния можно вычислить. Для этого нужно только знать закон взаимодействия двух точечных электрических зарядов. Этот закон (закон Кулона) уже давно был известен. Сила притяжения двух диполей максимальна, когда они располагаются вдоль одной линии
1 2 3 4 © © © ©
Рис. 2.8
(рис. 2.8). Эта сила возникает из-за того, что расстояние между разноименными зарядами, находящимися в точках 2 и 3, чуть меньше, чем между одноименными, расположенными в точках 1, 3 и 2, 4.
Сила взаимодействия диполей зависит от их взаимной ори-ентации. Поэтому она называется ориентационной. Хаотическое тепловое движение непрерывно меняет ориентацию молекул-диполей. Учитывая это, силу взаимодействия диполей нужно вычислять как среднюю по всевозможным ориентациям. Расчеты приводят к следующему результату: сила притяжения пропорциональна произведению дипольных моментов р1 и рг молекул и обратно пропорциональна расстоянию между ними в седьмой степени:
РіРг
(2.4.2)
Это очень быстрое убывание по сравнению с силой взаимо-действия точечных заряженных частиц, которая пропорци- 1
ональна -5. Н
Индукционные (поляризационные) силы
Можно указать еще одно достаточно простое взаимодействие молекул. Оно возникает между двумя молекулами, одна из которых обладает дипольным моментом, а другая - нет.
Дипольная молекула создает электрическое поле, которое поляризует молекулу с электрическими зарядами, равномерно распределенными по объему. Положительные заряды смещаются по направлению линий напряженности электрического поля, а отрицательные - против. В результате неполярная молекула растягивается (поляризуется) и у нее возникает ди- польный момент (рис. 2.9).
Рис. 2.9
Силу взаимодействия можно рассчитать и в этом случае. Она пропорциональна дипольному моменту р полярной моле-кулы, некоторой величине а, характеризующей способность неполярной молекулы поляризоваться (она называется поля-ризуемостью), и обратно пропорциональна седьмой степени расстояния между молекулами:
(2.4.3)
г
Эти силы притяжения называются индукционными или поляризационными, так как они возникают благодаря поляризации молекул, вызванной электростатической индукцией.
Дисперсионные силы
Хорошо известно, что силы притяжения существуют и между неполярными молекулами. Например, атомы инертных газов не имеют дипольного момента, но тем не менее притягиваются друг к другу.
Качественно и очень приближенно появление этих сил можно объяснить так. В атомах и молекулах электроны каким-то сложным образом движутся вокруг ядер, и в среднем по времени дипольные моменты молекул могут оказаться равными нулю. Но в каждый момент времени электроны занимают какое-то определенное положение. Поэтому мгновенное значение дипольного момента отлично от нуля. Такой «мгновенный» диполь создает поле, поляризующее соседние неполярные атомы. Из-за этого «мгновенные» диполи начинают взаимодействовать друг с другом. Полная сила взаимодействия между неполярными молекулами есть средний результат взаимодействия всевозможных «мгновенных» диполей.
Расчет, выполненный в рамках квантовой механики, приводит к выводу, что сила взаимодействия в этом случае пропорциональна произведению поляризуемостей молекул OCj и а2 и обратно пропорциональна седьмой степени расстояния:
(2.4.4)
Эти силы называются дисперсионными, потому что дисперсия света (зависимость показателя преломления света
3-2915
от частоты) определяется теми же свойствами молекул, что и рассмотренные силы.
Дисперсионные силы действуют между всеми атомами и молекулами, так как механизм их проявления не зависит от того, есть ли у них постоянные дипольные моменты или нет. Обычно эти силы превосходят как ориентационные, так и индукционные силы. Только при взаимодействии молекул с большими дипольными моментами, например молекул воды, ориентационная сила оказывается больше дисперсионной (для молекул воды в 3 раза). При взаимодействии же таких полярных молекул, как СО, НС1, дисперсионные силы в десятки и сотни раз превосходят другие силы.
Существенно, что все три типа сил притяжения одинаковым
образом убывают с расстоянием пропорционально 4=. Впрочем,
г1
на расстояниях, в несколько раз больших размеров молекул, начинает сказываться конечность скорости распространения электромагнитных взаимодействий. Из-за этого на расстояниях порядка Ю-5 см силы притяжения начинают убывать уже
ЇСЙ-1С Q
г8
Силы отталкивания
Теперь обратим внимание на силы отталкивания, действующие между молекулами на очень малых расстояниях. С одной стороны, ситуация здесь проще, а с другой - сложнее. Проще в том смысле, что эти силы очень быстро возрастают при сближении молекул, и поэтому та или иная быстрота изменения силы с расстоянием не оказывает заметного влияния на течение любых процессов.
Сложность состоит в том, что силы отталкивания в значительно большей мере, чем силы притяжения, зависят от индивидуальности молекул. Зная, как молекула А отталкивает молекулы Б и С, мы еще не в состоянии судить, какие силы отталкивания будут действовать между молекулами В и С. При непосредственном сближении молекул их электронные обо-лочки начинают перекрываться и особенность строения молекул сказывается в большей степени, чем при больших расстояниях между ними.
К достаточно хорошим результатам приводит допущение, что силы отталкивания возрастают при сближении молекул по закону
(2.4.5)
Учитывая, что силы притяжения с уменьшением расстоя-
1
ния увеличиваются пропорционально, а силы отталкива-
г"
1
ния - пропорционально -jg , можно примерную зависимость сил от расстояния изобразить графически.
График зависимости молекулярных сил
от расстояния между молекулами
Рассмотрим, как меняется в зависимости от расстояния между молекулами проекция результирующей силы взаимодействия между ними на прямую, соединяющую центры молекул. Если молекулы находятся на расстояниях, превышающих их размеры в несколько раз, то силы взаимодействия между ними практически не сказываются. Силы взаимодействия между молекулами короткодействующие.
На расстояниях, превышающих 2-3 диаметра молекул, сила отталкивания практически равна нулю. Заметна лишь сила притяжения. По мере уменьшения расстояния сила притяжения возрастает и одновременно начинает сказываться сила отталкивания. Эта сила очень быстро увеличивается, когда электронные оболочки молекул начинают перекрываться.
На рисунке 2.10 графически изображена зависимость проекции Fr силы взаимодействия молекул от расстояния между их
з- центрами. На расстоянии г0, примерно равном сумме радиусов молекул, Fr = 0, так как сила притяжения равна по модулю силе отталкивания. При г > г0 между молекулами действует сила притяжения. Проекция силы, действующей на правую молекулу, отрицательна. При г Происхождение сил упругости
Зависимость сил взаимодействия молекул от расстояния между ними объясняет появление силы упругости при сжатии и растяжении тел. Если пытаться сблизить молекулы на расстояние, меньшее г0, то начинает действовать сила, препятствующая сближению. Наоборот, при удалении молекул друг от друга действует сила притяжения, возвращающая молекулы в исходные положения после прекращения внешнего воздействия.
При малом смещении молекул из положений равновесия силы притяжения или отталкивания растут линейно с увеличением смещения. На малом участке кривую можно считать отрезком прямой (утолщенный участок кривой на рис. 2.10). Именно поэтому при малых деформациях оказывается справедливым закон Гука, согласно которому сила упругости пропорциональна деформации. При больших смещениях молекул закон Гука уже несправедлив.
Так как при деформации тела изменяются расстояния между всеми молекулами, то на долю соседних слоев молекул при-ходится незначительная часть общей деформации. Поэтому закон Гука выполняется при деформациях, в миллионы раз превышающих размеры молекул.
Атомно-силовой микроскоп
На действии сил отталкивания между атомами и молекулами на малых расстояниях основано устройство атомно-силового микроскопа (АСМ). Этот микроскоп в отличие от туннельного позволяет получать изображения не проводящих электрический ток поверхностей. Вместо вольфрамового острия в АСМ используют маленький осколок алмаза, заостренный до атомных размеров. Этот осколок закрепляется на тонком металлическом держателе. При сближении острия с исследуемой поверхностью электронные облака атомов алмаза и поверхности начинают перекрываться и возникают силы отталкивания. Эти силы отклоняют кончик алмазного острия. Отклонение регистрируется с помощью лазерного луча, отражающегося от зеркальца, закрепленного на держателе. Отраженный луч приводит в действие пьезоэлектрический манипулятор, аналогичный манипулятору туннельного микроскопа. Механизм обратной связи обеспечивает такую высоту алмазной иглы над поверхностью, чтобы изгиб пластины держателя оставался неизменным.
На рисунке 2.11 вы видите изображение полимерных цепей аминокислоты аланина, полученное с помощью АСМ. Каждый бугорок представляет собой одну молекулу аминокислоты.
Рис. 2.11
В настоящее время сконструированы атомные микроскопы, устройство которых основано на действии молекулярных сил притяжения на расстояниях, в несколько раз превышаю-щих размеры атома. Эти силы примерно в 1000 раз меньше сил отталкивания в АСМ. Поэтому применяется более сложная чувствительная система для регистрации сил.
Атомы и молекулы состоят из электрически заряженных частиц. Благодаря действию электрических сил на малых расстояниях молекулы притягиваются, но начинают отталкиваться, когда электронные оболочки атомов перекрываются.
Электрически нейтральные атомы и молекулы, валентно-насыщенные, способны к дополнительному взаимодействию друг с другом. Степень такого взаимодействия может быть различной – от рассмотренного выше процесса образования прочных комплексных соединений до совсем слабых сил, проявляющихся при взаимодействии любых частиц на сравнительно больших расстояниях.
Очень слабые силы притяжения между нейтральными атомами и молекулами, проявляющиеся на расстояниях, превосходящих размеры частиц , называют межмолекулярным взаимодействием или силами Ван- дер -Ваальса . Они действуют в газообразных и жидких веществах, а также между молекулами в молекулярных кристаллах. Межмолекулярное притяжение определяет возможность перехода вещества в жидкое и твердое агрегатные состояния (с выделением энергии), играет важную роль в процессах адсорбции, катализа, растворения и сольватации. Ван -дер - Ваальсово притяжение имеет электрическую природу и определяется тремя эффектами – ориентационным , индукционным и дисперсионным:
Е = Е ор. + Е инд. + Е дисп.
Ориентационное взаимодействие
Об ориентационном эффекте говорят в случае взаимодействия полярных молекул, т.е. диполей. При ориентационном взаимодействии диполи поворачиваются по отношению друг к другу разноименными полюсами, т.е. определенным образом ориентируются в пространстве . Притяжение обусловливается электростатическим взаимодействием полюсов различных диполей, а следовательно, энергия ориентационного взаимодействия тем выше, чем больше электростатический момент диполя и чем меньше расстояние между ними. Следовательно, вклад ориента-ционного взаимодействия в суммарное притяжение особенно велик для молекул с большим дипольным моментом (вода, аммиак и др.).
Тепловое движение молекул уменьшает возможность такой ориентации, следовательно, при повышении температуры ориентационное взаимодействие ослабевает.
Индукционное взаимодействие
Индукционное взаимодействие возникает при сближении друг с другом полярной и неполярной молекул и связано с поляризацией неполярной молекулы под воздействием полярной . При этом образуется индуцированный (наведенный) диполь, благодаря которому происходит взаимное притяжение молекул.
Подобное явление может наблюдаться и для полярных молекул (дипольный момент увеличивается, и индукционный эффект наклады-вается на ориентационный, вследствие чего возрастает взаимное при-тяжение молекул).
Энергия индукционного взаимодействия увеличивается с ростом дипольного момента и поляризуемости, от температуры она не зависит. Индукционный эффект в 10-20 раз меньше ориентационного, и ощутимое влияние индукционного взаимодействия проявляется в случае частиц, обладающих высокой поляризуемостью.
Дисперсионное взаимодействие
Дисперсионное взаимодействие проявляется для любых атомов и молекул независимо от их строения, в том числе и для двух неполярных молекул.
Вследствие перемещения электронов и колебательного движения атомных ядер в неполярной молекуле возникают мгновенные диполи , между которыми и происходит дисперсионное взаимодействие .
Направление диполей постоянно меняется вследствие движения электронов. Электрическое поле таких мгновенных диполей индуцирует мгновенные диполи в других частицах, и движение всех мгновенных диполей становится синхронным. В результате соединение молекулы притягиваются друг к другу, и энергия системы понижается.
Дисперсионное взаимодействие универсально (присуще всем частицам), проявляется лишь на очень небольших расстояниях, обладает малой энергией и увеличивается с ростом поляризации молекул.
Для реальных молекул проявляются обычно все три вида межмолекулярных взаимодействий.
Водородная связь
Промежуточный характер между обычной химической связью и межмолекулярным взаимодействием имеет водородная связь.
Водородная связь реализуется между положительно поляризован-ным атомом водорода одной полярной молекулы и отрицательно поляри-зованным атомом неметалла (чаще – фтора, кислорода, азота, реже – хлора, серы) другой молекулы .
Подобное взаимодействие не проявляется для других атомов, что обусловлено уникальными свойствами поляризованного атома водорода – его очень малыми размерами и отсутствием внутренних электронных оболочек. Эти особенности атома водорода позволяют партнеру прибли-зиться на столь малое расстояние, которое не может быть достигнуто при взаимодействии с другими частицами.
Возникновение водородной связи в очень грубом приближении можно объяснить действием электростатических сил. Так, например, в полярной молекуле фтороводорода общая электронная пара сильно смещена к атому фтора. В результате атом водорода приобретает поло-жительный заряд и может электростатически взаимодействовать с отрицательно заряженным атомом фтора соседней молекулы HF. Вследст-вие своих малых размеров атом водорода (теперь уже почти ион) способен проникнуть в электронную оболочку соседнего атома фтора, вследствие чего и возникает водородная связь:
Это «проникновение» свидетельствует о том, что вся полнота картины не может быть описана лишь электростатическим притяжением, в образование водородной связи вносит вклад и донорно-акцепторное взаимодействие.
Условием образования водородной связи является высокая электроотрицательность атома, связанного с атомом водорода. Только в таком случае электронное облако достаточно сильно смещается в сторону атома-партнера, и он приобретает высокий отрицательный заряд.
Энергия водородной связи невелика: она на порядок меньше энергии обычной ковалентной связи, но много выше энергии межмолекулярных взаимодействий. Несмотря на малую прочность, часто водородная связь определяет внутреннюю структуру вещества и существенно влияет на его физические и химические свойства. Благодаря водородным связям молеку-лы объединяются в димеры и более сложные ассоциаты:
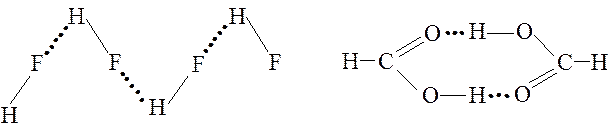
В кристалле льда каждый атом кислорода тетраэдрически связан с четырьмя атомами водорода: с двумя – полярной ковалентной связью, а с двумя другими – водородной связью. В свою очередь, каждый атом водорода связан двумя различными связями с двумя атомами кислорода.
Способностью к ассоциации обладают молекулы аммиака, спиртов, пероксида водорода, ряда кислот и др. Это приводит к повышению температур плавления и кипения, изменению взаимной растворимости. Ведь водородные связи могут образовываться и между двумя различными молекулами, например:

Так, смешение спиртов с водой сопровождается разогреванием и уменьшением объема, что объясняют образованием водородных связей:

Водородная связь влияет и на химические свойства веществ. Например, НF – слабая кислота, в отличие от других галогеноводородных кислот диссоциация HF на ионы осложнена способностью ее к образованию дифторид-иона и других, более сложных частиц. Эти частицы столь прочны, что выделены кислые соли фтороводородной кислоты, например, KHF 2 .
Кроме межмолекулярной , встречается и внутримолекулярная водородная связь, например:

Таким образом, убедившись в разнообразии типов химической связи, причина образования которой во всех случаях электростатическая, следует выяснить вопрос: почему число связей, образуемых атомом одного элемента, переменно, и от каких факторов это число зависит, чем определяется.
- Рецепты варенья из кабачков с лимоном, с курагой и в ананасовом соке
- Как приготовить вкусные куриные сердечки с картофелем в мультиварке Куриные сердечки рецепт в мультиварке с картофелем
- Сырный суп с курицей и грибами Куриный суп с сыром и грибами
- Четверка монет таро значение
- Что такое договор найма служебного жилого помещения?
- Хлеб по технологии в духовке на дрожжах
- Требования к главному бухгалтеру Нормативное регулирование бухгалтерского учета

 Live Journal
Live Journal Facebook
Facebook Twitter
Twitter