Только ионные связи наблюдаются в веществе. Химическая связь в комплексных соединениях. Строение вещества

Вариант 1
ЧАСТЬ А
А1
. Ионная связь образуется:
а) между двумя металлами б) между двумя неметаллами
в) между металлом и неметаллом г) между двумя молекулами
А2
а) углекислый газ б) аммиак
в) алмаз г) хлороформ
А3.
Орбитали s и р и р и р соответственно перекрываются в молекулах веществ:
а) H 2 S и Cl 2 б) HCl и HBr в) H 2 и Br 2 г) N 2 и HI
Хотя присутствие ионов в солевых растворах или расплавленных солях уже давно установлено, особенно в исследованиях электропроводности, распространение понятия иона на кристаллическую структуру, с другой стороны, основывалось на постулате, из которого успех был главным образом в вычислении очень хороших значений для ретикулярных энергий некоторых типов кристаллов. Разработка рентгеновских методов, предлагающих возможность создания реальной электронной карты плотности для кристалла. позволили прямо показать существование ионов в определенных типах сетей и, таким образом, подтвердить постулат ионной связи.
А4
а) оксид калия б) кремний в) медь г) гидроксид магния
А5
. Прочность водородной связи зависит:
а) от величины избыточного положительного заряда на атоме водорода
б) от электроотрицательности элемента, образующего связь с атомом водорода
в) от величины поляризации связи водород - гетероатом
г) все перечисленные ответы верны.
Ионный кристалл формируется простой геометрической сборкой положительно заряженных ионов, катионов и отрицательно заряженных ионов, анионов, энергии, обеспечивающей сцепление кристалла или энергии решетки, по существу электростатический. Очень важно количество преимущественно ионных соединений; эта категория включает в себя значительную часть соединений минеральной химии и составляющих многих разновидностей горных пород. Однако чисто ионные кристаллы редки, они практически ограничены фторидами и хлоридами тяжелых щелочных металлов; действительно, эволюция к более ковалентному или гомополярному характеру появляется быстро для других соединений.
А6 . Вещества твердые, прочные с высокими температурами плавления, расплавы которых проводят электрический ток, имеют кристаллическую решетку
а) металлическую б) молекулярную в) атомную г) ионную
А7 . Только ковалентные связи имеет каждое из двух веществ:
A9. Атомную кристаллическую решетку имеет
А10. Какие из перечисленных свойств характерны для веществ с молекулярной кристаллической решеткой?
Для наших подписчиков статья состоит из 4 страниц. Не все известны квасцы, соответствующие каждой возможной паре. Экспериментально было показано, что размер ионов играет решающую роль в стабильности и растворимости этих соединений, которые все легче подготовить, поскольку моновалентный ион большой, а трехвалентный ион мал.
Но ссылки не всегда являются ионными, так что другие геометрии наблюдаются, и они распространяются далеко за пределы ожидаемых. Ионные кристаллы обычно характеризуются значительными когезионными силами; это приводит к относительно высоким температурам плавления для этих соединений. В той же серии, как, например, щелочные фториды, они уменьшаются почти линейно, когда расстояние между ядром катиона и аниона увеличивается, равно как и энергия сети, или энергия решетки.
Укажите верный ответ.
В2.
| ФОРМУЛА ВЕЩЕСТВА | СТЕПЕНЬ ОКИСЛЕНИЯ АЗОТА | ||
| А) | NO 2 | 1) | - 3 |
| Б) | (CH 3) 2 NH | 2) | -2 |
| В) | NH 4 Br | 3) | + 2 |
| Г) | NH 3 | 4) | + 3 |
| 5) | + 4 | ||
| 6) | +5 |
ЧАСТЬ С
С 1. Из раствора массой 350 г с массовой долей соли 25 % выпариванием удалали 100 г воды. Массовая доля (в %) соли в полученном растворе равна …
С2 . Дайте характеристику фторида азота (III) по плану: вид связи, определение, схема образования связи, тип кристаллической решетки, физические свойства.
Контрольная работа по теме «Строение вещества»
Вариант 2
ЧАСТЬ А
А1
. В результате разрыва ионной связи образуются:
а) радикалы б) атомы металла и неметалла
в) катион и анион г) молекулы
А2
а) Ba(OН) 2 б) H 2 SO 4
в) NH 4 NO 3 г) Li 2 CO 3
А3. Линейное строение имеет молекула:
а) аммиака б) метанола
в) воды г) хлорида бериллия
А4
. Найдите название вещества, имеющего металлический тип связи:
а) мышьяк б) фосфор
в) галлий г) иод
А5
а) водород б) гидрид натрия
в) муравьиная кислота г) метан
А6 .В молекуле какого вещества длина связи между атомами углерода наибольшая
а) ацетилена б) этана в) этена г) бензола
А7. Какая из перечисленных химических связей самая длинная?
А9. Формула соединения, в котором степень окисления серы минимальна, - это:
Укажите верный ответ.
В2. Установите соответствие между формулой вещества и степенью окисления азота в нём
| ФОРМУЛА ВЕЩЕСТВА | СТЕПЕНЬ ОКИСЛЕНИЯ АЗОТА | ||
| А) | NaNO 2 | 1) | +5 |
| Б) | NH 4 NO 3 | 2) | +3 |
| В) | NH 4 NO 2 | 3) | -3, +5 |
| Г) | HNO 3 | 4) | 0, +2 |
| 5) | - 3, +3 | ||
| 6) | +4, +2 |
ЧАСТЬ С
С 1. К раствору массой 250 г, массовая доля соли в котором составляет 10 %, прилили воду объёмом 150 мл. Приняв плотность воды равной 1 г/мл, определите массовую долю соли в полученном растворе.
С2 . Дайте характеристику хлорида магния по плану: вид связи, определение, схема образования связи, тип кристаллической решетки, физические свойства.
Контрольная работа по теме «Строение вещества»
Вариант 3
ЧАСТЬ А
А1
Пара элементов, между которыми образуется ионная химическая связь:
а) углерод и сера в) калий и кислород
б) водород и азот г) кремний и водород
А2
. Только ковалентная связь наблюдается в соединении с формулой:
а) Ba(OН) 2 в) H 2 SO 4
б) NH 4 NO 3 г) Li 2 CO 3
А3.
В молекулах H 2 Te – H 2 Se – H 2 S длина связи:
а) не изменяется в) уменьшается
б) увеличивается г) сначала уменьшается, затем растет
А4.
Ковалентная связь отличается от ионной:
а) большей длиной в) большей энергией
б) меньшей энергией г) насыщаемостью
А5
. В молекуле какого соединения имеется ковалентная неполярная связь?
а) CS 2 в) COCl 2
б) H 2 O 2 г) CH 3 OH
А6
. Вещество с металлической связью:
а) оксид калия в) кремний
б) медь г) гидроксид магния
А7
. Наиболее прочные водородные связи образуются между атомом водорода и атомом:
а) азота б) кислорода в) хлора г) серы
А8. Сколько и каких типов химических связей может образовывать атом азота?
A9. Наиболее полярна химическая связь в молекуле
А10. Наименее электроотрицательный элемент
ЧАСТЬ В
В1. Установите соответствие между формулой соединения и типом ковалентной связи:
| ФОРМУЛА СОЕДИНЕНИЯ | ТИП КОВАЛЕНТНОЙ СВЯЗИ ПО ЧИСЛУ ЭЛЕКТРОННЫХ ПАР | ||
| А) | O 2 | 1) | одинарная |
| Б) | HCl | 2) | двойная |
| В) | N 2 | 3) | тройная |
| Г) | Cl 2 |
В2. Установите соответствие между формулой вещества и степенью окисления хрома в нём
| ФОРМУЛА ВЕЩЕСТВА | СТЕПЕНЬ ОКИСЛЕНИЯ ХРОМА | ||
| А) | K 2 Cr 2 O 7 | 1) | |
| Б) | CaCr 2 O 7 | 2) | +2 |
| В) | CrO 2 F 2 | 3) | + 3 |
| Г) | Ba 3 [Сr(OH)] 2 | 4) | +4 |
| 5) | + 5 | ||
| 6) | +6 |
ЧАСТЬ С
С 1. В воде растворили гидроксид калия массой 11,2 г, объём раствора довели до 200 мл. Рассчитайте молярную концентрацию полученного раствора.
С2 . Дайте характеристику хлора по плану: вид связи, определение, схема образования связи, тип кристаллической решетки, физические свойства.
Контрольная работа по теме «Строение вещества»
Вариант 4
ЧАСТЬ А
А 1 . Вещество с ионной связью:
а) кислород в) фторид натрия
б) метан г) этаналь.
А 2
. Ковалентная неполярная связь наблюдается в следующем веществе:
а) углекислый газ в) аммиак
б) алмаз г) хлороформ
А 3 .Кристаллическая решетка графита:
а) ионная в) атомная
б) молекулярная г) металлическая
А 4.
Химическая связь наименее прочна в молекуле:
а) бромоводорода в) хлороводорода
б) иодоводорода г) фтороводорода
А 5 . Какая химическая связь образуется между атомами с порядковыми номерами 1 и 16?
а) ионная в) ковалентная полярная
б) ковалентная неполярная г) металлическая
А 6.
Найдите название вещества, имеющего металлический тип связи:
а) мышьяк в) фосфор
б) галлий г) иод
А 7
. Укажите название вещества, молекулы которого способны к образованию водородных связей:
а) метанол в) гидрид кальция
б) этан г)водород
А8. Только ковалентные связи имеет каждое из двух веществ:
А10. Электроотрицательность элементов увеличивается в ряду:
1) C, Si, S ; 2) P, Cl, I; 3) Br, Cl, S; 4) Se, S, Cl.
ЧАСТЬ В
В1. Установите соответствие между типом орбитали и механизмом образования ковалентной связи:
В2. Установите соответствие между формулой вещества и степенью окисления азота в нём
| ФОРМУЛА ВЕЩЕСТВА | СТЕПЕНЬ ОКИСЛЕНИЯ АЗОТА | ||
| А) | NO 2 | 1) | - 3 |
| Б) | (CH 3) 2 NH | 2) | -2 |
| В) | NH 4 Br | 3) | + 2 |
| Г) | NH 3 | 4) | + 3 |
| 5) | + 4 | ||
| 6) | +5 |
ЧАСТЬ С
С 1. К раствору серной кислоты объёмом 400 мл, плотность которого равна 1,1 г/мл, а массовая доля кислоты 0,15, добавили воду массой 60 г. Определите массовую долю серной кислоты в полученном растворе.
С2 . Дайте характеристику хлорида азота (III) по плану: вид связи, определение, схема образования связи, тип кристаллической решетки, физические свойства.
Рассмотренный выше способ образования ковалентной химической связи, когда каждый из взаимодействующих атомов отдает по одному электрону для образования общей электронной пары, называется обменным . Но часто валентность элемента (т.е. число связей, образован-ных атомом) оказывается выше числа неспаренных электронов. Это обусловлено тем, что помимо обменного механизма образования кова-лентной химической связи, существует и другой, когда один атом («донор») отдает неподеленную пару электронов, а другой («акцептор») предоставляет вакантную орбиталь. Ковалентную химическую связь, образующуюся за счет неподеленной электронной пары донора и сво-бодной орбитали акцептора, называют донорно-акцепторной связью:
NH 3 + H NHВ молекуле аммиака три пары электронов образуют ковалентные связи N – H, а четвертая неподеленная пара электронов атома азота принадлежит лишь ему. В свою очередь, ион водорода представляет собой ядро со свободной 1 s-орбиталью.
При сближении молекулы аммиака и иона водорода неподеленная электронная пара азота попадает в сферу притяжения иона водорода, т.е. возникает четвертая ковалентная связь N – H:

Таким образом, в катионе аммония атом азота имеет 4 ковалентных связи. Три из них образованы по обменному механизму, а четвертая – по донорно-акцепторному.
Экспериментально установлено, что все 4 связи энергетически равноценны, независимо от происхождения, положительный заряд иона аммония равномерно распределен между всеми атомами.
Аналогично образуются две донорно-акцепторные связи в гексафторсиликат-ионе:
SiF 4 + 2F – ¾® 2–
Здесь донорами электронных пар являются два фторид-иона, акцептором – атом кремния, имеющий свободные d-орбитали.
Донорно-акцепторный механизм образования ковалентной связи отличается от обменного только происхождением электронной пары, ответственной за химическую связь. Во всем остальном оба вида ковалентной связи тождественны (в обоих случаях требуется антипарал-лельность спинов электронов, наблюдается перекрывание электронных облаков, понижение общей энергии системы и т.д.). Так, образование молекул можно объяснить на основе как одного, так и другого механизма:
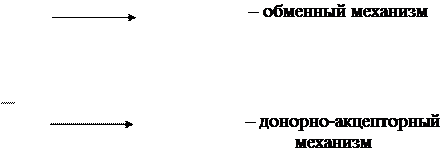

Возможность образования донорно-акцепторных связей иногда вносит существенные коррективы в прочность молекул. Рассмотрим, например, строение молекулы углерода (II). Исходя из строения атомов углерода и кислорода, следовало бы предположить, что между ними возникают две связи по обменному механизму:
В этом случае атом углерода является акцептором, принимая на свободную 2р-орбиталь неподеленную пару 2р-электронов донора-атома кислорода (кратко это изображают в виде формулы С О).
Возможность образования донорно-акцепторных связей обуслов-ливает существование многообразных химических соединений , называе-мых комплексными соединениями . В большинстве случаев соединения образуются между атомами или ионами металлов (обычно – d- или р- элементов), которые называют комплексообразователями , и ионами или молекулами, обладающими неподеленными электронными парами (F – , Cl – , OH – , H 2 O, NH 3 и др.), называемыми лигандами .
Атомы (ионы) d-элементов обладают большим числом вакантных орбиталей, которые, выступая в качестве акцепторов, координируют вокруг себя несколько ионов (или молекул) лигандов, например:
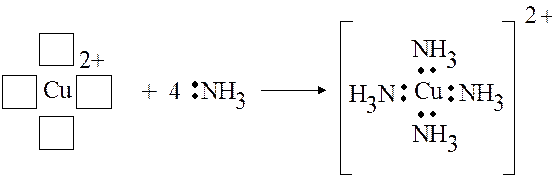
Поскольку в образовании связей в комплексных соединениях обычно принимают участие различные орбитали металлов, в том числе и d-орбитали, а образующиеся связи энергетически равноценны, можно утверждать, что при комплексообразовании имеет место гибридизация орбиталей центрального атома. Кроме изученными нами ранее типов гибридизации, при образовании комплексных соединений встречаются также типы sp 3 d 2 -, d 2 sp 3 - и другие, приводящие к образованию молекул различного пространственного строения, в том числе октаэдра, тригональной бипирамиды и других. Подробно этот материал будет изучаться в теме «Комплексные соединения».
Ионная связь
В предыдущей главе было показано, что ковалентная химическая связь, за счет которой образуется большинство простых и сложных веществ, обладает большой прочностью (большое перекрывание электронных облаков), геометрической направленностью (соединяет или центры атомов, или направлена параллельно межъядерной оси), насыщаемостью (электроны, образовавшие общую электронную пару, участия в образовании других связей не принимают).
Эти характеристики отличают ковалентную связь от ионной химической связи, механизм образования которой несколько иной.
При рассмотрении ковалентной полярной связи указывалось, что она образуется между атомами элементов, обладающих различной, но не очень резко различающейся электроотрицательностью. В случае резкого различия в электроотрицательности элементов (Dc ~ 1,7) говорят уже об ионной связи.
Первоначально Коссель считал, что при химических реакциях атомы стремятся приобрести электронные конфигурации инертных газов, что может быть достигнуто отдачей или присоединением электронов нейтральными атомами. Атомы, отдающие электроны, превращаются в положительные ионы (катионы ), а атомы, присоединяющие электроны – в отрицательно заряженные ионы (анионы ). Химическая связь осуществ-ляется за счет электростатического притяжения образовавшихся разноименно заряженных ионов.
Ионы могут быть простыми, т.е. состоящими из одного атома (например, Na + , K + , F – , Cl –), или сложными (например, NH , OH – , NO , PO ). Простые катионы легче всего образуются из атомов элементов с низким значением энергии ионизации, т.е. элементов главных подгрупп I и II групп Периодической системы (щелочных и щелочноземельных металлов). Образование простых анионов характерно для атомов типичных неметаллов, обладающих большим сродством к электрону (галогены, кислород, азот, сера).
Рассмотрим образование соединения с ионной связью на примере взаимодействия атомов натрия и фтора. У атома натрия и атома фтора по одному неспаренному электрону на внешнем энергетическом уровне, и, казалось бы, в данном случае должна образовываться ковалентная поляр-ная s-связь, т.е. произойти перекрывание одноэлектронных облаков ато-мов с образованием общего двухэлектронного облака.
Однако относительные электроотрицательности натрия и фтора существенно различаются (0,9 и 4,0 соответственно), и образующаяся химическая связь становится настолько полярной, что электронная плотность в молекуле NaF практически нацело смещается к атому фтора. Образуются два иона, связанные между собой силами электро-статического притяжения:
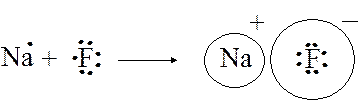
В отличие от ковалентной связи, ионная связь не обладает направленностью. Ионы можно представить как точечные заряды, соз-дающие электрические поля, которые равномерно распределяются по всем направлениям. Это означает, что два разноименных заряда, образазующие ионную связь, сохраняют способность электростатически взаимодейство-вать с другими ионами. В этом состоит еще одно различие между ковалентным и ионным типами связи: ионная связь характеризуется ненасыщаемостью . Поэтому к одному иону может притягиваться различное число ионов противоположного знака. Это число ограничивает-ся относительными размерами ионов. Ионная связь несколько менее прочна, чем ковалентная, что позволяет ей легко разрушаться в полярных растворителях.
В газообразном состоянии (при высоких температурах) ионные молекулы существуют в виде мономеров. При обычных температурах в жидком, а, тем более, в твердом состоянии происходит объединение этих молекул и их взаимная ориентация с образованием ионной кристал-лической решетки, в которой каждый ион окружен несколькими ионами противоположного знака. При этом все связи данного иона с соседними ионами равноценны, и весь кристалл можно рассматривать как единую гигантскую молекулу. Сам же термин «молекула» в применении к ионным соединениям следует понимать как условный, отражающий лишь элементарный состав вещества.
При какой же разнице в электроотрицательностях элементов следует говорить уже не о ковалентной полярной, а об ионной химической связи? Оказывается, что идеально ионных соединений не существует, а, значит, нет и истинной ионной связи. Прежде всего об этом свидетельствуют экспериментально измеренные истинные (или «эффективные») заряды атомов, из которых построены ионные соединения. Оказывается, что даже в соединениях, образованных самыми электроотрицательными и самыми электрополо-жительными элементами, связь не на 100% ионная. Так, эффективные заряды в соединении CsF не равны заряду электрона, а составляют 0,93 от его величины. Эффективный заряд на атоме магния в MgCl 2 не +2, а лишь +1,50, а алюминия в его оксиде вместо +3 только +1,77. Поэтому ионная связь должна рассматриваться как предельный случай ковалент-ной связи, когда разница в электроотрицательностях элементов, состав-ляющих молекулу, столь велика, что общая электронная пара переходит в полное владение более электроотрицательного атома.
Неполное разделение зарядов в ионных соединениях объясняют взаимной поляризацией, которая приводит к деформации электронных оболочек ионов. Различные ионы поляризуются в различной степени, следовательно, можно говорить о большей или меньшей доле ионной связи. Идеальная ионная связь – не более чем абстрактное понятие.
Таким образом, существенного различия между ковалентной и ионной связью нет: эти виды связи отличаются лишь степенью поляризации электронного облака.
Металлическая связь
Металлы представляют собой простые вещества, и можно было бы полагать, что связь в металлах должна быть ковалентной неполярной. В действительности валентные электроны металлов слабо связаны с ядром, и при соединении двух атомов не может образовываться доста-точно прочная ковалентная связь. Тем не менее в парообразном состоянии существуют ковалентно построенные двухатомные молекулы металлов, например, Li 2 , Nа 2 , K 2 , энергия связи в которых в несколько раз меньше, чем, например, энергия связи в молекуле водорода.
В жидком и твердом состоянии двухатомные молекулы в металлах отсутствуют. За счет чего же атомы металлов удерживаются между собой, что определяет прочность таких веществ? Следует говорить о наличии особого типа связи – металлической .
Предположения о природе металлической связи можно получить на основании двух отличий металлов от соединений с ковалентными и ионными связями. Во-первых, металлы отличаются от других веществ высокой электро- и теплопроводностью, и, во-вторых, являются в обыч-ных условиях кристаллическими веществами с высокими координацион-ными числами атомов (т.е. каждый атом окружен большим числом соседей с ним связанных).
Из первого свойства следует, что по крайней мере, часть электро-нов может относительно свободно передвигаться по всему объему куска металла. Из второго свойства – что атомы не связаны друг с другом локализованными двухэлектронными связями: ведь числа валентных электронов в атоме металла не достаточно для образования обычных ковалентных связей со всеми соседями.
У атомов металлов имеется малое количество электронов и избыток свободных орбиталей. Следовательно, при сообщении небольшой энергии валентные электроны могут занимать не только «свои», но и соседние орбитали, расположенные несколько выше по энергии и дальше от ядра. При сближении атомов в результате образования кристаллической решетки валентные орбитали соседних атомов перекрываются, вследствие чего электроны свободно перемещаются с орбитали одного атома на орбиталь другого, осуществляя связь между всеми атомами кристалла.
При этом атом металла превращается в положительно заряженный ион, но другой электрон, подходя к иону, может образовывать с ним на мгновение атом. Если рядом с ним в этот момент окажется другой атом, то между этими атомами на некоторое время может образовываться обычная ковалентная связь (неполярная ).
Таким образом, в кристалле металла между атомами возникает ковалентная неполярная связь, перемещающаяся по объему металла, а между ионами металла и электронами – ионная связь, т.е. связь в металлах представляет собой нечто промежуточное между ионной и ковалентной связью. Кристалл металла можно представить как сочетание атомов и ионов металла, в промежутках между которыми перемещаются электроны, получившие название «электронного газа». Следует отметить, что поведение этих электронов практически полностью подчиняется законам, выведенным для идеальных газов.
Таки образом, металлическая связь – это многоцентровая химии-ческая связь с дефицитом электронов, основанная на обобществлении валентных электронов атомов металлов в твердом и жидком состоянии .
Металлическая связь характерна только для конденсированного состояния вещества и представляет собой не связь между отдельными частицами, а связь целых агрегатов частиц. Прочность такой связи значительно выше, чем прочность связи в двухатомных молекулах металлов в парообразном состоянии (так, для лития соответственно 317 и 108 кДж/моль). По мере увеличения числа валентных электронов прочность металлической связи увеличивается.
Следует отметить, что метод валентных связей не может интерпретировать полностью металлическую связь: в металлах наблю-дается недостаток валентных электронов по сравнению с числом меж-атомных связей. Отсюда и интерметаллические соединения, как правило, не подчиняются законам классической ковалентности, а на основании положения в периодической системе невозможно предсказать истинный состав интерметаллидов.
- Численность последователей основных религий и неверующих
- Абсолютные и относительные координаты Что называется абсолютными координатами точек
- Какие меры относились к политике военного коммунизма
- Лунин, михаил сергеевич Лунин Николай Иванович: витамины
- Скончался академик борис сергеевич соколов Соколов, Борис Сергеевич Информацию О
- Рецепты варенья из кабачков с лимоном, с курагой и в ананасовом соке
- Как приготовить вкусные куриные сердечки с картофелем в мультиварке Куриные сердечки рецепт в мультиварке с картофелем

 Live Journal
Live Journal Facebook
Facebook Twitter
Twitter