Молекулярная химия
Cтраница 1
Химические свойства молекул резко меняются при преобразованиях их структуры. Примером могут служить даже простейшие соединения. Так, газ метан (СИ4), соединяясь всего лишь с одним атомом кислорода, превращается в ядовитую жидкость метанол, или метиловый спирт (СН3ОН), и химическая комплементарность его, так же как и действие на живые организмы, становится иной. Аналогичные, хотя и более сложные, изменения происходят и при модификациях структуры биомолекул.
Химические свойства молекул определяются главным образом электронами валентной оболочки. В основном состоянии эти электроны, как правило, спарены, поэтому при сближении двух молекул их взаимная потенциальная энергия возрастает вследствие отталкивания электронов. Если молекула возбуждена и электроны не спарены, любая посторонняя система с неспаренными электронами может вступить во взаимодействие с ней, как только начнут перекрываться волновые функции неспаренных электронов. Кроме того, возбужденный электрон обычно находится на орбитали, энергия которой выше уровня невозбужденного электрона, и поэтому менее прочно связан с ядром молекулы, благодаря чему его легче оторвать от молекулы электрофильным реагентом. Возбужденные электроны занимают, как правило, разрыхляющие орбитали. Следовательно, атомы в возбужденной молекуле связаны менее прочно, чем в невозбужденной, и при различного типа столкновениях возбужденные молекулы легче разрушаются.
Химические свойства молекул определяются валентными электронами, число которых, особенно в случае молекул, содержащих атомы тяжелых элементов, составляют лишь небольшую долю общего числа электронов системы. Поэтому желательно задачу расчета молекулы сформулировать так, чтобы в ней рассматривалась только система валентных электронов. Трудность состоит в том, что надо учитывать не только поле (кулоновское и обменное), создаваемое электронами внутренних оболочек, но и требование ортогональности (в общем случае линейной независимости) орбиталей валентных и внутренних оболочек.
Химические свойства молекул почти так же сильно зависят от геометрии молекулы, как и от энергии связей в ней. Особенно это относится к биологически активным соединениям. Какая из конкурирующих реакций окажется преобладающей, зачастую полностью определяется пространственными факторами, которые в свою очередь зависят от конфигурации исходных молекул. Молекула с неудобной конфигурацией может вообще не вступать в реакцию, тогда как другая молекула, того же химического состава, но с иной гео: метрией, может прореагировать мгновенно. Многие биологические процессы, которые наблюдаются при росте и размножении, связаны с геометрическими соотношениями ключа и замка между исходными веществами и продуктами реакции. Более того, действие многих новых лекарств основано на том, что по строению молекул они аналогичны молекулам какого-нибудь соединения, вредного для организма человека с биологической точки зрения. Такое лекарство занимает место молекулы-обидчика и затрудняет ее действие.
Химические свойства молекул определяются не только заселенностью внешних энергетических уровней, позволяющей выделять среди молекул их наиболее реакционноспособные образования - радикалы. На химические свойства большое влияние оказывают характеристики электронного строения. С другой стороны, реагент свои электроны может разместить, в первую очередь, на НСМО молекулы, как самой энергетически выгодной из незанятых орбиталей. Поэтому последние вещества химически более активны, чем N2 и СО.
Ныне химические свойства молекулы определяются ее составом и химическим строением.
Хотя химические свойства молекул, содержащих различные, изотопы разделяемого элемента, практически одинаковы, тем не менее возбуждение молекул может привести к заметным изменениям их химических свойств. Существует большое разнообразие схем, пригодных для разделения изотопов урана, основанных на селективном действии лазерного излучения. Использование в фотохимических процессах лазеров принесло с собой новые приемы и методы, которые дополнили обширный экспериментальный и теоретический материал, накопленный при работе с традиционными источниками. Различают два основных направления протекания фотохимических реакций при лазерном воздействии на молекулы. Одно из них - фотодиссоциация, происходящая, если изолированная молекула поглощает достаточное для разрыва химической связи количество лазерной энергии; в фотодиссоциацин участвует только та молекула, которая поглощает лазерное излучение. Второе направление может быть названо лазерным стимулированием химических реакций с участием двух молекул, когда молекула, поглотившая лазерную энергию, вступает в химические реакции с другими молекулами. Для всех химических процессов характерна конкуренция между равновесным и неравновесным направлениями протекания химический реакций.
Важнейшим фактором, определяющим химические свойства молекулы, является распределение в ней электронной плотности. Характер распределения зависит от взаимного влияния атомов.
Замещающие группы значительно влияют на химические свойства пуриновой молекулы; так, мочевая кислота легко и с количественным выходом превращается в ксантин под влиянием формамида (см. стр.
Действительно, как хорошо известно, химические свойства молекулы не становятся более сложными при простом увеличении числа электронов молекулы; далее, в каждой сложной молекуле существуют автономные внутренние оболочки, содержащие большинство ее электронов, причем на эти последние электроны приходится большая часть энергии молекулы, хотя сами оболочки не испытывают значительных изменений при химических реакциях; существуют также химические связи, описываемые локализованными парами электронов, причем эти связи, как известно, типичны для пар химических элементов, и они в существенно меньшей степени зависят от конкретного их окружения в молекуле, в котором они оказываются. Поэтому можно сказать, что в теории разделение большой системы на малые подсистемы с последующим введением корреляционных поправок, очевидно, позволит плодотворно соединить физическую интуицию, элегантные математические методы и практические вычислительные методы.
Короче говоря, энергии диссоциации связи - химические свойства молекул, которые можно измерить и которые можно надеяться вычислить теоретически. Энергии же связей - искусственные построения, которые вводятся как часть модели локализованных связей, цель которой состоит в том, чтобы помочь нам при расчете химических свойств молекулы. Понятно, что ни одна из этих величин не может заменить другую.
Эта интерпретация основывается на положении, что химические свойства молекулы зависят от строения ее внешней электронной оболочки.
В настоящее время все разделяют убеждение, что химические свойства молекулы больше всего определяются природой составляющих ее атомов и порядком их взаимосвязи - химическим строением молекулы. Мне кажется не менее обоснованным и допущение, что при различиях в геометрическом расположении химически структурно-идентичных молекул, могут возникнуть некоторые различия в их форме и величине, а как следствие должны появиться прежде всего различия в физических свойствах.
Конечно, проблема сопоставления свойств волновой функции с чисто химическими свойствами молекулы не характерна именно для методов ССП; она относится в большей или меньшей степени ко всем типам волновых функций.
Все эти новые представления основаны на том, что химические свойства молекул связаны со строением ее внешней электронной оболочки. В настоящее время электронную оболочку характеризуют плотностью ее заряда; эта плотность способна к перераспределению под влиянием разных факторов.
МОЛЕКУЛ СТРОЕНИЕ (молекулярная структура), взаимное расположение атомов в молекулах. В ходе химических реакций происходит перегруппировка атомов в молекулах реагентов и образуются новые соединения. Поэтому одна из фундаментальных химических проблем состоит в выяснении расположения атомов в исходных соединениях и характера изменений при образовании из них других соединений.
Первые представления о структуре молекул основывались на анализе химического поведения вещества. Эти представления усложнялись по мере накопления знаний о химических свойствах веществ. Применение основных законов химии позволяло определить число и тип атомов, из которых состоит молекула данного соединения; эта информация содержится в химической формуле. Со временем химики осознали, что одной химической формулы недостаточно для точной характеристики молекулы, поскольку существуют молекулы-изомеры, имеющие одинаковые химические формулы, но разные свойства. Этот факт навел ученых на мысль, что атомы в молекуле должны иметь определенную топологию, стабилизируемую связями между ними. Впервые эту идею высказал в 1858 немецкий химик Ф.Кекуле. Согласно его представлениям, молекулу можно изобразить с помощью структурной формулы, в которой указаны не только сами атомы, но и связи между ними. Межатомные связи должны также соответствовать пространственному расположению атомов. Этапы развития представлений о строении молекулы метана отражены на рис. 1. Современным данным отвечает структура г : молекула имеет форму правильного тетраэдра, в центре которого находится атом углерода, а в вершинах - атомы водорода.
Подобные исследования, однако, ничего не говорили о размерах молекул. Эта информация стала доступна лишь с разработкой соответствующих физических методов. Наиболее важным из них оказалась рентгеновская дифракция. Из картин рассеяния рентгеновских лучей на кристаллах появилась возможность определять точное положение атомов в кристалле, а для молекулярных кристаллов удалось локализовать атомы в отдельной молекуле. Среди других методов можно отметить дифракцию электронов при прохождении их через газы или пары и анализ вращательных спектров молекул.
Вся эта информация дает только общее представление о структуре молекулы. Природу химических связей позволяет исследовать современная квантовая теория. И хотя с достаточно высокой точностью молекулярную структуру рассчитать пока не удается, все известные данные о химических связях можно объяснить. Было даже предсказано существование новых типов химических связей.
Простая ковалентная связь.
Молекула водорода Н 2 состоит из двух идентичных атомов. По данным физических измерений длина связи - расстояние между ядрами атомов водорода (протонами) - составляет 0,70 Å (1 Å = 10 -8 см), что отвечает радиусу атома водорода в основном состоянии, т.е. в состоянии с минимальной энергией. Образование связи между атомами можно объяснить лишь в предположении, что их электроны локализуются в основном между ядрами, образуя облако отрицательно заряженных связывающих частиц и удерживая вместе положительно заряженные протоны.
Рассмотрим два водородных атома в основном состоянии, т.е. состоянии, в котором их электроны находятся на 1s -орбитали. Каждый из этих электронов можно рассматривать как волну, а орбиталь - как стоячую волну. При сближении атомов орбитали начинают перекрываться (рис. 2), и, как в случае обычных волн, возникает интерференция - наложение волн (волновых функций) в области перекрывания. Если знаки волновых функций противоположны, то при интерференции волны уничтожают друг друга (деструктивная интерференция), а если одинаковы, то происходит их сложение (конструктивная интерференция). При сближении атомов водорода возможны два исхода в зависимости от того, находятся ли волновые функции в фазе (рис. 2,а ) или в противофазе (рис. 2,б ). В первом случае произойдет конструктивная интерференция, во втором - деструктивная, при этом появятся две молекулярные орбитали; для одной из них характерна высокая плотность в области между ядрами (рис. 2,в ), для другой - низкая (рис. 2,г ) - фактически узел с нулевой амплитудой, разделяющей ядра.
Таким образом, при сближении атомов водорода и их взаимодействии 1s -орбитали образуют две молекулярные орбитали, а два электрона должны заполнить какую-то одну из них. Электроны в атомах всегда стремятся занять наиболее устойчивое положение - то, в котором их энергия минимальна. Для орбитали, показанной на рис. 2,в , характерна высокая плотность в области между ядрами, и каждый электрон, занявший эту орбиталь, будет бóльшую часть времени находиться вблизи положительно заряженных ядер, т.е. его потенциальная энергия будет мала. Напротив, у орбитали, показанной на рис. 2,г , максимальная плотность имеет место в областях, расположенных слева и справа от ядер, и энергия электронов, находящихся на этой орбитали, будет велика. Итак, электроны обладают меньшей энергией, когда они занимают орбиталь в , причем эта энергия даже меньше той, которая была бы у них при бесконечном удалении атомов друг от друга. Поскольку в данном случае имеются только два электрона, оба они могут занимать более выгодную с энергетической точки зрения орбиталь, если их спины антипараллельны (принцип Паули). Поэтому энергия системы, состоящей из двух атомов водорода, при сближении атомов уменьшается, и чтобы затем удалить атомы друг от друга, потребуется энергия, равная энергии образования стабильной молекулы водорода Н 2 . Заметим, что необходимым условием существования молекулы водорода является преимущественная локализация электронов между ядрами в соответствии с тем, что мы уже говорили выше. Молекулярную орбиталь в называют связывающей, а орбиталь г - разрыхляющей.
Для поступающих в вузы химического профиля
При изучении предмета «химия»
сведениям о собственно химических превращениях
предшествуют данные о составе и строении
вещества, его физических свойствах.
Эту науку иногда называют молекулярной химией.
Вообще индивидуальные особенности вещества (свойства), позволяющие распознать его и отличить от других веществ, разделяют на две группы. Одну из них представляют химические свойства вещества, обусловливающие его способность превращаться в другие, новые вещества. В нашей статье будут затронуты физические свойства вещества, не связанные с изменением его химической природы.
К физическим свойствам
вещества относятся:
а) агрегатное состояние (газ, жидкость, твердое
тело) при нормальных условиях (0 °С, 1 атм); б)
цвет; в) запах; г) плотность; д) температуры
плавления и кипения; е) тепло- и
электропроводность; ж) растворимость в воде и
других растворителях. Именно физические
свойства являются главным стержнем новой
области знаний, получившей название
«супрамолекулярная химия» (см.: Пожарский А.Ф.
Соросовский образовательный журнал, 1997, № 9, с.
32–39).
Если классическая химия имеет дело главным образом с реакциями, в которых происходят разрыв и образование валентных связей, то объектом изучения супрамолекулярной химии (или химии межмолекулярных связей) служат невалентные взаимодействия: водородная связь, электростатические взаимодействия, структуры «без связи». Сочетание известной прочности 1 и способности к быстрым и обратимым изменениям – характерное свойство всех биологических молекулярных структур: нуклеиновых кислот, белков, ферментов, переносчиков частиц.
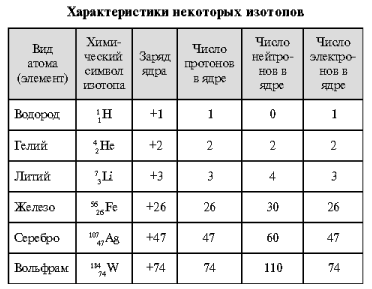
Все вещества состоят из атомов, молекул или ионов. Определим каждое из этих понятий. Атомами называют мельчайшие частицы вещества, характеризующиеся следующим строением: положительно заряженное ядро (плотное, тяжелое) и отрицательно заряженная электронная оболочка (рыхлая, легкая). Разновидности атомов (~100) отличаются друг от друга зарядом ядра. Единицу положительного заряда несет элементарная частица протон р (заряд +1). Число протонов у атомов различных видов разное. Число протонов определяет заряд ядра Z . Это число равно атомному номеру химического элемента в периодической системе.
Кроме протонов в состав ядра входят нейтральные элементарные частицы нейтроны n (заряд 0). По массе они примерно такие же, как протоны: m (n ) » m (p ) » 1 а. е. м. (атомная единица массы). Общее число протонов и нейтронов в ядре показывает массовое число А . Величина А обычно близка к целочисленному значению атомной массы элемента. Число нейтронов (N ) в ядре атома определяется путем вычитания из массового числа А числа протонов, равного заряду ядра Z : N = A – Z .
Атомы одного вида, ядра которых содержат одинаковое число протонов и разное число нейтронов, называют изотопами . Каждый элемент может иметь несколько изотопов. При обозначении изотопа вверху слева от символа элемента указывают его массовое число, а внизу слева – атомный номер. Например, у атома магния с порядковым (атомным) номером 12 есть три стабильных изотопа:
Единицей отрицательного заряда служит электрон е (заряд –1). Атом является электроотрицательной частицей: заряды ядра и электронной оболочки равны по величине и противоположны по знаку. В табл. 1 представлены количественные характеристики шести изотопов химических элементов.
Таблица 1

Благодаря химической связи из атомов образуются более сложные частицы – молекулы. Молекулой называют группу атомов (два или более) простого или сложного вещества, внутри которой связи между атомами значительно прочнее, чем связи между разными молекулами. Например, в молекулах простых веществ кислорода О 2 и азота N 2 химическая связь (показана черточками) между парой атомов, составляющих молекулу (О=О и N є N), прочная, а межмолекулярная связь, показанная точками (О=О...О=О...О=О), на несколько порядков слабее. Молекулы, как и атомы, – электронейтральные частицы.
Удаление из атомов одного или нескольких электронов не приводит к образованию атома нового элемента. Так, если из нейтрального атома лития Li, содержащего три электрона, удалить один электрон, то атом элемента лития сохранится, однако заряд его будет +1 (Li +). Заряд +1 возникает за счет того, что в этом случае заряд ядра +3 не будет полностью нейтрализован зарядом –2 оставшихся в атоме двух электронов, т. е. +3 – 2 = +1.
Аналогично, если к нейтральному атому фтора F присоединить один электрон, то образуется не атом нового элемента, а заряженный (заряд –1) атом элемента фтора (F –).
Итак, при удалении из нейтрального атома или присоединении к нему электронов атом приобретает заряд, равный числу перемещенных электронов. Атом, имеющий электрический заряд, называют ионом . Положительные ионы называют катионами , отрицательные – анионами .
Между противоположно заряженными ионами существует притяжение, обусловливающее устойчивость соединения. Связь между ионами Li + и F – называется ионной связью . К числу соединений с ионной связью относят большинство солей (в них металл соединен с кислотным остатком, например NaCl, MgSO 4), оксидов и гидроксидов металлов (BaO, Na 2 O; KOH, Fe(OH) 2).
Вещества молекулярного строения – газы: кислород О 2 , азот N 2 , сероводород H 2 S; жидкости: вода Н 2 О, триоксид серы SO 3 , бром Br 2 ; твердые вещества: нафталин С 10 Н 8 , сахароза C 12 H 22 O 11 , пентахлорид фосфора PCl 5 .
Химическая связь между атомами в молекуле характеризуется такими параметрами, как энергия связи, длина, кратность и полярность связи.
Энергия связи (Е св) – это энергия, необходимая для разрыва данной связи в 1 моль (N A = 6,02 10 23 молекул) вещества. Например, энергия связи между атомами в молекуле хлора Cl 2 для N A молекул равна энергии, затрачиваемой на расщепление 1 моль Cl 2 до атомов хлора:
Кратность связи определяется числом электронных пар, связывающих два атома (в записи на бумаге – числом черточек между атомами). Так, в этане Н 3 С–СН 3 связь между атомами углерода одинарная, в этилене Н 2 С=СН 2 – двойная, в ацетилене НС є СН – тройная. С увеличением кратности связи энергия связи возрастает. Энергии связей С–С, С=С и С є С составляют соответственно 348, 614 и 839 кДж/моль. Энергия одинарной связи О–О в пероксидах типа НО–ОН имеет значение Е св = 146 кДж/моль, а двойной связи О=О в молекулярном кислороде – Е св = 495 кДж/моль.
Длиной связи (l св) называют расстояние между ядрами соединенных атомов. Длины связей в различных соединениях примерно одного порядка и имеют значение десятых долей нанометра (1 нм = 10 –9 м). При увеличении кратности происходит уменьшение длин связей: l св (N–N) = 0,145 нм, l св (N=N) = 0,125 нм и l св (N є N) = 0,109 нм. Длины связей С–С, С=С и С є С равны соответственно 0,154, 0,134 и 0,120 нм.
Полярность связи обусловливается смещением связывающей электронной пары к одному из атомов, в результате чего образуется диполь 2 , который измеряется дипольным моментом (m ) – произведением концевого заряда (q ) на расстояние между зарядами (l ): m = q l . Cледовательно, дипольный момент тем больше, чем больше накапливаемые при разделении заряды и чем больше расстояние между положительным и отрицательным зарядами. Дипольный момент выражают в кулон-метрах (Кл м) или в дебаях (Д) (1 Д = 3,3 10 –30 Кл м). Если отрицательный заряд, равный заряду электрона (1,6 10 –19 Кл), и такой же положительный заряд находятся на расстоянии 0,1 нм, то дипольный момент равен: m = 1,6 10 –19 10 –10 = 1,6 10 –29 Кл м.
Зная дипольный момент молекулы HCl m = 3,44 10 –30 Кл м и межъядерное расстояние l (H–Cl) = 0,127 нм, можно рассчитать, что на атоме водорода имеется положительный заряд, а на атоме хлора – отрицательный, составляющий 0,17 от заряда электрона. Подобный расчет для молекулы KCl дает значения зарядов на атомах калия и хлора по 0,83 единицы заряда.
Приведем дипольные моменты некоторых химических связей (табл. 2).
Таблица 2

В этих примерах водород и углерод являются положительными концами диполей. У связи Н–С отрицательным полюсом диполя является углерод.
Дипольный момент молекулы, содержащей более двух атомов, зависит как от полярности связей, так и от молекулярной геометрии. Многоатомная молекула может иметь дипольный момент только в том случае, если ее связи полярны. Однако даже при наличии полярных связей молекула как целое может не иметь дипольного момента, если связи направлены так, что их полярности взаимно компенсируются. Это наблюдается в случае линейной молекулы СО 2:
Здесь стрелки указывают направление дипольного момента в сторону более электроотрицательного атома. Приведем ряд электроотрицательности 3 отдельных элементов (табл. 3).
Таблица 3
![]()
Поскольку кислород более электроотрицателен, чем углерод, связи в молекуле СО 2 оказываются полярными с повышенной концентрацией электронной плотности на атомах кислорода. Однако центры отрицательного и положительного зарядов совмещены в одной точке на атоме углерода, поэтому молекула в целом не имеет результирующего дипольного момента.
Другими примерами неполярных молекул, каждая из которых имеет полярные связи, являются трифторид бора ВF 3 , тетрахлорид углерода ССl 4 , гексафторид серы SF 6:

Симметричное расположение связей в неполярных молекулах служит причиной отсутствия у них положительно и отрицательно заряженных сторон.
- Задача
. Какие из
предложенных соединений имеют дипольный момент?
Если молекула обладает дипольным моментом,
укажите его направление:
а) NH 3 ; б) H 2 O; в) CH 4 ; г) CH 3 Cl; д) CH 2 Cl 2 ; е) CH 2 O; ж) HCN.
Решение
Согласно теории отталкивания валентных электронных пар, как связывающие электронные пары, так и свободные (типа обозначенных точками в молекулах аммиака Н 3 и воды Н 2:), принадлежащие одному атому, располагаются в пространстве как можно дальше друг от друга.
а) Аммиак представляет собой тригональную пирамидальную молекулу с неподеленной электронной парой в вершине пирамиды:

б) Молекула воды Н 2 О имеет уголковую структуру:

Молекулы NH 3 , H 2 O, CH 4 , CH 3 Cl и CH 2 Cl 2 имеют четыре валентные электронные пары вокруг центрального атома. Это определяет пространственную ориентацию присоединенных к центральному атому краевых атомов. У пяти названных соединений примерно тетраэдрическое расположение электронных пар.
в) Для молекулы метана СН 4 при соединении атомов водорода линиями получаем правильный тетраэдр с углеродом в центре:

г) В молекуле хлорметана СН 3 Сl дипольный момент направлен вдоль связи С–Сl. В этом диполе частичный отрицательный заряд находится на хлоре, а углерод и атомы водорода являются положительным концом диполя:
д) В молекуле дихлорметана CH 2 Cl 2 вклад дипольных моментов отдельных связей выглядит следующим образом:

Диполи связей C–H усиливают дипольный момент связей С–Сl в CH 2 Cl 2 .
е) Учитывая отталкивание валентных электронных пар, можно предположить, что валентные углы у атома С в формальдегиде СН 2 О будут равны ~120° (плоская тригональная структура, как у BF 3). Однако распределение заряда в СН 2 О асимметрично. Дипольный момент направлен по биссектрисе угла с отрицательным концом диполя на кислороде:
ж) В молекуле цианистого водорода Н–С є N имеется тройная связь. Поэтому все валентные электроны углерода участвуют в образовании химических связей. Строение молекулы линейное, таким образом достигается максимальное удаление электронов одинарной связи Н–С от электронов тройной связи C є N.
Дипольный момент направлен вдоль оси с частичным отрицательным зарядом на азоте.
Физические свойства органических веществ
Органической называют химию соединений углерода. При этом карбонаты металлов (Na 2 CO 3 , FeCO 3 , CaCO 3) и карбиды (СаС 2 , Al 4 C 3) обычно изучают в неорганической химии.
Под физическими свойствами вещества понимают его температуры кипения (t кип) и плавления (t пл), растворимость в воде. Эти характеристики напрямую связаны с величиной дипольного момента m .
При определенных условиях большинство веществ способно существовать в любом из трех агрегатных состояний: в твердом, жидком или газообразном. В газах молекулы находятся далеко друг от друга и не оказывают значительного взаимного влияния. Разнообразие физических свойств жидких и твердых веществ определяется главным образом действующими внутри них межмолекулярными силами притяжения, благодаря которым молекулы удерживаются возле друг друга. Рассмотрим взаимосвязь между строением вещества, действующими в нем межмолекулярными силами и его физическими свойствами.
Все межмолекулярные силы имеют электростатическую природу. Они подчиняются закону Кулона, согласно которому разноименные заряды притягиваются, а одноименные отталкиваются. В простейшем случае сила притяжения или отталкивания (F ) прямо пропорциональна произведению модулей зарядов (q 1 и q 2) и обратно пропорциональна квадрату расстояния (r ) между ними:
F = k (|q 1 ||q 2 |)/r 2 , где k – коэффициент пропорциональности.
Силы взаимодействия между нейтральными молекулами обычно намного меньше сил, удерживающих атомы в молекуле. Например, для испарения 1 моль жидкого HCl требуется 16 кДж теплоты, а для диссоциации того же количества HCl на атомы Н и Cl – уже 431 кДж.
Остановимся на двух типах межмолекулярных сил, характерных для органических веществ: диполь-дипольном взаимодействии и дисперсионном (наведенный диполь – наведенный диполь) взаимодействии.
Диполь-дипольные силы действуют между полярными молекулами.
Типы ориентации диполей:
(Стрелками показано направление действия сил.)
Температура кипения органических жидкостей повышается по мере возрастания молекулярного дипольного момента (табл. 4). Энергия притяжения (Е ) между дипольными молекулами подчиняется зависимости:
Е = m 4 /d 6 , где m – дипольный момент; d – расстояние между центрами диполей.
Таблица 4
Молекулярные массы, дипольные моменты и температуры кипения органических соединений

Индуцированный (наведенный) диполь возникает в результате неравномерного распределения молекулярных зарядов вследствие каких-то причин (например, случайного смещения электронов в одну сторону от ядра). Этот мгновенный дипольный момент индуцирует (вызывает) аналогичный дипольный момент у соседнего атома, потому что перемещение электронов в соседних атомах отчасти взаимозависимо (из-за взаимного отталкивания).
Схема взаимодействия индуцированных (мгновенных) диполей и электростатического притяжения между атомами:

Дисперсионные силы взаимодействия между двумя молекулами изменяются по закону F » 1/d 6 . Следовательно, эти силы имеют достаточно большую величину лишь при очень близком расположении молекул друг к другу. Величина дисперсионных сил притяжения зависит от способности молекул поляризоваться, т. е. деформировать свое электронное облако. Вообще говоря, чем больше молекула и чем дальше ее валентные электроны располагаются от ядер, тем больше ее поляризуемость. Значит, дисперсионные силы возрастают с увеличением размеров молекул и их молекулярной массы. Определенную роль играет и форма молекул.
Например, неопентан и н -пентан имеют одинаковую молекулярную формулу С 5 Н 12 , однако температура кипения н -пентана (36 °С) выше, чем у неопентана (9,5 °С). Такое различие объясняют разной формой молекул двух веществ:

Молекулы н -пентана сильнее притягиваются друг к другу, потому что обладают большим числом центров взаимодействия (плотная упаковка) и способны вступать в контакт по всей длине молекулы. У молекул неопентана (неплотная упаковка) поверхность возможных контактов гораздо меньше.
Другие примеры различия в физических константах изомеров представлены в табл. 5.
Таблица 5
Температуры кипения и плавления изомеров бутана и гексана

Упражнения
1. Для каждой из следующих молекул, содержащих полярные ковалентные связи, укажите положительный и отрицательный концы диполя (стрелкой ®). Используйте ряд электроотрицательности элементов.
а) HCl; б) IСl; в) HOCl; г) COCl 2 .
2. Какое соединение из каждой пары имеет больший дипольный момент m? Почему?
а) (СН 3) 3 СН и (СН 3) 3 Сl; б) СНСl 3 и ССl 3 F;
в) СН 3 NН 2 и СН 3 OH; г) СН 3 NН 2 и СН 3 NО 2 .
3. Подберите алканы, соответствующие следующим температурам кипения, °С: 106, 116, 126, 151. Алканы: октан СН 3 (СН 2) 6 СН 3 ; 2-метилгептан (СН 3) 2 СН(СН 2) 4 СН 3 ; 2,2,3,3-тетраметилбутан (СН 3) 3 СС(СН 3) 3 ; нонан СН 3 (СН 2) 7 СН 3 .
4. Для трех изомеров гептана состава С 7 Н 16 – н -гептана СН 3 (СН 2) 5 СН 3 , 2-метилгексана (СН 3) 2 СН(СН 2) 3 СН 3 и 2,4-диметилпентана (СН 3) 2 СНСН 2 СН(СН 3) 2 – установите, какому соединению соответствует конкретная температура кипения. Значения t кип этих веществ, °С: 80, 90 и 98.
________________________
1 Энергия невалентных взаимодействий в 10–100 раз меньше энергии валентных связей, но ее бывает достаточно для создания прочных и эластичных ассоциатов.
2 Диполь – это совокупность двух разноименных, но равных по абсолютной величине электрических зарядов, находящихся на некотором расстоянии друг от друга.
3 Электроотрицательностью называют способность атомов в молекуле смещать общую (связывающую) электронную пару.
А.Д.Микитюк
С природными веществами, состоящими из длинных молекул, в которых атомы связаны наподобие звеньев цепочки, химики и технологи имели дело давно. За примерами далеко ходить не надо: столь распространенные вещества, как каучук, целлюлоза, белок представляют собой цепочечные молекулы, состоящие из многих тысяч атомов. Структурные представления о таких молекулах возникли и развились в двадцатых годах, когда химики научились готовить их в лаборатории.
Одним из первых шагов в получении веществ, построенных из длинных молекул, было создание искусственного каучука. Эта великолепная работа была выполнена в 1926 г. советским химиком Сергеем Васильевичем Лебедевым. Задача получения каучука, который был остро необходим для изготовления автомобильных шин (резина ведь готовится из каучука), была продиктована тем, что природного каучука в Союзе не имеется.
В бразильских джунглях растет дерево гевея, источающее латекс - млечный сок, взвесь каучука. Индейцы делали из каучука мячи, пользовались им для создания обуви. Но в 1839 г. европейцы научились вулканизировать каучук. При обработке каучука Серой вместо липкого и текучего каучука получалась эластичная резина.
Сначала ее потребление было небольшим. Сейчас человечеству нужны миллионы тонн каучука в год. Гевея растет только в тропических лесах. Так что, если освобождаться от импорта, то надо готовить каучук на заводах.
Для этого требуется, конечно, знать, что же такое каучук. К началу работ Лебедева химическая формула каучука была известна. Вот она:
Нарисованная здесь цепочка не имеет ни начала, ни конца. Мы видим, что молекулы построены из одинаковых звеньев. Поэтому можно коротко записать формулу каучука в таком виде:

Число n достигает многих тысяч. Длинные молекулы, построенные из повторяющихся звеньев, получили название полимеров.
Теперь в технике и текстильной промышленности имеют широчайшее распространение очень большое число синтетических полимеров. К ним относятся нейлон, полиэтилен, капрон, полипропилен, полихлорвинил и многие другие.
Наиболее просто построена молекула полиэтилена. Мешочки из этого материала лежат теперь в ящиках кухонного стола в каждой квартире. Если предельно вытянуть молекулу полиэтилена, то она будет иметь вид, показанный на рис. 9.1. Как видите, физики сумели определить расстояния между атомами и углы между валентными связями.

Рис. 9.1
Длинные молекулы не обязательно состоят из повторяющихся звеньев, т. е. не могут быть представлены формулой такой, как для каучука. Химики научились "конструировать" молекулы, построенные из двух или более разных звеньев и следующие друг за другом как в порядке, так и в беспорядке. Если эти звенья чередуются в определенном порядке, скажем, по схеме
АВАВАВАВАВ,
то такую молекулу называют регулярным полимером. Но часто мы имеем дело с молекулами, где нет такой закономерности следования. Молекулу
АВВАВАААВВВВАВАВААВВА
называют нерегулярным полимером.
Естественную молекулу белка также называют полимером. Белки построены из 20 кусочков разного сорта. Эти кусочки называются аминокислотными остатками.
Между молекулами белков и синтетическими молекулами, построенными из нескольких кусочков, расположенных в беспорядке, имеется одно существенное различие. В куске синтетического полимера нет двух одинаковых молекул. Беспорядочное следование кусочков, из которых состоит цепочечная молекула, в одной молекуле - одно, а в другой - другое. В большинстве случаев это обстоятельство влияет отрицательно на свойства полимера. Раз молекулы непохожи друг на друга, то они не могут хорошо упаковаться. Из таких молекул в принципе нельзя построить идеальный кристалл. Вещества этого типа характеризуют "степенью кристалличности".
В последние десятилетия химики научились строить регулярные. полимеры, и промышленность получила в свое распоряжение много новых ценных материалов.
Что же касается природных белков определенного сорта (скажем, гемоглобина быка), то их молекулы хоть и построены беспорядочно, но они все одинаковые. Молекулу белка данного сорта можно сравнить со страницей книги: буквы следуют друг за другом в случайном, но вполне определенном порядке. Все молекулы белка - это копии одной и той же страницы.
Гибкость молекул
Длинную молекулу можно сравнить с рельсом. На длине 0,1 мм уместится 10 6 атомов. Поперечные размеры молекулы полиэтилена - что-нибудь около 3-4 A. Так что длина молекулы больше ее поперечного сечения в сотни тысяч раз. Так как рельс имеет толщину около 10 см, то зрительным образом длинной молекулы будет рельс длиной 10 км.
Это не значит, конечно, что не приходиться иметь дело с.короткими молекулами. Вообще, если не принять специальных мер, то в полимерном веществе мы найдем молекулы разной длины - от таких, которые состоят из нескольких звеньев, до таких, которые построены из тысяч звеньев.
Итак, длинная молекула похожа на рельс. Похожа, но не совсем. Рельс согнуть трудно, а длинная молекула гнется легко. Гибкость макромолекулы не похожа на гибкость ивового прута. Она возникает из-за особой способности всех молекул: одна часть молекулы может вращаться около другой части, если они соединены связями, которые химики называют одинарными (одновалентными). Нетрудно сообразить, что благодаря этому свойству полимерные молекулы могут принять самые причудливые формы. На рис. 9.2 показана модель гибкой молекулы в трех положениях. Если молекула плавает в растворе, то она большей частью сворачивается в клубок.

Рис. 9.2
Растяжение резинового шнура происходит благодаря разворотам, молекул. Так что упругость полимеров имеет совсем другую природу, чем упругость металлов. Если растянутый шнур отпустить, то он сократится. Значит, молекула стремится из линейной формы перейти в клубкообразную. В чем причина? Их могут быть две. Во-первых, можно допустить, что состояние клубка энергетически более выгодно; во-вторых, можно предположить, что сворачивание содействует возрастанию энтропии. Итак, какой закон термодинамики командует этим поведением: первый или второй? Надо думать, что оба. Но без сомнения состояние клубка выгодно и с точки зрения энтропии. Ведь чередование атомов молекулы, свернутой в клубок, более беспорядочно, чем в вытянутой молекуле. А мы знаем, что беспорядок и энтропия находятся в близком родстве.
Что же касается выигрыша в энергии, то он происходит за счет плотной упаковки атомов, составляющих полимерную молекулу. Сворачивание молекулы в спираль или клубок происходит таким образом, чтобы было обеспечено максимальное число контактов между валентно не связанными атомами.
Директор-распорядитель клетки
Все живое состоит из клеток. Все клетки имеют ядра. Во всех ядрах имеются особые полимерные молекулы, которые можно было бы назвать "ядерными". Но русское прилагательное не в ходу. Эти молекулы носят название нуклеиновых кислот. Среди них есть знаменитости. Знаменитые нуклеиновые кислоты настолько хорошо известны, что их сокращенные трехбуквенные символы РНК (рибонуклеиновая кислота) ДНК (дезоксирибонуклеиновая кислота) можно встретить на страницах романов и повестей.
Суперзвездой среди макромолекул является молекула ДНК. Причина тому следующая: эта полимерная молекула отвечает за рост организма, ибо - правда с помощью молекул РНК - фабрикует белки; молекула ДНК несет в себе кодовую запись признаков, однозначно характеризующих организм. Иными словами, ДНК ответственна за передачу наследственности от родителей к потомкам.
Что же собой представляют молекулы этих полимеров? Упорядочены ли звенья, составляющие молекулу, или расположены в беспорядке? Дело обстоит следующим образом. Одиночная молекула ДНК представляет собой цепь, хребет которой имеет одну и ту же структуру для молекул ДНК разных организмов. К хребту цепи присоединены четыре разных молекулы. Две из них побольше размером, две другие в два раза меньше. Атомы, составляющие основную цепь молекулы, расположены упорядочено, а вот "листочки", присоединенные к ветке, следуют друг за другом без всякого порядка. Однако замечательным и важнейшим обстоятельством является то, что все молекулы ДНК одного индивидуума тождественны и непохожи (в отношении следования "листочков") на молекулы другой особи даже того же вида.
Именно из-за различия в молекулах ДНК отличаются друг от друга все люди, все львы, все березы. Отличаются не только по этой причине, но главным образом именно из-за того, что "листочки" следуют друг за другом в разном порядке.
Одиночная молекула ДНК представляет собой спираль. Но в ядрах клетки эти молекулы сплетаются попарно в двойную спираль. Атомы двойной спирали плотно упакованы и образуют очень длинную жесткую молекулу, которая пересекает все поле зрения электронного микроскопа.
Определение структуры молекулы ДНК было произведено на основании химических сведений о нуклеиновых кислотах, знания правил сворачивания и упаковки молекул, которые требуют создания как можно более плотной упаковки атомов, а также результатов рентгеноструктурного анализа.
То, что молекула ДНК образует двойную спираль, позволило сразу же предложить гипотезу о передаче наследственности. При делении клеток молекулы ДНК "родителей" разворачиваются и новая молекула ДНК "наследника" строится из отрезков двух разных молекул ДНК "отца" и "матери". Эти отрезки молекул ДНК и играют роль генов, в существовании которых многие биологи были уверены еще задолго до того, когда стала ясной молекулярная структура носителей наследственности.
Работа молекулы ДНК - директора-распорядителя жизненных процессов - в настоящее время известна во всея деталях и описана в сотнях иаучных, научно-популярных и учебных книг.
Глобулярные кристаллы
Способность сворачиваться в клубок, или, как часто говорят, в глобулу, свойственна многим молекулам. Очень аккуратные и вполне тождественные друг другу глобулы создают молекулы белка. Тут есть одна тонкая причина. Дело в том, что молекула белка содержит части, которые "любят" воду, и такие кусочки, которые относятся к воде отрицательно. Кусочки, не любящие воду, называют гидрофобными. Сворачивание молекулы белка диктуется одним стремлением: все гидрофобные части должны спрятаться внутрь глобулы. Именно это и приводит к тому, что в растворе белка плавают глобулы, похожие друг на друга, как близнецы. Белковые глобулы более или менее шарообразны. Глобула имеет размер 100-300 A, так что увидеть ее в электронный микроскоп совсем нетрудно. Первые электронно-микроскопические картинки глобулярных кристаллов были получены несколько десятков лет тому назад, когда техника электронной микроскопии была еще совсем слабой. На рис. 9.3 приведена такая фотография для вируса табачной мозаики. Вирус посложнее белка, но для иллюстрации нашей мысли - стремления биологических глобул расположиться о высоким порядком - этот пример вполне подходит.

Рис. 9.3
Но почему авторы не приводят картины белкового кристалла? Дело вот в чем. Белковые кристаллы являются кристаллами совершенно необычными. Они содержат огромный процент воды (иногда до 90%). Это делает их съемку в электронном микроскопе невозможной. Исследование белковых кристаллов можно производить, лишь манипулируя ими в растворе. Тонюсенькая колбочка содержит раствор и монокристалл белка. Этот объект можно изучать всеми физическими методами, в том числе и с помощью рентгеноструктурного анализа, о котором мы уже неоднократно упоминали.
Несмотря на огромное количество воды - самой обыкновенной воды, ничуть не отличающейся от водопроводной,-глобулярные молекулы белков расположены в совершенно строгом порядке. Их ориентация к осям кристалла одинакова для всех молекул. А то, что сами молекулы тождественны, мы уже сказали выше. Этот превосходный порядок позволяет определить структуру белковой молекулы. Задача эта очень нелегкая, и исследователь Перутц, который еще в начале шестидесятых годов первый в мире определил структуру белка (это был гемоглобин), получил за свою работу Нобелевскую премию.
В настоящее время известна структура около сотни белковых молекул. Работа продолжается. Всего в живом организме имеется около десятка тысяч различных белков. От того, как они свернуты и в каком порядке следуют друг за другом разные аминокислотные остатки, зависит деятельность живого организма. Нет сомнения, что работа по определению структуры белковых молекул будет продолжаться до тех пор, пока не будет получена полная ясность в отношении всех десяти тысяч сортов молекул, определяющих жизненные процессы.
На рис. 9.3 мы привели фотографию одного из вирусов. О структуре этой частицы, пожалуй, стоит сказать несколько слов, так как вирусы.- это простейшие "живые" частицы. Они представляют собой комплексы белков и нуклеиновых кислот. Сами же белки и нуклеиновые кислоты относят к биоорганическим молекулам. Назвать эти молекулы "живыми" было бы неверно.
Белок и нуклеиновая кислота комбинируются в вирусе так, чтобы глобулы защищали нуклеиновую кислоту. Эта защита может осуществляться двумя способами. Либо глобулы образуют полый цилиндр, внутрь которого прячется нуклеиновая кислота, либо глобулы составляют полый шар, а нуклеиновая кислота располагается внутри полости.
Каковы размеры вирусов? Вот, скажем, вирус табачной мозаики. Его длина 3000 A, внешний диаметр 170 A, диаметр канала 80 A. В вирус входит 2140 молекул белка.
Поражает исключительная упорядоченность расположения молекул белка, образующих оболочку вируса. Все белковые молекулы свернуты в глобулы абсолютно тождественным образом. Строго закономерна и упаковка глобул.
Сферические вирусы близки к шару по своей форме. Однако на самом деле представляют собой высокосимметричные многогранники, известные геометрам под названием икосаэдров.
Трудно переоценить значение для науки структурных исследований простейших живых веществ для молодой науки - молекулярной биологии.
Пачки молекул
Если молекулы могут хорошо упаковаться, будучи предельно растянуты, то твердый полимерный материал может образовать разные довольно сложные структуры, обладающие, однако, одним общим свойством. В той или иной степени в твердом теле будут присутствовать участки, в которых молекулы примыкают друг к другу, как карандаши в пачке.
В зависимости от того, каков в теле процент таких пачечных участков, а также смотря по тому, сколь аккуратно упакованы молекулы, составляющие пачечный участок, полимер может обладать тем или иным "процентом кристалличности". Большинство полимеров противятся простой классификации твердых тел на аморфные и кристаллические. Удивительного в этом ничего нет, поскольку речь идет об огромных, да ещё вдобавок чаще всего неодинаковых молекулах. Упорядоченные ("кристаллические") участки в полимерах можно грубо разбить на три класса: пачки, сферолиты и кристаллы из складывающихся молекул.
Типичная микроструктура полимера показана на рис. 9.4. Это фотоснимок с увеличением в 400 раз, сделанный с пленки полипропилена. Звездообразные фигурки - это своего рода кристаллиты. Из центра звездочки при охлаждении полимера начался рост сферолита. Затем сферолиты встретились и поэтому не приобрели идеальной сферической формы (если удается наблюдать за ростом отдельного сферолита, то действительно видишь шар, так что название "сферолит" вполне оправдано). Внутри сферолита длинные молекулы уложены достаточно аккуратно. Скорее всего, сферолит можно представить себе как аккуратно сложенный канат. Роль каната играет пачка молекул. Таким образом, своей длинной осью молекулы расположены перпендикулярно к радиусу сферолита. На той же фотографии мы видим пластичные участки. Возможно, это пачки молекул, а может быть, и кристаллы из складывающихся молекул. Существование подобных кристаллов является интересным и достоверным фактом, относящимся к структуре линейных полимеров.

Рис. 9.4
Двадцать лет назад было сделано следующее замечательное открытие. Из раствора были выделены кристаллики различных полимерных веществ. Исследователи были поражены тем, что такие же кристаллики, поверхности которых похожи на спиральную лестницу, вырастали из растворов различных парафинов. В чем же причина этого спирального роста кристаллов, напоминающего результаты труда искусного кондитера (рис. 9.5)?

Рис. 9.5
Говоря о росте кристалла на стр. 99, мы обошли одно обстоятельство. Представим себе, что строящаяся плоскость кристалла заполнена атомами. Тогда не остается мест, которые притягивали бы атомы достаточно сильно. Можно подсчитать, что по такой схеме рост должен идти со скоростями, в немыслимое число раз меньшими, чем скорости роста, наблюдаемые в действительности. Выход из положения дает наличие спиральных дислокаций в кристалле. Если есть спиральная дислокация, то наращивание грани идет таким образом, что ступеньки, на которых атомам выгодно занять место, никогда не зарастут. Физики облегченно вздохнули, когда были обнаружены спиральные дислокации. Им стали понятны величины скоростей роста и стала очевидной суть картинок, подобных приведенной выше для парафина. Такие спиральные пирамидки наблюдаются очень часто, и в том, что они существуют, нет ничего удивительного. Нет удивительного, если речь идет о кристаллах, построенных из малых молекул. Для таких кристаллов объяснение проходит: размер молекулы, высота ступеньки, толщина кристалла - все эти данные не противоречат друг другу.
Но, обнаружив такую же картинку для полимера, мы сталкиваемся с новым явлением. Дело в том, что толщина слоев полиэфира равна 100-120 A, а длина молекулы равна 6000 A. Какой же вывод можно сделать из этих цифр? Да всего лишь один - в этих кристалликах молекулы складываются. Гибкость молекул позволяет им изогнуться без труда, и поэтому остается лишь раздумывать (раздумывание продолжается и до сих пор), какая из трех моделей, показанных на рис. 9.6, лучше. Различие между ними, конечно, второстепенное. Впрочем, специалист обидится. "Как же второстепенное,- скажет он,- на верхнем снимке молекулы загибаются, как попало, минуя ближайших соседей, на второй модели при сворачивании молекула становится соседкой самой себе. Различие между второй и третьей моделью заключается в том, что на среднем рисунке поверхность кристалла более гладкая, чем на нижнем".

Рис. 9.6
Специалист прав: характер укладка полимерных молекул имеет исключительно важное значение и кардинальным образом влияет на свойства вещества. Хотя полиэтилен, нейлон и другие материалы синтезированы впервые несколько десятков лет назад, изучение их надмолекулярной структуры и исследование приемов, заставляющих молекулы упаковываться разным образом, ведется и сейчас многими исследователями.
Мышечное сокращение
Мы закончим разговор о больших молекулах рассмотрением одного из примеров, показывающих, как работают макромолекулы в живом организме.
Биологи считали своей задачей объяснить соответствие формы живых органов - например, формы руки или листа дерева - функциям" этих органов.
Физики, решившие использовать методы исследования строения вещества и законы природы для изучения процессов, протекающих в живых организмах, стремятся понять жизнь на молекулярном уровне. Структура тканей может быть сегодня исследована весьма детально. После установления структуры становится возможным придумать модели биологических событий.
Достаточно существенными являются успехи в создании теории мышечного сокращения. Волокно мышцы состоит из двух типов нитей: тонких и толстых (рис. 9.7, а). Толстые нити состоят из белковых молекул, называемых миозином. Физики установили, что молекула миозина имеет форму палочки, заканчивающейся утолщением. В толстой нити молекулы сходятся хвостами в центре (рис. 9.7, в). Тонкие нити состоят из актина, структура которого напоминает две ниточки бус, которые образуют двойную спираль. Сокращение заключается в том, что толстые нити вдвигаются в тонкие.

Рис. 9.7
Детали этого механизма известны, но мы не можем на них останавливаться. Сигнал к сокращению подается нервным импульсом. Его приход освобождает атомы кальция, которые переходят от одной части нити к другой. В результате молекулы поворачиваются друг к другу так, что становится энергетически выгодным в движение одной гребенки молекул в другую.
Схемы, показанные на рисунке, основываются на электронно-микроскопических снимках. Примерный вид такого снимка показан на рис. 9.7, б. Оригиналы несравненно лучше.
Боюсь, что эта страница дает слабое представление о детальности, с которой изучен механизм мускульного сокращения. Но мы и хотели лишь одного - заинтересовать читателя. Рассматривайте эту последнюю страницу книги, посвященной молекулам, как заявку на детальный разговор о биологической физике, который - мы надеемся- специалист в области молекулярной биофизики поведет в одном из последующих выпусков "Физики для всех".
МОЛЕКУЛА
МОЛЕКУЛА, наименьшая частица вещества, обладающая его основными химическими свойствами. Состоит из атомов, расположенных в пространстве в определенном порядке и соединенных химическими связями. Состав и расположение атомов отражены в химической формуле. Число атомов в молекуле составляет от 2 (H2, O2, HCl) до многих тысяч (например, белки); размеры молекул варьируют от десятых долей до млн. нанометров. По величине молекулярной массы все вещества условно делят на низко- и высокомолекулярные. Вещество в газообразном состоянии состоит, как правило, из отдельных молекул (кроме благородных газов и паров металлов); в большинстве жидкостей отдельные молекулы соединены друг с другом в ассоциаты. Существуют кристаллы, образованные молекулами (нафталин , кристаллы белков, нуклеиновых кислот). Молекулы одного вещества превращаются в молекулы другого вещества в результате химических реакций.
Современная энциклопедия . 2000 .
Синонимы :Смотреть что такое "МОЛЕКУЛА" в других словарях:
молекула - ы, ж. molecule f. Мельчайшая частица вещества, обладающая всеми его химическим свойствами, способная существовать самостоятельно. БАС 1. Молекюль. Веселитский 26. Молекула и молекюль. Михельсон 1865. Молекюла. Так называется безконечная… … Исторический словарь галлицизмов русского языка
- (новолат. molecule, уменьшит. от лат. moles масса), наименьшая ч ца в ва, обладающая его осн. хим. св вами и состоящая из атомов, соединённых между собой химическими связями. Число атомов в М. составляет от двух (Н2, О2, HF, KCl) до сотен и тысяч … Физическая энциклопедия
МОЛЕКУЛА, мельчайшая частица вещества (например, химического соединения), определяющая химические свойства этого вещества. Молекула может состоять из одного атома, но обычно состоит из двух или более атомов, удерживаемых вместе ХИМИЧЕСКИМИ… … Научно-технический энциклопедический словарь
- (уменьшительная форма от лат. moles – масса) наименьшая частица химического соединения; состоит из системы атомов, с помощью химических средств может распадаться на отдельные атомы. Молекулы благородных газов, гелия и т. д. одноатомны; сложнейшие … Философская энциклопедия
Эксимер, генонема, эписома, хромосома, микрочастица, макромолекула Словарь русских синонимов. молекула сущ., кол во синонимов: 10 биомолекула (1) … Словарь синонимов
- (новолат. molecula уменьшит. от лат. moles масса), микрочастица, образованная из атомов и способная к самостоятельному существованию. Имеет постоянный состав входящих в нее атомных ядер и фиксированное Число электронов и обладает совокупностью… … Большой Энциклопедический словарь
МОЛЕКУЛА, молекулы, жен. (от лат. moles масса) (ест.). Мельчайшая частица вещества, способная существовать самостоятельно и обладающая всеми свойствами данного вещества. Молекулы состоят из атомов. Толковый словарь Ушакова. Д.Н. Ушаков. 1935 1940 … Толковый словарь Ушакова
МОЛЕКУЛА, ы, жен. Мельчайшая частица вещества, обладающая всеми его химическими свойствами. М. состоит из атомов. | прил. молекулярный, ая, ое. Молекулярная масса. Толковый словарь Ожегова. С.И. Ожегов, Н.Ю. Шведова. 1949 1992 … Толковый словарь Ожегова
Или частица система или группа атомов … Энциклопедия Брокгауза и Ефрона
- [франц. molecule от лат. moles масса ] наименьшая частица данного вещества, обладающая его основными хим. свойствами, способная к самостоятельному существованию и состоящая из одинаковых или различных атомов, соединенных в одно целое хим. связями … Геологическая энциклопедия
Книги
- Молекула , Джесси Рассел. Эта книга будет изготовлена в соответствии с Вашим заказом по технологии Print-on-Demand. High Quality Content by WIKIPEDIA articles! Моле?кула (новолат. molecula, уменьшительное от лат.…
- Самая главная молекула. От структуры ДНК к биомедицине XXI века , Франк-Каменецкий Максим Д.. Из всего, что нас окружает, самой необъяснимой кажется жизнь. Мы привыкли, что она всегда вокруг нас и в нас самих, и потеряли способность удивляться. Но пойдите в лес, взгляните так, будто…
- Манная каша на молоке: пропорции и рецепты приготовления Манная каша 1 порция
- Суп-пюре из брокколи с сыром Рецепт крем супа из брокколи с сыром
- Гороскоп: характеристика Девы, рождённой в год Петуха
- Причины выброса токсичных веществ Несгораемые углеводороды и сажа
- Современный этап развития человечества
- Лилия яковлевна амарфий Могила лилии амарфий
- Значение имени мариям Имя марьям значение происхождение

 Live Journal
Live Journal Facebook
Facebook Twitter
Twitter