Типы гибридизации примеры. Типы гибридизации атомов орбиталей
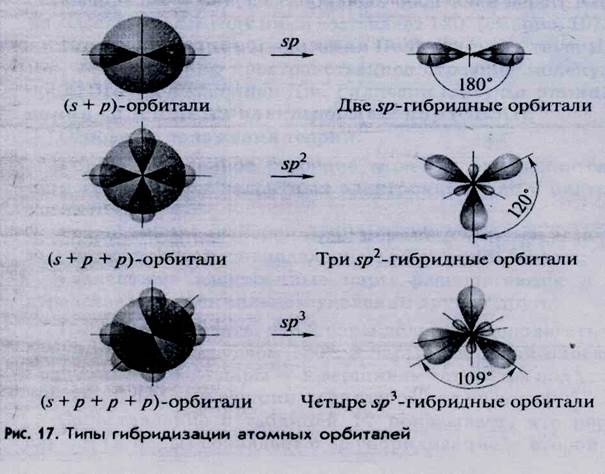
В таблицы 17 и на рисунках 17 и18 приведены наиболее распространенные типы гибридизации атомных орбиталей.

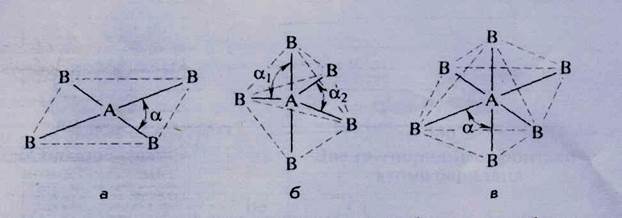
Рис. 18. Геометрическая модель структуры с гибридными орбиталями:
а - 5р 2 с/-гибридизация (плоский квадрат); б - 5р 3 сУ-гибридизация
Линус Полинг впервые разработал теорию состояний гибридизации, чтобы объяснить структуру молекул, таких как метан. 1 Эта концепция была разработана для простых химических систем, но эта более широко применяется позднее и с сегодняшнего дня считается оперативной эмпирикой для извлечения структур органических и неорганических соединений наряду с их связанными проблемами. Инновационный метод, предложенный для определения состояния гибридизации во времени экономического основания 2, 3, 4.
Мы знаем, что гибридизация - это не что иное, как смешение орбиталей в разном соотношении с образованием некоторых недавно синтезированных орбиталей, называемых гибридными орбиталями. Шаблон смешивания выглядит следующим образом. Сила состояния гибридизации центрального атома =.
(тригональная билирамида); в - 5р 3 сР-гибридизация (октаэдр)
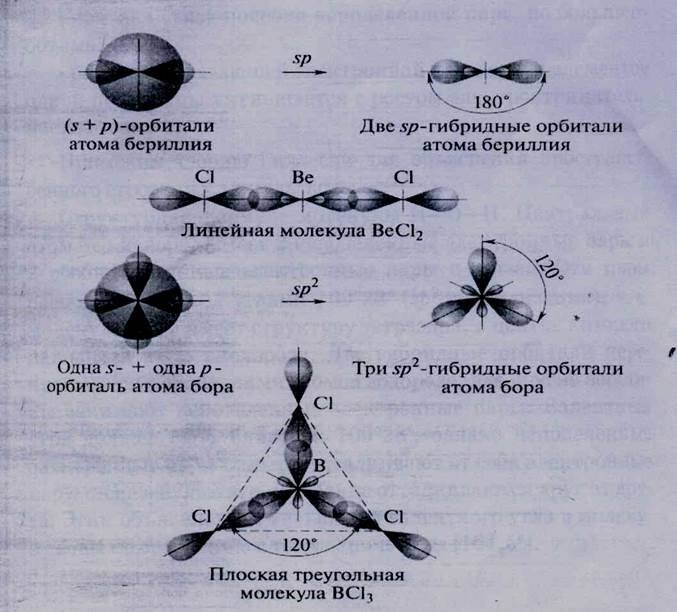
Гибридные орбитали располагаются в пространстве на максимальном удалении друг от друга. Например, в молекуле ВеСI 2 («р-гибридизация орбиталей атома бериллия), образуются две гибридные орбитали, располагающиеся под углом 180°. Максимум электронной плотности располагается в большей половине гантели. Поэтому именно в этой области происходит перекрывание с орбиталями атомов хлора. Соединив отрезками ядра атомов бериллия и хлора, получаем валентный угол, равный 180° (рис. 19). В молекуле BCI 3 (sp 2 - ги б ридизация орбиталей атома бора) оси гибридных орбиталей лежат в одной плоскости, угол между ними составляет 120° (см. рис. 19).
В дополнение к этим каждой одиночной паре и впоследствии можно рассматривать как одну σ-связь. Таким образом, в целом существует 5 σ-связей. Таким образом, в целом есть облигации 05σ. В случае определения состояния гибридизации с использованием вышеуказанного метода необходимо иметь четкое представление о самых внешних электронах разных членов семейства в периодической таблице следующим образом.
Примеры были рассмотрены в таблице. Тип статьи Теги У этой страницы нет тегов. . Лучше написать структурную формулу Льюиса, чтобы получить приблизительное представление о структуре молекулы и схеме склеивания. Используйте концепцию валентности, чтобы достичь этой структуры. Сконцентрируйтесь на электронных парах и других атомах, связанных непосредственно с соответствующим атомом.
· Помимо теории гибридизации Полинга существует и другая, объясняющая пространственное строение молекул теория. Это предложенная Дж. Гиллеспи теория отталкивания валентных электронных пар (ОВЭП).
· Основные положения теории:
· пространственное строение молекул определяется общим количеством валентных электронных пар у центрального атома;
Этот шаг имеет решающее значение, и можно непосредственно получить состояние гибридизации и формы, посмотрев структуру Льюиса после тренировки с несколькими молекулами. Количество σ-связей, образованных атомом в соединении, равно числу других атомов, с которыми оно непосредственно связано.
Количество одиночных пар на данном атоме можно рассчитать, используя следующую формулу. С = заряд на атоме. Примечание: Когда соответствующий атом образует дательную связь с другими атомами, он может получить положительный или отрицательный заряд в зависимости от того, пожертвовал ли он или принял одиночную пару, делая это соответственно.
· валентными электронными парами являются электронные пары 0-связей и неподеленные электронные пары;
· валентные электронные пары располагаются в пространстве на максимальном удалении друг от друга.
Нетрудно показать, что 2 пары должны располагаться на одной прямой иод углом 180°; 3 пары - в одной плоскости под углами 120°; 4 пары - к вершинам тетраэдра под углами 109°28"; 6 пар - к вершинам октаэдра под углами 90°.
Если он жертвует одинокую пару, накапливается положительный заряд. Если он получает одинокую пару, получается отрицательный заряд. Стерическое число = нет. σ-связей нет. одиночных пар. Теперь, исходя из стерического числа, можно получить тип гибридизации атома.
Если стерическое число и число σ-связей равны, то структура и форма молекулы одинаковы. Этот случай возникает, когда на данном центральном атоме нет одиночных пар. Примечание: структура молекулы включает как пары связей, так и одиночные пары. Он всегда поступает из стерического номера. Однако при назначении формы молекулы мы рассматриваем только пространственное расположение пар связей и атомов, связанных с центральным атомом.
Сопоставление с таблицей 17 показывает, что первый случай (2 пары) совпадает с яр гибридизацией, второй случай (3 пары) с а/? 2 -гибридизацией, третий случай (4 пары) с $р 3 ~гибридизацией и четвертый случай (6 пар) - с s гибридизацией. Таким образом, теория Гиллеспи приводит к тем же выводам, что и теория гибридизации Полинга.
Однако Полинг полагал, что в гибридизации могут принимать участие только обобществленные электронные пары. Гиллеспи же считал, что на пространственную структуру молекул влияют и неподеленные электронные пары. Суммируя экспериментальные факты, Гиллеспи сформулировал несколько правил, позволяющих предсказать геометрию молекулы:
Теория связи Валенсии. Два атома, имеющие орбиталь с неспаренным электроном, приближаются до перекрытия или взаимопроникновения этих орбиталей. Затем создается область между ядрами, в которых плотность вероятности нахождения электронов очень велика. Таким образом, два электрона начинают занимать одновременно две атомные орбитали.
Заметим, что в приведенном выше представлении есть только два электрона, а не четыре, как кажется. Эти два электрона находятся в двух орбиталях одновременно. Соединения с другими типами орбиталей также могут иметь место, например, в молекуле фтора. Как и в предыдущем случае, произойдет взаимопроникновение этих орбиталей, образующих область с высокой электронной плотностью между ядрами.
- геометрия молекулы определяется отталкиванием электронных пар в валентной оболочке центрального атома;
- наибольшее место в пространстве занимает неподелен- ная пара;
- кратная связь подобна неподеленной паре, но большего объема;
- размер связывающей электронной пары среди элементов одной подгруппы уменьшается с ростом электроотрицательности атома.
Применим теорию Гиллеспи для объяснения пространственного строения молекулы воды.
На приведенном ниже рисунке связывание молекулы фтора схематично показывает только орбиту, участвующую в связи. В этом случае также произойдет образование области высокой электронной плотности между ядрами. В молекулах, таких как кислород, существует необходимость в двух связях, которые могут быть легко визуализированы с использованием структур Льюиса. В этом случае пересечение орбиты сначала будет происходить с фронтальной точки, а оси будут выровнены, как показано ниже. Поэтому, как и в предыдущих случаях, между ядрами образуется область высокой электронной плотности.
Структурная формула молекулы Н-О-Н. Центральный атом - кислород имеет 2 неподеленные электронные пары и 2 обобществленные электронные пары a-связей. Эти пары располагаются под углами 109°28" (8р 3 -гибридизация), т.е. молекула воды имеет структуру тетраэдра, в центре которого находится атом кислорода. Две гибридные орбитали перекрываются с орбиталями атомов водорода, две другие вершины занимают неподеленные электронные пары. Валентный угол должен быть близок к 109°28", однако неподеленные электронные пары сильнее отталкивают от себя электронные пары о-связей, чем эти последние отталкиваются друг от друга. Этим объясняется уменьшение валентного угла в молекуле воды по сравнению с тетраэдрическим (104,5°).
Вторая связь затем происходит путем перекрытия двух параллельных орбитальных подходов, генерирующих две области с высокой электронной плотностью, выше и ниже оси сцепления. В таких молекулах, как азот, для этого потребуются 3 соединения: один лобный и два боковых. Важно отметить, что, как и в этом случае, все молекулы, содержащие множественные связи между двумя ядрами, будут только первыми.
Теория молекулярных орбиталей. В этой модели считается, что после аппроксимации атомных ядер и перекрытия атомных орбиталей они объединяются, что приводит к образованию молекулярных орбиталей. Для этого расчета возможны два решения в соответствии с приведенными ниже уравнениями. Для лучшей визуализации этого процесса рассмотрим образование молекулы Н2, как показано ниже.
![]()

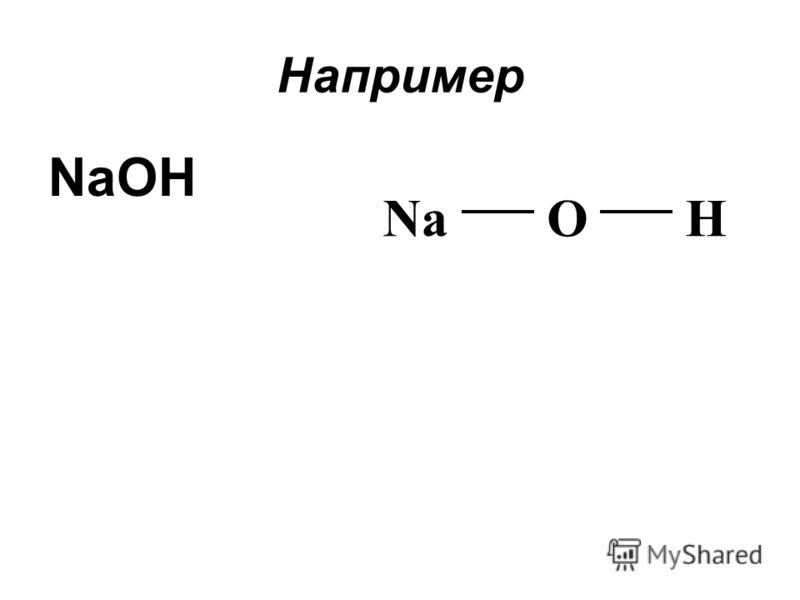
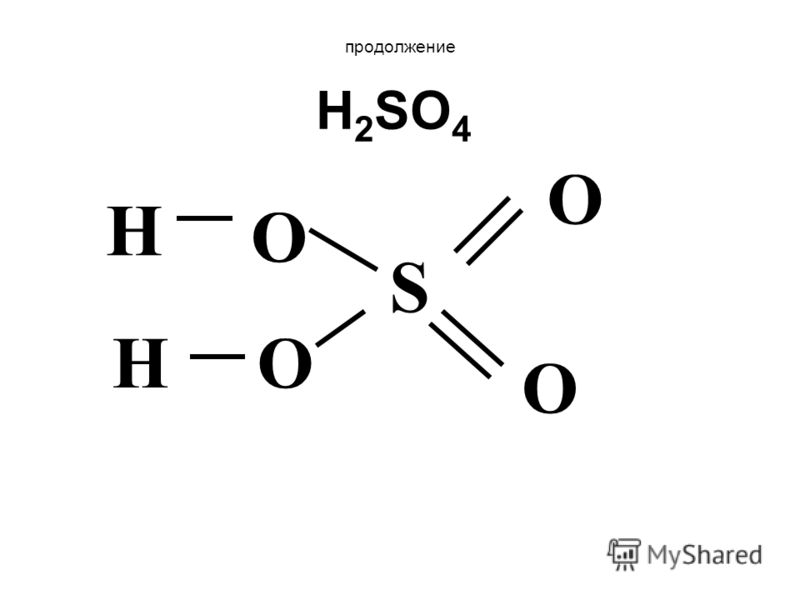
Примеры. Определите тип химической связи между атомами в молекулах веществ: гидроксида натрия, серной кислоты, гидроксида мышьяка, сульфата натрия. Покажите стрелкой к какому элементу смещена электронная пара Какая связь более полярна? Каковы степени окисления атомов элементов?

Для молекул, таких как кислород, где необходимо иметь две связи, два молекулярных орбитальных лиганда и два антилиганта возникли из комбинации четырех атомных орбиталей. В этом случае, это будет происходить первую комбинацию атомных орбиталей р приближающейся фронт, с осями выровненных, что приводит к образованию связывающей орбитали и одну антисвязывающих, после того, как сочетание двух атомных орбиталей приближается в боковом направлении, как показано ниже.
Диаграмма ниже показывает диаграмму молекулярных орбиталей для гомоядерных двухатомных молекул, образованных атомами первого или второго периода. После распределения всех электронов можно вычислить порядок связывания молекулы. Для этого достаточно уменьшить число электронов, занимающих орбитальные лиганды, числом электронов, которые занимают эти антилиганды, и делить число, полученное двумя. Полученное число представляет собой число связей между двумя атомами.
Алгоритм выполнения 1.Изобразить графическую формулу. 2. Под каждым элементом проставить значение электроотрицательности из таблицы. 3. Стрелкой показать смещение электронной плотности. 4. Рассчитать разность относительных электроотрицательностей и указать тип связи (ионная, КП, КНП) 5. По направлению и количеству смещений электронной плотности определить степени окисления атомов элементов.

Рассмотрим, например, образование молекулы кислорода. Каждый атом имеет восемь электронов, всего на шестнадцать. Эти электроны должны быть распределены на диаграмме, как показано на втором рисунке выше. Можно заметить, что десять электронов занимают орбитали лиганда и шесть антилигандных орбиталей.
Углеродный атом находится в очень большом количестве соединений в природе, образующих четыре ковалентные связи. Возьмем, к примеру, молекулу метана, где углерод связан с четырьмя атомами водорода. Электронное распределение углерода. Затем структура Льюиса метана показана на рисунке ниже. Если бы эта модель была правильной, то эта молекула должна иметь два разных типа связей.
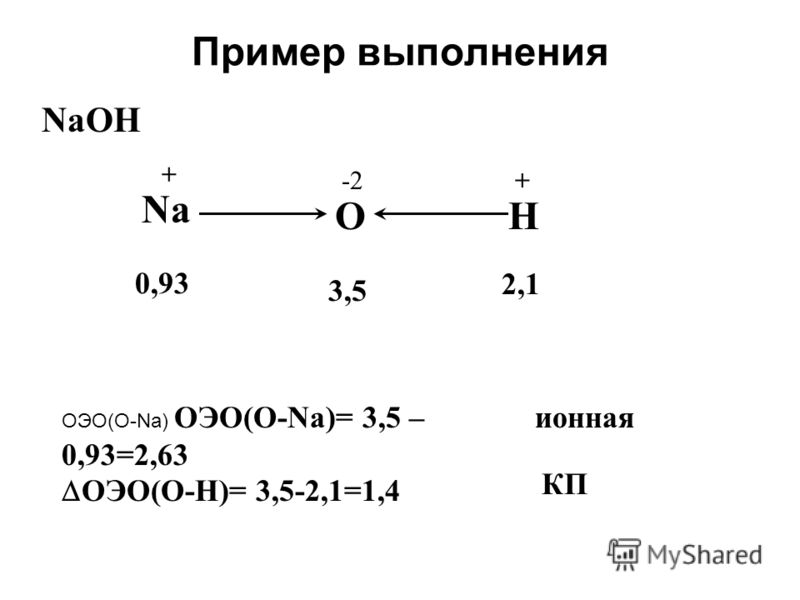
Пример выполнения NaOH Na OH 0,93 3,5 2, ОЭО(O-Na) ОЭО(O-Na)= 3,5 – 0,93=2,63 ОЭО(О-Н)= 3,5-2,1=1,4 ионная КП
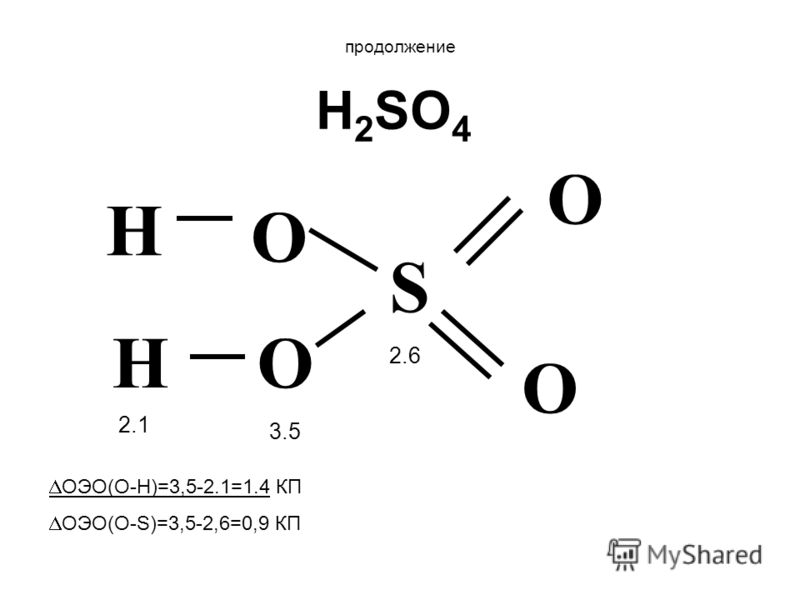
Продолжение H 2 SO 4 S O O O O H H ОЭО(О-Н)=3,5-2.1=1.4 КП ОЭО(O-S)=3,5-2,6=0,9 КП

Другими словами, молекула метана не может быть сформирована, как описано выше. Решение этой проблемы относительно просто: нужно представить себе, что орбиты подпространства с подобными энергиями могут смешиваться с новыми орбиталями. Геометрия этих орбиталей очень симметрична. Обычный тетраэдр, где ядер углерода находится в центре, а четыре орбитали выходят из него в вершины. Фактически, эти орбитали имеют две лепестки, похожие на орбитали р-типа, одна из которых намного меньше другой, согласно приведенному ниже рисунку.
На рисунке выше, где четыре орбитали появляются внутри тетраэдра, меньшая доля была проигнорирована для упрощения чертежа. Важно отметить, что ряд гибридных орбиталей всегда будет образовываться так же, как и при использовании чистой орбитали, и после гибридизации сохраняется такое же количество электронов. Таким образом, вы можете суммировать эту операцию в соответствии со схемой ниже. Гибридизацию можно затем определить как способность атомов перегруппировать свои орбитали валентного слоя с подобными энергиями.


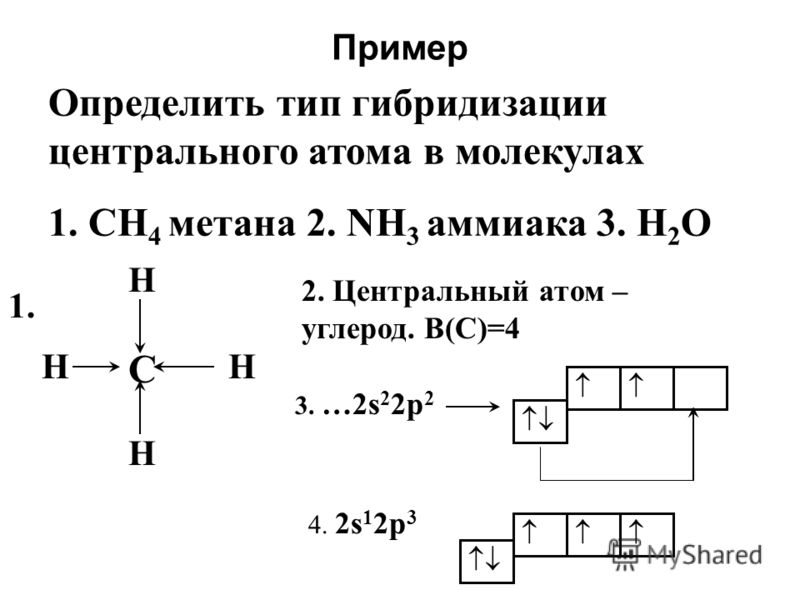
Определить тип гибридизации центрального атома в молекулах 1. СН 4 метана 2. NH 3 аммиака 3. Н 2 О Пример С НН Н Н Центральный атом – углерод. В(С)=4 3. …2s 2 2p s 1 2p 3
Эта перестройка происходит для достижения более низких энергетических состояний во время образования химических связей. В приведенной ниже таблице показаны наиболее частые типы гибридизации, причем первые два представляются орбиталями, а следующие три - только геометрической фигурой, образованной ими. Например, рассмотрим этинильную молекулу с линейной геометрией. В этой молекуле существует тройная связь между двумя атомами углерода, которые все еще присоединены к атому водорода, согласно структуре Льюиса ниже.
Таким образом, атомы углерода будут соединены фронтальным приближением по 1 орбитальной части каждого из них. Вторая гибридная орбиталь будет использоваться для соединения с орбиталью водорода, поступающей в линейную структуру, как показано на рисунке ниже.
5. В формировании структуры молекулы участвуют одна s и три p- электронные орбитали. Все связи в молекуле метана одинарные -связи. Тип гибридизации sp 3. Все электронные облака участвующие в гибридизации одинаковы. Следовательно углы между ними одинаковы и =0. Молекула неполярна. Геометрическая форма тетраэдр. Ответ sp 3 -гибридизация =0, неполярная молекула

Очевидно, что эта связь будет происходить по боковому приближению орбиталей. Эффект изолированной электронной пары. В молекуле аммиака азот связан с тремя атомами водорода. Из электронной конфигурации азота, как показано ниже, видно, что, используя только р-орбитали, этот атом мог бы создать три связи, необходимые для образования аммиака.
Тогда можно предположить, что в этом случае существует также образование орбиталей. Полученная молекула затем будет треугольной базовой пирамидой с парой изолированных или свободных электронов, как показано на рисунке ниже. Правдоподобным объяснением этого различия является электростатическое отталкивание, налагаемое электронной парой, изолированной над электронными облаками связей. Это отталкивание максимально удаляет эти облака из изолированной пары, тем самым уменьшая угол между связями.
Молекула аммиака Рассуждая аналогично для молекулы аммиака: 1 N H H H 2. B(N)=3, …2s 2 2p 3: связи+электронная пара. 5. SР 3 - гибридизация. Электронные облака разного характера. Углы между ними неодинаковы. 0. Молекула полярна.

Молекула воды 2. Кислород В=2. :O: H H s 2 2p 4 4. В молекуле 2 -связи и две электроные пары. В формировании структуры молекулы участвуют s- и три p-электронные орбитали. Тип гибридизации sp 3. 0 (т.к. Углы между электронными облаками различны). Молекула полярна.

Орбитальные гибриды: пороки и добродетели
Мирон, Орбитальцы появились в общих учебниках химии в начале второй половины прошлого века, чтобы описать электронную структуру атомов и объяснить молекулярные структуры. В течение 1970-х годов орбиталь появилась также в учебниках по химии для средних школ, где их дидактическое использование стало обобщаться в конце десятилетия. Во время этого процесса вульгаризации по существу квантомеханическое понятие орбиты претерпело по крайней мере два разных искажения, их описание как «пространственную область, где существует высокая вероятность нахождения электрона» или подобные выражения, или как синоним «облака».
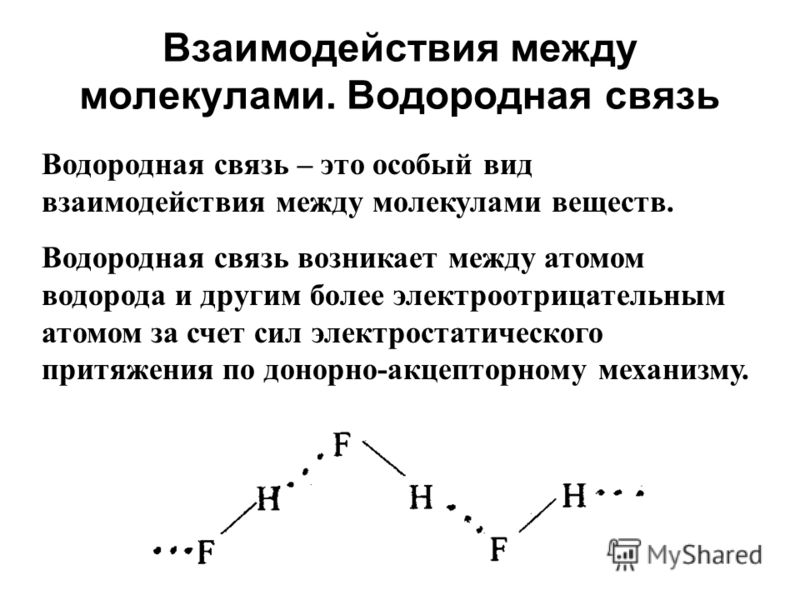
Взаимодействия между молекулами. Водородная связь Водородная связь – это особый вид взаимодействия между молекулами веществ. Водородная связь возникает между атомом водорода и другим более электроотрицательным атомом за счет сил электростатического притяжения по донорно-акцепторному механизму.
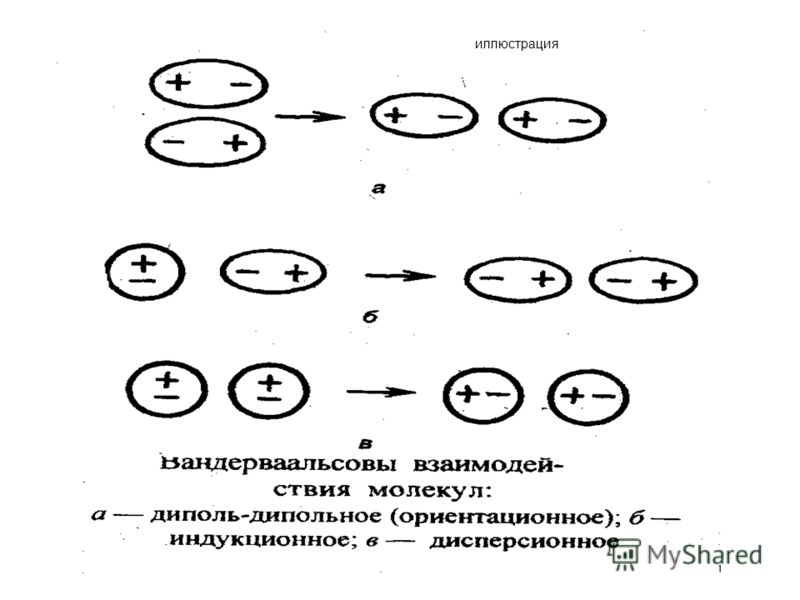
Вандерваальсово взаимодействие (межмолекулярное взаимодействие) 1873 год голландский ученый И. Ван-дер-Ваальс, предположил, что существуют силы, обусловливвающие притяжение между молекулами. Типы взаимодействия: 1) диполь-дипольное (ориентационное) Взаимодействие полярных молекул. 2) Индукционное. Взаимодействие полярных и неполярных молекул. Энергия этого вида взаимодействия слабее, чем ориентационного. 3)Дисперсионное. В неполярных молекулах (инертные газы) возникают флуктуации электронной плотности, в результате возникают мгновенные диполи, которые могут индуцировать соседние молекулы.

- Зависимость скорости ферментативной реакции от температуры, pH и времени инкубации Как влияет температура на рн
- Зависимость скорости ферментативной реакции от температуры, pH и времени инкубации Ph от температуры
- Святые богоотцы иоаким и анна Иоаким и анна когда почитание
- Храм святой великомученицы екатерины в риме
- Численность последователей основных религий и неверующих
- Абсолютные и относительные координаты Что называется абсолютными координатами точек
- Какие меры относились к политике военного коммунизма

 Live Journal
Live Journal Facebook
Facebook Twitter
Twitter