Какая гибридизация у алканов. Алканы — предельные углеводороды, их химические свойства

Углеводороды представляют собой простейшие органические соединения. Их составляют углерод и водород. Соединения этих двух элементов называются предельными углеводородами или алканами. Их состав выражается общей для алканов формулой CnH2n+2, где n - количество атомов углерода.
Алканы - международное наименование данных соединений . Также эти соединения называют парафинами и насыщенными углеводородами. Связь в молекулах алканов простая (или одинарная). Остальные валентности насыщены атомами водорода. Все алканы насыщены водородом до предела, его атомы находятся в состоянии sp3-гибридизации.
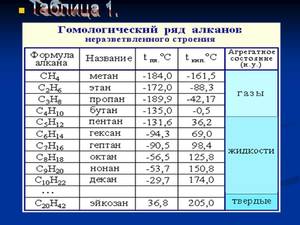
Гомологический ряд предельных углеводородов
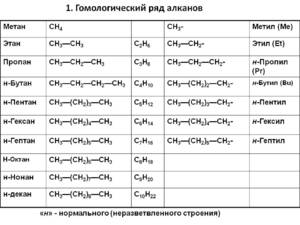
 Первым в гомологическом ряду насыщенных углеводородов стоит метан. Его формула CH4. Окончание -ан в наименовании предельных углеводородов являет отличительным признаком. Далее в соответствии с приведенной формулой в гомологическом ряду располагаются этан - C2H6, пропан C3H8, бутан - C4H10.
Первым в гомологическом ряду насыщенных углеводородов стоит метан. Его формула CH4. Окончание -ан в наименовании предельных углеводородов являет отличительным признаком. Далее в соответствии с приведенной формулой в гомологическом ряду располагаются этан - C2H6, пропан C3H8, бутан - C4H10.
С пятого алкана в гомологическом ряду названия соединений образуются следующим образом: греческое число, указывающее число атомов углеводорода в молекуле + окончание -ан. Так, по-гречески число 5 - пэндэ, соответственно за бутаном идет пентан - C5H12. Далее - гексан C6H14. гептан - C7H16, октан - C8H18, нонан - C9H20, декан - C10H22 и т. д.
Физические свойства алканов заметно изменяются в гомологическом ряду: увеличивается температура плавления, кипения, увеличивается плотность. Метан, этан, пропан, бутан при обычных условиях, т. е. при температуре равной примерно 22 градуса тепла по Цельсию, являются газами, с пентана по гексадекан включительно - жидкостями, с гептадекана - твердыми веществами. Начиная с бутана, у алканов есть изомеры.
Существуют таблицы, отражающие изменения в гомологическом ряду алканов , которые наглядно отражают их физические свойства.
Номенклатура насыщенных углеводородов, их производные
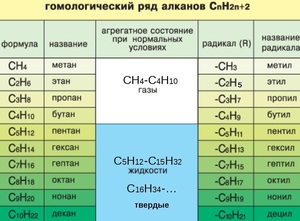 Если происходит отрыв атома водорода от молекулы углеводорода, то образуются одновалентные частицы, которые называют радикалами (R). Название радикалу дает то углеводород, из которого этот радикал произведен, при этом окончание -ан меняется на окончание -ил. Например, из метана при отрыве атома водорода образуется радикал метил, из этана - этил, из пропана - пропил и т. д.
Если происходит отрыв атома водорода от молекулы углеводорода, то образуются одновалентные частицы, которые называют радикалами (R). Название радикалу дает то углеводород, из которого этот радикал произведен, при этом окончание -ан меняется на окончание -ил. Например, из метана при отрыве атома водорода образуется радикал метил, из этана - этил, из пропана - пропил и т. д.
Радикалы также образуются и неорганическими соединениям. Например, отняв у азотной кислоты гидроксильную группу ОН, можно получить одновалентный радикал -NO2, который называется нитрогруппой.
При отрыве от молекулы алкана двух атомов водорода образуется двухвалентные радикалы, названия которых также образуются из названия соответствующих углеводородов, но окончание меняется на:
- илиен, в том случае, если атомы водорода оторваны от одного атома углерода,
- илен, в том случае, если от двух атомы водорода оторваны от двух соседних атомов углерода.
Алканы: химические свойства
Рассмотрим реакции, характерные для алканов. Всем алканам присущи общие химические свойства. Данные вещества являются малоактивными.
Все известные реакции с участием углеводородов подразделяются на два вида:
- разрыв связи С-Н (примером может служить реакция замещения);
- разрыв связи С-С (крекинг, образование отдельных частей).
Очень активны в момент образования радикалы. Сами по себе они существуют доли секунды. Радикалы легко вступают в реакции между собой. Их неспаренные электроны образуют новую ковалентную связь. Пример: CH3 + CH3 → C2H6
Радикалы легко вступают в реакции с молекулами органических веществ. Они либо присоединяются к ним, либо отрывают от них атом с неспаренным электроном, в результате чего появляются новые радикалы, которые, в свою очередь, могут вступать в реакции с другими молекулами. При такой цепной реакции получаются макромолекулы, которые перестают расти только тогда, когда оборвется цепь (пример: соединение двух радикалов)
Реакции свободных радикалов объясняют многие важные химические процессы, такие как:
- Взрывы;
- Окисления;
- Крекинг нефти;
- Полимеризацию непредельных соединений.
 Подробно можно рассмотреть химические свойства
насыщенных углеводородов на примере метана. Выше мы уже рассматривали строение молекулы алкана. Атомы углерода находятся в молекуле метана в состоянии sp3-гибридизации, и образуется достаточно прочная связь. Метан представляет собой газ баз запаха и цвета. Он легче воздуха. В воде малорастворим.
Подробно можно рассмотреть химические свойства
насыщенных углеводородов на примере метана. Выше мы уже рассматривали строение молекулы алкана. Атомы углерода находятся в молекуле метана в состоянии sp3-гибридизации, и образуется достаточно прочная связь. Метан представляет собой газ баз запаха и цвета. Он легче воздуха. В воде малорастворим.
Алканы могут гореть. Горит метан синеватым бледным пламенем. При этом результатом реакции будут оксид углерода и вода. При смешивании с воздухом, а также в смеси с кислородом, особенно если соотношение объемов будет 1:2, данные углеводород образует взрывчатые смеси, из-за чего он крайне опасен для применения в быту и шахтах. Если метан сгорает не полностью, то образуется сажа. В промышленности ее таким образом и получают.
Из метана получают формальдегид и метиловый спирт путем его окисления в присутствии катализаторов. Если же метан сильно нагреть, то он распадается по формуле CH4 → C + 2H2
Распад метана можно осуществить до промежуточного продукта в специально оборудованных печах. Промежуточным продуктом будет ацетилен. Формула реакции 2CH4 → C2H2 + 3H2. Выделение ацетилена из метана сокращает расходы производства почти в два раза.
Также из метана получают водород, производя конверсию метана с водяным паром. Характерными для метана являются реакции замещения. Так, при обычной температуре, на свету галогены (Cl, Br) по стадиям вытесняют водород из молекулы метана. Таким образом образуются вещества, называемые галогенопроизводными. Атомы хлора , замещая в молекуле углеводорода атомы водорода, образуют смесь разных соединений.
В такой смеси присутствуют хлорметан (CH3 Cl или хлористый метил), дихлорметан (CH2Cl2или хлористый метилен), трихлорметан (CHCl3 или хлороформ), тетрахлорметан (CCl4 или четыреххлористый углерод).
Любое из этих соединений может быть выделено из смеси. В производстве важное значение отводится хлороформу и тетрахлорметану, в силу того, что они являются растворителями органических соединений (жиров, смол, каучука). Галогенопроизводные метана образуются по цепному свободнорадикальному механизму.
Свет воздействует на молекулы хлора, вследствие чего они распадаются на неорганические радикалы, которые отрывают атом водорода с одним электроном от молекулы метана. При этом образуется HCl и метил. Метил реагирует с молекулой хлора, в результате чего получается галогенопроизводное и радикал хлора. Далее радикал хлора продолжает цепную реакцию.
При обычной температуре метан обладает достаточной стойкостью к щелочам, кислотам, многим окислителям. Исключение - азотная кислота. В реакции с ней образуется нитрометан и вода.
Реакции присоединения для метана не характерны, т. к. все валентности в его молекуле насыщены.
Реакции, в которых участвуют углеводороды могут проходить не только с расщеплением связи С-Н, но и с разрывом связи С-С. Такие превращения происходят при наличии высоких температур и катализаторов. К таким реакциям относятся дегидрогенизация и крекинг.
Из насыщенных углеводородов путем окисления получают кислоты - уксусную (из бутана), жирные кислоты (из парафина).
Получение метана
 В природе метан
распространен достаточно широко. Он - главная составная часть большинства горючих природных и искусственных газов. Он выделяется из каменноугольных пластов в рудниках, со дна болот. Природные газы (что очень заметно в попутных газах нефтяных месторождений) содержат не только метан, но и другие алканы. Применение этих веществ разнообразно. Они используются как топливо, на различных производствах, в медицине и технике.
В природе метан
распространен достаточно широко. Он - главная составная часть большинства горючих природных и искусственных газов. Он выделяется из каменноугольных пластов в рудниках, со дна болот. Природные газы (что очень заметно в попутных газах нефтяных месторождений) содержат не только метан, но и другие алканы. Применение этих веществ разнообразно. Они используются как топливо, на различных производствах, в медицине и технике.
В условиях лаборатории данный газ выделяют при нагревании смеси ацетат натрия + гидроксид натрия, а также реакцией карбида алюминия и воды. Также метан получают из простых веществ. Для этого обязательными условиями являются нагрев и катализатор. Промышленное значение имеет получение метана синтезом на основе водяного пара.
Метан и его гомологи могут быть получены при прокаливании солей соответствующих органических кислот с щелочами. Еще одним способом получения алканов является реакция Вюрца, при которой нагреваются моногалогенопроизводные с металлическим натрием.
Этап 1. Ответить на вопросы: 1. Общая формула алканов. 2. Общая формула алкенов. 3. Тип гибридизации алканов. 4. Тип гибридизации алкенов. 5. Характер связей алканов. 6. Характер связей алкенов. 7. Характерный тип реакций алканов, 8. Характерный тип реакций алкенов.

Этап 2. Написать уравнения реакций между веществами, указать условия, назвать вещества 1) пропана с хлором 2) пропена с хлором 3) бутена-1 с бромоводородом 4) гидратация бутена - 1 5) полимеризация бутена - 2 Написать уравнения реакций между веществами, указать условия, назвать вещества 1)бутана с бромом 2) бутена-1 с бромом 3) пентена–1 с хлороводордом 4)гидратация пентена-1 5) гидрирование пентена - 1

Этап 3. Составить полуструктурные формулы веществ. 1) 2 – метилпентен-1 2) 2, 3- диметилбутен- 1 3) пентадиен – 1, 3 4) 2-метилпентен – 2 5) 2–метилбутадиен -1,3 1) 3-метилпентен-1 2) 3 –этилпентен-1 3)2,3-диметилгексен-1 4)гексадиен – 1, 4 5)3-метилпентадиен 1,2.

Этап 4. Решить задачу. Задача. Массовая доля углерода в углеводороде 83,3%, относительная плотность по водороду 36. Найти молекулярную формулу. Задача. Массовая доля углерода в углеводороде 85,7%, плотность паров по водороду 28.Найти молекулярную формулу


Гибридизация – выравнивание (смешивание) атомных орбиталей (s и р ) с образованием новых атомных орбиталей, называемых гибридными орбиталями .
Атомная орбиталь – это функция, которая описывает плотность электронного облака в каждой точке пространства вокруг ядра атома. Электронное облако – это область пространства, в которой с высокой вероятностью может быть обнаружен электрон
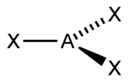
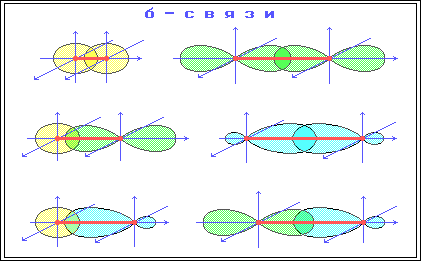
Sp-гибридизация
Происходит при смешивании одной s- и одной p-орбиталей. Образуются две равноценные sp-атомные орбитали, расположенные линейно под углом 180 градусов и направленные в разные стороны от ядра центрального атома. Две оставшиеся негибридные p-орбитали располагаются во взаимно перпендикулярных плоскостях и участвуют в образовании π-связей, либо занимаются неподелёнными парами электронов.
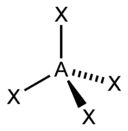
Sp2-гибридизация
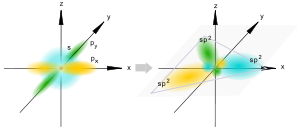
Sp2-гибридизация

Происходит при смешивании одной s- и двух p-орбиталей. Образуются три гибридные орбитали с осями, расположенными в одной плоскости и направленными к вершинам треугольника под углом 120 градусов. Негибридная p-атомная орбиталь перпендикулярна плоскости и, как правило, участвует в образовании π-связей
В таблице приведены примеры соответствия наиболее распространённых типов гибридизации и геометрической структуры молекул в предположении, что все гибридные орбитали участвуют в образовании химических связей (отсутствуют неподелённые электронные пары)
|
Тип гибридизации |
Число гибридных орбиталей |
Геометрия |
Структура |
Примеры |
|
Линейная |
|
BeF 2 , CO 2 , NO 2 + |
||
|
sp 2 |
Треугольная |
|
BF 3 , NO 3 - , CO 3 2- |
|
|
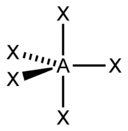
sp 3 |
Тетраэдрическая |
|
CH 4 , ClO 4 - , SO 4 2- , NH 4 + |
|
|
dsp 2 |
Плоскоквадратная |
|
Ni(CO) 4 , 2- |
|
|
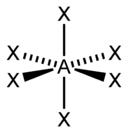
sp 3 d |
Гексаэдрическая |
| ||
|
sp 3 d 2 , d 2 sp 3 |
Октаэдрическая |
|
SF 6 , Fe(CN) 6 3- , CoF 6 3- |
4. Электровалентная, ковалентная, донорно-акцепторная, водородная связи. Электронное строение σ и π связи. Основные характеристики ковалентной связи: энергия связи, длина, валентный угол, полярность, поляризуемость.
Если между двумя атомами или двумя группами атомов имеет место электростатическое взаимодействие приводящее к сильному притяжению и образованию химической связи, то такая связь называется электровалентной или гетерополярной.
Ковалентная связь- химическая связь, образованная перекрытием пары валентных электронных облаков. Обепечивающие связь электронные облака называется общей электронной парой.
Донорно-акцепторная связь –это химическая связь между двумя атомами или группой атомов, осуществляемая за счет неподеленной пары электронов одного атома (донора) и свободного уровня другого атома (акцептора). Это связь отличается от ковалентной связи происхождением связи электронов.
Водородная связь -это вид химического взаимодейсвия атомов в молекуле отличающийся тем, что существенное участие в нем принимает атом водорода, уже связанный ковалентной связью с другими атомами
σ связь-это первая и более прочная связь, которая образуется при перекрывании электронных облаков в направлении прямой, соединяющий центры атомов.
σ связь-это обычные ковалентные связи атомов углерода с атомами водорода. Молекулы предельных углеродов содержат только σ связи.
π связь это менее прочная связь, которая образуется при перекрывании электронных плоскости атомов ядер
Электроны π и σ связи теряют свою принадлежность к определенному атому.
Особенности σ и π связи: 1)вращение атомов углерода в молекуле возможна в случае, если они соединены σ связью 2)появление π связи лишает атома углерода в молекуле в свободного вращения.
Длина связи- это расстояние между центрами связанных атомов.
Валентный угол- это угол между двумя связями, имеющий общий атом.
Энергия связи- энергия, выделяющаяся при образовании хим. связи и характеризующаяся ее прочность
Полярность связи обусловлена неравномерным распределением электронной плотности вследствие различий в электроотрицательностях атомов. По этому признаку ковалентные связи подразделяются на неполярные и полярные. Поляризуемость связи выражается в смещении электронов связи под влиянием внешнего электрического поля, в том числе и другой реагирующей частицы. Поляризуемость определяется подвижностью электронов. Полярность и поляризуемость ковалентных связей определяет реакционную способность молекул по отношению к полярным реагентам.
5.
Ионная связь (электровалентная)-
очень прочная химическая связь,
образующаяся между атомами с большой
разностью электроотрицательностей,
при которой общая электронная пара
переходит преимущественно к атому с
большей электроотрицательностью.
Ковалентная
связь – возникает за счет обобществления
электронной пары посредством обменного
механизма, когда каждый из взаимодействующих
атомов поставляет по одному электрону.
Донорно акцепторная связь (координационная
связь) химическая связь между двумя
атомами или группой атомов, осуществляемая
за счет неподеленной пары электронов
одного атома (донора) и свободной орбитали
другого атома (акцептора).пример NH4
Для возникновения
водородных связей важно, чтобы в молекулах
вещества были атомы водорода, связанные
с небольшими, но электроотрицательными
атомами, например: O, N, F. Это создает
заметный частичный положительный заряд
на атомах водорода. С другой стороны,
важно, чтобы у электроотрицательных
атомов были неподеленные электронные
пары. Когда обедненный электронами атом
водорода одной молекулы (акцептор)
взаимодействует с неподеленной
электронной парой на атоме N, O или F
другой молекулы (донор), то возникает
связь, похожая на полярную ковалентную.
При
образовании ковалентной связи в молекулах
органических соединений общая электронная
пара заселяет связывающие молекулярные
орбитали, имеющие более низкую энергию.
В зависимости от формы МО – σ-МО или
π-МО – образующиеся связи относят к σ-
или p-типу.
σ-Связь
– ковалентная связь, образованная при
перекрывании s-, p- и гибридных АО вдоль
оси, соединяющей ядра связываемых атомов
(т. е. при осевом перекрывании АО) .
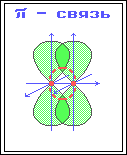
π-Связь
– ковалентная связь, возникающая при
боковом перекрывании негибридных р-АО.
Такое перекрывание происходит вне
прямой, соединяющей ядра атомов.
 π-Связи
возникают между атомами, уже соединенными
σ-связью (при этом образуются двойные
и тройные ковалентные связи) . π-Связь
слабее σ-связи из-за менее полного
перекрывания р-АО.
π-Связи
возникают между атомами, уже соединенными
σ-связью (при этом образуются двойные
и тройные ковалентные связи) . π-Связь
слабее σ-связи из-за менее полного
перекрывания р-АО.
 Различное
строение σ- и π-молекулярных орбиталей
определяет характерные особенности σ-
и π-связей.
1.σ-Связь
прочнее π-связи. Это обусловлено более
эффективным осевым перекрыванием АО
при образовании σ-МО и нахождением
σ-электронов между ядрами.
2.По
σ-связям возможно внутримолекулярное
вращение атомов, т. к. форма σ-МО допускает
такое вращение без разрыва связи (cм
аним. Картинку внизу)) . Вращение по
двойной (σ + π) связи невозможно без
разрыва π-связи!
3.Электроны
на π-МО, находясь вне межъядерного
пространства, обладают большей
подвижностью по сравнению с σ-электронами.
Поэтому поляризуемость π-связи значительно
выше, чем σ-связи.
Различное
строение σ- и π-молекулярных орбиталей
определяет характерные особенности σ-
и π-связей.
1.σ-Связь
прочнее π-связи. Это обусловлено более
эффективным осевым перекрыванием АО
при образовании σ-МО и нахождением
σ-электронов между ядрами.
2.По
σ-связям возможно внутримолекулярное
вращение атомов, т. к. форма σ-МО допускает
такое вращение без разрыва связи (cм
аним. Картинку внизу)) . Вращение по
двойной (σ + π) связи невозможно без
разрыва π-связи!
3.Электроны
на π-МО, находясь вне межъядерного
пространства, обладают большей
подвижностью по сравнению с σ-электронами.
Поэтому поляризуемость π-связи значительно
выше, чем σ-связи.
Характерные свойства ковалентной связи - направленность, насыщаемость, полярность, поляризуемость - определяют химические и физические свойства соединений.
Направленность связи обусловлена молекулярным строением вещества и геометрической формы их молекулы. Углы между двумя связями называют валентными.
Насыщаемость - способность атомов образовывать ограниченное число ковалентных связей. Количество связей, образуемых атомом, ограничено числом его внешних атомных орбиталей.
Полярность связи обусловлена неравномерным распределением электронной плотности вследствие различий в электроотрицательностях атомов. По этому признаку ковалентные связи подразделяются на неполярные и полярные (неполярные - двухатомная молекула состоит из одинаковых атомов (H 2 , Cl 2 , N 2) и электронные облака каждого атома распределяются симметрично относительно этих атомов; полярные - двухатомная молекула состоит из атомов разных химических элементов, и общее электронное облако смещается в сторону одного из атомов, образуя тем самым асимметрию распределения электрического заряда в молекуле, порождаядипольный момент молекулы).
Поляризуемость связи выражается в смещении электронов связи под влиянием внешнего электрического поля, в том числе и другой реагирующей частицы. Поляризуемость определяется подвижностью электронов. Полярность и поляризуемость ковалентных связей определяет реакционную способность молекул по отношению к полярным реагентам.
6.Номенклатура представляет собой систему правил, позволяющих дать однозначное название каждому индивидуальному соединению. Для медицины знание общих правил номенклатуры имеет особенно большое значение, так как в соответствии с ними строятся названия многочисленных лекарственных средств. В настоящее время общепринята систематическая номенклатура ИЮПАК (IUPAC - Международный союз теоретической и прикладной химии)*.
Однако до сих пор сохраняются и широко применяются (особенно в медицине) тривиальные (обыденные) и полутривиальные названия, использовавшиеся еще до того, как становилось известным строение вещества. В этих названиях могут отражаться природные источники и способы получения, особо заметные свойства и области применения. Например, лактоза (молочный сахар) выделена из молока (от лат. lactum - молоко), пальмитиновая кислота - из пальмового масла, пировиноградная кислота получена при пиролизе виноградной кислоты, в названии глицерина отражен его сладкий вкус (от греч. glykys - сладкий).
Тривиальные названия особенно часто имеют природные соединения - аминокислоты, углеводы, алкалоиды, стероиды. Употребление некоторых укоренившихся тривиальных и полутривиальных названий разрешается правилами ИЮПАК. К таким названиям относятся, например, «глицерин» и названия многих широко известных ароматических углеводородов и их производных.
Рациональная номенклатура предельных углеводородов
В отличие от тривиальной названия основываются на строении молекул. Названия сложных структур состовляют из названия блоков те радикалов связанных с основным навиболее важным узлом молекулы по этой номенклатуре алканы рассматриваются как производные метана у которого атомы водорода замещены соответствующими радикалами. Выбор метанового углерода произвольный поэтому 1 соедин может иметь неск названий.по этой номенклатуре алкены рассматривают как производные этилена а алкины-ацетилена.
7. Гомология органических соединений или закон гомологов - состоит в том, что вещества однойхимической функции и одинакового строения, отличающиеся друг от друга по своему атомному составу лишьна nСН 2, оказываются сводными и во всем своем остальном хим. характере, а различие их физическихсвойств возрастает или вообще изменяется правильно по мере увеличения разницы в составе,определяемой числом n групп СН 2. Такие хим. сходственные соединения образуют так наз. гомологическийряд, атомный состав всех членов которого возможно выразить общею формулою в зависимости от составапервого члена ряда и числа атомов углерода; органические вещества одного названия типо алканы только.
Изомеры- соединения имеющие одинаковый состав но разное строение и свойства.
8. Нуклеоф и льные и электроф и льные реаг е нты . Участвующие в замещения реакциях реагенты подразделяются на нуклеофильные и электрофильные. Нуклеофильные реагенты, или нуклеофилы, предоставляют свою паруэлектронов на образование новой связи и вытесняют из молекулы RX уходящую группу (X) с парой электронов, образовывавшей старую связь, например:
(где R - органический радикал).
К нуклеофилам относятся отрицательно заряженные ионы (Hal - , ОН - , CN - , NO 2 - , OR - , RS - , NH 2 - , RCOO - и др.), нейтральные молекулы, обладающие свободной парой электронов (например, Н 2 О, NH3, R 3 N, R 2 S, R 3 P, ROH, RCOOH), и металлоорганич. соединения R - Me с достаточно поляризованной связью С - Me + , т. е. способные быть донорами карбанионов R - . Реакции с участием нуклеофилов (нуклеофильное замещение) характерны главным образом Для алифатических соединений, например гидролиз (ОН - , Н 2 О), алкоголиз (RO - , ROH), ацидолиз (RCOO - , RСООН), аминирование (NH - 2 , NH 3 , RNH 2 и др.), цианирование (CN -) и т. д.
Электрофильные реагенты, или электрофилы, при образовании новой связи служат акцепторами пары электронов и вытесняют уходящую группу в виде положительно заряженной частицы. К электрофилам относятся положительно заряженные ионы (например, Н + , NO 2 +), нейтральные молекулы с электронным дефицитом, например SO 3 , и сильно поляризованные молекулы (СН 3 СОО - Br + и др.), причём поляризация особенно эффективно достигаетсякомплексообразованием с коэффициентами Льюиса (Hal + - Hal - · А, R + - Cl - · A, RCO + - Cl - · А, где A= A1C1 3 , SbCl 5 , BF 3 и др.). К реакциям с участием электрофилов (электрофильное замещение) относятся важнейшие реакцииароматических углеводородов (например, нитрование, галогенирование, сульфирование, реакция Фриделя - Крафтса):
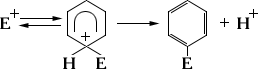
(E + = Hal + , NO + 2 , RCO + , R + и др.)
В определённых системах реакции с участием нуклеофилов осуществляются в ароматическом ряду, а реакции с участием электрофилов - в алифатическом (чаще всего в ряду металлоорганических соединений).
53. взаимодействие оксосоединений с металлорганическими (кетон или альдегид плюс металорганика)
Реакции широко используются для получения спиртов.при присоединении к формальдегиду реактива гриньяра(R-MgX) образуется первичный спирт, другим альдегидом вторичные, а кетонам тритичные спирты
- Рецепты варенья из кабачков с лимоном, с курагой и в ананасовом соке
- Как приготовить вкусные куриные сердечки с картофелем в мультиварке Куриные сердечки рецепт в мультиварке с картофелем
- Сырный суп с курицей и грибами Куриный суп с сыром и грибами
- Четверка монет таро значение
- Что такое договор найма служебного жилого помещения?
- Хлеб по технологии в духовке на дрожжах
- Требования к главному бухгалтеру Нормативное регулирование бухгалтерского учета

 Live Journal
Live Journal Facebook
Facebook Twitter
Twitter