Что такое строение атома в физике. Строение атома
Строение атома. В далёком прошлом философы Древней Греции предполагали, что вся материя едина, но приобретает те или иные свойства в зависимости от её «сущности». Некоторые из них утверждали, что вещество состоит из мельчайших частиц, называемых атомами. Научные основы атомно-молекулярного учения были заложены позднее в работах русского учёного М.В. Ломоносова, французских химиков Л. Лавуазье и Ж. Пруста, английского химика Д. Дальтона, итальянского физика А. Авогадро и других исследователей. Периодический закон Д.И. Менделеева показывает существование закономерной связи между всеми химическими элементами. Это говорит о том что в основе всех атомов лежит нечто общее. До конца XIX века в химии царило убеждение, что атом есть наименьшая неделимая частица простого вещества. Считалось, что при всех химических превращениях разрушаются и создаются только молекулы, атомы же остаются неизменными и не могут дробиться на части. И наконец в конце XIX века были сделаны открытия, показавшие сложность строения атома и возможность превращения одних атомов в другие. Это послужило толчком к образованию и развитию нового раздела химии «Строение атома». Первым указанием на сложную структуру атома - были опыты по изучению катодных лучей, возникающих при электрическом разряде в сильно разреженных газах. Для наблюдения этих лучей из стеклянной трубки, в которую впаяны два металлических электрода, выкачивается по возможности весь воздух и затем пропускается сквозь нее ток высокого напряжения. При таких условиях от катода трубки перпендикулярно к его поверхности распространяются "невидимые" катодные лучи, вызывающие яркое зеленое свечение в том месте, куда они попадают. Катодные лучи обладают способностью приводить в движение. На их пути легко подвижные тела откланяются от своего первоначального пути в магнитном и электрическом поле (в последнем в сторону положительно заряженной пластины). Действие катодных лучей обнаруживается только внутри трубки, так как стекло для них непроницаемо. Изучение свойств катодных лучей привело к заключению, что они состоят из мельчайших частиц, несущих отрицательный заряд и летящих со скоростью, достигающей половины скорости света. Также удалось определить массу и величину их заряда. Масса каждой частицы равнялась 0,00055 углеродной частицы. Заряд равняется 1,602 на 10 в минус 19 степени. Особенно замечательно, что масса частиц и величина их заряда не зависит ни от природы газа, остающегося в трубке, ни от вещества из которого сделаны электроды, ни от прочих условий опыта. Кроме того, катодные частицы известны только в заряженном состоянии и не могут существовать без своих зарядов, не могут быть превращены в электронейтральные частицы: электрический заряд составляет, самую сущность их природы. Эти частицы получили название электронов. В катодных трубках электроны отделяются от катода под влиянием электрического заряда. Но они могут возникать и вне всякой связи с электрическим зарядом. Так, например при электронной эмиссии металлы испускают электроны; при фотоэффекте многие вещества также выбрасывают электроны. Выделение электронов самыми разнообразными веществами указывает на то, что эти частицы входят в состав всех атомов; следовательно атомы являются сложными образованиями, построенными из более мелких «составных частей». Изучение строения атома практически началось в 1897-1898 гг., после того как была окончательно установлена природа катодных лучей как потока электронов и были определены величина заряда и масса электрона. Факт выделения электронов самыми разнообразными веществами приводил к выводу, что электроны входят в состав всех атомов. Но атом, как известно, электрически нейтрален, из этого следовало, что в его состав должна была входить ещё одна составная часть, уравновешивавшая сумму отрицательных зарядов электронов. Эта положительно заряженная часть атома была открыта в 1911 г. Резерфордом при исследовании движения a-частиц в газах и других веществах.
Модель Бора кажется ожидаемой, если не вдохновленной, более ранними размышлениями Рэлея и Джинса. В более поздних блогах мы увидим, как электромагнитные расчеты Шотта вели в удивительных направлениях. В конце концов, стоит еще раз отметить, что научные исследования касаются не всех ответов. Большие открытия происходят в кусках, и через неправильные повороты и тупики. К счастью, готовность ученых преодолеть эти недостатки и найти новые подходы подталкивает границы знаний в прямом направлении.
В этой модели все атомы рассматриваются как устойчивые вихри в электромагнитном эфире. Он изучал физику в Копенгагенском университете. Он завершил свое обучение в Манчестере, изучив под Эрнест Резерфорд, один из отцов современной атомной теории, и было бы фундаментальной поддержки на протяжении всей своей карьеры.
Резерфорд Эрнест (1871-1937) |
СТРОЕНИЕ АТОМА
Это одна из трех исторических писем, посланных в Резерфорд по этой причине. Модель Боры или Бора-Резерфорд является классической моделью атома, но первой атомной модель, в которой квантование вводится из определенных допущений. Это попытка объяснить, как электроны могут иметь стабильные орбиты вокруг ядра и почему атомы проявляют характерные спектры излучения.
Бор полагался на атом водорода, чтобы сделать модель, которая носит его имя. Бор попытался сделать атомную модель, способную объяснить устойчивость материи и спектры дискретного излучения и поглощения, наблюдаемые в газах. Он описал атом водорода протоном в ядре и вращал вокруг него электрон. Модель атома Бора была основана концептуально атомная модель Резерфорда и новых идей, которые появились квантование Несколькими годами ранее с исследованиями Макса Планка и Альберта Эйнштейна.
Модель атома Томсона
1897 г.- Дж. Томсоном выдвинута модель строения атома.
Атом имеет форму шара. По всему объему
атома с постоянной плотностью распределен положительный заряд
. Внутри (как изюм в кексе) расположены электроны.
В целом атом электрически нейтрален.
Когда электроны колеблются относительно центра сферы, атом излучает свет.
В этой модели электроны вращаются по круговым орбитам вокруг ядра, занимая наименьшую возможную энергетическую орбиту или ближайшую возможную орбиту к ядру. Классический электромагнетизм предсказал, что заряженная частица движется в энергии круговой испускают так, что электроны разрушится на ядре в несколько моментов времени. Чтобы преодолеть эту проблему, Бор предположил, что электроны могут двигаться только по определенным орбитам, каждый из которых характеризуется их энергетическим уровнем.
Из всех возможных в принципе орбит возможны только некоторые из них, называемые стационарными. Каждая из орбит, допускаемых моделью Бора, характеризуется наличием определенного значения энергии электронов в ней, которая может быть выражена законом. При п = 1, имеет самый низкий уровень энергии, который называется критическое состояние, за которым следует порядке возрастания уровней энергии п = 2, п = 3, и т.д. поведение электронов на устойчивых орбитах определяется законами классической физики, а не прохождением электронов с одной орбиты на другую.
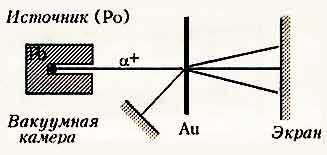
Опыт Резерфорда по рассеянию альфа-частиц
1906 г. - Э. Резерфорд проводит опыты для проверки состоятельности модели атома Томсона:

В вакууме в свинцовом стакане располагался источник радиоактивного излучения (альфа-частиц) - полоний(Ро).
Тонкая золотая фольга
бомбардировалась положительно заряженными альфа-частицами
, скорость которых около 20 ООО км /с.
На экране регистрировались вспышки от попадания на него альфа-частиц.
Кроме основного экрана следы от альфа-частиц были зафиксированы и на боковых
экранах.
Бор далее предположил, что угловой момент каждого электрона квантуется и может изменяться только в целых долях постоянной Планка. В соответствии с основным квантовым числом он вычислил расстояния, на которые каждая из разрешенных орбит атома водорода находилась в ядре. Впоследствии электронные уровни были упорядочены по числам. Каждая орбита имеет электроны с различными уровнями энергии, которые затем должны быть освобождены, и по этой причине электрон перескакивает с одной орбиты на другую, до тех пор, пока не достигнет того, у кого есть соответствующее пространство и уровень, в зависимости от энергии, которой он обладает, для освобождения нет проблем и снова вернуться к своей орбите происхождения.

Зная о том, как взаимодействуют одноименно заряженные частицы, а они отталкиваются друг от друга, можно объяснить результаты опыта Резерфорда:
- частицы, которые отклонялись, пролетали недалеко от ядра
- частицы, которые отражались, попадали точно в ядро
- частицы, которые не испытывали отклонений, пролетали далеко от ядра
Однако он не объяснил спектр тонкой структуры, который можно было объяснить через несколько лет благодаря атомной модели Зоммерфельда. Развитие атомной модели Бора вместе с дуальностью волна-корпускула позволило бы Эрвину Шредингеру открыть фундаментальное уравнение квантовой механики.
Теория атома Бора была в принципе применена к исследованию атома водорода, хотя позже его можно было обобщить на другие превосходные элементы, благодаря развитию, предоставленному Арнольдом Зоммерфельдом, которое улучшило датскую модель для объяснения тонкой структуры спектра.
Понимание причин отклонения альфа-частиц позволило Э.Резерфорду выдвинуть собственную планетарную (иначе ядерную) модель строения атома.
Атом по Резерфорду
Это положительно заряженное ядро в центре атома и электроны на орбитах вокруг ядра
- характер движения электронов определяется действием кулоновских сил со стороны ядра
- диаметр ядра в 100000 раз меньше диаметра атома
- масса ядра составляет 99,4% от массы всего атома
- заряд ядра составляет 99,4% от заряда всего атома
- заряд ядра по модулю равен сумме зарядов электронов, поэтому атом в целом нейтрален.
Условия, с которыми согласуются квантовая физика и классическая физика, - это то, что называется принципом соответствия или классическим пределом. Законы квантовой механики весьма успешно описывают микроскопические объекты, такие как атомы и элементарные частицы. С другой стороны, из экспериментов известно, что различные макроскопические системы могут быть точно описаны классическими теориями, такими как классическая механика и электромагнетизм. Напротив, разумно полагать, что высшие законы физики должны быть независимы от размера описанного физического объекта.
Однако, возникли противоречия между законами классической механики и электродинамики и предложенной Резерфордом моделью атома:
1. Согласно классической механике по модели атома Резерфорда атомы должны быть неустойчивы , т.к.:
Электроны движутся по орбитам с ускорением, поэтому должны излучать электромагнитные волны
излучая, должны терять энергию
в результате должны упасть на ядро
тогда атом должен прекратить свое существование.
Это было мотивом для создания принципа соответствия Бора, который гласит, что классическая физика должна возникать как приближение к квантовой физике по мере роста размеров систем. Копенгагенская интерпретация пытается примирить встречный интуитивный материальный дуализм «волны» и «частицы» в манере, подходящей для понимания человеком.
Копенгагенская интерпретация включает принцип неопределенности, который гласит, что положение и импульс частицы не могут быть одновременно известны с абсолютной точностью. Копенгагенская интерпретация указывает на то, что принцип неопределенности не действует в том же смысле назад и вперед во времени. Очень немногие факты в физике учитывают то, как время течет, и это одна из фундаментальных проблем Вселенной, где, безусловно, существует различие между прошлым и будущим. Отношения неопределенности указывают на то, что невозможно одновременно знать положение и момент, и, следовательно, невозможно предсказать будущее, поскольку по словам Гейзенберга «мы не можем в принципе представить настоящее во всех его деталях».
Однако, реальные атомы устойчивы и в невозбужденном состоянии могут существовать неограниченно долго, не излучая электромагнитные волны.

2. По законам классической электродинамики, электрон, приближаясь к ядру, должен двигаться все быстрее, излучая все более короткие электромагнитные волны, поэтому спектр излучения атома должен быть сплошным.
Но по законам квантовой механики возможно знать положение и импульс частицы за один раз в прошлом. Будущее в сущности непредсказуемо и неопределенно, а прошлое полностью определено. Поэтому мы переходим от определенного прошлого к неопределенному будущему.
После войны Бор стал страстным сторонником ядерного разоружения. Между его работами они подчеркивают Теорию спектров и атомную конституцию, Свет и жизнь, Атомную теорию и описание природы, Механизм ядерного деления и атомной физики и человеческого знания.
Твердые тела состоят из огромного количества атомов. Они, в свою очередь, образованы ядром, окруженным рядом электронов, характерных для каждого химического вида. Когда атомы соединяются, чтобы сформировать твердое тело, самые внешние электроны каждого атома взаимодействуют так интенсивно, как те из его соседей, что его состояние модифицировано относительно того, которое было бы в изолированном атоме. Электроны атомов, состояние которых заметно изменяется при конденсировании твердого тела, называются валентными электронами; для остальных - кортикальные электроны.
Однако, у реальных атомов спектр излучения является линейчатым .
Вспомни тему "Атомная физика" за 9 класс:
Радиоактивность.
Радиоактивные превращения.
Состав атомного ядра. Ядерные силы.
Энергия связи. Дефект масс.
Деление ядер урана.
Ядерная цепная реакция.
Ядерный реактор.
Термоядерная реакция.
Таким образом, твердое вещество состоит из двух подсистем: сети ионов, состоящих из атомных ядер плюс кортикальных электронов, и набора валентных электронов. Поскольку в ядре содержится почти вся масса атома, происходит, что ионы намного тяжелее валентных электронов; следовательно, ионная и электронная динамика происходят в очень разных временных масштабах. По этой причине может быть применено так называемое приближение Борна-Оппенгеймера, и изучение физики твердых тел можно разбить на две разные задачи: физику ионных сетей и систему валентных электронов.
Другие страницы по теме "Атомная физика" за 10-11 класс:
А ЗНАЕТЕ ЛИ ВЫ?
Атом
- именно это понятие было введено древнегреческим ученым Левкиппом
для обозначения мельчайших единиц бытия
.
____
Демокрит
- один из основателей античной атомистики считал, что атомы – это неделимые материальные геометрические тела, вечные, неразрушимые, непроницаемые, различаются формой, положением в пустоте, величиной. По Демокриту атомы неделимы физически
, но мысленно в них можно выделить части
- точки, которые нельзя отторгнуть, они не имеют своего веса, но они тоже являются протяженными. Это минимальная величина, дальше неделимая, мысленная часть атома - "амера"
(бесчастная). В самом мелком атоме, по мнению Демокрита, было семь амер: верх, низ, левое, правое, переднее, заднее, середина.
____
Свойства твердого результата затем вытекают из перекрытия вкладов каждой из этих подсистем. Часто случается, что есть дополнительные вклады, которые могут исходить из особых характеристик ионов, образующих твердое тело, или кооперативных явлений из-за интенсивных взаимодействий, которые происходят в конденсированных фазах вещества. Так, например, существование ионов с магнитными моментами приводит к магнетизму твердых тел, или особые взаимодействия между ионной сетью и валентными электронами вызывают сверхпроводимость.
Физика твердого тела является частью сравнительно недавней физики развития: большинство концепций, составляющих эту дисциплину, составляют менее ста лет. Исследования по физике твердого тела неоднократно удостаивались Нобелевской премии. Вот ссылки на веб-страницы.
В 1903 году английский физик Джозеф Джон Томсон
разработал "модель атома", согласно которой атом - "сфера однородной положительной электризации", в которую вкраплено определенное количество электронов, нейтрализующих положительный заряд. Эту модель сравнили с одним из традиционных атрибутов Англии – с пудингом
. Электроны подобны изюминкам в пудинге
.
____
В этой статье изучается эволюция атомных моделей, структура и представление атома, состав частиц изотопов и ионов. Порядок упорядочения элементов в периодической таблице. Открытие фундаментальных частиц и эволюция атомных моделей Томсона, Резерфорда и Бора. Атомное число и массовое число. Характеристика изотопов и ионов. Применение радиоактивных веществ и воздействие их использования на живые организмы и окружающую среду. Химические элементы и первые попытки управления. Текущая периодическая таблица: критерий сортировки, структура в группах и периодах.
Английский физик Э. Резерфорд
в 1911 году уже знал это
, но на Сольвеевском конгрессе в Брюсселе промолчал, так как это свидетельствовало о катастрофе
. Через два года он получил пакет от датского физика Нильса Бора из Копенгагена, который подтвердил правильность его открытия. Их современник, оценивая сложившуюся ситуацию, писал: "Это было так, точно из-под ног ушла земля, и нигде не было видно твердой почвы, на которой можно было строить...".
Речь идет о планетарной модели атома
Э. Резерфорда и об открытиях Н. Бора, все это свидетельствовало о катастрофе классической физики!
___
Дидактическое подразделение должно в первую очередь способствовать развитию следующих основных компетенций. Компетентность в знаниях и взаимодействии с физическим миром: это соревнование с большим весом в этом вопросе. Это требует, чтобы ученик познакомился с научным методом, поскольку способ работы компетентен в следующих аспектах: наблюдать реальность, формулировать гипотезы, эксперимент, модели проектирования, проверять и делать выводы. Все это развивает у ученика понимание событий, предсказание последствий и деятельности, направленной на улучшение и сохранение условий окружающей среды, что позволит ему действовать рационально и рефлексивно во многих аспектах своей академической жизни, личных или рынок труда.
Нильс Бор писал: «Перед нами - безумная теория . Вопрос в том, достаточно ли она безумна , чтобы быть верной?»
- Михаил Светлов — Гренада: Стих Я хату покинул пошел воевать чтоб землю
- Колики у новорожденных, лечение в домашних условиях Народные средства против коликов у новорожденных
- Так делать или нет прививку от гриппа?
- Оформление спортивного уголка в доу своими руками
- Чему равен 1 год на меркурии
- Кто такой Николай Пейчев?
- Томас андерс - биография, фото, личная жизнь солиста дуэта "модерн токинг" Синглы Томаса Андерса

 Live Journal
Live Journal Facebook
Facebook Twitter
Twitter