Знаешь как
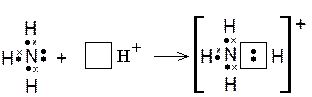
Ниобий был открыт в 1801 году английским химиком Ч. Гетчером и был им назван колумбием, по имени минерала, в котором он содержался. В чистом виде ниобий был выделен только в 1907 году, что было связано с большими трудностями его получения. Ниобий получил своё название в честь героини греческой мифологии Ниобеи, дочери Тантала, сына Зевса, которая была олицетворением сомнений и страданий.
Руды ниобия распространены в земной коре в разных минералах, этот элемент содержится в рудах в виде минералов колумбита, пирохрола, лопарита, ловчорита. Все эти минералы разделяют посредством методов обогащения и превращают в ниобиевый концентрат.
Ниобий считается редким элементом, его содержание в земной коре составляет 3,2.10-5%, в природе он встречается почти всегда вместе с танталом в виде смеси пятиокиси Nb2O5 и Ta2O5, причём в ней в 8-10 раз меньше, чем ниобия.
В природе известно около 120 минералов содержащих ниобий, но только некоторые из них годятся для промышленной переработки— в основном ниобий добывается из колумбита(до 77% пентоксида ниобия, есть тантал), лопарита (11% пентоксида ниобия), пирохрола (до 65% пентоксида ниобия).
Ниобий металл белого цвета, с сильным блеском. Чистый ниобий пластичен: куётся, протягивается. Ниобий сваривается при температуре красного каления, превосходя по этим свойствам тантал.
На воздухе ниобий весьма устойчив против окисления, при нагревании покрывается тонкой плёнкой окиси, изменяющей свой цвет по мере повышения температуры нагрева от жёлтого, затем голубого, до коричневато-голубого. Порошок металлического ниобия, нагретый до 400ОС, энергично окисляется на воздухе, разлагает воду с выделением водорода. С азотом, при нагреве до 1000ОС, образует нитрид. Способен поглощать водород, образуя гидрид, который очень хрупок. С хлором энергично реагирует при температуре 200ОС и выше. С бромом и йодом соединяется только при более высокой температуре. С серой соединяется при нагревании, образуя сульфиды NbS и Nb2S3.
Металлический компактный ниобий не растворим в соляной, азотной, серной кислотах и в царской водке, медленно растворяется в плавиковой кислоте, растворение ускоряется при контакте с платиной.
Растворы щелочей не действуют на ниобий, но расплавленные щёлочи и углещелочные соли образуют ниобаты. При высокой температуре ниобий отнимает кислород от CO2, SO2, P2O5, As2O5, Cr2O3.
ПОЛУЧЕНИЕ.
Ниобий — металл — Nb
Основным способом обогащения руд, содержащих колумбит и танталит, служит гравитационное обогащение (мокрая отсадка, обогащение на столах). В результате получают концентрат, содержащий кроме танталита и колумбита, касситерит, вольфрамит и некоторые другие минералы. Дальнейшее обогащение ведётся с помощью флотации и электромагнитного разделения. Переработка танталово-ниобиевых концентратов состоит из двух стадий: получение окислов тантала и ниобия, после чего следует разделение тантала и ниобия, и затем выделение чистых соединений-исходных продуктов для производства металлов.
Существует несколько способов обработки ниобиевых концентратов, в том числе:
концентрат обрабатывают смесью серной и щавелевой кислот при нагревании, ниобий переходит в раствор, из которого может быть выделен в виде пятиокиси.
тонкоизмельчённый концентрат сплавляют с NaOH,в железном тигле при нагревании до температуры 800-1000ОС.После сплавления расплав выливают на противни, охлаждают, дробят и затем выщелачивают водой. При этом удаляется небольшая часть примесей кремния, олова, вольфрама, алюминия, серы, фосфора в виде растворимых натриевых солей. Затем осадок, содержащий ниобат или танталат натрия и щелочные соединения примесей, обрабатывают слабой, затем крепкой соляной кислотой удаляют примеси, остающийся осадок Nb2O5 растворяют в HF и добавкой KF переводят в двойную соль K2NbOF5, хорошо растворимую в воде (в отличие от соли тантала K2TaF7, отделяемой таким образом от ниобия).
Металлический ниобий получают различными способами:
восстановлением хлорида ниобия при нагреве;
металлотермическим восстановлением пятиокиси ниобия алюминием;
способами применяемыми для восстановления тантала, с учётом несколько повышенной летучести ниобия при высокой температуре, по сравнению с танталом.
В результате длительного и сложного технологического процесса ниобий получают в виде порошка. Переработка порошков в компактные слитки, пригодные для различных целей, осуществляется главным образом спеканием порошков или плавкой в высоком вакууме.
ПРИМЕНЕНИЕ.
Применение ниобия в виде феррониобия и технически чистого металла в качестве легирующего элемента при производстве нержавеющих сталей, высоколегированных сплавов цветных металлов, твёрдых сплавов и магнитных материалов всё время возрастает.
Основная доля ниобия применяется в виде лигатурного сплава — феррониобия, в котором содержание ниобия составляет 35-57%; содержание углерода в этих лигатурах строго нормируется из расчета не превышения нормы 0,2%Св легируемой стали.
Ниобиевые сплавы находят всё большее применение в производстве космических летательных аппаратов. Из ниобиевых сплавов изготавливают трубы атомных реакторов, особенно теплообменников, заполненных жидкими щелочными металлами, а также детали турбореактивных двигателей, работающих при температурах до 1500ОС.
Пластинчатый ниобий нашёл применение в электронной промышленности (в рентгеновских трубках, высоковольтных выпрямителях).
Из ниобия и ниобиевых сплавов изготавливают нагреватели для работы в вакууме или в нейтральной атмосфере при температурах 1400 — 2000ОС.
Стали содержащие от 1 до5% ниобия, отличаются исключительной жаростойкостью и применяются для устройств котлов высокого давления. Добавка ниобия к специальным сортам стали резко повышает устойчивость сварных швов из этих сталей.
Чистый ниобий хорошо поглощает водород, при обычной температуре 1 грамм ниобия поглощает 100см3 газа, что в перспективе может быть использовано для создания двигателей на водородном горючем.
При сближении взаимодействующих атомов, например, атомов водорода, происходит перекрывание электронных облаков этих атомов. В результате перекрывания возрастает плотность отрицательного заряда в пространстве между ядрами атомов. Положительно заряженные ядра атомов притягиваются к отрицательно заряженной области перекрывания, что приводит к образованию устойчивой молекулы H 2 (рисунок 1.4). Образование химической связи возможно лишь в том случае, если спины взаимодействующих неспаренных электронов противоположно направлены.
Рисунок 1.4 – Возникновение общей электронной пары
при взаимодействии атомов водорода и образовании молекулы H 2
Схематически образование ковалентной связи на примере образования молекул водорода, хлороводорода и азота можно показать следующим образом:
В этих схемах внешние электроны атомов обозначают точками вокруг химического символа атома; общие для двух атомов электронные пары в образовавшейся молекуле показывают точками между символами атомов. При записи графических (структурных) формул химическую связь обозначают чёрточкой, которая заменяет обозначение общей электронной пары:
Химическая связь, образованная общей для двух атомов парой электронов, называется ковалентной связью . Валентность – это число химических связей, образуемых атомом данного элемента.
Выше рассмотрены примеры, в которых ковалентная связь образуется в результате взаимодействия неспаренных электронов, изначально принадлежавших двум различным атомам, и образования общей электронной пары. Такой механизм образования ковалентной связи называется обменным . Именно по обменному механизму образованы химические связи в молекулах водорода, хлороводорода и азота.
Кроме обменного механизма существует донорно-акцепторный механизм образования ковалентной связи, сущность которого можно показать на
примере образования иона аммония. Атом азота в молекуле аммиака связан с тремя атомами водорода тремя ковалентными связями, образованными по обменному механизму (крестиками в формуле аммиака показаны электроны, изначально принадлежавшие атомам водорода). Кроме того, у атома азота есть два спаренных электрона (неподелённая электронная пара). Такая пара электронов тоже может участвовать в образовании ковалентной связи с другим атомом, если во внешнем электронном слое этого атома ест ь свободная орбиталь. Незаполненная орбиталь есть у иона водорода, который вообще лишён электронов. При взаимодействии молекулы аммиака с ионом водорода ковалентная связь возникает вследствие того, что неподелённая пара электронов атома азота занимает свободную орбиталь иона H + и становится общей для обоих атомов. В результате этого взаимодействия образуется ион аммония (NH 4 +):
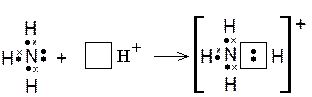
Именно по донорно-акцепторному механизму образованы ковалентные связи в комплексных ионах (см. раздел 3.1 «Понятие о комплексных соединениях»).
В задании № 1 студентам предлагается записать сокращённые электронные формулы и электронно-графические схемы атомов заданных элементов в основном и возбуждённом состояниях (если возбуждённое состояние может быть реализовано в химическом процессе), а также кратко охарактеризовать биологическую роль данного элемента в живых организмах.
Пример 1.1 азота в основном состоянии, проанализируйте возможность существования возбуждённых состояний и валентные возможности атома азота, охарактеризуйте биологическую роль азота в живых организмах.
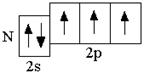
 Азот – p-элемент; у p-элементов валентными электронами (т.е. электронами, участвующими в образовании химических связей) являются электроны внешнего энергетического уровня, поэтому сокращённая электронная формула должна отражать строение внешнего энергетического уровня атома азота. Т.к. азот – элемент второго периода, то внешние электроны располагаются на втором энергетическом уровне, который образован одной s- и тремя p-орбиталями. Азот – p-элемент пятой группы, поэтому число электронов на внешнем уровне равно 5, из которых два располагаются на более низкой по энергии 2s-орбитали и ещё 3 – на p-орбиталях.
Азот – p-элемент; у p-элементов валентными электронами (т.е. электронами, участвующими в образовании химических связей) являются электроны внешнего энергетического уровня, поэтому сокращённая электронная формула должна отражать строение внешнего энергетического уровня атома азота. Т.к. азот – элемент второго периода, то внешние электроны располагаются на втором энергетическом уровне, который образован одной s- и тремя p-орбиталями. Азот – p-элемент пятой группы, поэтому число электронов на внешнем уровне равно 5, из которых два располагаются на более низкой по энергии 2s-орбитали и ещё 3 – на p-орбиталях.
Сокращённая электронная формула атома азота в основном состоянии: 2s 2 2p 3 . Поскольку на втором энергетическом уровне отсутствуют d-орбитали, то возбуждённое состояние атома азота не может быть реализовано. Поэтому атом азота может образовать за счёт трёх неспаренных электронов 3 ковалентные связи по обменному механизму и 1 связь по донорно-акцепторному механизму за счёт неподелённой электронной пары. Таким образом, максимальная валентность атома азота равна 4.
Азот – важнейший биогенный элемент, необходимый для существования животных и растений, он входит в состав аминокислот, важнейших биополимеров: белков, нуклеиновых кислот (ДНК, РНК), а также, витаминов, гормонов (например, адреналин, тироксин), нуклеопротеидов, хлорофилла, гемоглобина.
Пример 1.2 Запишите сокращённые электронно-графическую схему и электронную формулу атома ниобия в основном состоянии, проанализируйте возможность существования возбуждённых состояний и валентные возможности атома ниобия, охарактеризуйте биологическую роль ниобия.
Ниобий – d-элемент; у d-элементов валентными электронами являются электроны внешнего энергетического уровня и d-предвнешнего подуровня. Поскольку ниобий элемент пятого периода, то сокращённая электронная формула должна отражать строение внешнего (пятого) энергетического уровня и
4d-подуровня. Пятый энергетический уровень образован одной s-, тремя p-,
пятью d- и семью f-орбиталями:
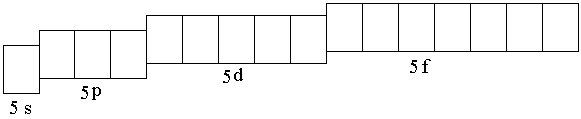
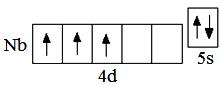
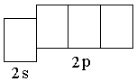
 В атоме любого d-элемента в невозбуждённом состоянии из всех орбиталей внешнего энергетического уровня занята только s-орбиталь, поэтому остальные орбитали при записи сокращённой электронно-графической схемы можно не указывать. Таким образом, валентные электроны в атоме ниобия будут располагаться на 5s-орбитали внешнего уровня и 4d-орбиталях предвнешнего. На s-орбиталях внешнего уровня у атомов
В атоме любого d-элемента в невозбуждённом состоянии из всех орбиталей внешнего энергетического уровня занята только s-орбиталь, поэтому остальные орбитали при записи сокращённой электронно-графической схемы можно не указывать. Таким образом, валентные электроны в атоме ниобия будут располагаться на 5s-орбитали внешнего уровня и 4d-орбиталях предвнешнего. На s-орбиталях внешнего уровня у атомов
d-элементов располагаются 2 электрона (если нет «проскока» электрона). Ниобий – третий d-элемент пятого периода, поэтому на d-орбиталях будет находиться 3 электрона. Таким образом, электронная формула атома ниобия в невозбуждённом состоянии 4d 3 5s 2 . Следует обратить внимание, что общее число валентных электронов в атоме ниобия (5) равно номеру группы, в которой находится элемент. При возбуждении атома ниобия пара электронов на 5s-орбитали распаривается, и один из электронов переходит на 5p-орбиталь:
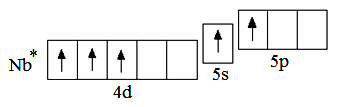
Сокращённая электронная формула атома ниобия в возбуждённом состоянии Nb* – 4d 3 5s 1 5p 1 . Как видно из электронно-графической схемы атома ниобия в возбуждённом состоянии, максимальная валентность атома ниобия равна 5.
Ниобий является неотъемлемым микроэлементом человеческого организма. Он концентрируется в костях, печени, мышцах, крови. Биологическая роль ниобия малоизучена. Известно, что ниобий гипоаллергенен: его можно безопасно использовать для введения в тело, так как он не вызывает биологического отторжения организмом. Это ценное свойство ниобия используется в восстановительной хирургии.
Ниобий – цена данного серо-стального металла в последние годы стремительно растет , поскольку материал все более активно применяют в производстве низколегированных сталей, которые главным образом предназначены для газопроводов и нефтепроводов. Нужно отметить, что на протяжении последних пятнадцати лет потребление ниобия в мире возрастает ежегодно на четыре – пять процентов. Данный металл в чистом виде крайне пластичен, поэтому его прокатывают в тонкие листы, толщиной порядка 0,01 миллиметр, в холодном состоянии, не применяя промежуточный отжиг.
Одному физику Камерлинг-Оннес из Голландии в 1911-ом году впервые удалось наблюдать уникальное явление сверхпроводимости. Когда в проводнике понизилась температура, в нем произошло скачкообразное исчезновение сопротивления электричеству. Таким сверхпроводником изначально была ртуть, однако ниобий стал первым важнейшим техническим материалом с подобным свойством. Кроме того что этот металл вобрал в себя комплекс свойств, необходимых технике, он еще и выглядит весьма красиво. Ниобий представляет собой блестящий, белый металл, который ювелиры даже пробовали применять для изготовления часовых корпусов.
Сплавами ниобия с вольфрамом либо рением в некоторых случаях заменяют такие благородные металлы, как:
- платина,
- золото,
- и иридий.
К тому же ниобиевый сплав с рением внешне очень напоминает металлический иридий, а еще он обладает практически аналогичными износостойкими характеристиками. За счет этого некоторые страны даже научились обходиться без дорогостоящего иридия при производстве перьевых напаек авторучек. Кроме того ниобий вводится в нержавеющую сталь при ее сварке, чтобы улучшить свойства образующегося шва.
Месторождения ценного металла - добыча ниобия по странам.
Преимущественно ниобий добывают в Канаде и Бразилии (здесь находится примерно 99 процентов от всех мировых месторождений ценного металла). Также добыча осуществляется в Австралии. Американская геологическая служба оценила мировые запасы этого материала по содержанию металла на примерном уровне в 4,3 миллиона тонн. В природной среде ниобий содержится в колумбите и пирохлоре. Эти элементы содержат в себе переменные пропорции тантала и ниобия. Пирохлор в первую очередь добывают именно ради ценного метала, а вот колумбит – больше ради тантала, ниобий из него извлекается в качестве побочного продукта.
Сколько стоит металл ниобий? Цена за грамм/килограмм.
В 2007-ом году цены на этот материал возросли более, чем в два раза. Причиной этого стал рост потребление металла, поскольку необходимо было оправдать издержки производства, которые постепенно возрастали (преимущественно посредством чрезмерного подорожания носителей энергии). Также стоимость ниобия стала выше с целью компенсации затрат на увеличение производственных мощностей. Эксперты прогнозируют, что в будущем и дальше будет дорожать ниобий. Цена за кг этого материала может достигнуть 39 долларов . На рынке России данный металл является дефицитным товаром, удовлетворить потребность в нем удается лишь благодаря экспорту.
Необычные, инновационные деньги – выпуск монеты Австрии из ниобия.
Монетный австрийский двор в 2003-ем году выпустил в свет инновационные, биметаллические монеты. Внешнее кольцо таких монет выполнено из 900-пробного серебра, тогда, как внутренний круг изготовлен из чистого ниобия 998-ой пробы. Необычные деньги произвели фурор, их выпуск ознаменовался небывалым успехом. Поскольку эксперимент прошел удачно, в следующем году монетный двор Австрии выпустил еще одну новую монету, которая также стала желанной добычей многих коллекционеров. Тогда и зародилась традиция: каждую весну на монетном дворе чеканят новые монеты, которые сочетают в себе драгоценные металлы.
Секрет популярности таких монет заключается преимущественно в использовании драгоценного металла ниобия. Этот материал является крайне редким. Кроме того интерес вызывает необыкновенный цвет монет. Раньше окрашивали исключительно поверхности металлических денег при помощи всевозможных эмалей, а для новых австрийских монет применяют анодное окисление, чтобы перекрасить сам металл. Проводится такой химический процесс в специальной жидкости – электролите. Она проводит электрический ток за счет диссоциации на ионы. В роли электролита также можно применять кислотные и солевые растворы.
Благодаря анодированию металл сверху покрывается тончайшей оксидной пленкой, способной приобретать различные оттенки. Глядя на такую монету из ниобия, кажется, что она светится и переливается всевозможными цветами. Подобный визуальный эффект достигается благодаря преломлению лучей света. Часть из них проходит через оксидный прозрачный слой и отражается от металлической поверхности. Вторая часть отражается прямо от пленочной поверхности. В итоге происходит интерференция света, которая и позволяет наблюдать широкую гамму цветов.
Стоит начать с того, что ниобий неразрывно связан с таким веществом, как тантал. Это даже несмотря на то что открыты эти материалы были не в одно и то же время.
Что такое ниобий
Что же на сегодняшний день известно о таком веществе, как ниобий? Он является химическим элементом, который располагается в 5 группе таблицы Менделеева, обладая атомным номером 41, а также атомной массой 92,9. Как и многие другие металлы, для этого вещества характерен серо-стальной блеск.
Одним из наиболее важных физических параметров этого его тугоплавкость. Именно благодаря этой характеристике применение ниобия стало широко распространено во многих отраслях промышленности. Температура плавления этого вещества - 2468 градусов по Цельсию, а температура кипения - 4927 градусов по Цельсию.
Химические свойства этого вещества также находятся на высоком уровне. Он характеризуется высоким уровнем устойчивости к воздействию отрицательных температур, а также к воздействию большинства агрессивных сред.
Производство
Стоит сказать о том, что наличие руды, которая содержит элемент Nb (ниобий), гораздо больше, чем той, что содержит тантал, но проблема заключается в скудности содержания самого элемента в этой руде.
Чаще всего для того, чтобы получить этот элемент, осуществляется процесс термического восстановления, в котором участвует алюминий или же кремний. В результате проведения этой операции получаются соединения феррониобий и ферротанталониобий. Стоит отметить, что получение металлического варианта этого вещества осуществляется с этой же руды, но при этом используется более сложная технология. Тигли из ниобия и другие полученные материалы характеризуются очень высокими эксплуатационными характеристиками.

Методы получения ниобия
В настоящее время одними из наиболее развитых направлений получения этого материала являются алюминотермическое, натриетермическое и карботермическое. Отличие между этими типами заключается также и в прекурсорах, которые используются для восстановления ниобия. Допустим, в натриетермическом способе используется K2NbF7. А вот, к примеру, при алюминотермическом способе применяется пятиокись ниобия.
Если говорить о карботермическом способе получения, то эта технология подразумевает под собой смешение Nb с сажей. Проходить этот процесс должен в высокотемпературной и водородной среде. В результате проведения этой операции будет получен карбид ниобия. Второй этап заключается в том, что водородная среда заменяется вакуумной, а температура сохраняется. В этот момент к карбиду ниобия добавляется его оксид и получается сам металл.

Важно отметить, что среди форм выпускаемого металла довольно распространен ниобий в слитках. Этот продукт предназначается для производства сплава на базе металла, а также других различных полуфабрикатов.
Также может выпускаться штабик этого материала, который разделяется на несколько категорий в зависимости от чистоты вещества. Меньше всего примесей содержится в штабике с маркировкой НБШ-00. Класс НБШ-0 характеризуется более высоким наличием таких элементов, как железо, титан и кремний тантала. Категория, которая обладает наиболее высоким показателем примесей, НБШ-1. Можно добавить, что у ниобия в слитках такой классификации не имеется.
Альтернативные способы производства
К альтернативным способам можно отнести бестигельную электроннолучевую зонную плавку. Этот процесс позволяет получать монокристаллы Nb. Тигли из ниобия производятся с использованием этого метода. Он относится к порошковой металлургии. Его применяют для того, чтобы сначала получить сплав этого материала, а после и его чистый образец. Наличие этого метода стало причиной тому, что довольно часто встречаются объявления о покупке ниобия. Этот способ позволяет использовать для получения чистого металла не саму руду, добыть которую довольно сложно, или же концентрат из нее, а вторичное сырье.

К еще одному альтернативному методу производства можно отнести прокат ниобия. Стоит отметить, что большинство различных фирм отдает предпочтение покупке именно прутьев, проволоке или листовому металлу.
Прокат и фольга
Фольга из этого материала представляет собой довольно распространенный полуфабрикат. Он является наиболее тонким листом проката этого вещества. Используется это сырье для производства некоторых изделий и деталей. Фольга из ниобия получается из чистого сырья путем холодного проката Nb слитков. Полученные изделия характеризуются такими показателями, как высокая устойчивость к коррозии, воздействию агрессивной среды, а также высокой температуры. Прокат ниобия и его слитков дает также такие характеристики, как стойкость изделия к износу, высокая пластичность, хорошая поддаваемость обработке.

Продукты, полученные таким образом, чаще всего используются в таких сферах деятельности, как авиастроение, ракетостроение, медицина (хирургия), радиотехника, электротехника, атомная энергетика, ядерная энергетика. Фольга из ниобия упаковывается в катушки и хранится в сухом, защищенном от попадания влаги месте, а также в защищенном месте от механического воздействия со стороны.
Применение в электродах и сплавах
Применение ниобия очень широко распространено. Он может использоваться, как хром и никель, в качестве материала, который входит в состав железного сплава, использующегося для производства электродов. Из-за того, что ниобий, как и тантал, способен образовывать сверхтвердый карбид, его часто применяют для производства сверхтвердых сплавов. Можно добавить, что в настоящее время пробуют при помощи этого материала улучшать свойства сплавов, полученных на основе

Так как ниобий является сырьем, способным создавать карбидные элементы, то он, как и тантал, применяется в качестве легирующей смеси при производстве стали. Стоит отметить, что долгое время применение ниобия в качестве примеси к танталу считалось отрицательным действием. Однако на сегодняшний день мнение изменилось. Было установлено, что Nb может выступать в качестве заменителя танталу, причем с большим успехом, так как из-за меньшей атомной массы можно использовать меньшее количество вещества, сохраняя все старые возможности и эффекты изделия.
Применение в электрической технике
Стоит подчеркнуть, что применение ниобия, как и его брата тантала, возможно в выпрямителях, благодаря тому, что они обладают свойством униполярной проводимости, то есть эти вещества пропускают электрически ток лишь в одном направлении. Возможно использование этого металла для создания таких устройств, как аноды, что используются в мощных генераторах и усилительных лампах.
Очень важно отметить, что применение ниобия дошло и до атомной энергетики. В этой отрасли изделия из этого вещества применяются в качестве конструкционных материалов. Это стало возможным, так как наличие Nb в деталях делает их устойчивыми к жару, а также придает им высокие качества химической стойкости.

Отличные физические характеристики этого металла привели к тому, что его довольно широко используют в ракетной технике, в реактивных самолетах, в газовых турбинах.
Производство ниобия в России
Если говорить о запасах этой руды, то всего насчитывается около 16 млн тонн. Наибольшее месторождение, занимающее примерно 70% всего объема, находится в Бразилии. На территории России же располагается около 25% запасов данной руды. Данный показатель считается значительной частью от всех запасов ниобия. Наибольшее месторождение этого вещества находится в Восточной Сибири, а также на Дальнем Востоке. На сегодняшний день на территории Российской Федерации добычей и производством этого вещества занимается компания Ловозерский ГОК. Можно заметить, что производством ниобия в России занималась также фирма "Стальмаг". Она разрабатывала татарское месторождение этой руды, однако в 2010 году была закрыта.
Также можно добавить, что занимается производством оксида ниобия. Его они получают, перерабатывая лопаритовый концентрат. Это предприятие вырабатывает от 400 до 450 тонн этого вещества, большая часть из которого уходит на экспорт в такие страны, как США и Германия. Часть оставшегося оксида уходит на Чепецкий механический завод, который производит как чистый ниобий, так и его сплавы. Там располагаются значительные мощности, позволяющие производить до 100 тонн материала в год.
Металл из ниобия и его стоимость
Несмотря на то что сфера применения этого вещества довольно широка, основное предназначение - это космическая и ядерная промышленность. По этой причине Nb относится к стратегическим материалам.
Основные параметры, которые влияют на стоимость ниобия:
- чистота сплава, большое количество примесей снижает цену;
- форма поставки материала;
- объемы поставляемого материала;
- расположение пункта приема руды (разные регионы нуждаются в разном количестве элемента, а значит и цена на него отличается).
Примерный список цен на материал в Москве:
- ниобий марки НБ-2 стоит в пределах 420-450 рублей за кг;
- стружка ниобия стоит от 500 до 510 рублей за кг;
- штабик марки НБШ-00 стоит от 490 до 500 рублей за кг.
Стоит отметить, что, несмотря на огромную стоимость этого товара, спрос на него только увеличивается.
- Рецепты варенья из кабачков с лимоном, с курагой и в ананасовом соке
- Как приготовить вкусные куриные сердечки с картофелем в мультиварке Куриные сердечки рецепт в мультиварке с картофелем
- Сырный суп с курицей и грибами Куриный суп с сыром и грибами
- Четверка монет таро значение
- Что такое договор найма служебного жилого помещения?
- Хлеб по технологии в духовке на дрожжах
- Требования к главному бухгалтеру Нормативное регулирование бухгалтерского учета

 Live Journal
Live Journal Facebook
Facebook Twitter
Twitter