Тип гибридизации атомных
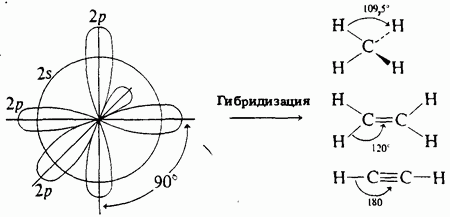
Валентные электроны атома углерода располагаются на одной -opбитали и двух -орбиталях. -Орбитали расположены под углом 90° друг к другу, а -орбиталь имеет сферическую симметрию (рис. 1-4). Таким образом, расположение атомных орбиталей углерода в пространстве не объясняет возникновения в органических соединениях валентных углов 109,5°, 120° и 180°.
В альдегидах функциональная группа представляет собой карбонил, связанный по меньшей мере с одним атомом водорода. С другой стороны, функциональная группа кетонов по-прежнему является карбонилом, связанным с двумя атомами углерода. Атом углерода карбонильной группы связан с кислородом и двумя другими атомами, все лежащими на одной плоскости, и поэтому является плоским тригонометрическим атомом углерода с углами изгиба примерно 120 °.
Ковалентные связи в карбоксильных соединениях
Атом кислорода, связанный простой связью с атомом углерода карбонила, представляет собой структурную характеристику нескольких классов органических соединений, две из которых представляют собой карбоновые кислоты и сложные эфиры. В карбоновых кислотах функциональная группа представляет собой карбоксигруппу, которая является углеродной группой, связанной с оксидирил. В сложных эфирах оксид водорода карбоновой кислоты замещается углеродом, который несет другие атомы.
Чтобы разрешить это противоречие, было введено понятие гибридизации атомных орбиталей. Для понимания природы трех вариантов расположения связей атома углерода понадобились представления о трех

Рис. 1-4. Гибридизация атома углерода

Структура метилацетата. В ацетилене каждый атом углерода связан только с двумя другими атомами. Поэтому для образования углерод-углеродных и углерод-водородных связей, которые определяют структуру этой молекулы, требуется только две гибридные орбитали. Таким образом, тройная связь, присутствующая в ацетилене, образована связью σ и двумя связями π. Нитрилы представляют собой органические соединения, которые содержат тройную связь между атомом углерода и атомом азота.
Кристаллографический метод рентгеновского излучения обеспечил окончательное испытание симметричной структуры бензола, где шесть атомов углерода занимают вершины правильного шестиугольника, и каждый из них связан с двумя другими атомами углерода и атомом водорода, все лежащие в одной плоскости. В бензоле все углерод-углеродные связи составляют 39 Å, а все углерод-водородные связи - 09 Å. Фактически, бензол обычно представлен шестиугольником без указания атомов углерода и водорода, которые его составляют.
Рис. 1-5. Гибридизация атома углерода в метане; 1 - атом углерода в основном состоянии; 2 - возбуждение (проматирование); 3 - -гибридизация; 4 - -гибридизированный атом углерода; 5 - образование четырех связей с атомами водорода; 6 - молекула метана
типах гибридизации (рис. 14). Возникновением концепции гибридизации мы обязаны Лайнусу Полингу, много сделавшему для развития теории химической связи.
Как видно на рисунке, эта молекулярная орбиталь характеризуется наличием двух почти круглых лопастей, один сверху и один ниже плоскости кольца. В бензоле электроны π полностью делокализуются на всем кольце, причем молекула очень симметрична со всеми углерод-углеродными связями одинаковой длины, большей, чем у двойной связи, но меньшей, чем у простой связи. Представление бензольной низкоэнергетической орбитали π.
Формула структуры бензола записывается с тремя двойными связями в шестиугольнике. Тем не менее, даже тогда Кекуле понял, что структура бензола с простыми и двойными связями чередовалась не представлена удовлетворительным образом свойства соединения и предположила, что структура бензола была представлена два формулами, в которых было обменены простые и двойные связи позиция. Кекуле думал, что эти структурные формулы соответствуют двум различным видам в динамическом равновесии между ними. Однако теперь известно, что структуры, которые отличаются друг от друга только положением электронов, не различимы и называются резонансными предельными формами.
Концепция гибридизации объясняет, каким образом атом углерода видоизменяет свои орбитали при образовании соединений. Ниже мы будем рассматривать этот процесс трансформации орбиталей постадийно. При этом надо иметь в виду, что расчленение процесса гибридизации на стадии или этапы есть, на самом деле, не более чем мысленный прием, позволяющий более логично и доступно изложить концепцию. Тем не менее заключения, о пространственной ориентации связей углеродного атома, к которым мы в итоге придем, полностью соответствуют реальному положению дел.
Истинная структура соединения представляет собой гибрид всех форм резонанса, которые могут быть написаны для него. Таким образом, ни один из этих двух структур Кекуле не обеспечивает точное представление о фактической молекуле бензола: гибридный резонанс, то есть двух формул Кекуле, взятые вместе, вместо того, чтобы предположить, что двойные связи не закреплены в одном положении, и что электроны π они делокализуются по всему кольцу.
Во время образования атомов атомные орбитали соединяются вместе, образуя молекулярные орбиты, т.е. просто: связывание. Изучение этого процесса показало, что орбиты валентной оболочки могут претерпевать изменения, которые приводят к образованию новых орбит, но имеют одинаковую форму и энергию.
Посмотрите на рис. 1-5, где показана электронная конфигурация атома углерода. Нас интересует только судьба валентных электронов. В результате первого шага, который называют возбуждением или промотированием, один из двух -электронов перемещается на свободную -орбиталь. На втором этапе происходит собственно процесс гибридизации, который несколько условно можно представить себе как смешение
Процесс гибридизации включает объединение разных типов орбит и повторное разделение на несколько идентичных частей. Если две орбиты гибридизованы, то две новые гибридизованные орбитали одинакового размера создаются и распределяются в пространстве, так что они взаимодействуют как можно меньше энергии.
Наконец, приведен пример молекулы аммиака - форма молекулы аммиака является результатом гибридизации атома азота. Три вновь образованные орбиты образуют связь с атомами водорода, а четвертая - свободной электронной парой. Вся молекула не имеет плоской структуры, но похожа на пирамиду.
одной и трех -орбиталей и образование из них четырех новых одинаковых орбиталей, каждая из которых на одну четверть сохраняет свойства -орбитали и на три четверти - свойства рорбиталей. Эти новые орбитали получили название -гибридных. Здесь надстрочный индекс 3 обозначает не число электронов, занимающих орбитали, а число -орбиталей, принявших участие в гибридизации. Гибридные орбитали направлены к вершинам тетраэдра, в центре которого находится атом углерода. На каждой -гибридной орбитали находится по одному электрону. Эти электроны и участвуют на третьем этапе в образовании связей с четырьмя атомами водорода, образуя валентные углы 109,5°. Чтобы облегчить восприятие материала, рядом с изображениями орбиталей показаны электронные конфигурации углеродного атома.
Образование плоских молекул с валентными углами 120° показано на рис. 1-6. Здесь, как и в случае -гибридизации, первый шаг - возбуждение. На втором этапе в гибридизации участвуют одна и две -орбитали, образуя три -гибридных орбитали, расположенных в одной плоскости под углом 120° друг к другу. Одна -орбиталь остается негибридизованной и располагается перпендикулярно плоскости -гибридных орбиталей. Затем (третий шаг) две -гибридные орбитали двух углеродных атомов объединяют электроны, образуя ко валентную связь. Такая связь, образующаяся в результате перекрывания "оконечностей" двух атомных орбиталей, называется -связью. Четвертый этап - образование второй связи между двумя углеродными атомами. Связь образуется в результате перекрывания обращенных друг к другу краев негибридизованных -орбиталей и называется -связью. Новая молекулярная орбиталь представляет собой совокупность двух занятых электронами -связи областей - над и под -связью. Обе связи ( и ) вместе составляют двойную связь между атомами углерода. И наконец, последний, пятый шаг - образование связей между атомами углерода и водорода с помощью электронов четырех оставшихся -гибридных орбиталей.
Третий, последний тип гибридизации, показан на примере простейшей молекулы, содержащей тройную связь молекулы ацетилена (рис. 1-7). Первый шаг - такой же, как раньше. На втором этапе происходит гибридизация одной и одной -орбиталей с образованием двух -гибрид-ных орбиталей и остаются неизмененными две -орбитали, необходимые для образования двух -связей. Следующий (третий) шаг - образование -связи между двумя -гибридизовэнными углеродными атомами, затем образуются две -связи (четвертый и пятый этапы). Одна -связь и две -связи между двумя атомами углерода вместе составляют тройную связь. И наконец, нашестом этапе образуются связи с двумя атомами водорода. Молекула ацетилена имеет линейное строение, все четыре атома лежат на одной прямой.
Мы показали, каким образом три основных в органической химии типа геометрии молекул возникают в результате различных трансформаций атомных орбиталей углерода. Можно предложить два способа определения типа гибридизации различных атомов в молекуле.
Рис. 1-6. (см. скан) -Гибридизация атомов углерода в этилене: 1 - возбуждение; 2 - -гибридизация; 3 - негибридизованная -орбиталь; -гибридные орбитали; 5 - образование -связи между двумя атомами углерода; 6 - образование -связи; 7 - образование четырех связей с атомами водорода или бериллий следует принимать во внимание конфигурацию атомов. Полезно обратиться к учебнику общей химии.
Для обычных органических молекул следует пользоваться простым и удобным способом 2.
Гибридизация - это мысленная операция превращения обычных (энергетически наиболее выгодных) атомных орбиталей в новые орбитали, геометрия которых соответствует экспериментально определенной геометрии молекул.
Инструкция
Рассмотрите молекулу простейшего предельного углеводорода метана. Его формула выглядит следующим образом: CH4. Пространственная модель молекулы представляет собою тетраэдр. Атом углерода образует с четырьмя атомами водорода совершенно одинаковые по длине и энергии связи. В них, согласно вышеприведенному примеру, участвуют 3 – Р электрона и 1 S – электрон, орбиталь которого стала в точности соответствовать орбиталям трех других электронов в результате произошедшей гибридизации . Такой тип гибридизации называется sp^3 гибридизацией. Она присуща всем предельным углеводородам .
А вот простейший представитель непредельных углеводородов – этилен. Его формула выглядит следующим образом: С2Н4. Какой тип гибридизации присущ углероду в молекуле этого вещества? В результате ее образуются три орбитали в виде несимметричных «восьмерок», лежащих в одной плоскости под углом 120^0 друг к другу. Их образовали 1 – S и 2 – Р электрона. Последний 3-й Р – электрон не видоизменил свою орбиталь, то есть она осталась в виде правильной «восьмерки». Такой тип гибридизации называют sp^2 гибридизацией.
Как же образуются связи в молекуле этилена ? Две гибридизованные орбитали каждого атома вступили во взаимодействие с двумя атомами водорода. Третья гибридизованная орбиталь образовала связь с такой же орбиталью другого атома углерода . А оставшиеся Р – орбитали? Они «притянулись» друг к другу по обе стороны от плоскости молекулы. Между атомами углерода образовалась двойная связь. Именно атомам с «двойной» связью присуща sp^2 гибридизация .
А что происходит в молекуле ацетилена или этина ? Его формула выглядит следующим образом: С2Н2. В каждом атоме углерода гибридизации подвергаются только два электрона: 1 --S и 1 – Р. Остальные два сохранили орбитали в виде «правильных восьмерок», перекрывающихся» в плоскости молекулы и по обе стороны от нее. Вот поэтому такой тип гибридизации носит название sp – гибридизации. Она присуща атомам с тройной связью.
Все слова , существующие в том или ином языке, можно разделить на несколько групп. Это важно при определении как значения, так и грамматических функций слова . Отнеся его к определенному типу , вы можете видоизменять его в соответствии с правилами, даже если оно вам раньше не встречалось. Типами элементов слова рного состава языка занимается лексикология.
Вам понадобится
- - текст;
- - словарь.
Инструкция
Выберите слово, тип которого вы хотите определить. Принадлежность его к той или иной части речи пока не играет роли, как и форма, и функция его в предложении. Это может быть абсолютно любое слово. Если оно не указано в задании, выпишите первое попавшееся. Определите, называет ли оно предмет, качество, действие или нет. По этому параметру все слова делятся на знаменательные, местоименные, числительные, служебные и междометные. К первому типу относятся существительные, прилагательные, глаголы и наречия . Именно они обозначают названия предметов, качеств и действий. Второй тип слов, у которых есть функция называния - местоименный. Способность называть отсутствует у числительного , междометного и служебного типов. Это сравнительно небольшие группы слов, но они есть в каждом языке .
Определите, способно ли заданное слово выражать понятие. Эта функция есть у слова рных единиц знаменательного типа, ведь именно они и формируют понятийный ряд любого языка. Однако любое число тоже относится к разряду понятий, а соответственно, числительное тоже несет в себе эту функцию. Есть она и у служебных слов, а вот у местоимений и междометий - отсутствует.
Рассмотрите, как будет себя вести слово, если оно окажется в предложении. Может ли оно являться членом предложения ? Им может быть любое слово знаменательного типа. Но эта возможность есть и у местоимения , а также у числительного. А вот служебные слова играют вспомогательную роль, ни подлежащим, ни сказуемым , ни второстепенными членами предложения они быть не могут, как и междометия.
Для удобства можно составить табличку из четырех столбцов шести строк. В верхней строке назовите соответствующие столбцы «Типы слов», «Называние», «Понятие» и «Способно ли быть членом предложения». В первом левом столбце запишите названия типов слов, их всего пять. Определите, какими функциями обладает заданное слово, а каких у него нет. В соответствующих графа поставьте плюсы и минусы . Если во всех трех графах стоят плюсы, то это знаменательный тип. У местоименного плюсы будут стоять в первом и третьем столбцах, у числительных - во второй и в третьей. Служебные слова могут только выражать понятие, то есть имеют один плюс во второй графе. Напротив междометий во всех трех столбцах будут стоять минусы.
Видео по теме
Гибридизацией называется процесс получения гибридов – растений или животных, произошедших от скрещения разных сортов и пород. Слово гибрид (hibrida) с латинского языка переводится как «помесь».

Гибридизация: естественная и искусственная
Процесс гибридизации в биологии основан на объединении в одной клетке генетического материала разных клеток от разных особей. Различается внутривидовая гибридизация и отдаленная, при которой происходит соединение разных геномов. В природе естественная гибридизация происходила и происходит без участия человека постоянно. Именно скрещиваясь внутри вида, изменялись и улучшались растения и появлялись новые сорта и породы животных. С точки зрения химии происходит гибридизация ДНК, нуклеиновых кислот, изменения на атомном и внутриатомном уровнях.
В академической химии под гибридизацией понимается специфическое взаимодействие в молекулах вещества атомных орбиталей. Но это не реальный физический процесс, а лишь гипотетическая модель, концепция.
Гибриды в растениеводстве
В 1694 году немецкий ученый Р. Камерариус предложил искусственно получать гибриды . А в 1717 году английский садовник Т. Фэрчайдл впервые скрестил разные виды гвоздик. Сегодня внутривидовая гибридизация растений производится с целью получения высокоурожайных или приспособленных, например, морозостойких сортов. Гибридизация форм и сортов является одним из методов селекции растений. Таким образом создано огромное количество современных сортов сельхозкультур.
При отдаленной гибридизации, когда скрещиваются представители разных видов и происходит объединение разных геномов, полученные гибриды в большинстве случаев не дают потомство или производят помеси низкого качества. Именно поэтому нет смысла оставлять семена созревших на грядке огурцов-гибридов, а всякий раз покупать их семена в специализированном магазине.
Селекция в животноводстве
В животном мире естественная гибридизация, как внутривидовая, так и отдаленная, также имеет место. Мулы были известны человеку еще за две тысячи лет до нашей эры. И в настоящее время мул и лошак используется в домашнем хозяйстве как относительно дешевое рабочее животное. Правда, такая гибридизация является межвидовой, поэтому самцы-гибриды рождаются обязательно стерильными. Самки же очень редко могут дать потомство.
Мул – это гибрид кобылицы и осла. Гибрид, полученный от скрещивания жеребца и ослицы, называется лошак. Специально разводятся мулы. Они выше и сильнее лошака.
А вот скрещивание домашней собаки с волком было очень распространенным занятием у охотников. Затем, полученное потомство подвергалось дальнейшей селекции, в результате создавались новые породы собак. Сегодня селекция домашних животных – важная составляющая успешности отрасли животноводства. Гибридизация проводится целенаправленно, с ориентацией на заданные параметры.
- Хлеб по технологии в духовке на дрожжах
- Требования к главному бухгалтеру Нормативное регулирование бухгалтерского учета
- Биография. Базаров Т. Ю., Еремин - Управление персоналом Тахир базаров управление персоналом
- Михаил Светлов — Гренада: Стих Я хату покинул пошел воевать чтоб землю
- Колики у новорожденных, лечение в домашних условиях Народные средства против коликов у новорожденных
- Так делать или нет прививку от гриппа?
- Оформление спортивного уголка в доу своими руками

 Live Journal
Live Journal Facebook
Facebook Twitter
Twitter