Изменение характеристик элементов в таблице менделеева. Экзамен по химии - Периодический закон и периодическая система химических элементов Д. И. Менделеева. Закономерности изменения свойств элементов малых периодов и главных подгрупп в зависимости от
Дмитрий Иванович Менделеев создал Периодическую систему в процессе работы над своим учебником «Основы химии», добиваясь максимальной логичности в изложении материала. Закономерность изменения свойств элементов, образующих систему, получила название Периодического закона.
Согласно периодическому закону, сформулированному Менделеевым в 1869 году, свойства химических элементов находятся в периодической зависимости от их атомных масс. То есть с увеличением относительной атомной массы, свойства элементов периодически повторяются (точнее, веществ, образованных элементами, но это часто опускают, говоря «свойства элементов»).
Диаграмма Полинга После стрелок суб-уровни заполняются в порядке возрастания энергии. Пример: Дайте электронное распределение кислорода в основном состоянии. Важно: продолжайте движение только на диаграмме, когда суб-уровень заполнен максимум электронами.
Ньюлендс поместил химические элементы в возрастающий порядок атомных масс и проверил, что каждые восемь элементов свойства повторяются, как музыкальные масштабы. Поскольку Ньюлендс также был музыкантом, это правило стало известно как «Закон о окладе Ньюлендса». Эти таблицы были созданы, когда было известно только 63 химических элемента; например, благородные газы - гелий, неон, аргон, криптон, ксенон, радон - были обнаружены только после того, как Менделеев сделал вывод из результатов, полученных в нескольких экспериментах, о том, что химические и физические свойства элементов повторялись с определенной регулярностью в функция атомной массы элементов.
Сравните: периодичность смены времен года с течением времени.
Данная закономерность иногда нарушается, например, аргон (инертный газ) превышает по массе следующий за ним калий (щелочной металл). Это противоречие было объяснено в 1914 году при изучении строения атома. Порядковый номер элемента в Периодической системе – это не просто очередность, он имеет физический смысл – равен заряду ядра атома. Поэтому
современная формулировка Периодического закона звучит так:
Свойства химических элементов, а также образованных ими веществ находятся в периодической зависимости от заряда ядра атома.
Эта закономерность была высказана Менделеевым следующим образом. В дополнение к более полной, чем таблица Менделеева, Современная периодическая классификация представляет химические элементы в порядке возрастания атомных чисел. Моусли установил понятие атомного номера, подтвердив, что это значение лучше характеризует химический элемент, чем его атомную массу. Оттуда Закон Периодичности получил новое утверждение: многие физические и химические свойства элементов периодически меняются в последовательности их атомных чисел.
Химические свойства элементов связаны с их электронными распределениями, которые мы только что видели. По физическим свойствам элементов они подразделяются на металлы, аметилы или неметаллы, полуметаллы, благородные газы и водород. Только одиннадцать элементов классифицируются как аметиты, физическое поведение которых не очень однородно, хотя они проявляют сходное химическое поведение. Водород Это атипичный элемент, обладающий свойством сочетаться с металлами, аметилами и полуметаллическими.
Период – это последовательность элементов, расположенных в порядке возрастания заряда ядра атома, начинающаяся щелочным металлом и заканчивающаяся инертным газом.
В периоде, с увеличением заряда ядра, растет электроотрицательность элемента, ослабевают металлические (восстановительные) свойства и растут неметаллические (окислительные) свойства простых веществ. Так, второй период начинается щелочным металлом литием, за ним следует бериллий, проявляющий амфотерные свойства, бор – неметалл, и т.д. В конце фтор – галоген и неон – инертный газ.
В условиях окружающей среды это чрезвычайно огнеопасный газ. Они имеют 1'е в валентном слое. Он, как правило, теряет е и становится одновалентным катионом. Они, как правило, теряют их и становятся двухвалентным катионом. Они, как правило, теряют их и становятся трехвалентным катионом. Группа имеет полуметалл и 4 металла. Вы можете потерять их или поделиться ими. Они имеют 5'е в самом внешнем слое. Они имеют тенденцию выигрывать 3 'и / или делиться ими. Группа имеет 2 неметалла, 2 полуметалла и один металл.
Они имеют 6'е в валентном слое. Существует 3 неметалла и 2 полуметалла. Они имеют 8'е в валентном слое. Они не связываются, потому что у них есть последний полный слой. Это все металлы, большинство из которых имеет 2 'и в валентном слое. Они имеют предпоследний неполный слой, представляющий от 9 до 18'е. Предпоследний слой имеет 8 или 18 электронов. Переходные элементы имеют 2 электрона в последнем слое. Предпоследний слой является неполным, имеющим от 8 до 18 электронов.
(Третий период снова начинается щелочным металлом – это и есть периодичность)
1-3 периоды являются малыми (содержат один ряд: 2 или 8 элементов), 4-7 – большие периоды, состоят из 18 и более элементов.
Составляя периодическую систему, Менделеев объединил известные на тот момент элементы, обладающие сходством, в вертикальные столбцы. Группы – это вертикальные столбцы элементов, имеющих, как правило, валентность в высшем оксиде равную номеру группы. Группу делят на две подгруппы:
Внутренние переходные элементы имеют 2 электрона в валентном слое. Чтобы было возможно обсудить периодическое свойство, атомный радиус, рассмотрим атом как сферу; поэтому атомный радиус будет расстоянием от ядра до внешнего электрона. Эта стабильность обусловлена тем, что они представляют последний слой с полными электронами: с 8'е. Чтобы получить конфигурацию благородного газа, элементы могут иметь ионные, ковалентные или металлические связи; в зависимости от природы вовлеченных атомов.
Катионы и анионы притягиваются друг к другу, образуя кристаллическую решетку. Из этого притяжения вытекает ионная связь, так называемая, потому что она происходит между ионами. Появление: металлы, как правило, дают электроны из валентного слоя их атомов, делая их катионами.
Главные подгруппы содержат элементы малых и больших периодов, образуют семейства со сходными свойствами (щелочные металлы – I А, галогены – VII A, инертные газы – VIII A).
(химические знаки элементов главных подгрупп в периодической системе располагаются под буквой «А» или, в очень старых таблицах, где нет букв А и Б – под элементом второго периода)
Побочные подгруппы содержат элементы только больших периодов, их называют переходные металлы.
Неметаллы склонны получать электроны в валентном слое их атомов, превращая их в анионы. - Происходит между атомами с электроотрицательностью очень далеко друг от друга, между металлом и аметалом с переносом электрона от металла к аметилу. Правильной формулой ионного соединения является та, которая устанавливает минимальную пропорцию комбинации между атомами, чтобы сформировать электрически нейтральную систему.
Пример. Размер катиона всегда меньше размера родительского атома, а размер аниона всегда больше размера исходного атома. Изоэлектроника: химические вещества, которые имеют одинаковое количество электронов и электронных уровней, но различное количество протонов.
(под буквой «Б» или «B»)
В главных подгруппах с увеличением заряда ядра (атомного номера) растут металлические (восстановительные) свойства.
-
Периодический закон и периодическая система химических элементов Д . И . Менделеева . Закономерности изменения свойств элементов малых периодов и главных подгрупп в зависимости от их порядкового (атомного ) номера . -
Периодический закон и периодическая система химических элементов Д . И . Менделеева . Закономерности изменения свойств элементов малых периодов и главных подгрупп в зависимости от их порядкового (атомного ) номера . -
Закономерности изменения свойств элементов малых периодов и главных подгрупп в зависимости от их порядкового (атомного ) номера .
Строение электронных оболочек атомов первых 20 химических элементов периодической системы Д . И . Менделеева . -
Строение атомов химических элементов . Состав атомного атомов первых 20 химических элементов периодической системы Д . И . Менделеева . -
1. Соединения атомов углерода (С) друг с другом и другими элементами периодической системы Д . И . Менделеева . При этом образуются цепи и циклы. 2. Атом углерода может находиться в трех разных гибридных состояниях. -
...(например, Периодический закон и периодическая система химических элементов Д .И .Менделеева , теория строения органических соединений Д .М.Бутлерова, открытие законов термодинамики, становление и развитие химической кинетики и др.) -
Строение атомов химических элементов . Состав атомного ядра. Строение электронных оболочек атомов первых 20 химических элементов периодической системы Д . И . Менделеева . -
С учетом химического состава и строения исходных материалов выбирают наиболее рациональную конструкцию изделий и устанавли-вают оптимальные режимы технологических процессов их изготовления.В зависимости от размера, структурных элементов различают... -
6. Закономерности биологических ритмов учитывают при профилактике, диагностике и лечении заболеваний.
Физиологические ритмы, как правило, имеют периоды от долей секунды до нескольких минут (ритмы давления
Ритм - это универсальное свойство живых систем . -
Химические свойства . Важнейшими общими химическими свойствами ароматических углеводородов являются их склонность к реакциям замещения и большая прочность бензольного ядра.
Найдено похожих страниц:10
При таком типе связывания происходит разделение или спаривание электронов. Встречается между элементами с электроотрицательностью поблизости; Образующиеся электронные пары состоят из одного электрона от каждого атома и принадлежат одновременно обе связанным атомам. В этом случае не происходит ни усиления, ни потери электронов, а сформированные структуры электрически нейтральны. Множества, образованные ковалентными связями, представлены как изолированные единицы ограниченной величины, называемые молекулами; поэтому ковалентное связывание также называют молекулярным связыванием.
Химические свойства элементов проявляются при взаимодействии их атомов. Периодическая система элементов отражает закономерное изменение этих свойств.
Типы конфигураций внешних энергетических уровней атомов определяют основные особенности химического поведения элементов. Эти особенности являются специфическими для элементов главных подгрупп (s- и p-элементы), побочных подгрупп (-элементы) и -элементов (лантаноиды и актиноиды).
Вещества, образованные ковалентным связыванием, называются молекулярными веществами. Они могут быть твердыми, жидкими или газообразными. Примечание. Ковалентное связывание происходит только путем взаимопроникновения полузаполненных орбиталей. Из взаимопроникновения этих двух орбиталей получается молекулярная орбиталь, которая содержит пару электронов ковалентной связи.
Р-орбитали атома образуют углы 90 °. При этом можно предсказать, что угол, образованный двумя ковалентными связями, исходя из атома халькогена, составляет 90 °. О-атом имеет радиус, значительно меньший, чем атом других камбогенов. Поскольку р-орбитали атома образуют углы А и В, пространственно невозможно сформировать вторую сигма-связь между этими атомами. Исследования привели химиков к выводу, что их молекулы могут быть представлены следующим образом: Молекулярная формула.
Особое место занимают элементы первого периода (Н и Не). Высокая химическая активность атомарного водорода объясняется способностью легко отдавать единственный -элекрон, тогда как электронная конфигурация атома гелия весьма устойчива, что обусловливает его химическую инертность.
Поскольку у элементов главных подгрупп происходит заполнение внешних энергетических уровней (с равным номеру периода), свойства элементов заметно меняются по мере роста порядкового номера Так, во втором периоде (конфигурация - химически активный металл, легко теряющий электрон, - также металл, но менее активный. Металлический характер следующего элемента выражен слабо, все последующие элементы второго периода, у которых происходит заполнение -подуровня, являются уже неметаллами.
Связывание серы как кислорода, появляющееся с правой стороны, является ковалентной координатой или дательной связью. Он символизируется стрелкой в структурной формуле. Ковалентную связь можно классифицировать как полярную или неполярную: Аполярная ковалентная связь: когда происходит между аметилами одного и того же химического элемента.
Полярная ковалентная связь: когда происходит между аметилами разных элементов. Давайте посмотрим на некоторые примеры, используя значения, установленные Полиуном для электроотрицательности. Молекулярная геометрия будет очень полезна для нас, когда мы изучим полярность молекул. Во льду каждый атом О находится в центре и в вершинах воображаемого тетраэдра. Между каждыми двумя атомами О, один из которых находится в центре, а другой в вершине тетраэдра, является атомом Н, связанным с одним из О ковалентной связью, а с другой - водородной связью.
Восьмиэлектронная конфигурация внешнего энергетического уровня чрезвычайно прочна, поэтому неон - благородный газ.
Аналогичный характер изменения свойств наблюдается у элементов третьего периода, а также и -элементов всех последующих периодов. Однако ослабление прочности связи внешних электронов с ядром у элементов главных подгрупп по мере роста определенным образом сказывается на их свойствах. Так, у р-элементов одной и той же группы отмечается нарастание металлических свойств. В главной подгруппе VIII группы ослабляется устойчивость конфигурации (по мере увеличения ), вследствие чего уже криптон (четвертый период) приобретает способность образовывать химические соединения.
В этой структуре молекулы воды, связанные вместе, образуют шестиугольные циклы. Кристаллическая решетка металлов состоит из катионов металлов, среди которых электроны, полученные соответствующими атомами при образовании катионов. Эти электроны составляют так называемую металлическую связь.
Это модель электронного газа или модель моря электронов, потому что металлы можно считать сформированными катионами, погруженными в море электронов. Металлические сплавы представляют собой твердые смеси двух или более элементов, все или, по крайней мере, большинство из которых присутствуют, из металлических элементов.
Специфика -элементов четвертого - шестого периодов связана также с тем, что они отделены от -элементов совокупностями элементов, в атомах которых происходит заполнение предшествующих энергетических уровней.
У d-элементов побочных подгрупп достраиваются незавершенные уровни, главное квантовое число электронов которых на единицу меньше номера периода. Конфигурация внешних энергетических уровней d-элементов, как правило, Все d-элементы - металлы.
18-каратное золото - сплав золота и меди. Бронза - медно-оловянный сплав. Латунь - сплав меди и цинка. Сталь представляет собой железный сплав с небольшим количеством углерода. Легкий сплав - сплав алюминия и магния. «Металлический монель» - это никель и медный сплав. Серебряная амальгама - ртутный и серебряный сплав. Золотая амальгама - ртутный и золотой сплав. Аннотации.
Это графическое представление реакции качественно и количественно. В зависимости от возбудителя аналитическая реакция может быть названа фотолизом, пиролизом и электролизом. Когда простое вещество вытесняет элемент соединения. Эта реакция возникает только тогда, когда простое вещество более реакционноспособно, чем элемент, подлежащий смещению.
Экспериментальными исследованиями была установлена зависимость

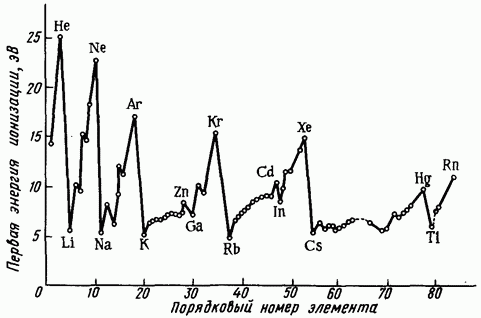
Рис. 1.7. Зависимость первой энергии ионизации от порядкового номера элемента Z
химических и физических свойств элементов от их положения в периодической системе.
Энергия ионизации.
Важнейшей характеристикой элемента, непосредственно связанной с электронной структурой атома, является энергия ионизации.
При обмене элементов или радикалов между составными веществами. Кислородный нокс равен -2. 2. Электронные пары связи, теоретически, назначаются на самый электроотрицательный атом. Они приводят к мнимым ионам, электрические заряды которых являются искомым носом. Среднее количество окисления элемента соответствует среднему арифметическому номеров окисления его атомов в соединении.
Например, соединение этиловый спирт. Концепция реакции окисления Это реакции, которые происходят с изменением количества окисления реагентов для продуктов. Это потеря электронов этим элементом. Это усиление электронов этим элементом. Химический состав содержит восстановительный элемент. Следовательно, оксидант - уменьшает редуктор - оксидные примеры. Проверьте явления окисления и восстановления. Обычно вещества, которые содержат элементы большей атомарности, находятся на одной стороне воды, то есть, если вода находится в реагентах, балансировка инициируется реагентами, и если вода находится в продуктах,, Попытайтесь убить других.
Энергией ионизации называется энергия, которую необходимо затратить для отрыва и удаления электрона от атома иона или молекулы. Энергия ионизции выражается в джоулях или электронвольтах, эВ . Энергия ионизации является мерой восстановительной способности атома. Чем ниже значение энергии ионизации, тем выше восстановительная способность атома. Атомы, теряя электроны, превращаются в положительно заряженные ионы. Для данного атома или иона энергия, необходимая для отрыва и удаления первого электрона, называется первой энергией ионизации второго - второй энергией ионизации
В ионных уравнениях, добиваясь успеха попытками, следуйте последовательности: металл, аметал, кислород и водород. В ионных уравнениях, после уравновешивания, возьмите тест, то есть проверьте, была ли сумма нагрузки на реагент такой же, как и у продуктов. Южноамериканские исследования, которые производят синтетические алмазы. Это, с химической точки зрения, то же, что и природные. О природных алмазах можно сказать, что: они не имеют промышленного применения, используются только в ювелирных изделиях и украшениях. представляют собой изотопное углеродное разнообразие, такое как графит. отличаются от графита на типы атомов углерода, которые образуют его структуру. его твердость можно отнести к жестким ковалентным связям его тетраэдрической структуры. имеют, как и в графите, все скрещенные гибридные атомы углерода, что дает одинаковые.
Энергия ионизации увеличивается в следующем порядке: так как удаление электрона от электронейтрального атома происходит легче, чем от иона. На рис. 1.7 представлена зависимость от порядкового номера элемента Резкие максимумы соответствуют атомам благородных газов, которые обладают наиболее устойчивой электронной конфигурацией Минимумы кривой характерны для щелочных металлов, атомы которых, отдавая свой единственный -электрон внешнего уровня, приобретают конфигурацию атома предшествующего благородного газа. Таким образом, периоды на кривой рис. 1.7 полностью соответствуют периодам системы Менделеева. В пределах одного периода изменяется не монотонно. На кривой наблюдаются вторичные менее резкие максимумы, соответствующие
заполнению -подуровня у элементов II группы . У следующих за ними элементов III группы появление первого -электрона снова снижает энергию ионизации. Следующие максимумы на кривой отвечают элементам V группы что соответствует энергетически выгодному половинному заполнению -подуровня. У расположенных за ними элементов VI группы энергия ионизации снова снижается.
Во II группе периодической системы резкие вторичные максимумы, соответствующие объясняются влиянием застроенного d-подуровня. В пределах одной группы с увеличением значения обычно убывают, что связано с увеличением расстояния внешнего электронного уровня от ядра.
Сродство к электрону.
Сродством к электрону называется энергия, которая выделяется при присоединении электрона к атому, молекуле или радикалу. Она выражается в тех же единицах, что и энергия ионизации.
Атомы элементов-окислителей, принимая электроны, превращаются в отрицательно заряженные ионы. Энергия сродства к электрону атомов (как и энергия ионизации) закономерно изменяется в соответствии с характером электронных структур атомов элементов. В периодах слева направо сродство к электрону и окислительные свойства элементов возрастают. В группах сверху вниз сродство к электрону, как правило, уменьшается.
Галогены отличаются самым высоким сродством к электрону, так как при присоединении одного электрона к нейтральному атому они приобретают законченную электронную конфигурацию благородного газа. Щелочные металлы характеризуются низким сродством к электрону. Для решения вопроса о том, какой из атомов легче отдает или присоединяет электрон, учитывают оба показателя: энергию ионизации и сродство к электрону. Согласно Малликену, полусумма энергии ионизации и сродства к электрону называется электроотрицательностью (ЭО)
Учитывая сложность определения величины сродства к электрону, американский ученый Полинг предложил термохимическую систему, согласно которой электроотрицательности атомов А и В определяют исходя из энергий связей Шкала электроотрицательностей атомов по Полингу приведена на с. 28.
Электроотрицательность возрастает в направлении слева направо для элементов каждого периода и уменьшается в направлении сверху вниз для элементов одной и той же группы периодической системы Менделеева.
Размеры атомов и ионов (радиусы атомов и ионов).
Атомы и ионы не имеют строго определенных границ вследствие волновой природы электронов. Поэтому определяют условные радиусы атомов и ионов, связанных друг с другом химической связью в

кристаллах. На рис. 1.8 представлена кривая, выражающая периодическую зависимость радиусов атомов от порядкового номера элемента
Радиусы атомов металлов в периодах с ростом порядкового номера элемента уменьшаются, так как при одинаковом числе электронных слоев возрастает заряд ядра, а следовательно, и притяжение им электронов Наибольшее уменьшение радиусов наблюдается у элементов малых периодов, у которых происходит

Рис. 1.8. Зависимость радиусов атомов от порядкового номера элемента
заполнение электронами внешнего энергетического уровня. В больших периодах и -элементов наблюдается более плавное уменьшение радиусов при увеличении заряда ядра атома. В пределах каждой подгруппы элементов, как правило, радиусы атомов увеличиваются сверху вниз, так как возрастает число энергетических уровней.
Радиусы ионов отличаются от радиусов атомов, так как они или лишились нескольких электронов, или присоединили последние. Поэтому радиусы положительно заряженных ионов меньше, а радиусы отрицательно заряженных ионов больше радиусов соответствующих атомов. Радиусы ионов также находятся в периодической зависимости от порядкового номера элемента. Например, в пределах одной группы радиусы ионов одинакового заряда возрастают с увеличением номера элемента (заряда ядра).
Значение периодического закона.
Открытие Д. И. Менделеевым периодического закона имеет огромное значение для развития химии. Периодический закон обобщил большое число природных закономерностей, он явился научной основой химии. Прежде всего удалось систематизировать богатейший, но разрозненный материал, накопленный к тому времени поколениями химиков, по свойствам элементов и их соединений, уточнить многие понятия, например понятия «химический элемент» и «простое вещество». К моменту открытия периодического закона были известны 63 элемента. Менделеев предсказал существование многих не известных к тому времени элементов; скандия (экабор), галлия (экаалюминий) и германия (экасицилий).
В отличие от своих предшественников, пытавшихся дать ту или иную систематику элементов, Менделеев был убежден, что им открыт закон природы и, основываясь на нем, он подошел к оценке имевшихся экспериментальных данных, далеко не все из которых казались достоверными. В ряде случаев, основываясь на периодическом законе, им были изменены принятые в то время атомные массы элементов которые ранее были определены на основе ошибочных представлений о валентности элементов и составе соединений. Например, высшему оксиду урана приписывался состав вместо
В некоторых случаях Д. И. Менделеев расположил элементы в соответствии с закономерным изменением свойств, предполагая возможную неточность значений их атомных масс ). Этим была поставлена задача уточнения атомных масс указанных элементов, и для некоторых из них атомные массы были исправлены. Первоначально казалось, что открытие благородных газов нарушит периодичность изменения свойств элементов, однако затем были открыты остальные благородные газы, которые хорошо вписались в периодическую систему.
Предсказания ученого блестяще оправдались. С тех пор периодический закон и периодическая система элементов
Д. И. Менделеева служат научной базой прогнозирования в химии. С момента опубликования периодической системы элементов в ней появилось более 40 новых элементов. На основе периодического закона были получены искусственным путем трансурановые элементы, в том числе № 101, названный менделевием. Периодический закон позволил предсказать свойства не открытых еще элементов, например 117, 118, 119 и 120.
Периодический закон сыграл решающую роль в выяснении сложной структуры атома. С помощью периодической системы элементов удается определять физико-химические константы химических соединений на основе сопоставления известных величин. Периодический закон - фундамент химии, в первую очередь неорганической; он помогает решению задач синтеза веществ с заданными свойствами; разработке новых материалов, в частности полупроводниковых; подбору специфических катализаторов для различных химических процессов и т. д.
- Рецепты варенья из кабачков с лимоном, с курагой и в ананасовом соке
- Как приготовить вкусные куриные сердечки с картофелем в мультиварке Куриные сердечки рецепт в мультиварке с картофелем
- Сырный суп с курицей и грибами Куриный суп с сыром и грибами
- Четверка монет таро значение
- Что такое договор найма служебного жилого помещения?
- Хлеб по технологии в духовке на дрожжах
- Требования к главному бухгалтеру Нормативное регулирование бухгалтерского учета

 Live Journal
Live Journal Facebook
Facebook Twitter
Twitter