Электроотрицательность степень окисления строения вещества. Задания для самостоятельной работы

- Наименее электроотрицательным является химический элемент
- железо
- магний
- кальций
Следует обратить внимание на словосочетание «наименее электроотрицательный», т. е. элемент с наибольшими металлическими свойствами. Этот аргумент позволит исключить из возможных ответов азот, как неметалл, и остановиться на кальции, как наиболее активном из предложенных в задании металлов. Ответ: 4.
Многоатомные ионы представляют собой совокупности атомов, которые внутренне поддерживают такое же связующее устройство и чистый заряд независимо от любого другого элемента или элементов, с которыми они объединяются. Поэтому заряд на многоатомном ионе может быть обработан как число окисления для определения соотношения и доли комбинации или эмпирической формулы, когда они образуют ионные соединения. Подобно бинарным соединениям, образующимся между основными элементами группы, норганические соединения, содержащие многоатомные ионы, образуют сетчатые ионные решетки, которые настолько обширны, что они видны невооруженным глазом.
- Наиболее полярна химическая связь в одной из молекул
- ССl 4
- СВr 4
Знание закономерностей изменения электроотрицательности в периодах и группах Периодической системы Д. И. Менделеева позволяет исключить из списка четырёхвалентных соединений углерода метан СН 4 , а из оставшихся галогенидов остановиться на CF 4 , как на соединении углерода с наиболее электроотрицательным из всех химических элементов - фтором. Ответ: 2.
Различный размер многоатомных ионов приводит к некоторым интересным и уникальным упаковочным устройствам для ионной решетки, однако они неизменно являются твердыми веществами при комнатной температуре. В результате сульфат представляет собой анион чистого заряда. Откуда берутся эти два электрона? Как и другие ионные анионы, сульфат приобретает 2 электрона из катион, вещество с низкой электроотрицательностью, которое имеет тенденцию пролить лишние электроны для достижения конфигурации электронов благородного газа.
Это приводит к широкому разнообразию соединений, включая сульфат лития, сульфат магния, сульфат железа, сульфат меди, сульфат алюминия и т.д. многоатомные ионы так стабильны, что они часто невосприимчивы к энергетике нормальных химических процессов. Например, в реакции однократной замены водной фазы между сульфатом меди и цинковым металлом: использование двух электронов переносится из нейтрального цинка в катион меди. Высокая стабильность сульфата также очевидна, когда сульфатные соединения растворяются в воде.
- В молекулах хлороводорода и хлора химическая связь соответственно
- ионная и ковалентная полярная
- ионная и ковалентная неполярная
- ковалентная полярная и ковалентная неполярная
- водородная и ковалентная неполярная
Ключевым словом для быстрого и верного выполнения этого задания является слово «соответственно». В предложенных вариантах только один из ответов начинается со слов «ковалентная полярная», т. е. связи, характерной для хлороводорода. Ответ: 3.
В таблице слева показаны некоторые примеры многоатомных ионов. Следует отметить, что существует много и гораздо больше, но этот репрезентативный образец может быть использован для демонстрации общих характеристик многоатомных ионов в номенклатуре. Обратите внимание, что большинство из них - это анионы, содержащие кислород. Это правда в целом, но не эксклюзивно. Например, цианид и тиоцианид представляют собой анионы, которые не содержат кислорода, а аммоний - положительно заряженный катион. Обратите внимание, что один и тот же элемент может образовывать разные многоатомные ионы, объединяясь с кислородом в разных пропорциях.
- Степень окисления марганца в соединении, формула которого К 2 МnO 4 , равна
Знание правил расчёта степеней окисления элементов по формуле позволит выбрать верный ответ. Ответ: 3.
- Наименьшую степень окисления имеет сера в соли
- сульфат калия
- сульфит калия
- сульфид калия
- гидросульфат калия
Очевидно, быстрому выполнению этого задания будет способствовать перевод названий солей в формулы. Так как сера - элемент VIA группы, то её наименьшая степень окисления равна -2. Этому значению соответствует соединение с формулой K 2 S - сульфид калия. Ответ: 3.
Существует последовательная номенклатура, связанная с этими анионами. Многоатомный ион, содержащий наиболее распространенное отношение кислорода, дается окончанием «съедать». Многоатомный ион, содержащий один меньше кислорода, имеет свое окончание, измененное на «ите». Он определяется как заряд, который, как можно предположить, может представлять атом. Состояние окисления представляет собой целочисленное значение, и оно может быть как положительным, отрицательным, так и нулевым. Окислительное состояние атома подвергается изменению при химической реакции.
- Степень окисления +5 атом хлора имеет в ионе
- С1O - 4
- С1O -
- С1O - 3
- С1O - 2
При выполнении этого задания следует обратить внимание на то, что в условии даны не электронейтральные соединения, а ионы хлора с единичным отрицательным зарядом («-»). Поскольку сумма степеней окисления атомов в ионе равна заряду иона, суммарный отрицательный заряд атомов кислорода в искомом ионе должен иметь значение -6 (+5 - 6 = -1). Ответ: 3.
Если окисляющее состояние увеличивается, то говорят, что атом окисляется. И если он уменьшается, то атом претерпел сокращение. В реакции окисления и восстановления электроны переносятся. В чистых элементах состояние окисления равно нулю. Существует несколько правил, которые мы можем использовать для определения состояния окисления атома в молекуле.
Чистые элементы имеют нулевое состояние окисления. Для одноатомных ионов состояние окисления такое же, как и их заряд. В многоатомном ионе заряд равен сумме состояний окисления во всех атомах. Таким образом, состояние окисления неизвестного атома может быть найдено, если известно состояние окисления других атомов.
- Степень окисления -3 азот имеет в каждом из двух соединений
- NF 3 И NH 3
- NH 4 Cl и N 2 O 3
- NH 4 Cl и NH 3
- HNO 2 и NF 3
Для определения верного ответа необходимо мысленно разделить варианты ответов на левый и правый подстолбики. Затем выбрать тот, в котором соединения имеют более простой состав, - в нашем случае это правый подстолбик бинарных соединений. Анализ позволит исключить ответы 2 и 4, так как в оксиде и фториде у азота положительная степень окисления, как у менее электроотрицательного элемента. Этот аргумент позволяет исключить и ответ 1, так как в нём первое вещество - всё тот же фторид азота. Ответ: 3.
Для нейтральной молекулы сумма всех состояний окисления атомов равна нулю. Помимо вышеуказанных способов, состояние окисления также может быть рассчитано с использованием структуры Льюиса молекулы. Окислительное состояние атома определяется разностью числа валентного электрона атома, если атом нейтрален, а число электронов принадлежит атому в структуре Льюиса. Например, метиловый углерод в уксусной кислоте имеет состояние окисления -3. В структуре Льюиса углерод связан с тремя атомами водорода. Поскольку углерод является более электроотрицательным, шесть электронов в связях относятся к углероду.
- К веществам молекулярного строения не относятся
- углекислый газ
- метан
- хлороводород
- карбонат кальция
Следует обратить внимание на отрицательное суждение, заложенное в условии задания. Так как газообразные при обычных условиях вещества имеют в твёрдом состоянии молекулярную кристаллическую решётку, то условию задания не отвечают варианты 1-3. Отнесение карбоната кальция к солям ещё раз подтвердит верный ответ. Ответ: 4.
Углерод делает другую связь с другим углеродом; поэтому они разделяли два электрона связи одинаково. Итак, все вместе, в структуре Льюиса, углерод имеет семь электронов. Когда углерод находится в нейтральном состоянии, он имеет четыре валентных электрона. Поэтому разница между ними делает количество окисления углерода равным.
Окислительный номер является характеристикой центрального атома координационного соединения. Иногда заряд и количество окисления сходны, но иногда они различны. Например, блочные и блочные элементы имеют тот же номер окисления, что и их заряды. Кроме того, многоатомные ионы имеют такое же число окисления, как и заряд. Один и тот же элемент может иметь разные номера окисления, в зависимости от других атомов, с которыми он связан. В свободном элементе число окисления всегда равно нулю. Ионы переходных металлов, элементы имеют разные номера окисления.
- Верны ли следующие суждения о свойствах веществ и их строении?
А. Мокрое бельё высыхает на морозе потому, что вещества молекулярного строения способны к сублимации (возгонке).
Б. Мокрое бельё высыхает на морозе потому, что молекулы воды имеют низкую молекулярную массу.
- верно только А
- верно только Б
- верны оба суждения
- оба суждения не верны
Знание физических свойств веществ молекулярного строения позволяет решить, что причиной высыхания мокрого белья на морозе является способность льда к сублимации, а не дипольное строение молекул воды. Ответ: 1.
Итак, в чем разница между состоянием оксидации и номером окисления? Термин число окисления в основном используется в координационной химии. Он имеет несколько иное значение, чем состояние окисления. Когда определяется состояние окисления, учитывается электроотрицательность атомов в связи. Но при определении числа окисления электроотрицательность не учитывается. Все электроны в связи принадлежат лигандам.
Уже обсуждалось ранее о трудностях в обучении определению чисел окисления. Эти правила являются неточными, противоречивыми и требуют огромного количества исключений. «Они очень не в рукаве» - «Они должны быть математически». . Обычно используются электроотрицательности Полинга.
- Молекулярное строение имеет каждое из веществ, формулы которых приведены в ряду
- СO 2 , HNO 3 , СаО
- Na 2 S, Br 2 , NO 2
- H 2 SO 4 , Сu, O 3
- SO 2 , I 2 , НСl
Так как предложенные варианты содержат по три вещества, логично мысленно разделить эти варианты на три вертикальных подстолбика. Анализ каждого из них, начиная с веществ более простого состава (средний подстолбик), позволит исключить ответ 3, так как в нём содержится металл медь, имеющий металлическую кристаллическую решётку. Аналогичный анализ правого подстолбика позволит исключить ответ 1, так как он содержит оксид щёлочноземельного металла (ионная решётка). Из двух оставшихся вариантов необходимо исключить вариант 2, так как он содержит соль щелочного металла - сульфид натрия (ионная решётка). Ответ: 4.
Это получается путем построения структуры Льюиса. Эта работа направлена на то, чтобы ответить на обе проблемы, то есть на удаление искусственного и магического на распределение количества окисления путем предложения соответствующей математической формулы.
Первый набор правил основан на условном присвоении номера окисления водороду и кислороду, а также постулате, что алгебраическая сумма чисел окисления равна заряду вида. За этими основными правилами следует длинный список вторичных правил. Этот набор правил полностью аксиоматичен.
Задания для самостоятельной работы
- Степень окисления +5 азот проявляет в соединении, формула которого
- N 2 O 5
- N 2 O 4
- N 2 O
- Степень окисления хрома в соединении, формула которого (NH 4) 2 Cr 2 O 7 , равна
- Степень окисления азота уменьшается в ряду веществ, формулы которых
- NH 3 , NO 2 , KNO 3
- N 2 O 4 , KNO 2 , NH 4 Cl
- N 2 , N 2 O,NH 3
- HNO 3 , HNO 2 , NO 2
- Степень окисления хлора увеличивается в ряду веществ, формулы которых
- НСlO, НСlO 4 , КСlO 3
- Сl 2 , С1 2 O 7 , КСlO 3
- Са(С1O) 2 , КСlO 3 , НСlO 4
- КСl, КСlO 3 , КСlO
- Наиболее полярна химическая связь в молекуле
- аммиака
- сероводорода
- бромоводорода
- фтороводорода
- Вещество с ковалентной неполярной связью
- белый фосфор
- фосфид алюминия
- хлорид фосфора (V)
- фосфат кальция
- Формулы веществ только с ионной связью записаны в ряду
- хлорид натрия, хлорид фосфора (V), фосфат натрия
- оксид натрия, гидроксид натрия, пероксид натрия
- сероуглерод, карбид кальция, оксид кальция
- фторид кальция, оксид кальция, хлорид кальция
- Атомную кристаллическую решётку имеет
- оксид натрия
- оксид кальция
- оксид серы (IV)
- оксид алюминия
- Соединение с ионной кристаллической решёткой образуется при взаимодействии хлора с
- фосфором
- барием
- водородом
- серой
- Верны ли следующие суждения о хлориде аммония?
А. Хлорид аммония - вещество ионного строения, образованное за счёт ковалентной полярной и ионной связей.
Второй набор правил имеет больше химического смысла. В основном он состоит в сравнении электронной среды элемента в молекуле с электроном того же элемента в изолированном атоме. Электронная среда элемента в изолированном атоме рассматривается просто как число валентных электронов.
Все электроны подсчитываются вокруг элемента, учитывая, что. Для каждой линии связи с менее электроотрицательным элементом назначаются два электрона. Один электрон назначается для каждой линии связи с элементом той же электроотрицательности. - Никакой электрон не назначается связями с элементами более высокой электроотрицательности. Очевидно, они приписывают все связанные с ней одиночные электроны. . Это электронное назначение включает в себя обработку каждого полярного канала, как если бы он был ионным.
Б. Хлорид аммония - вещество ионного строения, а потому твёрдое, тугоплавкое и нелетучее.
- верно только А
- верно только Б
- верны оба суждения
- оба суждения неверны
Электроотрицательностью называется свойство химического элемента притягивать к своему атому электроны от атомов других элементов, с которыми данный элемент образует химическую связь в соединениях.
Излишне говорить, что все это порождает огромную концептуальную путаницу у студентов. В этой работе предлагается новая формула, основанная на этом втором наборе правил, в котором количество окисления определяется из структуры Льюиса, так как оно, без необходимости представлять «ионизацию» любой ковалентной связи.
Несмотря на трудности, присущие им, ценность окисления продолжает играть очень важную роль в химии. Его использование в прогнозировании состава веществ, а также в идентификации и балансировке окислительно-восстановительных реакций особенно ценно. Однако его истинная важность заключается в том, что один из наиболее важных видов химической реакции определяется точно с точки зрения количества окисления: элемент окисляется, когда при химическом изменении увеличивается его количество окисления.
При образовании химической связи между атомами разных элементов общее электронное облако смещается к более электроотрицательному атому, из-за чего связь становится ковалентно-полярной, а при большой разности электроотрицательностей – ионной.
Электроотрицательность учитывается при написании химических формул: в бинарных соединениях сзади записывается символ наиболее электроотрицательного элемента.
Элемент уменьшается, когда при химическом изменении число его окисления уменьшается. Назначение номера окисления не просто. Главным образом, поскольку, как упоминалось ранее, существует два набора правил. Стоит отметить следующие аспекты. В этих наборах правил не указывается, с какими химическими или структурными свойствами связан номер окисления. Хотя в правилах для неорганических соединений это, по-видимому, связано с электрическим зарядом, в отношении органических соединений, похоже, связано с связностью элементов в частице. Вы ничего не можете сделать, исходя из любых химических критериев. Остается только запомнить их всех. В случае органических соединений существует только одна конвенция, но это очень тревожно: почему ионизацию ковалентных связей необходимо для определения количества окисления? Для неорганических соединений существует множество исключений из основных правил. Чтобы преодолеть это препятствие, необходимо добавить к фундаментальным правилам огромное количество дополнительных правил.
- Оба набора правил, похоже, не имеют никакого отношения друг к другу.
- Точно так же эти правила, по-видимому, основаны на весьма условных аргументах.
- В конкретном случае неорганических соединений все правила произвольны.
Электроотрицательность возрастает в направлении слева направо для элементов каждого периода и уменьшается в направлении сверху вниз для элементов одной и той же группы ПС.
Валентностью элемента называется свойство его атомов соединяться с определенным числом других атомов.
Различают стехиометрическую, электронную валентность и координационное число. Мы рассмотрим только стехиометрическую валентность.
Подразумевается, что различия между органическими и неорганическими веществами имеют фундаментальный порядок. - Подразумевается, что все неорганические вещества являются ионными, а все органические являются ковалентными. Они считают, что количество окисления и заряд то же самое. . Предлагается присвоить номера окисления с помощью следующей формулы.
Эта формула получена из той, которая используется в правилах распределения для органических соединений. Несмотря на выработку правил для органических соединений, эта формула применима практически ко всем типам веществ. Он состоит в сравнении электронной среды элемента в изолированном атоме с электронной средой идентичного элемента в определенной химической системе. Эта среда измеряется очень толстым способом с точки зрения того, сколько валентных электронов разделено и с кем они разделены.
Стехиометрическая валентность показывает, сколько атомов другого элемента присоединяет атом данного элемента. За единицу валентности принята валентность водорода, т.к. водород всегда одновалентен. Например, в соединениях HCl, H 2 O, NH 3 (правильное написание аммиака Н 3 N уже используется в современных пособиях), СН 4 хлор одновалентен, кислород двухвалентен, азот трехвалентен и углерод четырехвалентен.
Стехиометрическая валентность кислорода обычно равна 2. Так как почти все элементы образуют соединения с кислородом, то удобно его использовать в качестве эталона для определения валентности другого элемента. Например, в соединениях Na 2 O, CoO, Fe 2 O 3 , SO 3 натрий одновалентен, кобальт двухвалентен, железо трехвалентно, сера шестивалентна.
В окислительно-восстановительных реакциях нам важно будет определять степени окисления элементов.
Степенью окисления элемента в веществе называется его стехиометрическая валентность, взятая со знаком плюс или минус.
Химические элементы подразделяются на элементы постоянной валентности элементы переменной валентности.
1.3.3. Вещества молекулярного и немолекулярного строения. Тип кристаллической решетки. Зависимость свойств веществ от их состава и строения.
В зависимости от того, в каком состоянии соединения находятся в природе, они делятся на молекулярные и немолекулярные. В молекулярных веществах мельчайшими структурными частицами являются молекулы. Эти вещества имеют молекулярную кристаллическую решетку. В немолекулярных веществах мельчайшими структурными частицами являются атомы или ионы. Кристаллическая решетка у них атомная, ионная или металлическая.
Тип кристаллической решетки во многом определяет свойства веществ. Например, металлы, имеющие металлический тип кристаллической решетки , отличаются от всех остальных элементов высокой пластичностью, электро- и теплопроводностью . Эти свойства, а также и многие другие – ковкость, металлический блеск и т.п. обусловлены особым видом связи между атомами металла -- металлической связью. Необходимо отметить, что свойства, присущие металлам, проявляются только в конденсированном состоянии. Например, серебро в газообразном состоянии не обладает физическими свойствами металлов.
Особый тип связи в металлах – металлическая – обусловлен дефицитом валентных электронов, поэтому они общие для всей структуры металла. Наиболее простая модель строения металлов предполагала, что кристаллическая решетка металлов состоит из положительных ионов, окруженных свободными электронами, движение электронов происходит хаотически, подобно молекулам газа. Однако такая модель, качественно объясняя многие свойства металлов, при количественной проверке оказывается недостаточной. Дальнейшая разработка теории металлического состояния привела к созданию зонной теории металлов , которая основывается на представлениях квантовой механики.
В узлах кристаллической решетки находятся катионы и атомы металла, а электроны свободно перемещаются по кристаллической решетке .
Характерным механическим свойством металлов является пластичность , обусловленная особенностями внутреннего строения их кристаллов. Под пластичностью понимают способность тел под действием внешних сил подвергаться деформации, которая остается и после прекращения внешнего воздействия. Это свойство металлов позволяет придавать им различную форму при ковке, прокатывать металл в листы или вытягивать в проволоку.
Пластичность металлов обусловлена тем, что при внешнем воздействии слои ионов, образующих кристаллическую решетку, сдвигаются относительно друг друга без разрыва. Это происходит в результате того, что переместившиеся электроны благодаря свободному перераспределению продолжают осуществлять связь межу ионными слоями. При механическом воздействии на твердое вещество с атомной решеткой смещаются отдельные ее слои и сцепление между ними нарушается из-за разрыва ковалентных связей.
ионы , то эти вещества образуют ионный тип кристаллической решетки .

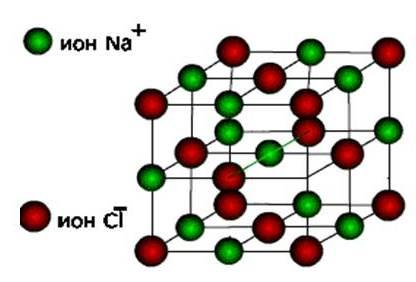
Это соли, а также оксиды и гидроксиды типичных металлов. Это твердые, хрупкие вещества, но основное их качество: растворы и расплавы этих соединений проводят электрический ток .
Если в узлах кристаллической решетки находятся атомы , то эти вещества образуют атомный тип кристаллической решетки (алмаз, бор, кремний оксиды алюминия и кремния). По свойствам очень твердые и тугоплавкие, нерастворимы в воде.
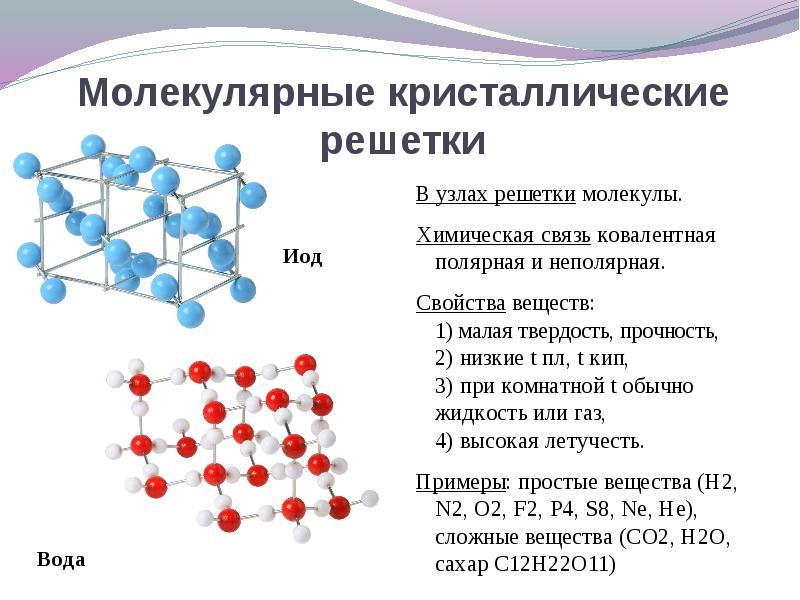
Если в узлах кристаллической решетки находятся молекулы , то эти вещества образуют (при обычных условиях газы и жидкости: О 2 , HCl; I 2 органические вещества).
Интересно отметить металл галлий, который плавится при температуре 30 о С. Эта его аномалия объясняется тем, что в узлах кристаллической решетки находятся молекулы Ga 2 и его свойства в чем становятся схожи с веществами, имеющие молекулярную кристаллическую решетку.
Пример. Немолекулярное строение имеют все неметаллы группы:
1) углерод, бор, кремний; 2) фтор, бром, иод;
3) кислород, сера, азот; 4) хлор, фосфор, селен.
В немолекулярных веществах мельчайшими структурными частицами являются атомы или ионы. Кристаллическая решетка у них атомная, ионная или металлическая
При решении этого вопроса проще идти от противного. Если в узлах кристаллической решетки находятся молекулы , то эти вещества образуют молекулярный тип кристаллической решетки (при обычных условиях газы и жидкости: О 2 , HCl; также I 2, ромбическая сера S 8 , белый фосфор Р 4 , органические вещества). По свойствам это непрочные легкоплавкие соединения.
Во втором ответе есть газ фтор, в третьем – газы кислород, азот, в четвертом – газ хлор. Значит, эти вещества имеют молекулярную кристаллическую решетку и молекулярное строение.
В первом ответе все вещества – твердые соединения при обычных условиях и образуют атомную решетку, значит, имеют немолекулярное строение.
Правильный ответ: 1) углерод, бор, кремний
- Гороскоп здоровья — Близнецы
- Безе: состав, калорийность, пищевая ценность, полезные свойства, вред
- Сонник: к чему снится Операция
- Салат из свежей капусты и огурца
- К чему снится голубка. Большой онлайн сонник. Сонник Мартына Задеки
- К чему снится когда за тобой гонятся
- Зависимость скорости ферментативной реакции от температуры, pH и времени инкубации Как влияет температура на рн

 Live Journal
Live Journal Facebook
Facebook Twitter
Twitter