Конспект по химии на тему химическая связь. Природа химической связи. Ковалентная связь. Тесты подготовки к ЗНО
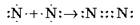
I СЕМЕСТР
УРОК 2
Тема урока. Химическая связь, строение вещества
Цели урока: актуализировать знания учащихся о природе химической связи, виды химической связи; развивать умения использовать теоретические знания для прогнозирования свойств элементов и их соединений на основании знаний о строении атома и строении вещества; развивать навыки составления молекулярных и структурных формул веществ, описывать свойства веществ на основании знаний о химическом связь.
Тесты подготовки к ЗНО
Химическое связывание является одной из основных основ химии, которая объясняет другие концепции, такие как молекулы и реакции. Без этого ученые не смогли бы объяснить, почему атомы притягиваются друг к другу или как образуются продукты после химической реакции. Чтобы понять концепцию связи, нужно сначала знать основы атомной структуры.
Строение и физико-химические свойства
Обычное содержит ядро, состоящее из протонов и нейтронов, причем электроны имеют определенные уровни энергии, вращающиеся вокруг ядра. В этом разделе основное внимание будет уделено этим электронам. Элементы отличаются друг от друга из-за их «электронного облака» или области, где электроны движутся вокруг ядра атома. Поскольку каждый элемент имеет отличное электронное облако, это определяет их химические свойства, а также степень их реактивности. При химическом связывании задействованы только валентные электроны, расположенные в самого внешнего энергетического уровня элемента.
Тип урока: повторения и систематизации знаний.
Формы работы: фронтальная, групповая.
Оборудование: периодическая система химических элементов, ряд активности металлов, таблица растворимости, схема к уроку 2.
1. Фронтальная беседа по основным вопросам темы
(с использованием схемы 2)
Объясните, как вы понимаете понятие «химическая связь».
Диаграммы Льюиса представляют собой графические представления элементов и их валентных электронов. Взаимозависимые электроны - это электроны, образующие самую внешнюю оболочку атома. На диаграмме Льюиса элемента символ элемента записывается в центре, а валентные электроны рисуются вокруг него как точки. Положение вытянутых валентных электронов не имеет значения. Таким образом, римская цифра группы соответствует числу валентных электронов элемента. Ниже представлено периодическое табличное представление числа валентных электронов.
Химическая связь - это сила, которая удерживает вместе определенное число атомов, ионов, молекул.
Итак, это взаимодействия, приводящие к объединению химических частиц вещества. Химическая связь бывает внутри-молекулярным и межмолекулярным (межмолекулярные взаимодействия).
Какие связи называются межмолекулярными?
Межмолекулярные связи - связи между молекулами. Это водородная связь, ион-дипольный связь (за счет образования этой связи происходит, например, образование гидратной оболочки ионов), диполь-дипольный (за счет образования этой связи соединяются молекулы полярных веществ, например, в жидком ацетоне) и др.
Связь в органических соединениях
Неиндитированные переходные металлы, лантаноиды и актиноиды более сложны с точки зрения различения количества валентных электронов, которые у них есть; однако в этом разделе вводится только склеивание, поэтому они не будут покрыты в этом устройстве. Чтобы нарисовать диаграммы левитов для молекулярных соединений или ионов, выполните следующие шаги.
Помните, что если есть два или более одного и того же элемента, то вам нужно удвоить или умножить, так как многие атомы имеют число валентных электронов. Следуйте номеру номера римской цифры, чтобы увидеть соответствующее количество валентных электронов для этого элемента.
Какая связь называется ионной?
Ионная связь - это химическая связь, образованная за счет электростатического притяжения разноименно заряженных ионов. В бинарных соединениях (соединениях из двух элементов) он образуется в случае, когда одни атомы легко отдают электроны, а другие склонны их принимать (обычно это атомы элементов, образующих типичные металлы, а также атомы элементов, образующих типичные неметаллы); электроотрицательности таких атомов в значительной степени отличается (Δχ> 2).
Всего: 6 2 = 8 валентных электронов. Это связано с тем, что анионы имеют более высокое сродство к электрону. Большинство анионов состоят из неметаллов, которые обладают высокой электроотрицательностью. Знак означает, что молекула имеет общий начальный заряд, поэтому он должен пропускать один электрон. Катионы являются положительными и имеют слабую сродство к электрону. Они в основном состоят из металлов; их атомные радиусы больше, чем неметаллы. Это, следовательно, означает, что экранирование увеличивается, а электроны имеют меньшую склонность к притяжению к «экранированному» ядру.
Ионная связь является ненаправленным и ненасичуваним.
Объясните механизм образования ковалентной связи.
Ковалентная связь - это химическая связь, возникающая за счет перекрывания электронных облаков неспаренных электронов. Ковалентная связь образуется между атомами с одинаковой или близкой електронегативністю. Необходимое условие - наличие неспаренных электронов у обоих атомов связываются (обменный механизм) или неподеленной пары у одного атома и свободной орбитали - у другого (донорно-акцепторный механизм):
Из нашего примера вода является нейтральной молекулой, поэтому никакие электроны не нужно добавлять или вычитать из общей суммы. Начните с добавления одиночных связей ко всем возможным атомам, убедившись, что они следуют правилу октета. Наконец, если возможно, переставьте электронные пары в двойные или тройные связи. Большинство элементов соответствуют правилу октета при химическом связывании, что означает, что элемент должен иметь контакт с восемью валентными электронами в связи или точно заполнять его валентную оболочку.
Наличие всего восьми электронов гарантирует, что атом стабилен. Именно по этой причине благородные газы, валентная электронная оболочка из 8 электронов, являются химически инертными; они уже стабильны и, как правило, не нуждаются в передаче электронов при связывании с другим атомом, чтобы быть стабильными. С другой стороны, щелочные металлы имеют валентную электронную оболочку одного электрона. Поскольку они хотят завершить правило октета, они часто просто теряют один электрон. Это делает их вполне реактивными, потому что они могут легко пожертвовать этот электрон другим элементам.
H - H |
Одна общая пара электронов; H одновалентний |
|||
|
Три общие пары электронов; N трехвалентный |
|||
Тема урока. Химическая связь, строение веществаНекоторые элементы, являющиеся исключениями из правила октета, включают алюминий, фосфор, сера и ксенон. Водород и гелий следуют правилу дуэта, так как их валентная оболочка допускает только два электрона. Исключений из правила дуэта нет. водород и гелий всегда будут содержать максимум два электрона. Ионное связывание - это процесс обмена электронами между двумя атомами. Это происходит между неметаллами и металлом. Ионное связывание также известно как процесс, в котором электроны «переносятся» друг в друга, потому что два атома имеют разные уровни сродства к электрону. На рисунке ниже ион ионов и ион хлора объединяются посредством ионного связывания. Это легко позволит более электроотрицательному атому хлора получить электрон, чтобы завершить третий уровень энергии. |
H - F |
Одна общая пара электронов; H и F одновалентно |
||
|
NH 4+ |
Четыре общие пары электронов; N четырехвалентное |
По характеру перекрывания электронных облаков («орбиталей») ковалентная связь делится на σ-связь и π-связь. σ-связь образуется за счет прямого перекрывания электронных облаков (вдоль прямой, соединяющей ядра атомов), π-связь - за счет бокового перекрывания (по обе стороны от плоскости, в которой находятся ядра атомов).
На протяжении всего этого процесса перенос электрона приводит к выбросу энергии в атмосферу. Другим примером ионного связывания является структура кристаллической решетки, показанная выше. Ионы расположены таким образом, что они демонстрируют унифицированность и стойкость; физическая характеристика в кристаллах и твердых телах. Более того, в концепции под названием «море электронов» видно, что молекулярная структура металлов состоит из стабилизированных положительных ионов и «свободнотекущих» электронов, которые ткут между катионами.
По числу общих электронных пар ковалентные связи делятся на такие:
Простые (одинарные) - одна пара электронов (σ -связь);
Двойные - две пары электронов (σ-связь и π-связь);
Тройные - три пары электронов (σ -связь и две π-связи).
Двойные и тройные связи называются кратными связями.
Приведите примеры соединений с кратными связями.
Это связано с металлическим свойством проводимости; проточные электроны пропускают через них электрический ток. Кроме того, это объясняет, почему сильные электролиты являются хорошими проводниками. Ионные связи легко ломаются водой, потому что полярность молекул воды защищает анионы от притяжения катионов. Поэтому ионные соединения легко диссоциируют в воде, и металлические свойства соединения позволяют проводить проводимость раствора.
Ковалентное связывание - это процесс разделения электронов между двумя атомами. Облигации обычно находятся между неметаллами и неметаллами. Поскольку их электроотрицательности находятся в широком диапазоне, электроны притягиваются и вытягиваются обеими атомами атома, что приводит к более сильному разрушению ковалентных связей.
За распределением электронной плотности между атомами, которые связываются, ковалентная связь делится на неполярный и полярный. Неполярная связь образуется между одинаковыми атомами, полярная - между разными (Δχ > 2).
Что такое электроотрицательности?
Электроотрицательности - это мера способности атома в веществе притягивать к себе общие электронные пары.
Существует три типа ковалентных связей: одинарная, двойная и тройная облигации. Одинарная связь состоит из двух связанных электронов. Естественно, что двойная связь имеет 4 электрона, а тройная связь имеет 6 связанных электронов. Поскольку тройная связь будет иметь больше силы в сродстве к электрону, чем одинарная связь, притяжение к положительно заряженному ядру увеличивается, а это означает, что расстояние от ядра до электронов меньше. Проще говоря, чем больше связей или тем больше прочность связи, тем короче длина связи.
Полярная ковалентная связь является процессом неравного распределения электронов. Он считается промежуточной средой между ионным связыванием и ковалентным связыванием. Это происходит из-за различий в значениях электроотрицательности двух атомов. Из-за этого более электроотрицательный атом будет привлекать и иметь более сильное тяговое усилие на электронах. Таким образом, электроны будут тратить больше времени на этот атом.
Электронные пары полярных связей смещены в сторону более електронегативних элементов. Собственно смещение электронных пар называется поляризацией связи. Частичные (избыточные) заряды, образующиеся в процессе поляризации, обозначаются δ+ и δ-, например: Hδ + ^ Fδ -.
Ковалентная связь имеет направленность и насыщаемость, а также способность поляризоваться.
Вышеприведенные символы указывают на то, что на стороне флюида он слегка отрицателен, а водородная сторона слегка положительна. Полярность - это конкурирующие силы между двумя атомами для электронов. Он также известен как полярная ковалентная связь. Молекула полярна, когда электроны притягиваются к более электроотрицательному атому из-за его большей сродства к электрону. Неполярная молекула представляет собой связь между двумя одинаковыми атомами. Они являются идеальным примером ковалентной связи.
Некоторые примеры - газообразный азот, газообразный кислород и газообразный водород. Мы уже говорили о валентных электронах и о том, как валентные электроны важны для определения химической реактивности разных типов. Так же, как напоминание об атомах, которые имеют неполную валентную оболочку, например, если это атом с одним электроном в его первая оболочка, этот атом не стабилен, и он хочет сделать все возможное, чтобы стабилизировать свою энергию. Существуют три разных способа, которыми атом может попытаться создать полный уровень валентности.
Для объяснения и прогнозирования взаимного направлении ковалентных связей используют модель гибридизации.
Гибридизация атомных орбиталей и электронных облаков - предполагаемое выравнивание атомных орбиталей по энергии, а электронных облаков - по форме в процессе образования атомом ковалентных связей.
Чаще всего встречаются три типа гибридизации: sp -, sp 2 - и sp 3-гi бридизація. Например:
Эта стратегия совместного использования - это то, о чем мы сегодня поговорим. Когда атом взаимодействует с другим атомом, он образует так называемую химическую связь. Это взаимодействие, эта химическая связь соединяет два атома вместе во что-то, называемое молекулой.
Теперь мы будем говорить о ковалентных связях, а это означает, что атомы собираются обмениваться электронами. Ковалентные связи - очень сильные связи. Они очень важны в биологии, потому что они очень стабильны и потому что большинство биологических молекул сделанные с ковалентными связями. Эти биологические молекулы тогда очень стабильны.
Sp -гибридизация - в молекулах C 2 H 2 , BeH 2 , CO 2 (линейное строение);
Sp2-гибридизация - в молекулах C 2 H 4 , C 6 H 6 , BF 3 (плоская треугольная форма);
Sp3-гибридизация - в молекулах CCl 4 , SiH 4 , CH 4 (тетраедрична форма); NH 3 (пирамидальная форма); H 2 O (угловая форма).
Назовите особенности металлической связи.
Металлическая связь - это химическая связь, образованная за счет обобществления валентных электронов всех атомов металлического кристалла, что связываются. В результате образуется единая электронная облачко кристалла, легко смещается под действием электрического напряжения, отсюда высокая электропроводность металлов.
Таким образом, атомы с более чем одним валентным электроном, например, берут углерод. У углерода есть четыре валентных электрона, поэтому он имеет возможность образовывать четыре разные ковалентные связи. Водород в основном разделяет электроны, поэтому он имеет два валентных электрона.
И, у атома углерода, вместо четырех, теперь имеется восемь валентных электронов. Как углерод, так и водород стабилизировали свои валентные уровни путем разделения электронов. Вместо точечного представления связь между этими атомами часто сокращается с помощью линии.
Металлическая связь образуется в том случае, когда атомы, которые связываются, большие и поэтому склонны отдавать электроны. Простые вещества с металлической связью - металлы (Na , Baan>, Al , Cu , Au и др.), сложные вещества - інтерметалеві соединения (AlCr 2, Ca 2Cu , Cu 5Zn 8 и др.).
Металлическая связь не имеет направленности и насыщаемости. Он сохраняется и в расплавах металлов.
Теперь, поскольку углерод имеет четыре валентных электрона, он может образовывать четыре разные связи. Возможно сформировать множественные связи с одним и тем же атомом-партнером, если этот атом также имеет достаточно валентных электронов, чтобы это произошло.
Примером двойной связи было бы, если бы у меня было два атома кислорода. Эти два атома кислорода могут разделять четыре электрона между двумя атомами, образуя молекулу кислорода. Это кислород, который мы дышим в воздухе и который удерживает нас в живых.
Мы можем иметь тройную связь и что три атома электронов или шесть электронов разделены между двумя атомами. Азотный газ, который находится в атмосфере, представляет собой молекулу, в которой два атома азота соединены тройным путем. Одна из последних замечательных замечаний в отношении ковалентных связей заключается в том, что вы можете сделать некоторые прогнозы о том, как будет выглядеть молекула. Длина связи предсказуема, поэтому расстояние между этими двумя атомами всегда будет таким же, пока оно Эти два атома.
Какая связь называется водородным?
Водородная связь - это міжмолекулярний связь, образованная за счет взаимодействия високоелектронегативного атома и атома Водорода с большим положительным частичным зарядом. Образуется в тех случаях, когда в одной молекуле является атом с неразделенной парой электронов и высокой електронегативністю (F , O , N ), а в другой - атом Водорода, связанный очень полярным связью с одним из таких атомов.
Приведите примеры межмолекулярных водородных связей:
H - O - H ... OH 2
H - O - H ... NH 3
H - O - H ... F - H
H - F ... H - F
Внутренне-молекулярные водородные связи существуют в молекулах полипептидов, нуклеиновых кислот, белков и тому подобное.
Мерой прочности любой связи является энергия связи.
Энергия связи - это энергия, необходимая для разрыва определенного химической связи в 1 моль вещества. Единица измерения - 1 кДж/моль.
Энергии ионной и ковалентной связей - одного порядка, энергия водородной связи на порядок меньше.
На какие группы по типу строения делятся все вещества?
На молекулярные и немолекулярні. Среди органических веществ преобладают молекулярные вещества, среди неорганических - немолекулярні.
По типу химической связи вещества делятся на вещества с ковалентной связью вещества с ионной связью (йонни вещества) и вещества с металлической связью (металлы).
Вещества с ковалентной связью могут быть молекулярными и немолекулярними. Это существенно сказывается на их физических свойствах.
Приведите примеры веществ молекулярного строения.
Молекулярные вещества состоят из молекул, связанных между собой слабыми межмолекулярными связями, например: H 2, O 2, N 2, Cl 2, Br 2, S 8, P 4 и другие простые вещества; CO 2, SO 2, N 2O 5, H 2O , HCl , HF , NH 3, CH 4, C 2H 5OH , органические полимеры и многие другие вещества. Эти вещества характеризуются высокой прочностью, имеют низкие температуры плавления и кипения, не проводят электрического тока, некоторые из них растворяются в воде или других растворителях.
Какие свойства имеют вещества немолекулярної строения?
Немолекулярні вещества с ковалентними связями или атомные вещества (алмаз, графит, Si , SiO 2, SiC и др.), образуют очень прочные кристаллы (исключение - слоистый графит), они нерастворимы в воде и других растворителях, имеют высокие температуры плавления и кипения, большинство из них не проводит электрического тока (кроме графита, выделяется электропроводностью, и полупроводников - кремния, германия и др.)
Охарактеризуйте физические свойства ионных веществ.
Все ионные вещества - твердые тугоплавкие вещества, растворы и расплавы которых проводят электрический ток. Многие из них растворяются в воде. Следует отметить, что в ионных веществах, кристаллы которых состоят из сложных ионов, присутствуют ковалентные связи, например: (Na +)2(SO 42-), (К+)3(PO 43-), (NH 4+)(NO 3-) и тому подобное. Ковалентними связями связаны атомы, из которых состоят сложные ионы.
Приведите примеры физических свойств веществ с металлической связью.
Металлы (вещества с металлической связью) очень разнообразны по своим физическим свойствам.
Характерными физическими свойствами металлов является их высокая электропроводность (в отличие от полупроводников уменьшается с повышением температуры), высокая теплоемкость и пластичность (у чистых металлов).
В твердом состоянии почти все вещества состоят из кристаллов. По типу строения и типу химической связи кристаллы («кристаллические решетки») делят на атомные (кристаллы немолекулярних веществ с ковалентной связью), ионные (кристаллы ионных веществ), молекулярные (кристаллы молекулярных веществ с ковалентной связью) и металлические (кристаллы веществ с металлической связью).
III. Управляемая практика
На усмотрение учителя и в зависимости от подготовленности класса задания можно использовать для фронтальной, групповой или индивидуальной работы.
Задача 1. Приведите примеры веществ, имеющих ионную, атомную и молекулярную кристаллические решетки. Какое из этих веществ будет иметь самую низкую температуру плавления, а какая - высшую? Почему?
Задание 2. Кислород образует химические связи с Натрием, Хлором, Азотом и Цинком. Запишите формулы этих соединений, укажите вид химической связи и тип кристаллической решетки. Объясните, какая связь будет наименее полярным.
Задание 3. Учитывая положение Кислорода, Серы и Селена в периодической системе укажите вид химической связи и тип кристаллической решетки в соединениях этих элементов с Гідрогеном. Объясните, в каком из этих соединений связь наименее полярный.
Задание 4. Из химических связей является наиболее полярным?
H - Cl, H - Br, H - ИH - P, H - S.
Объясните, почему. Укажите вид химической связи.
Задание 5. Приведите примеры веществ, в которых Фтора образует ионный, ковалентные полярная и неполярная связи, укажите тип кристаллических решеток в этих соединениях.
Задание 6. Металл массой 4,5 г, что имеет степень окисления в соединениях +3, прореагировало с хлоридной кислотой. При этом выделился водород объемом 5,6 л (н. в.). Назовите металл.
Задание 7. Некоторый металл массой 1,22 г в результате взаимодействия с хлором образует вещество массой 4,75 г. Степень окисления этого металла в хлориде +2. Назовите металл.
Задание 8. В результате взаимодействия некоторого металла массой 0,92 г с хлором получили хлорид металла массой 2,34 г. Назовите металл, если его степень окисления в хлориде равна +1.
Задача 9. В результате взаимодействия некоторого металла с водой в процессе нагревания образовался оксид со степенью окисления металла +2. Масса оксида, образовавшегося равна 16,2 г, образованной воды - 0,4 г. Определите, какой металл был взят для реакции с водой.
IV. Подведение итогов и выводы
Оцениваем работу учащихся, оценки выставляем по желанию учащихся.
V. Домашнее задание
Повторить теорию электролитической диссоциации.
Приложение

Ковалентная полярный (Δχ) - ________________________________________________
Ковалентная неполярная (Δχ) - ______________________________________________
Ионный (Δχ) - ______________________________________________________________
Металлический (Δχ) - __________________________________________________________
δ-связь- ________________________________________________________________
π-связь- ________________________________________________________________
Типы гибридизации

Типы кристаллических решеток
Виды химических связей.
Типы кристаллических решеток
План
1.Сущность образования химической связи.
3. Ионная химическая связь.
4. Ковалентная химическая связь.
5.Металлическая химическая связь.
6. Агрегатные состояния веществ и водородная связь.
7.Виды кристаллических решеток
1.Сущность образования химической связи.
На внешнем энергетическом уровне может быть от одного до восьми электронов;
Если количество электронов на внешнем уровне максимальна – уровень завершённый (у инертных газов(He , Ne , Ar , Kr , Xe , Re ));
:: Ne ::
Внешние уровни других элементов не завершены и в процессе химического взаимодействия они завершаются с образованием химической связи.
H ∙ + ∙ H = H (:) H
Химическая связь осуществляется за счёт валентным электронов и не спаренных, но по разному.
Основной движущей силой приводящей к образованной химической связи является стремление атомов завершить энергетический уровень.
Образование химической связи сопровождаются выделением энергии.
Химическая связь – это взаимодействие двух или нескольких атомов приводящей к образованию устойчивой молекулы.
2.Понятие электроотрицательности (ЭО).
Электротрицательность(ЭО) – это способность атома одного элемента присоединять электроны от атомов других элементов.
В периоде (слева направо) ЭО увеличивается т. к. с увеличением заряда ядра атомов уменьшается атомный радиус.
В группах (сверху вниз) ЭО уменьшается т.к. увеличивается атомный радиус.
У металлов ЭО меньше чем у неметаллов.
3.Ионная химическая связь
Ионная связь образуется в результате полного переноса одного или нескольких электронов от одного атома к другому. Такой тип связи возможен только между атомами элементов, электроотрицательности которых значительно отличаются. При этом происходит переход электрона от атома с меньшей электроотрицательностью к атому с большей электроотрицательностью. Надо запомнить, что такой тип химической связи образуется между атомами металлов и неметаллов. Например, элементы первой и второй группы главных подгрупп периодической системы (типичные металлы) непосредственно соединяются с элементами шестой и седьмой группы главных подгрупп периодической системы (типичные неметаллы).
Рассмотрим механизм образования ионного связи в составе калий хлорид. Атом калия содержит один валентный электрон (определяем по номеру группы, в которой находится Калий). Атом хлора содержит семь валентных электронов (определяем по номеру группы, в которой находится хлор). При взаимодействии атомов калия с атомами хлора валентный электрон атома калия полностью переходит на внешний уровень атома хлора, достраивая его в восьмиелектроннои структуры. При этом атом калия, теряя электрон, приобретает положительный заряд +1 и превращается в катион K + , а атом хлора, присоединяя электрон, приобретает отрицательный заряд -1 и превращается в анион Cl - . Разноименно заряженные ионы притягиваются благодаря электростатическим силам и образуется соединение калий хлорид. Этот процесс можно изобразить схемой:
0 0 + -
K ∙ + ∙: Cl :: → K [:: Cl ::]
- Как приготовить классические вареники с творогом
- Как сделать тесто для яблочной шарлотки Как приготовить шарлотку с яблоками песочное тесто
- Отечественной войны 2 степени
- День полного освобождения Ленинграда от фашистской блокады
- Манная каша на молоке: пропорции и рецепты приготовления Манная каша 1 порция
- Суп-пюре из брокколи с сыром Рецепт крем супа из брокколи с сыром
- Гороскоп: характеристика Девы, рождённой в год Петуха

 Live Journal
Live Journal Facebook
Facebook Twitter
Twitter