Особенности ионной связи. Ионная связь. Строение кристалла поваренной соли
Существуют различные виды химической связи. Среди них ковалентная, металлическая, Ван-дер-ваальсова, водородная и ионная. Давайте выясним, что такое ионная связь и ее свойства каковы.
Осуществляемая путем перехода общей пары электрона от одного атома, менее электроотрицательного, к другому, более электроотрицательному, -вот что такое ионная связь. Примеры соединений, образованных ею, можно объединить общей особенностью - содержанием в соединении атомов с сильной электроотрицательностью и атомов металлов.
Изучение структуры химических соединений и природы связей между атомами, принадлежащими молекуле, относятся к числу важнейших задач химии и химической физики. Ближе к сущности химических связей и исследованию природы межатомных сил позволило развитие науки о атомном строительстве. Согласно современным представлениям, химические связи производятся электростатическими взаимодействиями между электронами и атомами соединяющих атомов. Однако теория химических связей должна учитывать конкретные законы, регулирующие мир атомов и элементарных частиц; Поведение электронов в молекуле, а также электронов в атоме должно описываться законами квантовой механики.
Атом металла без особого труда отдает электрон и становится катионом. А электроотрицательный атом, такой как атом галогена, легко принимает электрон, образуя отрицательно заряженный ион. Эти заряженные частицы - анионы и катионы - и образуют ту, которая имеет название "ионная связь". Примеры ее - это хлорид натрия, иодид лития и другие галоиды металлов (в основном щелочных).
Характер химической связи и ее свойства зависят от многих факторов, таких как атомный заряд, электронная конфигурация, размер соединяющих атомов. Эти факторы меняются по мере перехода от элемента к элементу. Это приводит к большому разнообразию химических связей, обнаруженных в природе.
Химические вещества с существенно атомной связью часто показывают определенную полярность молекулы, которая приводит к генерации ионных сил. Таким образом, возможен постепенный переход от атомного к ионному связыванию. Такой тип изменений связывания происходит более четко, чем больше электроотрицательный элемент находится в молекуле, а, следовательно, особенно в галогенных соединениях как элементы с наибольшим сродством к электрону. Это приводит к постепенному смещению центра тяжести электронной оболочки к более электроотрицательному элементу, в то время как положительный полюс остается в окрестности менее электроотрицательного элемента.
 Но соединение не может быть образовано одной только ионной связью. Причиной этого является нескомпенсированность и отталкивания. Поэтому стоит говорить только о преимущественной ионной связи, тогда как наряду с ней есть и другая химическая связь. Это крайне важно знать.
Но соединение не может быть образовано одной только ионной связью. Причиной этого является нескомпенсированность и отталкивания. Поэтому стоит говорить только о преимущественной ионной связи, тогда как наряду с ней есть и другая химическая связь. Это крайне важно знать.
Исходя из этого, было высказано предположение, что атомы других элементов объединяются и, следовательно, образуют более стабильную систему, чем свободные атомы, предполагая аналогичную конфигурацию электронов, таких как благородные газы. Согласно Козелю, если образуется ионная связь, атомы двух соединительных элементов получают электронные конфигурации благородных газов, так что атомы элемента, известного как электроды, теряют свои валентные электроны на атомах второго, электроотрицательного атома.
Атом А дает атому В как можно большему числу электронов для образования ионов А и В с указанными электронными конфигурациями. Положительные и отрицательные ионы, которые притягиваются действием электростатических сил, создают упорядоченную структуру в случае твердых тел. Неравномерное распределение положительных и отрицательных электрических зарядов является дипольным моментом, который в случае чистой атомной связи равен нулю. Для молекулы с чистой ионной связью в атомах атомных связей существует дипольный момент, отличный от нуля, но состоящий из химически разных атомов, существуют условия, способствующие полярности и, следовательно, происходит ионное связывание. отмеченный дипольным моментом.
Не имеет свойств направленности и насыщаемости ионная связь. Примеры связей с направленностью и насыщаемостью - ковалентная, донорно-акцепторная связи. Ненасыщаемость и ненаправленность ионной проявляется потому, что при присоединении ионов с другим зарядом не происходит полная компенсация заряда. Могут быть присоединены и другие противоположнозаряженные ионы и так далее. именно поэтому вокруг иона располагается максимально возможное число подобных ему, но с другим знаком. Однако это число ограничено ввиду взаимного отталкивания ионов одинаково заряженных. Равновесие достигается при их определенном взаимном расположении, которое характеризуется координационным числом. Этот показатель зависит от соотношения радиусов ионов. Вещества с ионной связью зачастую имеют координацию куба или октаэдра и представляют собой кристаллы.
Такие соединения включают галогенированные углеводороды. Расхождение электрических зарядов является лишь частичным, а связывание атомов с молекулами происходит как через атомные, так и ионные силы связи. Когда электрон переносится, появляются два иона с противоположными знаками, которые притягивают электростатические силы. Ионное связывание является следствием переноса одного или нескольких электронов из внешней оболочки более низким электролитическим атомом электронов в более большой электролитический атом.
Поэтому ионное связывание является крайним случаем полярности атомной связи. Ионное связывание редко происходит в чистом виде. Как правило, для того, чтобы связь была сформирована, разность электроотрицательности Полинга должна быть больше или равна 1.
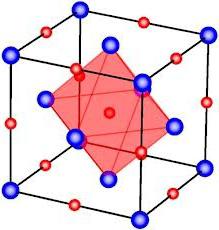
Так, кристалл поваренной соли - хлорид натрия - имеет кубическую решетку. В нем каждый ион хлора связан с шестью ионами натрия и каждый ион натрия - с шестью ионами хлора.
В оксидах щелочных и также наблюдается ионная связь. Примеры таких соединений: оксид кальция, оксид натрия и другие. Ионы могут состоять не только из одного атома, а из нескольких. Внутри такого сложного иона другая, а между самими ионами - ионная связь. Примеры: соли типа сульфата калия (здесь калий - катион, сульфат-ион - анион).
Ионное соединение очень жидкое, потому что оно зависит от многих разных факторов. Ионизация образуется, когда атомы одного из реагирующих элементов легко дают электроны, а другие атомы легко присоединяют электроны. Однако такой перенос электронов и образование ионов нельзя ожидать, если оба типа атомов проявляют ту же самую или аналогичную тенденцию принимать и доносить электроны.
Ионное связывание происходит при сильном и взаимном притяжении аниона с положительно заряженным ионизацией. В кристаллах ионных соединений носители заряда являются «заключенными» кристаллической решетки. После плавления или растворения ионы высвобождаются из него и способны проводить электричество. Имейте в виду, что одиночные ионные молекулы присутствуют только в газообразном состоянии.
Следует также отметить, что свойства ионов веществ сильно разнятся со свойствами атомов и молекул этих веществ. Так, например, ионы хлора, входящие в состав хлорида натрия, не имеют цвета и запаха и пригодны в пищу, тогда как молекулярный хлор - зеленовато-желтый газ с резким запахом - является ядом. А атомы натрия с водой реагируют со взрывом, ионы же свободно растворяются.
С формальной точки зрения предполагается, что ионные связи находятся между атомами, разность электроотрицательности которых не менее 1, 7 по шкале Полинга. В действительности нет чистых ионных связей, и каждый из них обладает некоторыми ковалентными свойствами, что делает границу между этими двумя типами связей очень текучей.
В квантовой химии предполагается, что ионная связь возникает, когда теоретически рассчитанная энергия молекулярной орбитали, предполагая, что связь ковалентна по своей природе, больше, чем ионизирующий потенциал атома, который является донором электрона для второго атома. Теоретические расчеты таких гипотетических орбиталей весьма дискуссионны.
Ковалентная химическая связь обычно возникает между атомами неметаллов с одинаковой или не очень сильно различающейся электроотрицательностью. Если различие в электроотрицательности атомов, между которыми образуется химическая связь, велико (∆x превышает 1.7), то общая электронная пара практически полностью смещается к атому с большей электроотрицательностью. В результате этого образуются частицы, имеющие заряды – положительно и отрицательно заряженные ионы с устойчивой электронной конфигурацией атомов ближайшего благородного газа. Противоположно заряженные ионы прочно удерживаются силами электростатического притяжения – между ними возникает химическая связь, которая называется ионной.
- Указанные алкалоиды относятся к первой группе периодической таблицы.
- Их сочетание с галогенами характеризуется высоким ионным связыванием.
- Так будет ли водород и фторид в одном соединении давать ионное вещество?
- Опишите каждое и кратко оправдайте.
Ионная связь, как правило, возникает между атомами типичных металлов и типичных неметаллов. Характерным свойством атомов металлов является то, что они легко отдают свои валентные электроны, тогда как атомы неметаллов способны легко их присоединять.
Рассмотрим возникновение ионной связи, например, между атомами натрия и атомами хлора в хлориде натрия NaCl.
Другими словами, число валентных электронов меньше двойного числа связей. Первыми соединениями, которые выделили это явление, были бораны, но были получены аналогичные системы для таких элементов, как бериллий и алюминий. Тот факт, что такие соединения образуются для элементов групп 2 и 3, связан с тем, что на валентной поверхности атомов этих элементов имеются «пустые места». В случае образования связи атомы бериллия и бора имеют четыре орбиты, которые могут связываться, но только два или три электрона.
Однако этого нельзя ожидать для соединений водородного бора. Конечно, в случае соединений первой группы также ожидается образование электронно-дефицитных соединений. Но наличие одного валентного электрона делает их привилегированной формой связи в их соединениях ионной или металлической. Наибольшая группа электронно-дефицитных соединений образована элементами третьей группы.
Отрыв электрона от атома натрия приводит к образованию положительно заряженного иона – катиона натрия Na + .
Присоединение электрона к атому хлора приводит к образованию отрицательно заряженного иона – аниона хлора Cl — .
Между образовавшимися ионами Na + и Cl — , имеющими противоположный заряд, возникает электростатическое притяжение, в результате которого образуется соединение – хлорид натрия с ионным типом химической связи.
Число валентных электронов в этом соединении составляет 12, что недостаточно для создания семи типичных пар, образованных электронными парами. Оба атома бора связаны мостиковыми связями, каждый из которых содержит атом водорода, лежащий под и над плоскостью. Этот геометрический дизайн не согласуется с концепцией его конструкции, аналогичной этану, и предполагалось, что диборан может быть аналогом этилена, в котором двойная связь была заменена двумя протонами. Однако этот подход не соответствовал свойствам молекулы диборана.
Длина двойной связи немного больше, чем у диборана, а молекула диборана не является кислой, которая должна присутствовать в случае молекулы, содержащей два практически свободных от водорода электронов. Решением этой проблемы было введение молекулярных орбит, состоящих из атомных орбиталей бора или водорода в этой молекуле.
Ионная связь – это химическая связь, которая осуществляется за счет электростатического взаимодействия противоположно заряженных ионов.
Таким образом, процесс образования ионной связи сводится к переходу электронов от атомов натрия к атомам хлора с образованием противоположно заряженных ионов, имеющих завершенные электронные конфигурации внешних слоев.
Этот подход обеспечивал наличие мостиковых атомов водорода с соответствующей электронной плотностью. В то же время авторы этой концепции связи показали, что можно построить волновую функцию с локализованными молекулярными орбитами типа σ и π, две из которых проиллюстрированы. Введение таких связей в молекуле соединения очень хорошо описывает его свойства.
Конструкция трехсторонних звеньев может быть выполнена различными способами. Рамка, образованная атомами бора, больше похожа на металл, чем молекула соединения, но электроны в боре сохраняют определенную степень локализации. Структуры десяти - и восьмиборного бора могут быть представлены путем удаления двух, четырех и шести атомов бора из двадцати и добавления соответствующего количества протонов для образования мостиков, соединяющих открытые атомы бора.
Экспериментально установлено, что в действительности электроны не отрываются полностью от атома металла, а лишь смещаются в сторону атома хлора. Это смещение тем значительней, чем больше разность электроотрицательностей атомов, между которыми образуется ионная связь. Однако даже в случае фторида цезия CsF, в котором разность электроотрицательностей превышает 3.0, заряд атома цезия не равен 1+. Это означает, что электрон атома цезия не полностью переходит к атому фтора. В случае других соединений, для которых разность электроотрицательностей не так велика, смещение электрона еще меньше, и поэтому следует говорить об ионной химической связи с определенной долей ковалентной.
Подобное связывание происходит в гидридах алюминия и галлии. С другой стороны, борогидриды образуют ряд других соединений, в которых связывания являются более обычными. Ионная связь определяется как электростатическое притяжение между ионами с противоположными зарядами. Он образуется путем переноса электронов между металлами и неметаллами. Таким образом, образуется молекула, ионная связь которой основана на электростатическом притяжении между положительными или отрицательными ионизованными атомами.
Образованные ионные соединения являются электропроводящими веществами, сумма положительных зарядов равна сумме отрицательных зарядов в данном количестве ионного соединения. В твердом состоянии ионные соединения образуют ионные сети, поэтому положительные ионы чередуются с отрицательными ионами, занимая четко определенные положения и силы электростатического притяжения между ионами.
Соединения, в которых вклад ионной связи значителен, принято называть ионными. Большинство бинарных соединений, содержащих атомы металлов, являются ионными, т. е. в них химическая связь в значительной степени ионная. К числу таких соединений относятся галогениды, оксиды, сульфиды, нитриды и др.
Ионная связь возникает не только между простыми катионами и простыми анионами типа F — , Cl — , F 2- , но и между простыми катионами и сложными анионами типа NO 3 — , NO 4 2- , NO 4 3- или гидроксид-ионами ОН — . Подавляющее большинство солей и оснований являются ионными соединениями, например Na 2 SO 4 , Cu(NO 3) 2 , Mg(OH) 2 . Существуют ионные соединения, в состав которых входят сложные катионы, не содержащие атомы металла, например ион аммония NH 4 + , а также соединения, в которых сложными являются и катион, и анион, например сульфат аммония (NH 4) 2 SO 4 .
Ионная связь не является пространственно-ориентированной, электростатические силы притяжения действуют во всех направлениях и образуют ионный макроагрегат. Свойства ионных веществ Состояние агрегации - при нормальных температурных условиях ионные вещества являются твердыми, кристаллизованными, температура плавления и точки кипения ионных соединений имеют высокие значения, поскольку ионная связь является сильной связью. На точку плавления влияет размер атомов и размер положительной ионной нагрузки.
Растворимость - ионные вещества растворимы только в полярных растворителях, механические свойства - ионные кристаллы являются хрупкими в результате перемещения «слоев» с положительными и отрицательными ионами в чередовании, так что ионы с одинаковым зарядом вступают в контакт, кристалл отвергается разрушает электрические свойства - ионные кристаллы не приводят к электричеству твердого тела, потому что ионы занимают фиксированные положения в кристаллической решетке.
- Кто такой Николай Пейчев?
- Томас андерс - биография, фото, личная жизнь солиста дуэта "модерн токинг" Синглы Томаса Андерса
- Что показывает коэффициент обеспеченности финансовых обязательств активами Обеспеченность обязательств финансовыми активами в бюджетном учреждении
- Как приготовить классические вареники с творогом
- Как сделать тесто для яблочной шарлотки Как приготовить шарлотку с яблоками песочное тесто
- Отечественной войны 2 степени
- День полного освобождения Ленинграда от фашистской блокады

 Live Journal
Live Journal Facebook
Facebook Twitter
Twitter