Химическая формула валентность конспект урока по химии. Конспект интегрированного урока химии и математики «Составление химических формул бинарных соединений по валентности. Записи на доске и в тетрадях
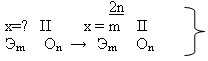
Тип урока. Комбинированный.
Методы обучения. Частично поисковый.
Цели. Дидактическая: закрепить понятие “валентность”, навыки определения валентности по формуле и Периодической таблице.
Психологическая: вызвать интерес к предмету, выработать умение логически рассуждать, грамотно выражать свои мысли.
Воспитательная: развивать умение работать коллективно, оценивать ответы своих товарищей.
Валансные электроны, впервые введенные в разделе 4 раздела 4, представляют собой электроны в самых внешних оболочках атомов, и они являются наиболее реактивными и наиболее важными для понимания того, как атомы объединяются для образования соединений. Большинство элементов, которые мы рассмотрим при формировании соединений, являются основными элементами группы, и для этих элементов их валентные электроны всегда находятся в их самых внешних и р-орбиталях. На рисунке 5-2 все валентные электроны для общих элементов основной группы представлены в виде точек вокруг символа.
Оборудование. Наборы для построения моделей молекул различных веществ, таблички-анаграммы для химической разминки, мишень эффективности
ХОД УРОКА
1. Ориентировочно-мотивационный этап
Химическая разминка
Анаграммы – это слова, в которых изменен порядок букв. Попробуйте разгадать некоторые из химических анаграмм. Переставьте буквы в каждом слове и получите название химического элемента. Обратите внимание на подсказку.
Для водорода и гелия они могут иметь только два электрона в своей валентной оболочке в этом первом ряду, но для элементов после этого можно видеть, что число валентных электронов колеблется от 1 до. Существует также большая периодическая картина, согласно которой элементы в той же колонке или семействе на периодической таблице всегда имеют одинаковое количество валентных электронов.
Валансные электроны для первых 26 основных элементов группы
Представлены только электроны во внешней, валентной оболочке. Они варьируются от одного электрона для щелочных металлов до восьми электронов для благородных газов. Все эти электроны были найдены на самых внешних и р-орбиталях для каждого из этих элементов. Обратите внимание, что в нижней строке атомный номер перескакивает с 20 на Нечеткую линию указывает, где будут расположены переходные металлы.
“Одоврод” – у этого элемента самая маленькая относительная атомная масса.
“Маилинюй” – этот элемент называют “крылатым” металлом.
“Дикосолр” – входит в состав воздуха.
“Цалький” – без него наши кости были бы непрочными и хрупкими.
“Озежел” – этот элемент входит в состав крови и участвует в переносе кислорода.
Это представление о представлении валентных электронов в виде точек является сокращением, созданным американским химиком Гилбертом Ньютоном Льюисом. Соответственно, они называются для атомов. Льюис изучал, как связаны атомы и, в частности, роль электронов в самой внешней оболочке. Он обнаружил, что может объяснить многие соединения двух или более атомов, предположив, что они могут делиться электронами, чтобы каждый атом имел в общей сложности восемь электронов в своей внешней оболочке.
Одним из самых известных химиков двадцатого века был Линус Полинг. Среди его многочисленных достижений он - человек, который первым применил квантовую механику к описанию орбитальной гибридизации, критичной для понимания химической связи; он изобрел концепцию электроотрицательности и разработал первоначальную шкалу, на которой он был измерен; он первым описал подробно то, что мы теперь называем «резонансом», важной темой в органической химии; используя рентгеновскую кристаллографию, он вывел структуры альфа-спиральной и бета-листовой структуры, обнаруженные во всех белках; и он был первым человеком, который описал генетическое заболевание, серповидноклеточную анемию, с молекулярной детализацией, для которой Фрэнсис Крик назвал его «отцом молекулярной биологии».
Учитель. Если вы легко разгадали слова-анаграммы, скажите себе: “Я – молодец!”
2. Актуализация знаний
Лови ошибку (Ребята ищут ошибку, работают парами, спорят, совещаются. Придя к какому-то мнению, предлагают свой аргументированный вариант ответа)
Слово “валентность”(от лат. “valentia”) возникло в середине XIX в., в период завершения химико-аналитического этапа развития химии. “Валентность – способность атомов одного элемента присоединять определенное количество атомов другого элемента”. С одним атомом одновалентного элемента соединяется один атом другого одновалентного элемента (HF, NaCl). С атомом двухвалентного элемента соединяются один атом одновалентного (H 2 O) или один атом двухвалентного (CaO). Значит, валентность элемента можно представить как число, которое показывает, со сколькими атомами одновалентного элемента может соединяться атом данного элемента.
Широкий спектр его достижений редко встречается у любого другого ученого. Помимо своих научных достижений, Полинг также был политическим активистом и использовал свой престиж, чтобы помочь получить атмосферные испытания ядерного оружия, за которые он был награжден Нобелевской премией мира. Это сделало его единственным человеком помимо Марии Кюри, чтобы выиграть Нобелевскую премию Приз в двух разных областях; он также является единственным человеком, который выиграл две нераскрытые Нобелевские премии.
Д. И. Менделеев
Госдепартамент скорее произвольно отказался выдавать ему паспорт. Льюис не просто выяснил, как диаграммы молекул с точками, он также тот, кто объяснил ковалентную связь, придумал термин «фотон», выяснил, как электроны соединяются вместе, и, среди прочего, он вдохновил Линуса Полинга, еще один экстраординарный химик, изучал природу химической связи. Он был назначен 35 раз за Нобелевскую премию, но не выиграл, однако два его ученика, Гарольд Юри и Гленн Сиборг, получили Нобелевские премии за свою работу над открытиями новых элементов и новые изотопы.
Есть элементы, которые имеют постоянную
валентность:
одновалентны (I) - H, Li, Na, Rb, Cs, F, I
двухвалентны (II) - Be, Mg, Ca, Sr, Ba, Zn, Cd K
трехвалентны (III) - B, Al, O
Крестики нолики: (Соедините элементы прямой, критерий правильного ответа – постоянная валентность выбранных элементов)
1 вариант
2 вариант
Химик, который обнаружил ковалентную связь и создал метод структуры Льюиса, изображающий молекулы. Библиотека Бэнкрофта, Калифорнийский университет. Как показано на рис. 5-2, структуры точек Льюиса рисуются с использованием химического символа из периодической таблицы для представления ядра атома и размещения точек вокруг снаружи для представления электронов в валентной оболочке. Обратите внимание, как когда в структуре Льюиса атомов больше четырех электронов, электроны соединяются вместе на стороне атома.
Оценка работы учащихся
Это одна из ключевых идей Льюиса: он понял, что, поскольку орбитали содержат два электрона, электроны на атомы любят спариваться, даже когда они образуют связи. Только с четырьмя орбиталями в валентной оболочке большинства основных элементов группы электроны должны быть спарены, когда их достаточно, чтобы обойти.
3. Изучение новых знаний
Задание 1: дана общая формула соединения водорода с каким-либо элементом
Зная, что валентность водорода равна I, определите валентность элемента.
Ребята работают парами, при необходимости объединяются в четвёрки, спорят, совещаются. Придя к какому-то мнению, предлагают свой аргументированный вариант ответа. В результате получаем схему №1
Учащиеся должны знать
Однако структуры Льюиса для отдельных атомов не особенно полезны, но это спаривание электронов будет очень важным, когда мы перейдем к более крупным многоатомным структурам. Когда электроны соединяются вместе на одном атоме, их называют «одиночными парами электронов» или Обратите внимание на то, что неоновый, нереактивный благородный газ имеет восемь электронов, расположенных в четыре одиночные пары. Это простое представление о том, как его восемь электронов удерживаются в четырех его валентных и р-орбиталях.
Это число «восемь»является особым в химии, потому что у многих элементов есть восемь пространств на валентных орбиталях. В разделе 4 раздела 4 мы видели, что атомы образуют ионы, чтобы попытаться получить или потерять электроны для достижения этих восьми электронов, которые заполняют эту самую внешнюю оболочку и, следовательно, создают стабильный атом или ином. В следующих нескольких разделах мы узнаем, как октетное правило будет использовать это магическое число, восемь, чтобы помочь нам построить большую часть молекул в природе.
схема 1
Задание для закрепления:
- определите валентности элементов в соединениях с водородом: PH 3 , HF, H 2 S, CaH 2 ,
- назовите соединения.
Задание 2: таким же способом можно определить валентности элементов в соединениях с кислородом зная, что кислород двухвалентен. Например:
Ребята работают парами, при необходимости объединяются в четвёрки, спорят, совещаются. Придя к какому-то мнению, предлагают свой аргументированный вариант ответа. В результате получаем схему №2
Пара валентных электронов на атоме не участвует в связи. Способ представления молекулярных структур, в которых атомы и их электроны представлены в виде двухэлектронных связей и одиночных пар электронов. Каждому атому присваиваются формальные заряды. Джон Далтон первым изложил материю, состоящую из невидимых частиц, называемых атомами. Атомы означают, что нельзя разрезать. Таким образом, атом может быть определен как самая маленькая частица элемента или химического вещества, которое обычно участвует в химической реакции, но может иметь или не иметь независимого существования.
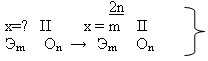 схема
2
схема
2
Задание для закрепления:
- определите валентности элементов в соединениях с кислородом:
- Как называются бинарные соединения, содержащие кислород?
NO 2 , N 2 O 5 , SO 2 , SO 3 , Cl 2 O 7 .
Задание 3: что же нужно обязательно знать, чтобы определить валентность элементов в бинарном соединении? (валентность одного из элементов)
Это означает, что атом неустойчив. Например, водородный газ является самой маленькой молекулой, состоящей из двух атомов водорода. Подобным же образом гелий, неон, аргон и т.д. являются примерами атома. Молекулу можно определить как самую маленькую частицу элемента или соединения, которое обычно не участвует в химической реакции, но имеет независимое существование. Это означает, что молекула стабильна. Термин «молекула» дал Авогадро. Свойства одной молекулы такие же, как и все соединение, то есть свойства соединения определяются молекулой, а не атомами.
Определите валентность атомов в соединении
Ребята работают парами, при необходимости объединяются в четвёрки, спорят, совещаются. Придя к какому-то мнению, предлагают свой аргументированный вариант ответа. В результате получаем схему №3

Учитель: какая из приведённых схем
Символы и формулы и их значения
Символы могут быть определены как краткое представление элемента. Элементы, имеющие символы, полученные из латинских имен. Элементы, имеющие имя, основанное на ученом. Символ не только аббревиатура для полного имени элемента, но и имеет качественное и количественное значение.
Изложение нового материала
Один атом натрия Один атомный вес натрия Один грамм атомного веса натрия. . Это короткое представление молекулы. Название и формулы некоторых общих соединений приведены ниже. Значение молекулярной формулы или формулы. Химическая молекулярная формула имеет как качественное, так и количественное значение. Химическая формула дает следующую информацию.
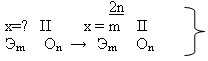 схема
2
схема
2

наиболее полно отражает правило определения валентности по формуле? (схема 3, т.к.она отражает общий случай, а схемы 1 и 2 лишь частные)
4. Закрепление изученного материала.
- Соединение представляет собой аммиак.
- Аммиак состоит из азота и водорода.
Рассмотрим следующее соединение. Некоторые элементы не сочетаются с водородом. Для таких элементов суммарная емкость измеряется относительно хлора. Таким образом, в два раза количество кислорода, которое сочетается с 1 атомом элементов, также называется валентностью. Таким образом, количество атомов водорода или количество атомов хлора или вдвое больше, чем число атомов кислорода, которые объединяются с одним атомом элементов, дают валентность этого элемента.
Самостоятельная работа
Текст работы заранее написан на доске. Двое учащихся решают задание на обратной стороне доски, остальные в тетрадях.
Задание 4. Проверьте, правильно ли написаны формулы следующих соединений: Na 2 S, KBr, Al 2 O 3 , Mg 3 N 2 , MgO.
5. Обобщение и систематизация знаний.
Творческая работа в группах
Некоторые элементы могут иметь более одной валентности. Например, железо объединяется с хлором, чтобы получить хлорид железа и хлорид железа. Таким образом, железо имеет валентность 2 и 3 соответственно в этих соединениях. Соединение с металлом, имеющим более низкую валентность, называется соединением, а металл, имеющий более высокую валентность, называется -соединением.
Большинство неорганических компонентов составлены, если две противоположно заряженные единицы. Радикалы могут быть разделены на. Магний, кальций, оксид являются примерами простых радикалов. Аммоний, сульфат, нитрат являются примерами составных радикалов.
Задание 5. Используя наборы для составления моделей молекул различных веществ, составьте формулы и модели молекул для следующих соединений:
1-я группа – меди и кислорода,
2-я группа – цинка и хлора,
3-я группа – калия и йода,
4-я группа – магния и серы.
После окончания работы один учащийся из группы отчитывается о выполненном задании и вместе с классом проводит анализ ошибок.
Учащиеся должны уметь
В зависимости от присутствующего в нем заряда радикалы бывают двух типов. Чодхари, Ганга Рам; Карна, Шила Кант Лал; Шарма, Канчан; Сингх, Санджай; Гупта, Дипак Кумар. Атом можно определить как самую маленькую частицу элемента или химического вещества, которое обычно участвует в химической реакции, но может иметь или не иметь независимого существования. Молекулу можно определить как самую маленькую частицу элемента или соединения, которая обычно не включает химическую реакцию, но имеет независимое существование. Термин «молекула» дал Авогадро Символ - это не только полное имя, но и качественное и количественное значение. Валентность элемента - это способность элемента, который измеряется в терминах количества атома водорода или его эквивалента, которые объединены с атомом элемента. Некоторые элементы могут быть более одной валентности Атомы или группа атомов, которые используются в качестве одной единицы во время химической реакции и несут положительный или отрицательный заряд, называются радикалами. Пока нет обсуждения этой заметки.
Задание 6. Напишите формулы соединений металлов с неметаллами: кальция с кислородом, алюминия с хлором, натрия с фосфором. Назовите эти соединения.
После выполнения работы ученики обмениваются тетрадями, происходит взаимопроверка.
Задание 7. Запишите порядок действия при составлении формул веществ, анализируя предложенный пример
Порядок действия |
|
6. Рефлексия
У Вас есть возможность сделать самооценку своей деятельности на уроке. Вам предлагается “Мишень эффективности”.
Отметьте свои знания по новой теме, отметив на рисунке соответствующий им сектор штриховкой. Сдайте свои записи.

7. Домашнее задание. По учебнику “Химия-8” (УМК Кузнецова Н.Е. и др.) § 14, упражнение1-71 обязательное (дополнительные с 1-72 по 1-74).
Сообщения о французском ученом Ж.Л.Прусте и английском ученом Дж.Дальтоне.
Литература
- Кузнецова Н.Е. и др. Химия: Учебник для учащихся 8 класса общеобразовательных учреждений.- М.: Вентана-Граф, 2010. – 320с.: ил.
- Кузнецова Н.Е., Шаталов М.А. Обучение химии на основе межпредметной интеграции: 8-9 классы: Учебно-методическое пособие.- М.: Вентана-Граф, 2004. – 352с.
- Емельянова Е.О., Иодко А.Г. Организация познавательной деятельности учащихся на уроках химии в 8-9 классах. Опорные конспекты с практическими заданиями, тестами: В 2-х частях. Часть I.– М.: Школьная пресса, 2002.- 144с.
- Кузнецова Л.М. Новая технология обучения химии в 8 классе.- Обнинск: Титул,1999.- 208с.:ил
Тема урока: Составление химических формул бинарных соединений по валентности.
«У научного изучения предметов две основные или конечные цели: предвидение и польза»
Д. И. Менделеев
Цели:
Образовательные : рассмотреть понятие «валентность» как атомность элемента, научить учащихся определять валентность в бинарных соединениях, познакомить учащихся с различными видами валентности, повторить понятия о кратном данного числа, о наименьшем общем кратном нескольких чисел, повторить правило нахождения НОК нескольких чисел и применение этого правила; обратить внимание учащихся на интеграцию курсов химии и математики.
Развивающие: развивать познавательный интерес учащихся, вырабатывать умение логически рассуждать, применять ранее полученные знания, грамотно выражать свои мысли.
Воспитательные: способствовать воспитанию интереса к предмету, к результату своего труда, развивать умение работать в парах, коллективно, оценивать ответы своих товарищей.
Планируемые результаты обучения:
Учащиеся должны знать:
определение понятия “валентность”;
валентность атомов водорода и кислорода в соединениях.
Учащиеся должны уметь:
определять по валентности атомов водорода и кислорода валентность атомов других элементов в бинарных соединениях;
определять валентность атомов элементов по формулам веществ, используя алгоритм для решения задач.
Основные понятия: валентность, постоянная и переменная валентность, бинарные соединения, наименьшее общее кратное.
Тип урока: комбинированный.
Средства обучения: алгоритм определения валентности.
Оборудование: Периодическая система химических элементов Д. И. Менделеева, шаростержневые модели молекул, таблица «Алгоритм определения валентности».
Ход урока
Организационный этап: приветствие учащихся.
Актуализация опорных знаний.
Фронтальная беседа учителя химии с учащимися по теме “Химическая формула”.
При изучении химии очень важно научиться составлять формулы химических веществ.
Что выражает химическая формула? (состав определенного вещества, взятого в чистом виде)
Химическая формула – это условное обозначение вещества, атома, молекулы, иона с помощью символов элементов, числовых и вспомогательных знаков.
По химической формуле мы можем определить:
Тип вещества,
Качественный и количественный состав,
Относительную молекулярную массу,
Массовую долю химического элемента в данном веществе,
Валентность химических элементов.
Все вещества состоят из атомов. Одним из основных свойств атомов является способность образовывать химические связи. Атомы разных элементов могут образовывать определенное, свойственное им количество связей.
Давайте сравним качественный и количественный состав в молекулах: HCl , H 2 O, NH 3 , CH 4 .
Что общего в составе молекул? (наличие атомов водорода)
Чем эти вещества отличаются друг от друга? (в этих веществах разное количество атомов водорода)
Атом водорода не может присоединить более одного атома другого химического элемента, поэтому валентность водорода принята за единицу. И поэтому с валентностью водорода сравнивают валентность всех других элементов.
Примеры:
HCl - один атом хлора связан с одним атомом водорода;
H 2 O - один атом кислорода связывает два атома водорода;
NH 3 - один атом азота связывает три атома водорода;
CH 4 - один атом углерода связывает четыре атома водорода.
Почему различные атомы удерживают различное количество атомов водорода?
(каждый атом образует с другими атомами определенное количество связей).
Это называют валентностью.
Валентность – это свойство атомов удерживать определённое число других атомов в соединении.
Валентность обозначается римскими цифрами.
Записи на доске и в тетрадях:
| I I | I II | I III | I IV |
Валентность атома водорода принята за единицу - I, а у кислорода – II.
Сообщение учащегося о валентности.
В начале XIX века Дж. Дальтоном был сформулирован закон кратных отношений, из которого следовало, что каждый атом одного элемента может соединяться с одним, двумя, тремя и т.д. атомами другого элемента (как, например, в рассмотренных нами соединениях атомов с водородом).
В середине XIX века, когда были определены точные относительные веса атомов (И.Я. Берцелиус и др.), стало ясно, что наибольшее число атомов, с которыми может соединяться данный атом, не превышает определённой величины, зависящей от его природы. Эта способность связывать или замещать определённое число других атомов и была названа Э. Франклендом в 1853 г. “валентность”.
Поскольку в то время для водорода не были известны соединения, где он был бы связан более чем с одним атомом любого другого элемента, атом водорода был выбран в качестве стандарта, обладающего валентностью, равной 1.
В конце 50-х гг. XIX вeка А. С. Купер и А. Кекуле постулировали принцип постоянной четырёхвалентности углерода в органических соединениях. Представления о валентности составили важную часть теории химического строения А. М. Бутлерова в 1861 г.
Периодический закон Д.И. Менделеева в 1869 г. вскрыл зависимость валентности элемента от его положения в периодической системе.
Вклад в эволюцию понятия “валентность” в разные годы внесли В.Коссель, А.Вернер, Г.Льюис.
Начиная с 30-х гг. XX века представления о природе и характере валентности постоянно расширялись и углублялись. Существенный прогресс был достигнут в 1927 г., когда В. Гейтлер и Ф. Лондон выполнили первый количественный квантово-химический расчёт молекулы водорода H 2 .
Беседа с учащимися: Что такое валентность?
Определение валентности в разных источниках звучит по-разному. Давайте подумаем, какое из этих трех определений более совершенно и в чем недостатки других.
1-й ряд
«Валентность
химического элемента – способность его атомов соединяться с другими атомами в определенных соотношениях».
2-й ряд
«Валентность
– способность атомов одного элемента присоединять определенное количество атомов другого элемента».
3-й ряд
«Валентность
– свойство атомов, вступая в химические соединения, отдавать или принимать определенное количество электронов или объединять электроны для образования общих для двух атомов электронных пар ».
Обсуждение в группах, приходим к выводу, что 3-е определение наиболее точно отражает суть определения валентности.
Изложение нового материала:
Тема нашего урока:
Составление формул бинарных соединений по валентности.
Новый материал запоминается легче, если он нанизывается на уже полученные знания. Поэтому сейчас предстоит работа с извлечением этого материала из памяти. И в этом вам поможет учитель математики.
Учитель ведет диалог с учениками:
Учитель: перечислите несколько чисел, кратных 12.
12, 24, 36, 48 ….
Учитель: перечислите несколько чисел, кратных 18.
18, 36, 54, 72……
Учитель: назовите числа, которые кратны и 12 и18.
36 и 72 и т.д.
Учитель: назовите наименьшее общее кратное 12 и 18.
Учитель: Сформулируйте определение наименьшего общего кратного нескольких чисел.
Наименьшим общим кратным нескольких чисел называется самое меньшее натуральное число, которое делится на каждое из данных чисел.
Учитель: сформулируйте правило нахождения наименьшего общего кратного двух или нескольких чисел.
Чтобы найти НОК двух или нескольких чисел, надо разложить эти числа на простые множители, затем, взяв разложение одного из них, умножить его на недостающие простые множители из разложений других чисел.
Учитель предлагает следующее упражнение:
№1 . Найдите А) НОК (48, 90); Б) НОК (6, 15, 20)
Решение:
А) 48/2 90/2 Б) 6/2 15/3 20/2
24/2 45/3 3/3 5/5 10/2
12/2 15/3 1/ 1/ 5\5
НОК (48,90) = 2 4 *3*3*5 НОК (6,15,20) = 2 3 * 5 * 3
НОК (48,90)= 720 НОК (6,15,20) = 60
Ответ : А) 720; Б) 60.
Учитель: чему равно НОК двух взаимно простых чисел?
НОК двух взаимно простых чисел равно их произведению.
№2. Найдите НОК (7,11)
Учитель: Как вы помните, существует еще один способ нахождения НОК чисел – это способ подбора.
Найдите НОК следующих чисел способом подбора:
А) 10 и 2 Б) 14 и 21 В) 20 и 15 Г) 2; 3 и 5
Ответы: А) 10 Б) 42 В) 60 Г) 30.
Учитель: Ребята, мы с вами повторили, как можно найти НОК двух или нескольких чисел. А теперь вы познакомитесь с тем, как эти знания применяются в химии при определении валентности.
В. Гете когда-то сказал: «Просто знать еще не все, знания нужно уметь использовать».
Определение валентности элементов по формулам в бинарных соединениях.
Помнить: в формулах бинарных соединений число единиц валентностей всех атомов одного элемента равно числу единиц валентности всех атомов другого элемента.
Записать формулу вещества. Р 2 О 5
Римской цифрой указать валентность одного из элементов. Р 2 О 5 (II)
Определить валентность другого химического элемента. Р 2 О 5
Х*2= II *5 X = V
Составление химических формул бинарных соединений по валентности элементов.
Записываем символы химических элементов, входящих в состав формулы, проставляя над ними соответствующие значения валентности:
СаО, В 2 О 3 , СО 2 ,
Составляем формулу соединения по валентности:
а) СаО: если валентности химических элементов равны, то индексы не ставим.
б) В 2 О 3: если значения валентностей не делятся друг на друга, ставим значения валентностей крест накрест.
в) СО 2: если валентность одного элемента делится на валентность другого, то значение большей валентности разделить на значение меньшей и полученное число в виде индекса поставить возле элемента с меньшей валентностью.
Упражнение: определить валентность элементов в веществах: ученики цепочкой выходят к доске. Задание проецируем на доску.
SiH 4 , CrO 3 , H 2 S, CO 2 , CO, SO 3 , SO 2 , Fe 2 O 3 , FeO, HCl, HBr, Cl 2 O 5 , Cl 2 O 7 , РН 3 , K 2 O, Al 2 O 3 , P 2 O 5 , NO 2 , N 2 O 5 , Cr 2 O 3 , SiO 2 , B 2 O 3 , SiH 4 , Mn 2 O 7 , MnO, CuO, N 2 O 3 .
Оценочно-рефлексивный этап.
Первичная проверка усвоения знаний. Для выполнения данного задания учащиеся получают «Алгоритм определения валентности» и задания трех уровней. Каждый учащийся выбирает свой уровень задания.
Репродуктивный уровень (“3”). Определите валентность атомов химических элементов по формулам соединений: NH 3 , Au 2 O 3 , SiH 4 , CuO.
Прикладной уровень (“4”). Из приведённого ряда выпишите только те формулы, в которых атомы металлов двухвалентны: MnO, Fe 2 O 3 , CrO 3 , CuO, K 2 O, СаH 2.
Творческий уровень (“5”). Найдите закономерность в последовательности формул: N 2 O, NO, N 2 O 3 и проставьте валентности над каждым элементом.
| Алгоритм определения валентности | Пример |
|
| 1. Запишите формулу вещества. | ||
| 2. Обозначьте известную валентность элемента | ||
| 3. Найдите число единиц валентности атомов известного элемента, умножив валентность элемента на количество его атомов | ||
| 4. Поделите число единиц валентности атомов на количество атомов другого элемента. Полученный ответ и является искомой валентностью | 2 | 2 |
| 5. Сделайте проверку, то есть подсчитайте число единиц валентностей каждого элемента | I II | I II |
Проводим взаимопроверку выполненного задания (учащиеся обмениваются тетрадями).
Работа над ошибками: о тветы на доске.
Подведение итогов урока.
Беседа с учащимися:
Какую проблему мы поставили в начале урока?
К какому выводу мы пришли?
Дать определение “валентности”.
Как определить НОК?
Чему равна валентность атома водорода? Кислорода?
Как определить валентность атома в соединении?
Оценка работы учащихся.
Домашнее задание: учебник Г. Е. Рудзитис, Ф. Г. Фельдман §17, стр. 60, упр. 1, 2, 4, 6
Проблемный вопрос: Почему водород и литий имеют постоянную валентность, а гелий не имеет валентности?
«Как преуспеть ученикам – догонять тех, кто впереди, и не ждать тех, кто позади»
Аристотель
Желаем вам всегда быть впереди.
- Манная каша на молоке: пропорции и рецепты приготовления Манная каша 1 порция
- Суп-пюре из брокколи с сыром Рецепт крем супа из брокколи с сыром
- Гороскоп: характеристика Девы, рождённой в год Петуха
- Причины выброса токсичных веществ Несгораемые углеводороды и сажа
- Современный этап развития человечества
- Лилия яковлевна амарфий Могила лилии амарфий
- Значение имени мариям Имя марьям значение происхождение

 Live Journal
Live Journal Facebook
Facebook Twitter
Twitter