Основы молекулярной теории. Молекулярно-кинетическая теория. Основные положения молекулярно-кинетической теории строения вещества
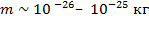
Основные положения молекулярно-кинетической теории строения вещества
Предположение о том, что любое вещество состоит из мельчайших неделимых частиц – атомов, было высказано около 2500 лет назад древнегреческими философами Левкиппом и Демокритом. По их представлениям все тела образуются в результате соединения атомов. Различия в свойствах тел объясняются тем, что тела состоят из различных атомов или одинаковые атомы по-разному соединены между собой в пространстве. Существенный вклад в развитие молекулярно-кинетических представлений сделал в середине XVIII в. великий русский ученый Михаил Васильевич Ломоносов (1711–1765). Он объяснил основные свойства газа, предположив, что все молекулы газа движутся беспорядочно, хаотично и при столкновениях отталкиваются друг от друга. Беспорядочным движением молекул М. В. Ломоносов впервые объяснил природу теплоты. В начале XIX столетия английский ученый Д. Дальтон показал, что многие закономерности явлений природы можно объяснить, используя представления об атомах и молекулах, и научно обосновал молекулярное строение вещества.К началу ХХ столетия была окончательно создана и подтверждена множеством опытов молекулярно-кинетическая теория строения вещества.
В это время молекулы добавляют путем образования. небольшие капли жидкости. Такое явление, которое является прохождением газа а. жидкость, она называется конденсацией. Существуют также внутримолекулярные силы или силы, которые сохраняются. атомы вместе в молекуле. Внутримолекулярные силы ответственны за устойчивость отдельных молекул, в то время как. межмолекулярные силы ответственны прежде всего за. макроскопические свойства вещества. В общем, межмолекулярные силы значительно слабее. внутримолекулярные силы.
Поэтому, как правило, требуется меньше. энергии для испарения жидкости, которая разрушает их связи. молекулы. Различные молекулярные силы следующие: Диполь-дипольные силы Диполь-дипольные силы - это те, которые присутствуют между молекулами. полярным, то есть между молекулами, имеющими дипольный момент. Его происхождение является электростатическим и может быть понято в терминах закона. Чем больше дипольный момент, тем больше сила. В жидкостях молекулы не связаны так жестко, как. в твердом состоянии, но имеют тенденцию выравниваться таким образом, чтобы в среднем. привлекательные взаимодействия максимальны.
Молекулярно-кинетической теорией (МКТ) называют учение о строении и свойствах вещества на основе представления о существовании атомов и молекул как наименьших частиц химических веществ.
В основе молекулярно-кинетической теории лежат три основных положения:
1. Все вещества – жидкие, твердые и газообразные – образованы из мельчайших частиц – молекул, которые сами состоят из атомов.
Ион-дипольные силы закона Кулона также объясняют возникающие ионно-дипольные силы. между ионом и диполем. Сила этого взаимодействия зависит от заряда и размера иона и величины. диполь. Обвинения в катионах обычно больше. сконцентрированы, так как катионы обычно меньше катионов. анионы. Следовательно, при равных нагрузках катион взаимодействует больше. сильно с диполями, что анион. Дисперсионные устройства До сих пор анализировались только ионные и полярные молекулы. Интересно, что происходит с неполярными молекулами.
Если ион или полярная молекула расположены вблизи атома. нейтральное электронное распределение атома искажается силой, действующей на ион или. полярная молекула. Говорят, что полученный диполь в атоме или молекуле является индуцированным диполем, поскольку разделение положительного и отрицательного зарядов в нейтральном атоме связано с близостью полярного иона или молекулы. Кроме того, тем больше его поляризуемость. и привлекательное взаимодействие между полярной молекулой и индуцированным диполем называется дипольным индуцированным дипольным взаимодействием. тем больше число электронов и тем более диффузное электронное облако в атоме или молекуле.
Молекул а – мельчайшая устойчивая частица вещества, сохраняющая его основные химические свойства .
Молекулы химического вещества могут быть простыми и сложными, т.е. состоять из одного или нескольких атомов. Молекулы и атомы представляют собой электрически нейтральные частицы. При определенных условиях молекулы и атомы могут приобретать дополнительный электрический заряд и превращаться в положительные или отрицательные ионы.
Дисперсионные силы обычно увеличиваются с молярной массой по следующей причине. когда чистые силы притяжения находятся на максимуме. Эти силы являются привлекательными по своей природе и играют важную роль в определении физических свойств веществ. Поляризуемость дает ключ к тому, почему газы, образованные нейтральными атомами или неполярными молекулами, например. Легкость, с которой может быть индуцирован дипольный момент, зависит не только от заряда иона или от силы диполя, но и от поляризуемости нейтрального атома или неполярной молекулы.
Атомы – мельчайшие частицы химического элемента, сохраняющие его химические свойства.
Число различных атомов сравнительно невелико и равно числу химических элементов и их изотопов. Атомы представляют собой весьма сложные образования, но классическая MKT использует модель атомов в виде твердых неделимых частичек сферической формы. Полагается, что движение атомов и молекул, их взаимодействия подчиняются законам механики. Это позволяет использовать законы механики для выяснения свойств тел, состоящих из большого числа хаотически движущихся малых частиц. С помощью современных методов исследования (электронный и зондовый микроскопы) удалось получить изображения молекул. Приблизительные линейные размеры атома: , масса ![]() .
.
Большие молярные массы часто указывают на большие атомы, электронное распределение которых легче нарушается, потому что внешние электроны менее сильно связаны с ядром. Это справедливо для гелия. Притягательные силы, возникающие в результате временных диполей, индуцированных в атомах или молекулах. Они могут быть очень слабыми. точки кипения и растворимости. называемых дисперсионными силами. и дисперсионные силы возрастают по величине с числом электронов. Обычно. молекулы с большой молярной массой имеют больше электронов.
Эти параметры помогут понять природу этих физических изменений. имейте в виду взаимосвязь между изменением энергии и увеличением или уменьшением молекулярного порядка. Давление пара измеряется только при наличии достаточного количества пара. его молекулы в газовой фазе оказывают давление пара. Водородный мост. Водородный мост представляет собой особый тип диполь-дипольного взаимодействия между атомом водорода полярной связи. Изучая фазовые превращения. уровни ртути стабилизируются, и никаких изменений не наблюдается. устанавливается паровая фаза.
2. Атомы и молекулы находятся в непрерывном хаотическом тепловом движении.
 Рис. 109.
Траектория броуновской частицы.
Рис. 109.
Траектория броуновской частицы.
|
Наиболее ярким экспериментальным подтверждением представлений молекулярно-кинетической теории о беспорядочном движении атомов и молекул является броуновское движение. Это тепловое движение мельчайших микроскопических частиц, взвешенных в жидкости или газе. Оно было открыто английским ботаником Р.Броуном в1827г. Броуновские частицы движутся под влиянием беспорядочных ударов молекул. Из-за хаотического теплового движения молекул эти удары никогда не уравновешивают друг друга. В результате скорость броуновской частицы беспорядочно меняется по модулю и направлению, а ее траектория представляет собой сложную зигзагообразную кривую (рис.109). Теория броуновского движения была создана А.Эйнштейном в1905г. Экспериментально теория Эйнштейна была подтверждена в опытах французского физика Ж.Перрена, проведенных в1908–1911гг.
3. Между частицами вещества существуют силы взаимодействия – притяжения и отталкивания. Эти силы действуют на небольших расстояниях.
Как только несколько молекул покидают жидкость. Молекулы в твердом состоянии имеют самый высокий порядок. Баланс жидкого пара Давление пара. Перед началом процесса испарения. Из опыта известно, что энергия необходима для перехода от твердого состояния к жидкости и от жидкости к газообразной. Некоторые молекулы возвращаются к жидкой фазе. Состояние динамического равновесия достигается, когда скорость конденсации и испарения равна. Скорость испарения постоянна при данной температуре и скорость конденсации возрастает с увеличением концентрации молекул в паровой фазе. кинетическая энергия его молекул уменьшается, и в конечном итоге молекулы соединяются, образуя небольшие капли жидкости.
При сближении двух атомов или молекул сначала преобладают силы притяжения. Но на некотором расстоянии между их центрами силы отталкивания возрастают настолько, что становятся равными по модулю силам притяжения. При дальнейшем сближении силы отталкивания превосходят силы притяжения.
МКТ стала одной из самых успешных физических теорий и была подтверждена целым рядом опытных фактов. Основными доказательствами положений МКТ стали:
Знание конденсации или сжижения является противоположностью испарения. Давление паров, измеренное в динамическом равновесии конденсации и испарения, называется равновесием давления пара. с газом это можно довести до состояния жидкости двумя способами: путем охлаждения газообразного образца. Важно помнить, что давление пара в равновесии - это максимальное давление пара, которое жидкость оказывает при данной температуре и постоянная при постоянной температуре. Критическая температура и давление. Температура испарения и температура кипения.
· Диффузия
· Броуновское движение
· Изменение агрегатных состояний вещества.
На основе МКТ развит целый ряд разделов современной физики, в частности, физическая кинетика и статистическая механика. В этих разделах физики изучаются не только молекулярные (атомные или ионные) системы, находящиеся не только в «тепловом» движении, и взаимодействующие не только через абсолютно упругие столкновения. Термин же молекулярно-кинетическая теория в современной теоретической физике уже практически не используется, хотя он встречается в учебниках по курсу общей физики.
Молярная теплота испарения. Сначала в движении есть только одно чувство: молекулы перемещаются из жидкости в пустое пространство. Вскоре молекулы в пространстве на жидкости устанавливают парообразную фазу. потому что это тепло непосредственно связано с величиной межмолекулярных сил жидкости. в процессе, называемом конденсацией. По мере увеличения концентрации молекул в паровой фазе. однако. Давление паров. Он изменяется с температурой. Конденсация происходит потому, что молекула, которая сталкивается с поверхностью жидкости, захватывается межмолекулярными силами в жидкости. что приемлемо, если известно значение сокращенного термина.
1.4 . Число степеней свободы молекул
 Рис. 110.
Рис. 110.
|
Молекула одноатомного газа, которую можно рассматривать как материальную точку (рис. 110а ), имеет три поступательные степени свободы , так как для описания положения такой молекулы газа в пространстве достаточно трёх координат . При этом не учитывается энергия вращательного движения.
В механике молекула двухатомного газа в первом приближении считается совокупностью двух материальных точек, которые жестко связанны недеформируемой связью (рис. 110, б). Жесткой связью называется связь, при которой расстояние между атомами не изменяется. Двухатомные молекулы с жесткой связью имеют поступательные степени свободы и вращательные степени свободы: .
Молекулярное движение становится настолько энергичным, что молекулы всегда будут отделены друг от друга. Промышленные процессы сжижения используют комбинацию этих двух методов. среднее расстояние между молекулами уменьшается таким образом, что они удерживаются вместе взаимным притяжением. Нормальной точкой плавления вещества является температура плавления, измеренная при давлении 1 атм. При температурах ниже Тс. Это также максимальная температура, при которой вещество может существовать как жидкость.
Эта сила достаточно велика, чтобы удерживать молекулы вместе в жидкости. Существование критической температуры качественно объясняется следующим образом. Межмолекулярное притяжение является конечной величиной для данного вещества. нарушая это влечение. Жидкостно-твердое равновесие Переход от жидкого состояния в твердое состояние называется замораживанием или затвердеванием. и анализ второго. над которыми газообразная форма не может быть сжижена. Баланс твердого пара. Изменение состояния от твердого тела до пара известно как сублимация.
В основе молекулярно-кинетической теории строения вещества лежат следующие 3 положения:
Всякое тело в природе в каком бы состоянии оно не находилось – твердом, жидком или газообразном, не является сплошным, а состоит из весьма большого числа структурных частиц – молекул.
Молекулы любого вещества находятся в состоянии непрерывного движения, характерной особенностью которого является его полнейшая беспорядочность или хаотичность, означающая, что все направления в движении молекул являются равноправными, равновероятными, не существует какого-либо преимущественного направления для движения молекул.
Точкой плавления твердого тела является температура, при которой твердая и жидкая фазы сосуществуют в равновесии. под сжатием. У каждого вещества есть температура. твердые вещества также имеют давление пара. критической температуры. независимо от того, насколько велико приложенное давление. Известно, что расплавленная теплота плавления с энергией, которая требуется для расплавления 1, формирует твердое вещество. Чтобы вызвать изменение состояния от твердого к жидкости, необходимо применить энергию.
Минимальное давление, которое необходимо применять для разжижения вещества при критической температуре, называется критическим давлением. Эксперименты Юла настоящий газ. Клаузиус. мало что нужно будет заново открыть. Максвелл и Больцман разработали кинетическую теорию.
Между молекулами в веществе действуют одновременно силы притяжения и силы отталкивания. И те и другие с увеличением расстояния между молекулами быстро уменьшаются. Однако убывание сил отталкивания оказывается более быстрым, чем сил притяжения, в результате чего оказывается, что силы отталкивания преобладают на весьма малых расстояниях, а силы притяжения на более далеких расстояниях, однако и те и другие очень быстро убывают с расстоянием. Поэтому межмолекулярные силы являются коротко действующими силами. Они действуют на малых расстояниях между молекулами порядка 10 -9 м и менее.
Работа Бернулли была проигнорирована более ста лет. Если газ является элементом или соединением в его стабильном состоянии. Идеальная концепция газа и разница между идеальным и реальным газом. свойства реальных газов значительно отличаются от свойств идеальных газов. Молекулы оживляются случайным движением и подчиняются законам движения Ньютона. Каждая молекула образована атомом или группой атомов. Теоретические уравнения Эйнштейна были подтверждены экспериментами Перрина. Но если температура слишком низкая или слишком высокое давление.
Всякое вещество состоит из молекул, состоящих из атомов.
Молекулы – это наименьшие частицы вещества, сохраняющие все его химические свойства. Они могут состоять из двух или большего числа одинаковых или различных атомов. Различных видов молекул известно огромное число, различных же атомов, соответствующих химическим элементам периодической системы Менделеева, совсем немного, причем в природе их встречается всего 88, а остальные получены искусственным путем.
При расчете свойств движения мы предполагаем, что ньютоновская механика может быть применена на микроскопическом уровне. он будет держать или отбрасывать. Что касается всех наших предположений. кислород. Кинетическая теория газов использует молекулярное описание для получения макроскопических свойств вещества. в зависимости от того, указывают ли экспериментальные факты или нет, что наши прогнозы правильны. Направление и скорость движения любой из молекул могут резко измениться при столкновениях. Газ состоит из частиц, называемых молекулами.
Массы атомов и молекул чрезвычайно малы (порядка 10 -23 – 10 -24 г) и выражать их в граммах или килограммах неудобно. Поэтому в химии и физике введены специальные атомные единицы массы. Заатомную единицу массы принимают 1/12 массы изотопа атома изотопа углерода С 12 . Массы атомов и молекул, выраженные в атомных единицах, называют соответственно относительными атомными и молекулярными массами.
Общее число молекул велико. Мы считаем, что все его молекулы идентичны. Объем молекул является, по-видимому, малой долей объема, занимаемого газом. Однако. кроме случаев шока. с небольшими трудностями и тем. после такого короткого времени. Любая из молекул в частности. Среднее расстояние между ними велико по сравнению с размером одной из молекул. он снова доступен как кинетическая энергия. кинетическая энергия, которая становится потенциальной энергией во время удара. В той степени, что это правда. из-за таких потрясений. что мы можем полностью игнорировать это изменение.
Относительной атомной массой химического элемента называют отношение массы атома этого элемента к 1/12 массы атома углерода С 12 . Аналогично,относительной молекулярной массой вещества называют отношение массы молекулы этого вещества к 1/12 массы атома углерода С 12 . Молекулярная масса равна сумме атомных масс входящих в состав молекулы атомов. Она легко подсчитывается по химической формуле вещества. В случае химически простых веществ (т.е. веществ, состоящих из атомов) их относительная молекулярная масса совпадает с относительной атомной массой.
Аварии являются эластичными и кажущейся продолжительностью. Хотя есть много молекул. когда конденсируется газ. Он будет следовать зигзагообразному пути. В столкновениях между молекулами со стенками сосуда сохраняются импульс и кинетическая энергия. Следовательно, наше предположение возможно. Следовательно, предположим, что диапазон молекулярных сил сравним с размером молекул. Мы знаем, что объем, занимаемый газом, может быть изменен в очень широком диапазоне. мы предполагаем, что полученное большое количество ударов сохраняет полное распределение скоростей молекул со случайным средним движением.
В химии и физике единицей количества вещества является моль (седьмая основная единица системы СИ ).Молем вещества называют такое количество вещества, которое содержит столько частиц, сколько атомов содержится в 0,012 кг изотопа углерода С 12 . Из определения следует, что моль любого вещества, независимо от того, в каком состоянии оно находится, содержит одинаковое число молекул. Число молекул, содержащихся в 1 моле любого вещества, является одной из важнейших физических констант и называетсяпостоянной Авогадро N A = 6,0210 23 1/моль. Масса моля вещества численно равна его относительной молекулярной массе, выраженной в граммах, и обозначается тем же символом, что и относительная молекулярная масса.
Ввиду малых размеров молекул, их число в любом макроскопическом объеме тела огромно. В 1 см 3 газа при нормальных атмосферных условиях содержится 2,710 19 молекул (число Лошмидта), а в 1 см 3 воды – 3,310 22 молекул. При этом каждая молекула может состоять из нескольких атомов.
Сами атомы также являются сложными системами, состоящими из положительно заряженных ядер и электронных оболочек. Ядро атома имеет размеры порядка 10 -13 см и в нем сосредоточена почти вся масса атома (плотность ядра вещества чрезвычайно велика по сравнению с плотностью обычных веществ и составляет около 10 14 г/см 3). Электрический заряд ядра положителен, по абсолютной величине равен сумме зарядов атомных электронов нейтрального атома иопределяется порядковым номером элемента в периодической таблице. Атом в целом нейтрален.
Из строения вещества следует, что между атомами и молекулами, входящими в состав вещества, должны существовать силы взаимодействия , которые по своей природе являются электрическими силами – силами взаимодействия между заряженными частицами, из которых состоят атомы, а следовательно, и молекулы. Так как в атоме имеются частицы с разными знаками электрических зарядов, то неизбежно должны существовать как силы притяжения, так и силы отталкивания. Действительно, электроны одной молекулы и ядра другой притягиваются друг к другу, а между электронами обеих молекул, так же как и между их ядрами, действуют силы отталкивания. Хотя в целом атом и молекула электронейтральны, но заряды в атоме, и следовательно, молекуле могут быть расположены не вполне симметрично, а как бы раздвинуты друг относительно друга на некоторое расстояние. Такая асимметрия в расположении зарядов в молекуле может появиться (индуцироваться) также из-за взаимодействия этих зарядов. Появление этой асимметрии приводит к тому, что между молекулами, даже нейтральными, возникают силы притяжения. На малых расстояниях эти силы притяжения компенсируются силами отталкивания, которые обусловлены главным образом электростатическим отталкиванием.
Количественно определить силы взаимодействия между молекулами трудно, их можно определить лишь весьма приближенно. Такие оценки в полном согласии с опытом показывают, что и силы притяжения, и силы отталкивания очень сильно зависят от расстояний между центрами молекул:
(знак «+» относится к силам отталкивания, а «-« - к силам притяжения). В случае нейтральных молекул n7 для сил притяжения иn9 для сил отталкивания, т.е. силы отталкивания убывают быстрее, и поэтому они могут играть роль только при непосредственном соприкосновении молекул.
Силы межмолекулярных взаимодействий определяют структуру вещества и характер молекулярного движения в нем. Известно, что газообразные, жидкие и твердые вещества имеют разную структуру, и характер молекулярного движения в них оказывается различным.
В газах среднее расстояние между молекулами во много раз больше размеров самих молекул. Межмолекулярные силы на таких расстояниях незначительны (потенциальная энергия взаимодействия молекул п меньше их средней кинетической энергии движения к, и молекулы движутся почти независимо друг от друга. В достаточно разреженном газе можно считать, что движение каждой молекулы происходит практически без действия сил, т.е. прямолинейно и равномерно. Прямолинейность движения молекул в таком газе нарушается лишь при столкновении его молекул между собой или со стенками сосуда. В момент столкновения молекула резко меняет направление своего движения и затем продолжает двигаться в новом направлении равномерно и прямолинейно вплоть до следующего столкновения и т.д. Таким образом,в газообразном состоянии вещества молекулы совершают хаотическое поступательное движение. Путь газовой молекулы представляет бесконечную ломаную линию, состоящую из множества неравных отрезков, следующих один за другим без всякого порядка. В газе отсутствует всякий порядок не только в направлении движения молекул, но нет также никакого порядка и в размещении их в пространстве для любого момента времени. Вещество в газообразном состоянии не сохраняет ни формы, ни объема.
Иначе обстоит дело в твердых кристаллических телах. В кристаллах расстояние между частицами много меньше, чем в газах, а межмолекулярные взаимодействия сильнее. Вещество в твердом состоянии сохраняет как форму, так и объем. Характер молекулярного движения в кристалле совсем иной. В кристалле частицы (молекулы, атомы или ионы – в зависимости от вещества) не могут разорвать свои связи с ближайшими соседями и переходят с места на место крайне редко. Большую часть времени ониколеблются около некоторых неподвижных положений равновесия, которые распределены в пространстве не хаотически, а тем или иным закономерным образом (в виде некоторой пространственной решетки, называемойкристаллической решеткой ), который также определяется характером межмолекулярных взаимодействий.
Что же касается жидкостей, то в них сочетаются свойства, типичные для кристаллов, со свойствами, типичными для газов. Жидкое состояние характеризуется тем, что вещество стремится сохранить объем, но не сохраняет формы. Молекулы жидкости не так прочно связаны друг с другом, как молекулы кристаллов, но и не так свободны, как молекулы газов. Молекулы жидкости, как и молекулы кристаллов, колеблются, но положения равновесия, около которых совершаются эти колебания, не остаются неподвижными, как в кристаллах, а непрерывно меняются . По теории, развитой советским физиком Френкелем, каждая молекула жидкости колеблется около данного положения равновесия лишь в течение некоторого промежутка времени, после чего она меняет свое положение равновесия, перемещаясь на расстояние порядка диаметра самих молекул. Время, в течение которого молекулы в жидкости колеблются около определенных положений равновесия, Френкель назвалвременем оседлой жизни молекул .
При повышении Т жидкости время оседлой жизни молекулы быстро уменьшается, т.е. молекулы чаще перескакивают с одного места на другое, и жидкость по своим свойствам приближается к плотным газам: в жидкости колебательное движение частиц сочетается с поступательным перемещением (перескоком) их из одного положения равновесия в другое.
Следует отметить, что несмотря на различный характер движения молекул в газах, жидкостях и твердых телах, общим для всех этих случаев является то, что молекулярное движение всегда имеет беспорядочный характер, т.е. скорости молекул не имеют какого-либо преимущественного направления, а распределены хаотически по всем направлениям. Интенсивность этого хаотичного движения молекул, его энергия и определяют тепловое состояние тел. Поэтому хаотическое движение молекул в веществе обычно называют тепловым движением .
Иногда молекулы жидкости соединяются в агрегаты, состоящие из большого числа молекул, причем агрегатное расположение их определенным образом упорядочено. В этом случае жидкости обладают некоторыми свойствами, характерными для твердых кристаллических тел (жидкие кристаллы ).
- Манная каша на молоке: пропорции и рецепты приготовления Манная каша 1 порция
- Суп-пюре из брокколи с сыром Рецепт крем супа из брокколи с сыром
- Гороскоп: характеристика Девы, рождённой в год Петуха
- Причины выброса токсичных веществ Несгораемые углеводороды и сажа
- Современный этап развития человечества
- Лилия яковлевна амарфий Могила лилии амарфий
- Значение имени мариям Имя марьям значение происхождение

 Live Journal
Live Journal Facebook
Facebook Twitter
Twitter