Как составить электронную конфигурацию иона. Способы записи электронных конфигураций атомов и ионов. Принцип минимума энергии
Точное решение уравнения Шредингера удается найти лишь в редких случаях, например, для атома водорода и гипотетических одноэлектронных ионов, таких как He + , Li 2+ , Be 3+ . Атом следующего за водородом элемента - гелия - состоит из ядра и двух электронов, каждый из которых притягивается к обоим ядрам и отталкивается от другого электрона. Уже в этом случае волновое уравнение не имеет точного решения.
Однако атомы позитрония физически довольно легко описывать: это система из двух практически одинаковых и точечных частиц, которые притягивают друг друга только с одной силой - «электрослабое взаимодействие». При нормальных обстоятельствах даже электромагнитное усилие достаточно для описания. С другой стороны, в «обычных» атомах нейтронов, протонов и электронов пространственная протяженность ядер и дополнительное сильное взаимодействие усложняют расчет.
Дело становится физически захватывающим, когда к элементу позитрония добавляется другой электрон. В таких отрицательно заряженных атомах три частицы взаимодействуют друг с другом, и это задача для физиков, потому что свойства трехчастичных систем могут быть только рассчитаны. Тем не менее, благодаря своей простоте ион позитрония представляет собой интересную модельную систему для квантовой механики.
Поэтому большое значение имеют различные приближенные методы. С помощью таких методов удалось установить электронное строение атомов всех известных элементов. Эти расчеты показывают, что орбитали в многоэлектронных атомах не сильно отличаются от орбиталей атома водорода (эти орбитали называют водородоподобными). Главное отличие - некоторая сжатость орбиталей из-за большего заряда ядра. Кроме того, для многоэлектронных атомов найдено, что для каждого энергетического уровня (при данном значении главного квантового числа n ) происходит расщепление на подуровни . Энергия электрона зависит уже не только от n , но и от орбитального квантового числа l . Она увеличивается в ряду s -, p -, d -, f -орбиталей (рис. 7).
Однако до сих пор экспериментальные данные отсутствуют, чтобы проверить приближенные методы, используемые в теории. В качестве прелюдии к проекту изучения иона позитрония исследователи Гейдельберга Макс Планка теперь определили жизнь экзотики в шесть раз точнее, чем это было возможно ранее. Результат: ионы позитрония живут в среднем почти половину наносекунды. Это очень хорошо согласуется с вычисленным значением.
Институт ядерной физики им. Макса Планка. Для измерения, которое заняло в общей сложности восемь месяцев, исследователи сняли позитроны через чрезвычайно тонкую углеродную пленку. Около каждых десятитысячных позитронов захватывает два электрона и образует ион позитрония. Если подсчитать ионы позитрония, поступающие с другого конца на разные расстояния с подходящим методом обнаружения, тогда можно определить время жизни. На этих скоростях диапазон ионов находится всего в нескольких миллиметрах, доступной и простой в использовании шкале размеров.
Рис. 7
Для высоких энергетических уровней различия в энергиях подуровней достаточно велики, так что один уровень может проникать в другой, например
6s d4f p.
Заселение атомных орбиталей для многоэлектронного атома в основном (то есть энергетически наиболее выгодном) состоянии происходит в соответствии с определенными правилами.
В дополнение к дальнейшему повышению точности измерения времени жизни другие свойства этого необычного иона в настоящее время находятся в пределах досягаемости экспериментальных исследований в первый раз. Распознайте внешний слой. Расчет массы осуществляется с помощью подходящего представления и единиц. 5 с. 54.
Теория метода валентных связей
Часть 1: Модель атома. Атом - электрически нейтральная сущность, у которой есть ядро, расположенное в его центре. Ядро состоит из нейтронов, незаряженных частиц и протонов, положительно заряженных частиц; эти частицы называются нуклонами. Электроны, отрицательно заряженные частицы, движутся вокруг ядра. Атом по существу состоит из пустоты, мы говорим, что его структура лакуна. А также называется массовым числом. Атом, электрически нейтральный, в ядре есть столько электронов вокруг ядра, сколько протонов в ядре.
Принцип минимума энергии
Принцип минимума энергии определяет порядок заселения атомных орбиталей, имеющих различные энергии. Согласно принципу минимума энергии, электроны занимают в первую очередь орбитали, имеющие наименьшую энергию. Энергия подуровней растет в ряду:
1s s p s p s d p s d p s f5d p s f6d ...
Атом водорода имеет один электрон, который может находиться на любой орбитали. Однако, в основном состоянии он должен занимать 1s -орбиталь, имеющую самую низкую энергию.
Теория молекулярных орбиталей
Распределение электронов называется электронной структурой. Последняя электронная структура, содержащая электроны, называется внешним слоем. Электронные слои находятся вокруг ядра, размещенного в центре. Электроны находятся на слоях. Одноатомный ион представляет собой атом, который потерял или получил один или несколько электронов. Катион представляет собой атом, который потерял по меньшей мере один электрон из его внешнего слоя; это положительно заряженный ион. Анион - это атом, который приобрел по крайней мере один электрон во внешнем слое; это отрицательно заряженный ион.
В атоме калия последний девятнадцатый электрон может заселить либо 3d -, либо 4s -орбиталь. В соответствии с принципом минимума энергии, электрон занимает 4s -орбиталь, что подтверждается экспериментом.
Следует обратить внимание на неопределенность записи 4f 5d и 5f 6d . Оказалось, что у одних элементов более низкую энергию имеет 4f -подуровень, а у других - 5d -подуровень. То же самое наблюдается для 5f - и 6d -подуровней.
Примеры: Изотопы Ядра, которые имеют одинаковое количество протонов, но другое количество нейтронов, называются изотопными ядрами. Примечание. Существуют также атомы или изотопы, когда их ядра изотопны. Где живут люди? Вне Дьявола Воверта, далеко за пределами Петанухнока. Чтобы позвонить в их дверь, вам нужно спуститься по крутой лестнице, как справедливость, которая ведет к царству бесконечно малого. Не бойтесь этих сил 10, это удобный способ написать очень большой и очень небольшие числа. Положим клетку кожи под обычный световой микроскоп.
Теория метода валентных связей
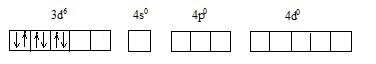
1s 2 2s 2 2p 6 3s 2 3p 6 4s 0 3d 6 4p 0 4d 0
В соответствии с правилом Хунда электроны на внешнем энергетическом уровне располагаются следующим образом:
Комплексообразователь имеет координационное число к.ч. = 6, поэтому может присоединить 6 лигандов, каждый из которых имеет неподеленную электронную пару и является, таким образом, донором электронов. Акцептор (комплексообразователь) для размещения шести электронных пар должен предоставить шесть вакантных орбиталей. При образовании комплексного иона 3+ четыре неспаренных электрона в d – состоянии Co 3+ сначала образуют электронные пары, в результате чего две 3d-орбитали освобождаются:
Пошлем немного света и измерим: 10-4 м, десятую часть миллиметра. Эта ячейка состоит из миллиардов молекул. Нам нужен электронный микроскоп и хороший пучок энергии, чтобы увидеть, например, молекулу воды. Отсюда материал появляется как гнездование кукол Молекула воды, как и все молекулы, в свою очередь состоит из сборки атомов: в этом случае два атома водорода и один атом кислорода. Диаметр среднего атома примерно в десять раз меньше диаметра молекулы. Над трибунами волосы зрителя пролетают ветром: это электрон.
Помимо атома, чтобы «видеть» что-то, нужно потратить миллиарды франков, огромное количество энергии и мобилизовать ускоритель частиц. Давайте увеличим масштаб ядра: протоны и нейтроны скручиваются друг против друга, дрожа, как мулоны в зимний период. Наконец, внутри нейтронов и протонов открывается святая святых, открывая кварки.

Затем образуется сам комплексный ион 3+ , имеющий следующее строение:

Этот последний угол дома измеряется в 10-18 м: камера в миллион миллиардов раз уже, чем усы. Стандартная модель говорит физикам, что нет ничего внутри кварков: это был бы самый маленький кирпич во Вселенной, поэтому мы сделаны из объектов, которым от 15 до 20 миллиардов лет! миллион лет: природа любит возиться со старыми вещами. Завершите карту идей из текста и диаграммы: Атом и живая материя: кто в чем?
Вырежьте диаграммы и поместите их в нужные поля. Мероприятие 2: Электронная структура атомов и ионов. Выведите формулы ионов фосфора и ионов алюминия. Атом серы имеет 16 электронов, что указывает на его электронную структуру. Выведите электронную структуру иона и формулу иона. Помимо благородных газов все остальные атомы имеют меньшую энергию и более устойчивы, как правило, достигают внешней электронной конфигурации петли или эллиота. Элементы той же группы имеют одинаковую внешнюю электронную конфигурацию.
В образовании этого комплексного иона принимают участие внутренние 3d-орбитали и внешние 4s- и 4p-орбитали. Тип гибридизации — d 2 sp 3 .
Наличие только спаренных электронов говорит о диамагнитных свойствах иона.
Теория кристаллического поля
Теория кристаллического поля основывается на допущении, что связь между комплексообразователем и лигандами частично . Однако принимается во внимание влияние электростатического поля лигандов на энергетическое состояние электронов центрального иона.
Например, Берилий, Магний, Кальций, Стронций, Барий и Радио имеют все два электрона во внешней «оболочке», а их атомы имеют низкую энергию ионизации, т.е. плохую электростатическую силу притяжения между ядром и электронами снаружи. Первой энергией ионизации элемента является энергия, необходимая для вычитания внешнего электрона на атом. Эта энергия уменьшается, когда вы двигаетесь по группе сверху вниз и увеличиваетесь, когда мы двигаемся в течение периода слева направо.
Если атом на внешней орбите имеет 1, 2 или 3 электрона, для достижения стабильности он будет стремиться их потерять. Вместо этого атомы, которые на внешних орбитах имеют 5, 6 или 7 электронов, имеют тенденцию покупать 3 или 2. Например, на практике тенденция потерять или купить электроны проявляется двумя способами: путем образования ионов или связывания химическое вещество. Рассмотрим Кальций, электронная структура которого: 2; сдавая два электрона последней орбиты, его электронная конфигурация становится такой же, как Аргон, поэтому она достигает состояния с низкой реакционной способностью.
Рассмотрим две комплексные соли: K 2 и K 3 .
K 2 – имеет тетраэдрическую пространственную структуру (sp 3 — гибридизация)
K 3 – имеет октаэдрическую пространственную структуру (sp 3 d 2 -гибридизация)
Комплексообразователи имеют следующую электронную конфигурацию:
d – электроны одного и того же энергетического уровня одинаковы в случае свободного атома или иона. Но действие электростатического поля лигандов способствует расщеплению энергетических уровней d – орбиталей в центральном ионе. И расщепление тем больше (при одном и том же комплексообразователе), чем сильнее поле, создаваемое лигандами. По своей способности вызывать расщепление энергетических уровней лиганды располагаются в ряд:
Каждый атом, имеющий такое же количество протонов и электронов, электрически нейтрален. Поэтому в момент выделения одного или нескольких электронов в ядре будет один или несколько положительных зарядов, которые не будут уравновешены отрицательными зарядами электронов, и атом станет ионом. Точнее, потеря электронов остается чрезмерным положительным зарядом, поэтому она превращается в положительный ион: катион.
Переходные металлы, с другой стороны, дают катионы, где непросто предсказать заряд. Например, железо может образовывать двухвалентные или трехвалентные катионы, пруд может образовывать двумерный или четырехвалентный. Преобразование атома в ион имеет некоторые важные последствия, в частности он определяет.
CN — > NO 2 — > NH 3 > SCN — > H 2 O > OH — > F — > Cl — > Br — > I —
Строение комплексного иона влияет на характер расщепления энергетических уровней комплексообразователя.
При октаэдрическом строении комплексного иона, d γ -орбитали (d z 2 -, d x 2 — y 2 -орбитали) подвержены сильному взаимодействию поля лигандов , и электроны этих орбиталей могут иметь большую энергию, чем электроны d ε -орбитали (d xy , d xz , d yz – орбитали).
Значительное снижение энергии и, следовательно, реактивности, для достижения внешней конфигурации защелки; важное изменение объема: когда катион образуется из атома, радиус и объем атома уменьшаются, когда образуется атом, радиус и объем атома увеличиваются; превращение электрически нейтрального химиката в другое с положительными или отрицательными электрическими зарядами. Когда между атомами образуется связь, два или более разных элемента. Важно отметить, что электронное родство и электроотрицательность элементов в качестве измеряемых электронов, притягивающих энергию.
Расщепление энергетических уровней для электронов в d-состоянии в октаэдрическом поле лигандов можно представить в виде схемы:

Здесь Δ окт – энергия расщепления в октаэдрическом поле лигандов.
Определить электроустойчивость
Когда два или более атомов объединяются, чтобы образовать молекулу. Атом с более высокой электроотрицательностью стремится привлечь общую пару электронов к себе. Чтобы определить, сколько энергии он будет привлекать, используется термин «электроотрицательность». Кроме того, его значение не является постоянным. Это просто зависит от природы атома, к которому присоединен конкретный атом.
Большая разница в электроотрицательности приводит к ионной связи. Было обнаружено, что когда разница между электроотрицательностями двух атомов равна 7, образующаяся между ними связь будет 50% ионной по своей природе. Если два атома имеют одинаковые электроотрицательности, связь между ними будет ковалентной, а большая разница в электроотрицательности приводит к ионной связи.
- Когда разница равна нулю, ссылка на 100% ковалентна.
- Нет связи с 100% ионным характером.
- Размер электронной конфигурации атома. ядерное притяжение. степень окисления.
- Процент знака.
При тетраэдрической структуре комплексного иона d γ -орбитали обладают более низкой энергией, чем d ε -орбитали:

Здесь Δ тетр – энергия расщепления в тетраэдрическом поле лигандов.
Поскольку ковалентная связь является более слабой связью, тогда как ионная связь является более прочной связью, большой ионный процент связи по-прежнему является ее стабильностью. Какой элемент имеет самую высокую электроотрицательность? Какой элемент имеет самую низкую электроотрицательность?
Как рассчитать электрорегуляцию
Поскольку электроотрицательные элементы являются относительным свойством, у него нет единиц. Электроотрицательность может быть выражена в следующих трех шкалах. Из них наиболее часто используется Полинги, камни. Связь между породой Полинга и электроотрицательностью Малликена, такая как.
Энергию расщепления Δ определяют экспериментально по спектрам поглощения веществом квантов света, энергия которых равна энергии соответствующих электронных переходов. Спектр поглощения, а также и окраска комплексных соединений d-элементов, обусловлены переходом электронов с d-орбитали низшей энергии на d-орбиталь с более высокой энергией.
Так, в случае соли K 3 , при поглощении кванта света, вероятен переход электрона с d ε -орбитали на d γ -орбиталь. Этим объясняется, что данная соль имеет оранжево-красную окраску. А соль K 2 не может поглощать свет и, вследствие этого, она бесцветна. Это объясняется тем, что переход электронов с d γ -орбитали на d ε -орбиталь неосуществим.
Теория молекулярных орбиталей
Метод МО был ранее рассмотрен в разделе .
С помощью этого метода изобразим электронную конфигурацию высокоспинового комплексного иона 2+ .
Электронная конфигурация иона Ni 2+ :
1s 2 2s 2 2p 6 3s 2 3p 6 4s 0 3d 8 4p 0 4d 0 или …4s 0 3d 8 4p 0 4d 0

В комплексном ионе 2+ в образовании химической связи принимают участие 8 электронов центрального иона Ni 2+ и 12 электронов шести лигандов NH 3.
Комплексный ион имеет октаэдрическое строение . Образование МО возможно только в том случае, когда энергии исходных взаимодействующих частиц близки по своим значениям, а также ориентированы в пространстве соответствующим образом.
В нашем случае, орбиталь 4s иона Ni 2+ равноценно перекрывается с орбиталями каждого из шести лигандов. В результате этого образуются молекулярные орбитали: связывающая σ s св и разрыхляющая σ s разр.
Перекрывание трех 4p-орбиталей комплексообразователя с орбиталями лигандов приводит к образованию шести σp-орбиталей: связывающих σ х св, σ y св, σ z св и разрыхляющих σ х разр, σ y разр, σ z разр.
Перекрывание d z 2 и d x 2 — y 2 комплексообразователя с орбиталями лигандов способствует образованию четырех молекулярных орбиталей: двух связывающих σ св х 2 — y 2 , σ св z 2 и двух разрыхляющих σ разр х 2 — y 2 , σ разр z 2 .
Орбитали d xy , d xz , d yz иона Ni 2+ не связываются с орбиталями лигандов, т.к. не направлены к ним. Вследствие этого, они не принимают участия в образовании σ-связи, и являются несвязывающими орбиталями: π xz , π xy , π yz .
Итого, комплексный ион 2+ содержит 15 молекулярных орбиталей. Расположение электронов можно изобразить следующим образом:
(σ s св) 2 (σ х св) 2 (σ y св) 2 (σ z св) 2 (σ св х 2 — y 2) 2 (σ св z 2) 2 (π xz) 2 (π xy) 2 (π yz) 2 (σ разр х 2 — y 2) (σ разр z 2)
Схематично образование молекулярных орбиталей изображено на диаграмме ниже:

- Чему равен 1 год на меркурии
- Кто такой Николай Пейчев?
- Томас андерс - биография, фото, личная жизнь солиста дуэта "модерн токинг" Синглы Томаса Андерса
- Что показывает коэффициент обеспеченности финансовых обязательств активами Обеспеченность обязательств финансовыми активами в бюджетном учреждении
- Как приготовить классические вареники с творогом
- Как сделать тесто для яблочной шарлотки Как приготовить шарлотку с яблоками песочное тесто
- Отечественной войны 2 степени

 Live Journal
Live Journal Facebook
Facebook Twitter
Twitter