Вода ковалентная связь. Ковалентная связь. Полярная и неполярная ковалентные связи. Ковалентная связь, видео
Ковалентная связь. Полярная и неполярная ковалентные связи
КОВАЛЕНТНАЯ СВЯЗЬ - это связь, возникающая между атомами за счет образования общих электронных пар (Например, H2, HCl, H2O, O2).
По степени смещенности общих электронных пар к одному из связанных ими атомов ковалентная связь может быть полярной и неполярной.
И с ней мы теперь можем попробовать нашу еду. Это была ситуация, когда человек хотел избавиться от электрона, а другой хотел его принять. Что происходит в ситуации, когда ни один из них не настолько экстремален. Давайте рассмотрим другие примеры. Лучшим примером является элементный кислород. Здесь мы имеем ионную связь. Из-за образования ионов путем объединения натрия и хлора. Пропуская натрий-электрон хлора, мы создали положительно заряженный катион и анион, потому что он отрицательный. И затем они объединились для создания ионной связи.
Итак, что произойдет, если у нас есть два атома, которые не хотят передавать электроны? Их электроотрицательность очень похожа. И лучший пример - два одинаковых элемента, таких как кислород. Давайте посмотрим на периодическую таблицу. И оба этих атома кислорода хотели бы иметь 8 электронов. Они были бы настолько стабильны и могли претендовать на редкие газы. Но они, очевидно, не имеют 8 электронов, и вокруг них есть только атомы кислорода. Так что же они могут сделать? Скажем, этот кислород придет к этому и скажет: Почему мы не можем делиться некоторыми электронами?
А) КОВАЛЕНТНАЯ НЕПОЛЯРНАЯ СВЯЗЬ (КНС) - образуют атомы одного и того же химического элемента - неметалла (Например, H2, O2, О3).
Механизм образования связи.
Каждый атом неметалла отдает в общее пользование другому атому наружные не спаренные электроны. Образуются общие электронные пары. Электронная пара принадлежит в равной мере обоим атомам.
Этот атом может претендовать на заполнение первого слоя, так как только два электрона войдут в первый слой. Это тот случай, когда правило восьми электронов не применяется. Он тоже может притворяться. И теперь кислород может притворяться, что в его слое 8 электронов. и теперь все счастливы. Это также ковалентная связь. Когда каждая строка показывает два электрона. Эти два утверждения выражают то же самое. Однако в этом случае кислород является более электроотрицательным, чем водород, и хочет, чтобы электроны привлекали больше водорода.
Таким образом, электроны теперь проводят больше кислорода вокруг кислорода, чем водорода. Водород будет представлять собой так называемый частичный положительный заряд на его стороне молекулы. Но у кислорода будет частичный отрицательный заряд. Это называется ковалентной полярной связью. Он по-прежнему ковалентен, мы разделяем электроны, но он полярный, потому что электроны больше притягиваются к одной стороне молекулы. И благодаря этому вся молекула будет иметь так называемую полярность. Одна сторона молекулы будет более отрицательной, а другая более положительной.
Рассмотрим механизм образования молекулы хлора:
Электронная схема образования молекулы Cl2:
Структурная формула молекулы Cl2:
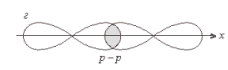
σ
Cl – Cl , σ (p – p) - одинарная связь

Рассмотрим механизм образования молекулы кислорода:
О2 – кнс.
Потому что электроны будут тратить больше времени в отрицательной части, с кислородом. Таким образом, для металлов мы не можем напрямую нарисовать электронную структуру. Например, возьмите атом железа. У нас есть группа нейтральных атомов железа. И мы представим одну вещь, общую для всех металлов. У них есть кластер электронов в их валентном слое, но металлы очень рады предоставить свои электроны, они любят отдавать. Поэтому, если вы поместите несколько из этих атомов вместе, они начнут делиться всеми своими электронами.
Поэтому они все становятся позитивными. Можно сказать, что они очень общинные. А поскольку все электроны находятся в этом море, а атомы железа имеют положительный заряд, они втягиваются в это море. И это позволяет металлам вести электричество. Они снабжают электронами, которые можно легко перемещать. А также можно отличать металлы по-разному. Вы можете перемещать их по-другому. Представьте себе, что это плотная масса электронов, и вы можете изгибать, сжимать, растягивать или растягивать эту массу, не нарушая ее.
Электронная схема образования молекулы О2:

Структурная формула молекулы О2:
σ
О = О
π
В молекуле кратная, двойная связь:
Одна σ (p – p)

Но когда вы принимаете соль, у вас очень сильная, но жесткая связь. Когда вы пытаетесь согнуть палку из соли, вы просто сломаете ее. Существует не резиновое поле электронов, которое вы можете изгибать, как хотите. Таким образом, это три типа химических связей. Надеюсь, вы можете представить их сейчас. Это очень полезно, потому что остальная химия, все, что мы делаем, будет каким-то образом связана с этими облигациями. И мы объясним, что означают эти ссылки в разных сюжетных линиях. Например, при кипении, при каких температурах готовят и их свойства в целом.
и одна π (р – р)
Б) КОВАЛЕНТНАЯ ПОЛЯРНАЯ СВЯЗЬ (КПС) - образуют атомы разных неметаллов, отличающихся по значениям электроотрицательности (Например, HCl, H2O).
Встречаются исключения, когда ковалентную связь образуют атом неметалла и металла!
Например, AlCl3, разница в электроотрицательности ∆ Э.О.<1.7, т.е. ∆ Э.О.= 3,16 (Cl) – 1,61(Al) = 1,55
Электроотрицательность (ЭО) - это свойство атомов одного элемента притягивать к себе электроны от атомов других элементов. Самый электроотрицательный элемент – фтор F.
Электроотрицательность можно выразить количественно и выстроить элементы в ряд по ее возрастанию. Наиболее часто используют ряд электроотрицательности элементов, предложенный американским химиком Л. Полингом.
Таблица. Электроотрицательности (ЭО) некоторых элементов (приведены в порядке возрастания ЭО).

Механизм образования связи.
Каждый атом неметалла отдает в общее пользование другому атому свои наружные не спаренные электроны. Образуются общие электронные пары. Общая электронная пара смещена к более электроотрицательному элементу.
Рассмотрим механизм образования молекулы хлороводорода:
НCl – кпс.
Электронная схема образования молекулы НCl:

Часть I
1. Электроотрицательность (ЭО) - это способность атомов оттягивать к себе электронные пары.
3. Если ковалентная химическая связь образуется между атомами разных элементов-неметаллов, то общие электронные пары смещены в сторону более электроотрицательного элемента. На нём возникает избыточный отрицательный заряд, а на атоме-партнёре - избыточный положительный заряд. Такая связь называется ковалентной полярной.


5. Дополните таблицу «Ковалентная полярная связь».

Часть II
1. Поиграйте в «крестики-нолики». Покажите выигрышный путь, состоящий из формул веществ с ковалентной полярной связью, и запишите схемы их образования.

2. Выберите формулы соединений с ковалентной полярной химической связью. Из букв, соответствующих правильным ответам, вы составите слово, означающее имитацию алмаза или другого драгоценного камня, выполненного из стекла:
страз.
1) HF С
3) FeBr3 Т
5) SO2 Р
7) CO2 А
9) PCl5 З
3. Постройте график зависимости порядкового номера химического элемента от электроотрицательности элементов одного периода. Точные значения электроотрицательности найдите с помощью Интернета. Сделайте вывод:
С увеличением порядкового номера ЭО растёт.
4. Постройте график зависимости порядкового номера химического элемента от электроотрицательности элементов одной главной подгруппы. Точные значения электроотрицатель¬ности найдите с помощью Интернета.
В группе с увеличением порядкового номера ЭО уменьшается.
5. Наиболее полярной является химическая связь в молекуле:
4) фтороводорода - HF
6. Расположите следующие вещества в порядке уменьшения полярности химической связи.
4) фосфид калия - К3Р
2) фосфид алюминия - АlР
3) хлорид фосфора (V) - РСl5
1) белый фосфор - Р4
- Имена мальчиков рожденных в январе Азербайджанские имена родившиеся в январе по гороскопу
- Суточный диурез у беременных женщин
- Как рассчитать налог на автомобиль по лошадиным силам Изменения по транспортному налогу в году
- Храм Солнца: Черная Пагода Конарака
- В Туве упал космический корабль «Прогресс» видео падения Борис Леконцев, заслуженный метеоролог РФ
- Тесты что лишает меня энергии
- Владимир Иванович Долгих: биография Долгих секретарь цк кпсс

 Live Journal
Live Journal Facebook
Facebook Twitter
Twitter