В третьем периоде 5 группе главной подгруппе. Периоди ческая система химических элементов — это графическое выражение периодического закона. Группой. Принципа наименьшей энергии
16. Какой из газов, взятых одинаковой массой занимает наибольший объем при одинаковых условиях:
17. Определите молярную массу эквивалента (г/моль) серы в оксиде серы (VI):
18. Какова массовая доля (%) металла в оксиде если молярная масса эквивалента трехвалентного металла равна 15 г/моль:
19. Какова относительная молекулярная масса газа, если этот газ тяжелее воздуха в 2,2 раза:
Ориентацию электронного облака в пространстве
Периодическая таблица из 18 столбцов. Эта форма Периодической таблицы химических элементов принята кубинской нормой и в настоящее время используется для преподавания химии, эта периодическая система пытается подчеркнуть как химические, так и электронные отношения. Горизонтальные линии называются периодами, каждый период соответствует формированию нового слоя электронов. Выровненные элементы имеют строго аналогичные электронные структуры. Начало и конец длинного периода представляют собой добавление электронов в валентной оболочке; в центральной части число электронов подстилающего слоя увеличивается.
20. Какое из приведенных уравнений называется уравнением Менделеева – Клапейрона:
3) PV = RT
21. Укажите 3 газа, имеющих одинаковую плотность по любому другому газу:
1) CH 4 , SO 2 , Cl 2
2) C 2 H 4 , CH 4 , F 2
3) CO, Cl 2 , H 2
4) CO, C 2 H 4 , N 2
5)N 2 , CH 4 , H 2
22. Сколько молей кислорода образуется из 3 моль хлората калия при его полном термическом разложении:
Характеристики периодической таблицы
Периодическая таблица помогает понять поведение, свойства и реактивность элементов. Свойства элементов имеют тенденцию к регулярному воспроизведению при упорядочении элементов по их атомному номеру. Шкаф соответствует каждому химическому элементу. В этом случае они отображают соответствующее имя, символ, атомный номер, атомную массу и другие данные.
Информация о химическом элементе. Из его местоположения в периодической таблице можно вывести атомную структуру элемента. Металлы находятся слева от стола, из них. Некоторые свойства металлоидов. В общем, эти элементы имеют очень разнообразные и переменные свойства. То есть, в зависимости от того, с кем они, они изменят свой характер.
23. Какое количество (моль) FeS 2 потребуется для получения 64 г SO 2 по уравнению:
4 FeS 2 + 11O 2 = 2Fe 2 O 3 + 8SO 2 ;
24. Какая масса (г) карбоната кальция будет израсходована для получения 44,8 л углекислого газа, измеренного при н.у.:
1) 200,0;
25.Эквивалентом алюминия является:
1) атом алюминия;
2) 1/2 часть атом алюминия;
3) 1/3 часть атом алюминия;
Они действуют как простые неметаллические вещества, когда они реагируют с металлическими веществами. Они действуют как металлические вещества, когда они реагируют с простыми неметаллическими веществами. Некоторые из них имеют электрические свойства полупроводников. . Горизонтальные строки периодической таблицы называются периодами. Вопреки тому, что происходит в случае групп в периодической таблице, элементы, составляющие одну и ту же строку, имеют разные свойства, но сходные массы: все элементы периода имеют одинаковое количество орбиталей.
4) два атома алюминия;
5) 1 моль атомов алюминия.
26.Закон постоянства состава веществ справедлив для веществ:
1) с молекулярным строением;
2) с немолекулярным строением;
3) с ионной кристаллической решеткой;
4) с атомной кристаллической решеткой;
5) для оксидов и солей.
27. Эквивалентом магния является:
Следуя этой норме, каждый элемент помещается в соответствии с его электронной конфигурацией. Остальные периоды, называемые длинными периодами, содержат 18 элементов в случае периодов 4 и 5 или 32 элемента за период. Длительный период 7 включает в себя группу актинидов, которая была завершена синтезом радиоактивных ядер за пределами элемента 92, уран. Период, в течение которого элемент занимает, совпадает с его последним электронным слоем. То есть элемент с пятью электронными слоями будет в пятом периоде.
Периодическая таблица состоит из 7 периодов.
- Период 1: имеет только два химических элемента.
- Период 2 и период 3: У них есть восемь химических элементов.
- Период 4 и 5: У них есть восемнадцать химических элементов.
- Период 6: Он содержит тридцать два химических элемента.: Период 7: Неполный.
1) атом магния;
2) 1/2 часть атома магния;
3) 1/3 часть атома магния;
4) два атома магния;
5) 1 моль атомов магния.
28. На нейтрализацию 2,45 г кислоты расходуется 2,80 г гидроксида калия. Определить
молярную массу эквивалента кислоты:
1) 98 г/моль;
2) 36,5 г/моль;
3) 63 г/моль;
4) 40 г/моль;
Г/моль.
Принципа наименьшей энергии
Номер периода указывает количество уровней энергии, которые имеют атомы элементов, находящихся в этом периоде. Вертикальные столбцы периодической таблицы называются группами. Все элементы, принадлежащие группе, имеют одинаковую атомную валентность и, следовательно, имеют сходные характеристики или свойства друг с другом.
В группе химические свойства очень схожи, потому что все элементы группы имеют одинаковое количество электронов в их последнем или последнем слоях. Элементами последней группы справа являются благородные газы, которые имеют последний энергетический уровень и, следовательно, все они крайне нереактивны.
Классификация и номенклатура неорганических соединений
1) Na 2 O; CaO; CO 2
2)SO 3 ; CuO; CrO 3
3)Mn 2 O 7 ; CuO; CrO 3
4)SO 3 ; CO 2 ; P 2 O 5
5) Na 2 O; H 2 O; CO 2
30. Лишь кислотные оксиды ряд:
1) CO 2 ; SiO 2 ; MnO; CrO 3
2) V 2 O 5 ; CrO 3 ; TeO 3 ; Mn 2 O 7
3) CuO; SO 2 ; NiO; MnO
4) CaO; P 2 O 3 ; Mn 2 O 7 ; Cr 2 O 3
5) Na 2 O; H 2 O; CuO; Mn 2 O 7
31. Не может быть использовано для нейтрализации серной кислоты:
Некоторые свойства благородных газов
Преимущества и недостатки периодической системы из 18 столбцов
В общем, эти элементы не реагируют практически ни с кем. . Преимущества этой компоновки по сравнению с 8 столбцами. Группы, возглавляемые железом, кобальтом и никелем, уже имеют определенное место. Существует разделение между металлами и неметаллами. . При анализе периодической таблицы химических элементов из 18 столбцов видно, что хотя четыре недостатка таблицы из восьми столбцов были решены, водород и лантаноиды и актиниды по-прежнему не имеют логического места в этой таблице, Кроме того, деля второй и третий периоды, каждый из которых имеет восемь элементов, было введено новое неудобство.1) гидрокарбонат натрия;
2) оксид магния;
3) хлорид гидроксомагния;
4) гидросульфат натрия;
5) оксид натрия
32. Для нейтрализации серной кислоты можно использовать:
2) Mg(OH) 2
33. С помощью стеклянной трубки выдыхают углекислый газ в растворы. Изменение будет в растворе:
3) Ca(OH) 2 ;
34. Растворением в воде соответствующего оксида можно получить:
Периодическая система как рабочий инструмент
Эти периоды были разделены так, чтобы они соответствовали элементам перехода. В общем случае периодическая таблица не так точна, что, зная свойства элемента данной группы, мы можем предсказать точные свойства остальных элементов этой группы. Периодическая система ориентирует и указывает тренд, но не может предоставить точные данные. Однако его ценность как руководство для систематического изучения свойств элементов и их соединений намного превосходит тот недостаток, который может быть связан с отсутствием подробной информации.
35. При определенных условиях образуется соль в случае:
1) N 2 O 5 +SO 3 ;
4) H 2 SO 4 +NH 3 ;
36. Может образовывать кислые соли:
1) H 3 PO 4 ;
37. Может образовывать основные соли:
2) Ba(OH) 2 ;
38. Масса известняка, необходимая для получения 112 кг негашеной извести:
39. Реагирует с водой:
2) CаO;
40. Растворим в воде:
С помощью периодической таблицы можно предсказать, как объединить различные типы элементов, вычислить массы и, следовательно, количество вещества веществ, которые могут образовывать комбинацию элементов, а также знать периодические свойства задействованных атомов.
Периодическая таблица - очень полезный инструмент для организации химии элементов и их соединений. Эта таблица выглядит довольно измененной, так как элементы упорядочены в порядке возрастания атомного номера. Эта таблица, которую мы называем Периодической таблицей или Периодической системой, является выражением отношений, существующих между химическими элементами. По этой причине он одобряет его исследование и позволяет вывести многие его свойства, просто зная его ситуацию в нем.
3) Ba(OH) 2 ;
41. Для получения фосфата калия на гидрофосфат калия надо подействовать:
42. Кислотный оксид:
3) Mn 2 O 7 ;
43. Будут непосредственно взаимодействовать в водном растворе:
2) Cu(OH) 2 и ZnO;
3) AI 2 O 3 и HCI;
4) Rb 2 O и NaOH;
5) CaO и K 2 O.
44. Все соли кислые в группе:
1) KCI, CuOHCI, NaHSO 4 ;
2) KAI(SO 4) 2 , Na, Ca(HCO 3) 2 ;
Лабадие Суарес: Общая химия. . В химии критерии, используемые для организации химических элементов, были установлены с течением времени. При работе с этими данными он понял, что, организуя элементы по массе своих атомов, некоторые свойства повторялись несколько раз и с той же пропорцией, следовательно, это была периодическая переменная. Вспоминая, что периодическое - это все, что повторяется в четко определенные временные интервалы, например, как и фазы и фазы Луны.
Он был создан для организации уже найденной информации, чтобы облегчить доступ к данным. Когда было предложено, многие элементы еще не были обнаружены, хотя его принцип соблюдается и по сей день с 118 элементами. Были предложены некоторые другие модели таблицы, такие как спиральная форма, предложенная Филиппом Стюартом на основе цикличности химических элементов, но наиболее используемым остается Менделеев.
3) CuS, NaHSO 3 , Cu(HS) 2 ;
4) NaHCO 3 , Na 2 HPO 4 , NaH 2 PO 4 ;
5) AIOHCI 2 , NaHCO 3 , NaCN.
45. Не образует кислых солей:
4) HPO 3 ;
46. Составлено неверно название:
1) сульфат железа;
2) сульфат калия;
3) гидрохлорид железа (II);
4) хлорид меди (I);
5) сульфат аммония.
47. При отщеплении воды от одноосновной кислоты массой 16,0 г, образованной элементом в степени окисления +5, получится оксид массой 14,56 г. Была взята кислота:
Дмитрий Иванович Менделеев родился в Сибири и был профессором Санкт-Петербургского университета, когда обнаружил. Элемент 101 атомного номера периодической таблицы назван в честь него. Таблица содержит химические элементы, расположенные в порядке возрастания атомного номера и делятся на группы по характеристикам, которые являются общими среди них. Каждый элемент имеет рядом со своим символом атомный номер и массовое число. Они могут принимать любое физическое состояние при комнатной температуре.: Они представляют низкую реактивность, до недавнего времени считались инертными. Они хорошие проводники тепла и электричества. . Группа 16:: Элементы этой группы названы в честь греческого значения «медьщики».
1) азотная;
2) метаванадиевая;
3) ортофосфорная;
4) мышьяковая;
5) хлорноватая.
48. При прокаливании на воздухе металла (III) массой 10, 8 г получен оксид металла массой 20, 4 г. Для прокаливания был взят:
2) алюминий AI;
3) железо Fe;
4) скандий Sc;
5) натрий Na.
49. Признак, характеризующий соляную кислоту:
1) двухосновная;
2) слабая;
3) летучая;
4) кислородсодержащая;
5) кислота – окислитель.
50. Двухосновная кислота:
1) азотная;
2) соляная;
3) уксусная;
4) синильная;
Селеновая.
51. Одноосновная кислота:
1) селенистая;
2) фосфористая;
3) теллуровя;
4) борная;
5) синильная.
52. Два типа кислых солей образует:
1) серная кислота;
3) метафосфорная кислота;
4) селеновая кислота;
5) сернистая кислота.
53. Не образует кислых солей:
1) серная кислота;
2) ортофосфорная кислота;
3) метафосфорная кислота;
4) селеновая кислота;
5) сернистая кислота.
54. Укажите катионный комплекс:
1) Na 3 ;
3) K 3 ;
4) CI 3 ;
5) K 2 .
55. Комплексный неэлектролит:
1) Na 3 ;
2) ;
3) K 3 ;
4) CI 3 ;
5) K 2 .
56. Анионный комплекс:
1) гексацианоферрат (III) калия;
2) тетрахлородиамминплатина (IV);
3) хлорид диамминсеребра;
57. Комплексный неэлектролит:
1) гексацианоферрат (III) калия;
2) тетрахлородиамминплатина (IV);
3) хлорид диамминсеребра;
4) сульфат тетраамминмеди (II);
5) хлорид гексааквахрома (III).
58. Формула хлорида гексааквахрома (III):
1) Na 3 ;
2) CI
3) CI 2 ;
4) CI 3 ;
5)K 2 Cr 2 O 7 .
59. Формула хлорида гексааквахрома (II):
1) Na 3 ;
2) CI
3) CI 2 ; 3bl
4) CI 3 ;
5)K 2 Cr 2 O 7 .
60. Желтая кровяная соль относится:
1) К аквакомплексам;
2) Гидратам;
3) К ацидокомплексам;
4) К аммиакатам;
5) К хелатам.
61. Медный купорос относится:
1) К аквакомплексам;
2) Гидратам;
3) К ацидокомплексам;
4) К аммиакатам;
5) К хелатам.
62. Для получения СаСО 3 к раствору Са(НСО 3) 2 следует прибавить:
1) Са(ОН) 2 ;
“Строение вещества и периодический закон Д.И. Менделеева”
63. В ядре наиболее распространенного изотопа свинца 207 Pb нейтронов:
2) 125
64. Максимальное число электронов на уровне n = 3:
65. На энергетическом уровне с n = 4 подуровней:
66. Число энергетических уровней в атоме вольфрама:
67. В ядре атома осмия протонов:
68. Ядро атома криптона содержит:
Р и 44n
69. Число электронов у иона хрома :
70. Ион, имеющий в своем составе 18 электронов и 16 протонов, обладает зарядом ядра:
71. Максимальное число электронов, которые могут занимать 3s-орбиталь:
72. Электронную конфигурацию 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 имеет атом:
73. Неверны обозначения орбиталей:
3) 1p, 2d
74. Одинаковую с атомом аргона электронную конфигурацию имеет частица:
1) Са 2+
75. Сродством к электрону называют:
1) энергию, необходимую для отрыва электрона от невозбужденного атома;
2) способность атома данного элемента к оттягиванию на себя электронной плотности;
3) переход электрона на более высокий энергетический уровень;
4) выделение энергии при присоединении электрона к атому или иону;
5) энергию химической связи.
76. В результате ядерной реакции ![]() образуется изотоп:
образуется изотоп:
77. В атоме водорода поглощения фотона с минимальной энергией требует переход электрона:
78. Корпускулярно-волновую природу электрона характеризует уравнение:
79. Для валентного электрона атома калия возможны значения квантовых чисел (n, l , m l , m s):
1) 4, 1, -1, - :
2) 4, 1, +1, + : 3bm
3) 4, 0, 0, + :
4) 5, 0, +1, + :
80. Заряд ядра атома, у которого конфигурация валентных электронов в основном состоянии …4d 2 5s 2:
81. Главное квантовое число n определяет:
1) форму электронного облака;
2) энергию электрона;
82. Орбитальное квантовое число l определяет:
1) форму электронного облака;
2) энергию электрона;
3) ориентацию электронного облака в пространстве;
4) вращение электрона вокруг собственной оси;
5) гибридизацию электронного облака.
83. Магнитное квантовое число m определяет:
1) форму электронного облака;
2) энергию электрона;
3) ориентацию электронного облака в пространстве;
4) вращение электрона вокруг собственной оси;
5) гибридизацию электронного облака.
84. Спиновое квантовое число m s определяет:
1) форму электронного облака;
2) энергию электрона;
3) ориентацию электронного облака в пространстве;
4) вращение электрона вокруг собственной оси;
5) гибридизацию электронного облака.
85. При - распаде ядро атома радиоактивного элемента испускает:
1) электрон;
2) позитрон;
4) два протона;
5) два нейтрона.
86. При - - распаде ядро атома радиоактивного элемента испускает:
1) электрон;
2) позитрон;
3) два протона и два нейтрона, объединенные в ядро атома гелия;
4) два протона;
5) два нейтрона.
87. При + - распаде ядро атома радиоактивного элемента испускает:
1) электрон;
2) позитрон;
3) два протона и два нейтрона, объединенные в ядро атома гелия;
4) два протона;
5) два нейтрона.
88. Наименьшее значение суммы (n + l) имеет атомная орбиталь:
89. Наибольшее значение суммы (n + l) имеет атомная орбиталь
90. Атом азота будет более устойчивым, если на 2р-подуровне три электрона распределяются по одному на каждой орбитали. Это соответствует содержанию:
2) Принципа Паули;
3) Правила Гунда;
4) 1-го правила Клечковского;
5) 2-го правила Клечковского.
91. Двадцать первый электрон атома скандия располагается на 3d–подуровне, а не на 4р–подуровне. Это соответствует содержанию:
1) Принципа наименьшей энергии;
2) Принципа Паули;
3) Правила Гунда;
4) 1-го правила Клечковского;
5) 2-го правила Клечковского.
92. Девятнадцатый электрон атома калия располагается на 4s–подуровне, а не на 3d- подуровне. Это соответствует содержанию:
1) Принципа наименьшей энергии;
2) Принципа Паули;
3) Правила Гунда;
4) 1-го правила Клечковского ;
5) 2-го правила Клечковского.
93. Единственный электрон атома водорода в основном состоянии располагается на первом энергетическом уровне. Это соответствует содержанию:
1) Принципа наименьшей энергии;
2) Принципа Паули;
3) Правила Гунда;
4) 1-го правила Клечковского;
5) 2-го правила Клечковского.
94. Максимальное число электронов на втором энергетическом уровне атомов элементов
равно 8. Это соответствует содержанию:
1) Принципа наименьшей энергии;
2) Принципа Паули;
3) Правила Гунда;
4) 1-го правила Клечковского;
5) 2-го правила Клечковского.
95. Один из механизмов образования ковалентной связи:
1) радикальный;
2) обменный;
3) молекулярный;
4) ионный;
5) цепной.
96. Примером неполярной молекулы, имеющей полярную ковалентную связь, будет:
4) CCl 4
97. Неполярная молекула:
98. В ряду молекул LiF – BeF 2 - BF 3 - CF 4 - NF 3 - OF 2 - F 2:
1) характер связи не меняется;
2) ионный характер связи усиливается;
3) ковалентный характер связи ослабевает;
4) ковалентный характер связи усиливается;
5) правильного варианта ответа нет.
99. Ковалентная связь по донорно-акцепторному механизму образуется в молекуле:
2) CCl 4 ;
3) NH 4 C1;
4) NH 3 ;
100. В молекуле азота образуются:
1) только -связи;
2) только -связи;
3) как -, так и -связи;
4) одинарная связь;
5) двойная связь.
101. Молекула метана имеет структуру:
1) плоскую;
2) тетраэдрическую ;
3) пирамидальную;
4) квадратную;
102. Образование ионной решетки характерно для:
1) иодида цезия;
2) графита;
3) нафталина;
4) алмаза;
103. Для какого из перечисленных ниже веществ характерно образование атомной решетки:
1) нитрат аммония;
2) алмаз;
4) хлорид натрия;
5) натрий.
104. Химические элементы расположены в порядке возрастания электроотрицательности в
1) Si, P, Se, Br, Cl, O;
2) Si, P, Br, Se, Cl, O;
3) P, Si, Br, Se, Cl, O;
4) Br, P, Cl, Si, Se;
5) Si, P, Se, Cl, O, Br
105. Валентные орбитали атома бериллия в молекуле гидрида бериллия … гибридизованы
106. Молекула гидрида бериллия имеет структуру:
1) квадратную
Плоскую
3) тетраэдрическую
5) шарообразную.
107. Валентные орбитали атома бора в молекуле BF 3 гибридизованы по типу:
108. Какая из молекул является наиболее прочной?
109. Какая из указанных молекул имеет наибольший диполь?
110. Какую пространственную конфигурацию имеет молекула при sp 2 гибридизации АО:
1) линейная
2) тетраэдр
3) плоский квадрат
Плоская тригональная
111.Молекула имеет октаэдрическое строение если происходит следующая гибридизация
3) d 2 sp 3
112. Современная теория строения атома основана на представлениях:
1) классической механики;
2) квантовой механики;
3) теории Бора;
4) электродинамики;
5) химической кинетики.
113. Из перечисленных ниже характеристик атомов элементов периодически изменяются:
1) заряд ядра атома
2) относительная атомная масса;
3) число энергетических уровней в атоме;
4) число электронов на внешнем энергетическом уровне;
5) общее число электронов.
114. Внутри периода увеличение порядкового номера элемента обычно сопровождается:
1) уменьшением атомного радиуса и возрастанием электроотрицательности атома;
2) возрастанием атомного радиуса и уменьшением электроотрицательности атома;
3) уменьшением атомного радиуса и уменьшением электороотрицательности атома
4) возрастанием атомного радиуса и возрастанием электроотрицательности атома
5) уменьшением электроотрицательности.
115. Атом какого из элементов легче всего отдает один электрон:
1) натрий, порядковый номер 11;
2) магний, порядковый номер 12;
3) алюминий, порядковый номер 13;
4) кремний, порядковый номер 14;
5) сера, порядковый номер 16.
116. Атомы элементов IА группы периодической системы элементов имеют одинаковое число:
1) электронов на внешнем электронном уровне;
2) нейтронов;
3) всех электронов;
5) протонов.
117. Какой из приведенных элементов назван в честь страны:
118. Какой ряд включает только переходные элементы:
1) элементы 11, 14, 22, 42;
2) элементы 13, 33, 54, 83;
3) элементы 24, 39, 74, 80;
4) элементы 19, 32, 51, 101;
5) элементы 19, 20, 21, 22.
119. Атом какого из элементов VА группы имеет максимальный радиус:
2) фосфор;
3) мышьяк;
4) висмут;
5) сурьма.
120. Какой ряд элементов представлен в порядке возрастания атомного радиуса:
1) О, S, Se, Te;
3) Na, Mg, AI, Si;
4) J, Br, CI, F;
5) Sc, Te, V, Cr .
121. Металлический характер свойств элементов в ряду Mg – Ca – Sr – Ba
1) уменьшается;
2) возрастает;
3) не изменяется;
4) уменьшается, а затем возрастает;
5) увеличивается, а затем уменьшается.
122. Основные свойства гидроксидов элементов JА группы по мере увеличения порядкового номера
1) уменьшаются,
2) возрастают,
3) остаются неизменными,
4) уменьшаются, а затем возрастают,
5) возрастают, а затем уменьшаются.
123. Простые вещества каких элементов обладают наибольшим сходством физических и химических свойств:
3) F, CI;
124. Существование каких из приведенных элементов было предсказано Д.И. Менделеевым:
3) Sc, Ga, Ge;
125. Что отличает большие периоды от малых:
1) наличие щелочных металлов;
2) отсутствие инертных газов;
3) наличие d- и f- элементов;
4) наличие неметаллов;
5) наличие элементов с металлическими свойствами.
126.Как по электронной формуле элемента определить период, в котором находится данный элемент:
1) по значению главного квантового числа внешнего энергетического уровня ;
2) по числу валентных электронов;
3) по числу электронов во внешнем энергетическом уровне;
4) по количеству подуровней во внешнем энергетическом уровне;
5)по значению подуровня, где находится последний валентный электрон.
127. Какой элемент имеет наименьший ионизационный потенциал:
128. Химический элемент третьего периода образует высший оксид состава Э 2 О 3 . Как распределяются электроны в атоме данного элемента?
1) 1s 2 2s 2 2p 1
2) 1s 2 2s 2 2p 6 3s 1
3) 1s 2 2s 2 2p 6 3s 2 3p 1
4) 1s 2 2s 2 2p 6 3s 2 3p 6
5) 1s 2 2s 2 2p 3
129.Какой химический элемент образует основание с наиболее ярко выраженными свойствами
1) кальций
3) алюминий
Калий
5) берилий
130. Химический элемент имеет следующее распределение электронов по электронным слоям в атоме 2.8.6. Какое положение он занимает в периодической системе химических элементов Д.И. Менделеева:
1) 6 период 6 группа
Период 6 группа
3) 2 период 6 группа
4) 3 период 2 группа
5) 2 период 8 группа
131. Квантовые числа последнего электрона в атоме элемента, равны n = 5, l = 1, m = -1, m s = - . Где находится этот элемент в периодической системе?
1) 5 период, первая группа
2) 5 период, главная подгруппа 4 группы
3) 4 период, шестая группа
период, шестая группа главная подгруппа
5) 5 период, шестая группа побочная подгруппа.
132. Формула высшего оксида химического элемента ЭО 2 . К какой группе главной подгруппы периодической системы химических элементов Д.И. Менделеева принадлежит этот элемент?
Четвертая
5) шестая.
133. Из приведенного перечня элементов - Li, Na, Ag, Au, Ca, Ba- к щелочным металлам относятся:
1) все металлы;
2) Li, Na;
3) Li, Na, Ag, Au;
134. В ряду от Li к Fr:
1) усиливаются металлические свойства;
2) уменьшаются металлические свойства;
3) уменьшается атомный радиус;
4) усиливается связь валентных электронов с ядром;
5) уменьшается активность по отношению к воде
135. К металлам не относится последовательность элементов:
3) B, As, Te;
136. С ростом порядкового номера элемента кислотные свойства оксидов N 2 O 3 - P 2 O 3 - As 2 O 3
Sb 2 O 3 - Bi 2 O 3
1) усиливаются;
2) ослабевают;
3) остаются неизменными;
4) усиливаются, затем ослабевают;
5) ослабевают, затем усиливаются.
137. Молекула аммиака имеет форму:
1) изогнутую;
2) линейную;
3) плоскостную;
4) пирамидальную;
138. В ряду С-Si-Ge-Sn-Pb неметаллические признаки элементов:
1) возрастают;
2) ослабевают;
3) не изменяються;
4) возрастают а затем ослабевают;
5) ослабевают а затем возрастают.
139. Валентные орбитали у атома углерода в молекуле метана СН 4 можно описать на основе
представлений о гибридизации типа (sp; sp 2 ; sp 3 ; d 2 sp 3 ; dsp 2).
При этом молекула метана имеет форму:
1) линейную;
2) плоскую;
3) тетраэдрическую;
5) квадратную.
140. Валентные орбитали у атома кремния в молекуле силана SiH 4 можно описать на основе представления о гибридизации типа (sp; sp 2 ; sp 3 ; d 2 sp 3 ; dsp 2).
Поэтому молекула силана имеет форму:
1) линейную;
2) плоскую;
3) тетраэдричесую;
5) квадратную.
141.Какое максимальное число ковалентных связей может образовывать атом азота:
142. Атом азота молекулы аммиака с ионом водорода образует:
1) ионную связь;
2) ковалентную связь по обменному механизму;
3) неполярную ковалентную связь;
4) ковалентную связь по донорно - акцепторному механизму;
5) водородную связь.
143. Какое утверждение неверно:
4) Ионная связь обладает насыщаемостью ;
144. Какое утверждение неверно:
1) Ковалентная связь обладает насыщаемостью;
2) Ковалентная связь обладает направленностью;
3) Ионная связь обладает ненасыщаемостью;
4) Ионная связь обладает направленностью;
5) Ионная связь обладает ненаправленностью.
“Закономерности химических процессов и их энергетика”
145. Какие изменения температуры Т и давления Р способствует образованию СО по реакции С(тв.) + СО 2 (г.) 2СО (г.) -119,8 кДж:
1) повышение Т и повышение Р;
2) повышение Т и понижение Р;
3) понижение Т и повышение Р;
4) понижение Т и понижение Р;
5) повышение Р.
146.Во сколько раз увеличится скорость химической реакции при увеличении температуры на 30 0 , если температурный коэффициент скорости равен 2 ?
147. На сколько градусов надо понизить температуру, чтобы скорость реакции уменьшилась в 27 раз, если температурный коэффициент скорости равен 3 ?
148. Во сколько раз возрастет скорость реакции Х+ 2Y = Z при увеличении концентрации
Y в 3 раза?
149. Во сколько раз станет больше скорость прямой реакции по сравнению со скоростью обратной реакции в системе 2NO + O 2 2NO 2 при увеличении давления в 2 раза?
150. Укажите правильное выражение скорости для системы: 2Cr+3Cl 2 = 2CrCl 3
154. Катализатор ускоряет химическую реакцию благодаря:
1) снижению энергии активации;
2) повышению энергии активации;
3) уменьшению теплоты реакции;
4) увеличению концентрации;
5) все ответы не верны.
155. Равновесие реакции Fe 3 O 4 +4CO «3Fe +4CO 2 -43.7 кДж смещается влево:
1) при понижении температуры;
2) при повышении температуры;
3) при повышении давления;
4) при увеличении концентрации исходных веществ;
5) при добавлении катализатора.
156.Во сколько раз увеличится скорость химической реакции при увеличении температуры на 30 0 , если температурный коэффициент скорости равен 3?
157. На сколько градусов надо повысить температуру, чтобы скорость реакции увеличилась в 27 раз, если температурный коэффициент скорости равен 3?
158. Во сколько раз возрастает скорость реакции X+2Y=Z при увеличении концентрации Х в 3 раза?
159. Во сколько раз станет больше скорость прямой реакции по сравнению со скоростью обратной реакции в системе 2СO+O 2 2СO 2 при увеличении давления в 2 раза?
160. Как увеличится скорость газовой реакции 2NO 2 =N 2 O 4 при увеличении концентрации NO 2 в 5 раз?
161. Во сколько раз уменьшится скорость газовой реакции 2NO+O 2 =2NO 2 при разбавлении смеси реагирующих газов в 3 раза?
162. На сколько градусов надо понизить температуру, чтобы скорость реакции уменьшилась в 81 раз при температурном коэффициенте, равном 3?
163. Во сколько раз станет больше скорость реакции 2NO+O 2 =2NO 2 при увеличении давления в системе в 4 раза?
164. Во сколько раз станет больше скорость прямой реакции по сравнению со скоростью обратной реакции в системе 2NO+O 2 2NO 2 при увеличении давления в системе в 5 раз?
165. Как изменится скорость реакции 2SO 2,г +O 2,г 2SO 3,г при увеличении концентрации 1) увеличится в 3 раза; 2) увеличится в 9 раз;
3) уменьшится в 3 раза; 4) уменьшится в 9 раз; 5) не изменится. 166. Как изменится скорость реакции 2О 3,г 3О 2,г при увеличении давления в 2 раза? 1) уменьшится в 2 раза; 2) уменьшится в 8 раз; 3) увеличится в 4 раза;
4) уменьшится в 4 раза; 5) увеличится в 2 раза. 167. Как изменится скорость реакции 2NО г +О 2,г 2NO 2,г при одновременном уменьшении концентрации NO и O 2 в 2 раза? 1) возрастет в 2 раза; 2) уменьшится в 2 раза; 3) возрастет в 2 4 раза; 4) уменьшится в 2 4 раза; Уменьшится в 8 раз.
168. Как изменится скорость прямой реакции H 2 O ,г Н 2,г + О 2,г если давление в системе увеличится в 4 раза? 1) увеличится в 2 раза; 2) уменьшится в2 раза; 3) не изменится; 4) увеличится в 4 раза;
5) уменьшится в 4 раза. 169. Закон действия масс был открыт: 1) М.В. Ломоносовым 2) Г.И. Гессом 3) Дж.У. Гиббсом К. Гульдбергом и П. Вааге
5) Вант – Гоффом 170. Какая из указанных систем является гомогенной Раствор хлорида натрия
2) вода со льдом 3) насыщенный раствор с осадком 4) уголь и сера в атмосфере воздуха 5) смесь бензина с водой 171. Величина константы скорости химической реакции не зависит 1) от природы реагирующих веществ 2) от температуры 3) от присутствия катализаторов От концентрации веществ
5) ни от каких факторов 172. Энергия активации – это 1) энергия, необходимая для отрыва электрона от атома 2) избыточная энергия которой должны обладать молекулы в расчете на 1 моль для ого, чтобы их столкновение могло привести к образованию нового вещества 3) потенциал ионизации 4) энергия, которая выделяется в результате реакции 5) энергия, которая выделяется при присоединении электрона к атому. 173. Возрастание скорости реакции с ростом температуры принято характеризовать: 1) константой скорости химической реакции 2) константой химического равновесия Элементы главной подгруппы шестой группы периодической системы это кислород, сера, селен, теллур и полоний. Последний из них - радиоактивный металл; известны как природные, так и искусственно полученные его изотопы. Во внешней электронной оболочке атомы рассматриваемых элементов содержат шесть электронов - два на -орбитали и четыре на р-орбитали. Атом кислорода отличается от атомов других элементов подгруппы отсутствием -подуровня во внешнем электронном слое: Как указывалось в § 41, такая электронная структура атома кислорода обусловливает большие энергетические затраты на «распаривание» его электронов, не компенсируемые энергией образования новых ковалентных связей. Поэтому ковалентность кислорода, как правило, равна двум. Однако в некоторых случаях атом кислорода, обладающий неподеленнымн электронными парами, может выступать в качестве донора электронов и образовывать дополнительные ковалентные связи по донорно-акцепторному способу. У серы и у остальных элементов подгруппы число неспаренных электронов в атоме может быть увеличено путем перевода s- и р-электронов на -подуровень внешнего слоя. В связи с этим указанные элементы проявляют ковалентность, равную не только 2, но также 4 и 6. Все элементы данной подгруппы, кроме полония, неметаллы, хотя и менее активные, чем галогены. В своих соединениях они проявляют как отрицательную, так и положительную окисленность. В соединениях с металлами и с водородом их степень окисленности, как правило, равна -2. В соединениях с неметаллами, например с кислородом, она может иметь значение или . Исключение при этом составляет сам кислород. По величине электроотрицательности он уступает только фтору (см. табл. 6 на стр. 118); поэтому только в соединении с этим элементом его окисленность положительна . В соединениях со всеми другими элементами окисленность кислорода отрицательна и обычно равна -2. В пероксиде водорода и его производных (см. § 117) она равна -1. Как и в группе галогенов, физические и химические свойства рассматриваемых элементов закономерно изменяются с увеличением порядкового номера. Появление новых электронных слоев влечет за собой увеличение радиусов атомов, уменьшение электроотрицательности, понижение окислительной активности незаряженных атомов и усиление восстановительных свойств атомов со степенью окисленности -2. Таблица 25. Некоторые свойства кислорода и его аналогов Поэтому неметаллические свойства, ярко выраженные у кислорода, оказываются очень ослабленными у теллура. Некоторые свойства элементов главной подгруппы шестой группы приведены в табл. 25.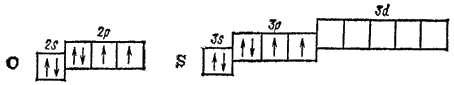

- Причины выброса токсичных веществ Несгораемые углеводороды и сажа
- Современный этап развития человечества
- Лилия яковлевна амарфий Могила лилии амарфий
- Значение имени мариям Имя марьям значение происхождение
- Семь советов от Отцов Церкви
- Унжа (Костромская область)
- Митрополит алексий московский святитель и чудотворец краткая биография Митрополит алексий годы

 Live Journal
Live Journal Facebook
Facebook Twitter
Twitter