Тремя общими электронными парами. Химия. Схема образования ионной связи
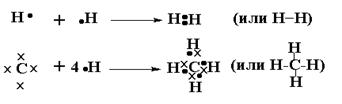
Состоянию для любого атома с Е min соответствует “завершенная снаружи“ электронная оболочка (для атомов 1 го периода –Н и Не – это два электрона, для всех остальных элементов восемь электронов, - правило октета). Способов достиженияЕ min у атомов несколько.
Схема образования ионной связи
Используются два способа достижения атомами состояния с Е min:
То, что долгое время было частью повседневной жизни компаний, на первый взгляд может показаться немного странным в частном секторе: голосование и обмен электронными календарями. Как мы решаем это в моей семье и насколько это легко? Поскольку все больше людей участвуют в планировании встреч и необходимости увеличения координации, электронные синхронизированные календари чрезвычайно помогают. Это касается проектных групп и подразделений в компаниях, а также для организаций и групп в государственном или частном секторе.
Эта система также отлично подходит для семей. В отличие от компаний, речь идет не об установлении общих назначений между членами семьи, а о координации назначений за пределами семьи и других членов семьи. Пока мы не посмели увидеть необычное решение с первого взгляда.
(а) приём электронов, недостающих до завершения наружного слоя электронной оболочки;
(б) отдача наружных электронов для “обнажения “ ранее завершенного предвнешнего слоя электронной оболочки.
Оба способа достижения атомами Е min реализуются одновременно при возникновении ионной связи:
В результате передачи электрона от атома Na атому Cl оба атома приобрели Е min
Мы семья из трех человек и объединяем их на значительном количестве назначений, которые должны быть частично скоординированы - в том числе. потому что мне часто приходится назначать вечера вечером. Каждый из нас занимается своим трудоустройством в течение дня, используя различные технические средства.
Связанные и общие календари - три принципа
Вот типичная неделя с датами в 6 календарях. В то время мы выбрали прагматичный подход: «Давайте попробуем!» Был наш девиз. На практике некоторые вещи хорошо работали, другим пришлось менять или снова падать. Со временем были установлены следующие принципы - также в смысле «правил игры».
(8 электронов “снаружи” у каждого). Теперь атомы стали противоположно заряженными ионами, которые притягиваются друг к другу электростатически, - ионная связь.
Ковалентная связь
 Третий способ
достижения атомами Е
min
-
обобществление электронов соединяющихся атомов с одновременной достройкой
электронных оболочек соединяющихся атомов.
Третий способ
достижения атомами Е
min
-
обобществление электронов соединяющихся атомов с одновременной достройкой
электронных оболочек соединяющихся атомов.
Перемещение
Преимущества очевидны: даты всех доступны для всех. Голос - будь то по телефону, будь то на кухонном столе - лишний. Запросы с семьей могут быть отменены, что более профессионально, особенно в профессиональной жизни. Один невосприимчив к сюрпризам, который избавляет нервы и оказывает положительное влияние на семейную жизнь. Разделение на профессиональную и личную повестку дня позволяет лучше сосредоточиться, временно угасая другие календари одним щелчком - единственным недостатком и самым большим препятствием - по крайней мере, в первые несколько недель: все участники должны изменить свои привычки и если это необходимо, обойтись без того, что было выиграно, что нельзя недооценивать и поэтому обсуждать заранее.
Между соединяющимися атомами возникают общие электронные пары, находящиеся в совместном пользовании обоих атомов. В итоге сразу несколько атомов достигли Е min (здесь 2 электрона у атома Н и 8 электронов у атома С).
Общие (связывающие) электронные пары – ковалентная связь , - главный вид связи в органической химии.
Теперь вы вполне можете придумать, что моя семья широко преувеличивает и стреляет из пушек по воробьям. Однако мы не занимаемся решением «всего» в семье с помощью электронных средств - это только средство для достижения цели. Выполняя обыденное, например, планирование, описанным образом, мы предотвращаем столкновения и разногласия с окончанием срока, оставляя больше времени на действительно важные вещи в семье. Нет никаких сомнений в том, что существуют другие решения, которые можно использовать для управления семейными встречами.
Астрономическая транскрипция - орфография и определение
Это видео: обозначение и определение атомной связи. В качестве предварительного знания вы должны принести знания о периодической таблице элементов, атомной структуре и орбиталях. Моя цель - познакомить вас с основами атомной связи в этом видео. Фильм делится на пять секций. Во-первых: общая электронная пара, вторая: привязка, третья: атомная связь, четвертая: одиночная пара и пятая: сводка. Во-первых, общая электронная пара. Мы хотим взглянуть на химический элемент лития, и нам интересен фтор. Химический элемент натрия не должен отсутствовать.
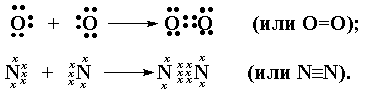 Связи между
органогенными элементами могут быть как простые (одинарные), так и кратные
(двойные или тройные, осуществляемые, соответственно, двумя или тремя общими
электронными парами).
Связи между
органогенными элементами могут быть как простые (одинарные), так и кратные
(двойные или тройные, осуществляемые, соответственно, двумя или тремя общими
электронными парами).
Такое, хотя и очень упрощенное, представление о ковалентной связи с позиций ПМ удобно использовать для обсуждения (объяснения) способов разрыва и образования связей, механизмов и типов органических реакций.
Как насчет кислорода? Магний тоже неплохой. Там у меня все еще есть калий, и фосфор не должен отсутствовать. Кальций, азот, йод и, наконец, алюминий. Вы уже осознали существенную разницу. Синие подложки - это металлы. Красные куски - исключительно неметаллические. Говоря об атомных связях в химии, это означает химические связи между атомами неметаллов. Эти атомы имеют сильную тенденцию к сбору, что приводит к образованию общих электронных пар. Атом фтора имеет не спаренный внешний электрон. У атома иода также есть неспаренный внешний электрон.
Для объяснения структуры молекул а, следовательно, и их химических свойств ПМ недостаточна. Структура молекул может быть объяснена только с позиций квантово-механической модели строения атома.
С позиций КММ химическая связь – это перекрывание орбиталей соединяющихся атомов с образованием между их ядрами областей повышенной электронной плотности.
Оба непарных валентных электрона объединяются, образуя общую электронную пару. Общая электронная пара также часто записывается как линия связи, и это выглядит так. Из-за общей электронной пары образуется химическая связь, она называется атомной связью. Другим допустимым именем для атомного связывания является ковалентное связывание. Термин гомополярная связь также допустима. Ученые также говорят о привязке электронной пары. Связь также называется валентным числом. Связь указывает количество связей атома.
Интегралом являются атомы водорода, фтора и хлора. Двухвалентным элементом является кислород. В три раза атомы химического элемента азота. Также можно записать атом элемента с соответствующими связями или связующими рукавами, как сказано. Для водорода, фтора и хлора это только одна связь за раз. Атом кислорода имеет две связи. Азот имеет три связи, один атом углерода может образовывать четыре связи. Для атома водорода получаем значения 1, а фтор имеет связь 1, но имеет 7 валентных электронов. То же самое касается атома хлора, связи 1, числа валентных электронов.
Способов перекрывания орбиталей - два:
1) “лобовое “ перекрывание (s - связь);
2) “боковое “ перекрывание (p - связь).
s - связь (сигма – связь)
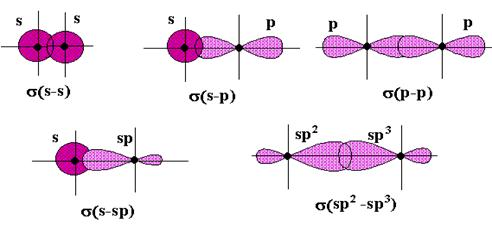 |
В образовании s - связи могут участвовать атомные орбитали всех типов – и простые (s- и p-), и гибридные (sp, sp 2 и sp 3). Область повышенной электронной плотности (область перекрывания) лежит на линии связи (воображаемой линии, соединяющей центры атомов) – рис.8.
Схемы образования s - связи перекрыванием орбиталей различного типа
Атом кислорода имеет известную связь: он имеет 6 валентных электронов. Азот дает значения 3, а для углерода значения одинаковы: привязка 4 и количество валентных электронов. Давайте перейдем к сути темы: в-третьих, атомная связь. Таким образом, мы можем сформулировать связь между двумя атомами, которая возникает в результате образования общих электронных пар, называемых атомными связями или ковалентными связями. Каждый атом вносит один электрон в одинарную связь. Атомная связь направлена. В-четвертых: одиночные пары электронов.
Это происходит непосредственно из правила октета. Объединение двух атомов водорода, каждый с одним валентным электроном, создает одну молекулу водорода. Химическое объединение двух атомов фтора приводит к образованию молекулы фтора. Вы можете считать, что молекула фтора имеет шесть одиночных пар электронов. Реакция атома водорода с атомом хлора дает одну молекулу хлористого водорода. Можно сказать, что эта молекула имеет 3 одиночных пары электронов. Атом водорода образует молекулу воды с атомом кислорода и другим атомом водорода.
p - связь (пи –связь)
В образовании p - связи могут участвовать только симметричные негибридные р - орбитали* соединяющихся атомов, ориентированные вдоль параллельных осей пространства.
При этом способе перекрывания орбиталей область повышенной электронной плотности (область перекрывания) не лежит на линии связи.
Важно при этом подчеркнуть, что p - связь – это не двойная связь, это такой способ перекрывания орбиталей. p - связь - одинарная, образованная одной общей электронной парой (как и s) ковалентная связь. Но p - электроны находятся на периферии молекулы и в первую очередь подвергаются “атаке“ реагента. Кроме того p - связь менее прочна, чем s - связь, а потому соединения с p - связью обладают повышенной реакционной способностью.
Схема образования ионной связи
Легко видеть, что молекула воды имеет две одинокие пары электронов. Три атома водорода реагируют с атомом азота с образованием молекулы аммиака. Из структурной формулы видно, что молекула имеет свободную электронную пару. Четыре атома водорода реагируют с одним атомом углерода с образованием одной молекулы метана. Метан не имеет одиночных пар электронов. Числа одиночных пар электронов даны по правилу октета, или если мы их обобщаем, достижением конфигурации благородного газа для образовавшейся молекулы.
* В образовании p - связей могут также участвовать и d – орбитали (здесь не рассматриваются).
Кратные связи
С позиций КММ кратная связь - это одновременное наличие s - и p - связей между двумя атомами.
Если между атомами есть химическая связь, - s -связь есть всегда. Двойная связь - это одна s - и одна p - связи (см. рис.11). Тройная связь - это одна s - и две p - связи (см. рис.12). При изображении структурных формул s - и p - связи показывают одинаковыми валентными штрихами. Важно при этом помнить о различной природе s - и p - связей.
Отдельные электроны разных атомов образуют пары электронов. Эти пары электронов называются атомной связью или как ковалентная связь. Также допускается обозначение гомополярного связывания или двухэлектронной связи. Атомные связи образуются между атомами неметаллов. В зависимости от того, сколько атомов связано с атомом элемента, говорят о связях 1, 2, 3 или Мы рассмотрели химические элементы с рядом внешних электронов от 1 до 7. Это связано с достижением конфигурации благородного газа или, как правило, из правила октета.
Если существует неравенство, В меньше, чем п, то мы получаем пары свободных электронов. В молекуле водорода нет одиноких пар, но шесть в молекуле фтора. Молекула хлористого водорода имеет три одиночные пары электронов. В молекуле аммиака мы сталкиваемся с одной одинокой парой электронов. Молекула метана не имеет одиночных пар электронов. Молекула кислорода на самом деле не выглядит так. Если вам это не нравится, пусть это исключается из рассмотрения. Число одиночных пар электронов связано с достижением конфигурации благородного газа или правила, правила октета.
Структура и модели молекул
а) порядок связи атомов в молекуле (“кто с кем“ связан);
б) характер взаимного расположения атомов в пространстве друг относительно друга;
в) типы связей между атомами.
Структурообразующей является s - связь , поскольку она направленная .
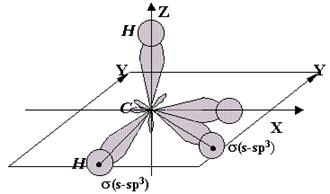 Направленность
s - связи выражается в том,
что несколько атомов, связанных с одним и тем же (центральным) атомом молекулы,
располагаются в пространстве строго по направлениям ориентации гибридных орбиталей
центрального атома.
Направленность
s - связи выражается в том,
что несколько атомов, связанных с одним и тем же (центральным) атомом молекулы,
располагаются в пространстве строго по направлениям ориентации гибридных орбиталей
центрального атома.
Спасибо за внимание. Атом азота имеет 4 пары валентных электронов: 3 пары связующих и 1 неперевязывающую пару. Можно ли описать структуру аммиака исключительно на основе отталкиваний между электронными парами? Однако обратите внимание, что пара связывания разделяется между двумя атомами и расположена между двумя атомами, которые она соединяет. С другой стороны, свободная пара локализуется только на одном атоме и, следовательно, более диффузна. Поэтому репрессия, проявленная из свободной пары, является более важной, чем отталкивание, создаваемое парой связывания. в другом месте следующая последовательность отталкивания.
Углерод в первом валентном состоянии (sp 3). (Н – С) – связи - s(sp 3 – s). Атомы Н располагаются по направлениям ориентации гибридных sp 3 – орбиталей атома С. Молекула объёмная.
Структура (а) и модель (б) молекулы этилена С 2 Н 4 .
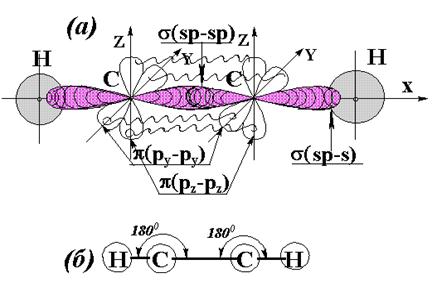 |
Углерод во втором валентном состоянии (sp 2). Атомы Н располагаются по направлениям ориентации гибридных sp 2 – орбиталей углерода. Все шесть атомов молекулы С 2 Н 4 лежат в одной плоскости (ХУ). Молекула этилена – плоская. Между атомами углерода – две связи: 1) s (sp 2 – sp 2) и 2) p (р z - р z). Между атомами углерода и водорода 4 s (sp 2 – s) связи.
Структура (а) и модель (б) молекулы ацетилена С 2 Н 2 .
Углерод в третьем валентном состоянии (sp).Атомы Н располагаются по направлениям ориентации гибридных sp – орбиталей углерода; все четыре атома молекулы лежат на одной линии, - молекула ацетилена линейна. Между атомами углерода три связи: 1) s (sp – sp) , 2) p (р z - р z) и 3) p (р y - р y). Между атомами углерода и водорода 2 s (sp – s) связи.
11. В каком ряду перечислены вещества только с ковалентной полярной связью:1) СН4 Н2 Сl2 2)NH3 HBr CO2 3) PCl3 KCl CCl4 4) H2S SO2 LiF
12. В каком ряду перечислены вещества только с ионным типом связи:
1) F2O LiF SF4 2) PCl3 NaCl CO2 3) KF Li2O BaCl2 4) СаF2 CH4 CCl4
13. Соединение с ионной связью образуется при взаимодействии
1) CH4 и O2 2)NH3 и HCl 3) C2H6 и HNO3 4) SO3 и H2O
14. В каком веществе все химические связи - ковалентные неполярные?
1) Алмаз 2) Оксид углерода (IV) 3) Золото 4) Метан
15. Связь, образующаяся между элементами с порядковыми номерами 15 и 53
1)ионная 2)металлическая
3)ковалентная неполярная 4)ковалентная полярная
16. Водородная связь образуется между молекулами
1) этана 2) бензола 3) водорода 4) этанола
17. В каком веществе есть водородные связи?
1) Сероводород 2)Лед 3) Бромоводород 4) Бензол
18.В каком веществе есть одновременно ионные и ковалентные химические связи?
1) Хлорид натрия 2) Хлороводород 3) Сульфат натрия 4) Фосфорная кислота
19. Более выраженный ионный характер имеет химическая связь в молекуле
1)бромида лития 2)хлорида меди 3)карбида кальция 4)фторида калия
20. Тремя общими электронными парами образована ковалентная связь в молекуле 1) азота 2) сероводорода 3) метана 4) хлора
21.Сколько электронов участвует в образовании химических связей в молекуле воды? 1) 2 2) 3 3) 4 4) 18
22.Четыре ковалентные связи содержит молекула: 1) СО2 2) С2H4 3) Р4 4) С3Н4
фтора? Перекрыванием каких орбиталей они образованы?
(С подробным решением!)
1) В молекуле Na2SO4 присутствует химическая связь...
а) только ионная
б) ковалентная полярная и неполярная
в) ионная и ковалентная полярная
г) ионная и ковалентная неполярная
2) Какая химическая связь в соединении K2S
3) Сколько общих электронных пар в молекуле азота?
4) В какой из формул есть двойная химическая связь: S2; H2; N2; CI2 ?
1. Формула вещества с ионной связью: A.HCI. Б. КВr. В.Р4. Г.СН3ОН. 2. Вещество с металлической связью: А. Оксид калия. В. Кремний. Б. Медь. Г.Гидроксид магния. 3. Число общих электронных пар в молекуле азота: А. Одна. Б. Две. В. Три. Г. Четыре. 4. Полярность химической связи уменьшается в ряду соединений, формулы которых: A. CI2, H2S, С02. В. NH3, РН3, S02. Б. HCI, НВr, HI. Г. ВН3, NH3, HF. 5. Вид гибридизации электронных орбиталей атома серы в молекуле соединения, формула которого H2S: A. sp3. Б. sp2. В. sp. Г. Не гибридизированы. 6. Кристаллическая решетка оксида кремния (IV): А. Атомная. В. Металлическая. Б. Ионная. Г. Молекулярная. 7. Число Сигма- и Пи- связей в молекуле этена: А. 6 Сигма и Пи - нет. В. 4 Сигма и 2 Пи. Б. 3 Сигма и 3 Пи. Г. 5 Сигма и 1 Пи 8. Вещества, формулы которых СН2=СН-СН2-СНз и СН2=С-СН3, - это: СНз А Гомологи. Б. Изомеры. В. Одно и то же вещество. 9. Гомологом вещества, формула которого СН3-СН2-СН2-ОН, является: А. Бутаналь. В. Этаналь. Б. Бутанол-2. Г. Этанол. 10. Вещество, формула которого СНз- С=СН2, . ..| СН3-СН2 А. 2-метилбутен-1. В. 2-этилпропен-2. Б. 2-этилпропен-1. Г. 2-метилбутен-2. . . . 11. Составьте схему образования соединений, состоящих из химических элементов: А. Кальция и фтора. Б. Мышьяка и водорода. Укажите тип химической связи в каждом соединении. 12. Какую геометрическую форму имеет молекула соединения с ковалентной связью из задания 11 ? 13. Расположите соединения, формулы которых CH3NH2, NH3, C6H5NH2, C2H5NH2, в порядке возрастания кислотных свойств. Объясните ответ. 14. Составьте структурные формулы не менее трех возможных изомеров веществ состава С4H8O2. Назовите эти вещества. 15. Какой объем кислорода потребуется для полного сгорания 1 м3 пропана?
- Манная каша на молоке: пропорции и рецепты приготовления Манная каша 1 порция
- Суп-пюре из брокколи с сыром Рецепт крем супа из брокколи с сыром
- Гороскоп: характеристика Девы, рождённой в год Петуха
- Причины выброса токсичных веществ Несгораемые углеводороды и сажа
- Современный этап развития человечества
- Лилия яковлевна амарфий Могила лилии амарфий
- Значение имени мариям Имя марьям значение происхождение

 Live Journal
Live Journal Facebook
Facebook Twitter
Twitter