Строение атомов элементов 1 4 периодов. Периодическая система Д.И. Менделеева и электронная структура атомов. Правила заполнения электронных оболочек
ЧАСТЬ 1.
1. Совокупность электронов в атоме называется электронной оболочкой.
2. Электроны на электронной оболочке атома располагаются по электронным слоям, или энергетическим уровням.
3. Номер периода соответствует числу электронных слоев в атоме химического элемента.
4. Номер группы соответствует числу электронов на внешнем энергетическом уровне.
Как физика больших, так и малых объектов подверглись резким обновлениям, а на горизонте науки появились такие элементы, как теория относительности, атомы, элементарные частицы, радиоактивность, особенности и т.д. была интенсивность физического обследования, в зависимости от того, насколько глубоко мы вошли в проблему. Самый простой способ понять это - изучить микрокосм: мы начали с доказательства существования атома, затем мы познакомились с электронами и нуклонами, и теперь мы открываем новые, еще более «элементарные» компоненты реальности.
5. Запишите схемы строения электронных оболочек атомов химических элементов с порядковыми номерами с 1-го по 10-й в таблице Д.И. Менделеева, а также калия и кальция.
ЧАСТЬ 2.
1. В приведенном перечне: мышьяк, теллур, германий, йод, селен, полоний, астат, - число элементов, в атомах которых по шесть электронов на внешнем энергетическом уровне, равно:
В шести тысячах световых лет отсюда скрывается космический монстр. Независимо от имени и принадлежности, существо только что проснулось и стало известно. Наблюдая объекты созвездия Лебедя, астрофизики никогда не жалуются на скуку. Масса и относительно небольшие размеры указывают на то, что мы имеем дело с двойной системой, в которой один из компонентов представляет собой черную дыру или необычную нейтронную звезду, а другую - маленькую звезду размером Солнца или меньше. Это была одна из десяти миссий в 11-летней программе, вторая - в направлении Красной планеты.
1) одному
2) двум
3) трем
4) четырем
2. Атомы химических элементов 4-го периода имеют одинаковое число:
1) электронов и на внешнем энергетическом уровне
2) нейтронов
3) энергетических уровней
4) протонов
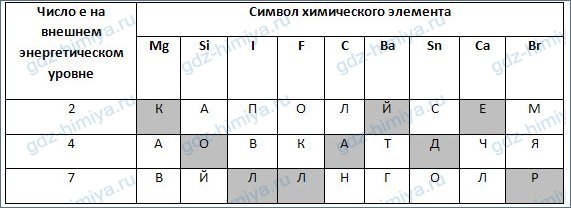
3. Установите соответствие между символом химического элемента (в заданном порядке) и числом электронов на внешнем энергетическом уровне его атома. Из букв, соответствующих правильным ответам, вы составите название установки, которая позволит человечеству еще глубже познать строение атома: коллайдер.
Многие из них воспринимали телескопы, видимые через телескопы, как произведение могучей цивилизации. Шашка успешно прошла до ключевого момента посадки на баржу: машина потеряла равновесие и взорвалась. К сожалению, прошло намного хуже, потому что у Сокола даже не было шанса приземлиться.
По прошествии минуты полета произошел взрыв, достаточно сильный, чтобы убедиться, что ракета не была повторно использована. Ниже записи около 3 из взрыва: после твитов Элтона Маска мы знаем только, что вероятная причина, вероятно, не стандартная утечка танков, но особенности немного придут к нам. Если это так, они могут рассчитывать на будущее. Университет Северной Каролины разработал совершенно новый способ применения инсулина без использования шприцев и игл. Решение представляет собой небольшое устройство, напоминающее наклейку или патч, покрытый сотней микрон.

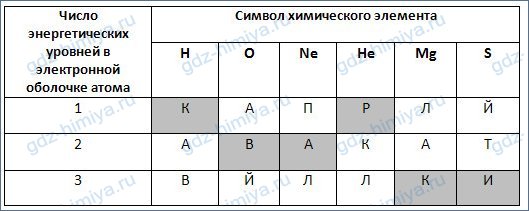
4. Установите соответствие между символом химического элемента (в заданном порядке) и числом энергетических уровней в электронной оболочке атома. Из букв, соответствующих правильным ответам, вы составите название частиц, в свою очередь, состоят протоны и нейтроны: кварки.
Это еще не все: на интеллектуальном патче также вводится фермент, который позволяет вам контролировать уровень сахара в крови, поэтому вы решаете, хотите ли вы доставить инсулин. Авторы уверяют, что во время проектирования они моделировали по самой природе и механизму действия поджелудочной железы. Пациенты теперь должны соблюдать строгие измерения уровня глюкозы в крови - часто болезненные и неточные - и, в зависимости от их результатов, принимать правильную дозу инсулина. Это чрезвычайно важно, потому что предоставление организму непревзойденной дозы инсулина может привести к серьезным осложнениям.
5. Верны ли следующие суждения?
А. Число электронов в электронной оболочке атома Cl равно 7.
Б. Число электронов на внешнем энергетическом уровне атома Br равно 35.
4) Оба суждения неверны.
6. Вычеркните "лишний" химический элемент из ряда P, Be, S, N, Ne , Ca, H.
По признаку завершенности внешнего электронного слоя атома.
7. Предложите алгоритм оставления электронной схемы атома химического элемента.
1. Определить общее число электронов на оболочке по порядковому номеру;
2. Определить число энергетических уровней по номеру периоды;
3. Определить число вншних электронов по номеру группы;
4. Рассчитать число электронов на предпоследнем уровне, предварительно указав число электронов на всех уровнях.
8. Сравните строение электронных оболочек атомов Ca и Mg.
1) сходство
: на внешнем уровне есть одинаковое число электронов, равное 2.
кальций 2e8e8e2e, магний 2e8e2e.
2) различие : в числе энергетических уровней, у кальция 4, у магния 3.
Рассмотрим связь между положением элемента в периодической системе и электронным строением его атомов. У каждого последующего элемента периодической системы на один электрон больше, чем у предыдущего. Полные записи электронных конфигураций (формул) первых двух периодов приведены в табл. 2.2.
Таблица 2.2
Электронные конфигурации элементов первых двух периодов
Первый период состоит из двух элементов: водорода и гелия (Z=2). Оба элемента являются s-элементами. Атомом гелия заканчивается формирование первого уровня (K-оболочки; n = 1) атома, обозначим её .
У элементов второго периода формируется второй энергетический уровень (L – оболочка; n = 2), заполняются s- и p- подуровни. Li (Z = 3) и Be (Z=4) относятся к s –элементам, остальные шесть элементов периода входят в число p-элементов. У элемента Ne (Z=10) полностью заполнен 2p –подуровень, обозначим его электронную конфигурацию как . Электронные конфигурации элементов в основном состоянии в краткой записи представлены в приложении 1(запись электронной конфигурации полностью заполненных подуровней предыдущих периодов не приводится).
У элементов 3-го периода заполняется третий уровень (оболочка М; n=3), состоящий из 3s-, 3p- и 3d-орбиталей. Начинается период с натрия (Z=11),электронная конфигурация которого ![]() , и заканчивается аргоном (Z=18), с электронной конфигурацией
, и заканчивается аргоном (Z=18), с электронной конфигурацией ![]() . Натрий – аналог лития, аргон – неона. В третьем периоде, так же, как и во втором, восемь элементов, из них два первых элемента Na(Z=11) и Mg(Z=12) являются s-элементами, шесть последних (Al - Ar) – p-элементами.
. Натрий – аналог лития, аргон – неона. В третьем периоде, так же, как и во втором, восемь элементов, из них два первых элемента Na(Z=11) и Mg(Z=12) являются s-элементами, шесть последних (Al - Ar) – p-элементами.
Хотя в третьем уровне (оболочка М) имеется подуровень 3d, который остается незаконченным, в четвертом периоде начинает формироваться следующий уровень- четвертый (оболочка N; n=4) и период начинается с s- элемента калия (Z=19).
Внешний 4s - электрон придает элементу свойства, сходные со свойствами натрия. Появление электрона в 4s-состоянии при наличии свободных 3d-орбиталей обусловливается экранированием(заслонением) ядра плотным и симметричным электронным слоем . В связи с отталкиванием от этого слоя для 19-го электрона атома калия и 20-го электрона атома кальция энергетически выгодным оказывается 4s- состояние:
То есть энергия 4s–подуровня несколько ниже, чем энергия 3d–подуровня (см. рис. 2.4). В соответствии с правилом Клечковского, (n+ℓ) у 4s(4) ниже, чем (n+ℓ) у 3d (5). С элемента скандия (Z=21) начинается заполнение 3d-подуровня, так как он энергетически более выгоден, чем 4p-подуровень. Пять орбиталей 3d-подуровня могут быть заняты десятью электронами, что осуществляется у атомов от скандия до цинка (Z=30). Элементы от ![]() до
до ![]() относятся к d-элементам. У d - элементов 4-го периода, следовательно, достраивается слой М (третий уровень; n=3) до 18 электронов. В связи с этим важно отметить, что физические и химические свойства элементов в первую очередь определяются структурой внешнего энергетического слоя их атомов и лишь в меньшей степени зависят от строения предшествующих (внутренних) электронных слоёв. У атомов всех d-элементов внешний слой образован одним, двумя s-электронами, поэтому химические свойства d-элементов с увеличением порядкового номера изменяются не так резко, как свойства s- и p-элементов. Все d-элементы принадлежат к металлам, тогда как заполнение внешнего p-подуровня приводит к переходу от металла к типичному неметаллу и, наконец, к благородному (инертному) газу.
относятся к d-элементам. У d - элементов 4-го периода, следовательно, достраивается слой М (третий уровень; n=3) до 18 электронов. В связи с этим важно отметить, что физические и химические свойства элементов в первую очередь определяются структурой внешнего энергетического слоя их атомов и лишь в меньшей степени зависят от строения предшествующих (внутренних) электронных слоёв. У атомов всех d-элементов внешний слой образован одним, двумя s-электронами, поэтому химические свойства d-элементов с увеличением порядкового номера изменяются не так резко, как свойства s- и p-элементов. Все d-элементы принадлежат к металлам, тогда как заполнение внешнего p-подуровня приводит к переходу от металла к типичному неметаллу и, наконец, к благородному (инертному) газу.
После заполнения 3d-орбиталей у последующих шести элементов (Ga-Kr) заполняются p-орбитали внешнего слоя. Четвертый период завершается формированием подуровня 4р у криптона – или , являющегося аналогом аргона. Всего в четвертом периоде 18 элементов. Таким образом, четвертый период начинается двумя s-элементами и заканчивается шестью р-элементами, но в отличие от второго и третьего периодов между s- и p-элементами располагаются десять d-элементов (вставная декада большого периода; переходные элементы).
В пятом периоде заполнение электронных уровней и подуровней происходит, как и в четвертом периоде, а именно: у двух первых элементов (s-элементов 37 Rb и 38 Sr) и шести последних (р - элементов ) заполняется внешний слой. Между s- и р - элементами располагаются десять d – элементов (), у которых заполняются d – орбитали предвнешнего уровня (4d - подуровень). Всего в пятом периоде 18 элементов.
Шестой период содержит 32 элемента (см. приложение 1) и тоже начинается двумя s – элементами ( и ). Далее у лантана начинает заполняться d – орбиталь предвнешнего уровня (5d - подуровень):
![]() .
.
После чего заполнение этого подуровня приостанавливается, а начинает заполняться энергетически более выгодный 4f – подуровень (рис. 2.4), семь орбиталей которого могут быть заняты 14 электронами. Это происходит у 14 атомов элементов лантаноидов , относящихся к f – элементам. Поскольку у этих элементов заполняется глубинный 4f – подуровень третьего снаружи уровня, они обладают близкими химическими свойствами. С гафния (Z=72) возобновляется заполнение 5d подуровня и заканчивается у ртути (Z=80), после чего электроны заполняют 6р – подуровень: шестой период, как и пятый, завершается шестью р – элементами . В шестом периоде 32 элемента, из них: два s – элемента, шесть р – элементов, десять d – элементов и четырнадцать f – элементов.
- Имена мальчиков рожденных в январе Азербайджанские имена родившиеся в январе по гороскопу
- Суточный диурез у беременных женщин
- Как рассчитать налог на автомобиль по лошадиным силам Изменения по транспортному налогу в году
- Храм Солнца: Черная Пагода Конарака
- В Туве упал космический корабль «Прогресс» видео падения Борис Леконцев, заслуженный метеоролог РФ
- Тесты что лишает меня энергии
- Владимир Иванович Долгих: биография Долгих секретарь цк кпсс

 Live Journal
Live Journal Facebook
Facebook Twitter
Twitter