Фосфор строение атома и степени окисления. Строение атомов. Строение электронной оболочки атома
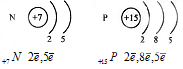
"Химия. 8 класс". О.С. Габриелян
Строение атомов. Строение электронной оболочки атома
Вопрос 1 (1).
а) - схема строения атома алюминия; б) - схема строения атома фосфора; в) - схема строения атома кислорода.
Вопрос 2 (2).
а) сравним строение атомов азота и фосфора.
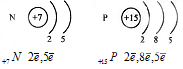
Строение электронной оболочки
этих атомов схоже, оба на последнем энергетическом уровне содержат по 5 электронов. Однако у азота всего 2 энергетических уровня, а у фосфора - 3.
б) Сравним строение атомов фосфора и серы.
Атомы фосфора и серы имеют по 3 энергетических уровня, причем у каждого последний уровень незавершенный, но у фосфора на последнем энергетическом уровне 5 электронов, а у серы 6.
Некоторые органические молекулы содержат ионные связи. Например, структура хлорида метиламмония не может быть представлена с использованием только ковалентных связей, так как это означает, что азот будет иметь 5 связей, т.е. 10 электронов в его валентной оболочке. Правильная структура представлена в виде катиона метиламмония, связанного ионной связью с хлоридным анионом.
Некоторые молекулы могут быть нарисованы как ионные или ковалентные. Это относится, например, к метоксиду натрия. В целом, когда существует большая разница в электроотрицательности, облигации предпочитают быть оттянутыми как ионные. Некоторые соединения плохо представлены одной структурой Льюиса. Когда вы можете написать несколько правильных структур Льюиса, которые отличаются только расположением электронов, молекула обычно имеет свойства, которые могут.
Вопрос 3 (3).
Атом кремни
я содержит в ядре 14 протонов и 14 нейтронов. Число электронов, находящихся вокруг ядра, как и число протонов равно порядковому номеру элемента. Число энергетических уровней определяется номером периода и равно 3. Число внешних электронов определяется номером группы и равно 4.
Вопрос 4 (4).
Количество содержащихся в периоде элементов равно максимально возможному числу электронов на внешнем энергетическом уровне и это число определяется по формуле 2n 2 , где n - номер периода. Поэтому в первом периоде содержится только 2 элемента (2 . 1 2 = 2), а во втором периоде 8 элементов (2 . 2 2 = 8).
Резонансные структуры Льюиса, соответствующие данному виду, могут быть: эквивалентными структурами Льюиса. к этим структурам будет соответствовать одна и та же энергетическая устойчивость. или через объединенную структуру. в предыдущем случае. Ну. будет вносить больший вклад в гибрид. Правильные структуры Льюиса, соответствующие одному и тому же виду, называются резонансными формами. когда они неотличимы друг от друга. формальдегид. Первая резонансная форма является наиболее стабильной. Чтобы провести реалистичные резонансные формы, мы должны принимать во внимание следующие правила: Все резонансные формы должны быть действительными структурами Льюиса.
Вопрос 5 (5).
В астрономии - Период вращения Земли вокруг своей оси 24 часа.
В географии - Смена сезонов с периодом 1 год, а также морские приливы и отливы.
В физике - Периодические колебания маятника, движение поршня в двигателе внутреннего сгорания.
В биологии - Деление клеток микроорганизмов при оптимальных условиях через каждые 20 мин.
Обладайте как можно большим количеством ссылок. обладают распределением зарядов в соответствии со значениями электроотрицательности. Отрицательные заряды более стабильны на электроотрицательных атомах. Формы, которые вносят наибольший вклад в структуру, являются наиболее стабильными. в порядке важности: максимально возможное количество ссылок и минимально возможное разделение сборов. и все электроны спарены в разных резонансных формах. Положение атомов и углы связи не могут меняться. Большинство стабильных соединений не имеют неспаренных электронов. Число неспаренных электронов должно оставаться постоянным. Резонансная стабилизация важнее, когда она служит для делокализации заряда между двумя или более атомами. Между резонансными формами изменяется только положение электронов.
Вопрос 6 (6).
Электроны и строение атома были открыты в начале ХХ века, чуть позже было написано это стихотворение, которое отражает во многом нуклеарную, или планетарную, теорию строения атома, а также В. Брюсов допускает возможность, что и электроны тоже сложные частицы, строение которых учёные ещё не изучили.
- Манная каша на молоке: пропорции и рецепты приготовления Манная каша 1 порция
- Суп-пюре из брокколи с сыром Рецепт крем супа из брокколи с сыром
- Гороскоп: характеристика Девы, рождённой в год Петуха
- Причины выброса токсичных веществ Несгораемые углеводороды и сажа
- Современный этап развития человечества
- Лилия яковлевна амарфий Могила лилии амарфий
- Значение имени мариям Имя марьям значение происхождение

 Live Journal
Live Journal Facebook
Facebook Twitter
Twitter