Окислительно восстановительные реакции в растворах электролитов. Виды окислительно-восстановительных реакций. Энергетика и направление химических процессов
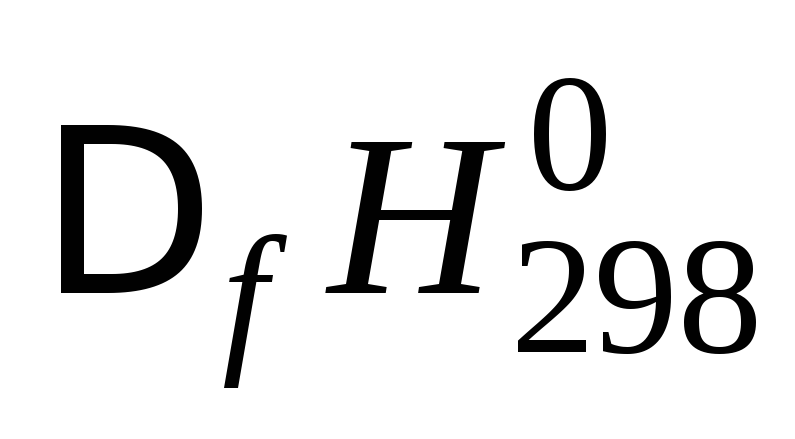
Реакции, протекающие с изменением степеней окисления участвующих в реакции элементов, называются окислительно-восстановительными реакциями (ОВ-реакции). Как минимум, два элемента меняют свою степень окисления: один – повышает, другой – понижает. В ходе ОВ-процесса происходит переход электронов от одних частиц (молекул, атомов, ионов) к другим.
Свойства электрохимической деформации металла: Снижение потенциала восстановления металла вправо, уменьшение способности реагировать с разбавленными кислотами, химическая реактивность уменьшается. Из двух членов, стоящие левее, электронов более легко расщепляются с образованием катионов, и, следовательно, способен снижать катион металла в правой неподвижные из него. Металлы, стоящие перед водородом, способны вытеснять водород из кислот, растворимы в кислотах и называются неблагородными металлами.
Металлы за водородом не способны вытеснять водород из кислот, не растворяются в кислотах и называются благородными металлами. Существуют химические реакции, которые переносят электроны между реагирующими частицами и тем самым изменяют их числа окисления.
Рассмотрим реакцию: 0 ¯ -1 0 -1
Cl 2 + 2KJ = J 2 + 2KCl
Мысленно любую ОВ-реакцию можно разделить на две полуреакции - окисления и восстановления:
Cl 2 + 2e = 2Cl - - присоединение электронов, восстановление окислителя ,
окислитель
2J - - 2e = J 2 - О тдача электронов, О кисление восстановителя .
восстановитель
Окисление и редукция всегда происходят одновременно. Частицы, которые вызывают окисление других частиц и уменьшают себя, называются окислителями. Редукционными агентами являются частицы, которые уменьшают другие частицы и окисляют себя. Важной группой окислительно-восстановительных процессов являются реакции металлов с водой и кислотными растворами. Некоторые металлы реагируют с водой при нормальной температуре, другие реагируют только с водяным паром, другие вообще не реагируют с водой.
Электролиты представляют собой соединения, которые после плавления или растворения расщепляются на свободные ионы. Этот процесс требует электролитической диссоциации. Существует упорядоченное движение электрически заряженных частиц, и поток проходит через раствор. Процессы, происходящие на электродах, имеют окислительно-восстановительный характер и называются электрохимическими процессами - электролизом. На аноде происходит окисление. Наступает катодное восстановление.
Атомы, молекулы, ионы, принимающие электроны, называют окислителями (окислитель – “грабитель”).
Атомы, молекулы или ионы, которые отдают электроны, называются восстановителями .
Каждая полуреакция представляет собой равновесие между окисленной (Ox) и восстановленной (Red) формами какого-либо элемента (редокспара). Окисленной называется форма с более высокой степенью окисления элемента. Равновесный стандартный потенциал любой редокспары Е 0 Ox/ Red приводится в справочнике.
ПРИМЕЧАНИЕ: независимо от формы записи равновесного процесса знак потенциала не менять! !!
Cl 2 + 2e = 2Cl - или 2Cl - - 2e = Cl 2 , E 0 (Cl 2 /2Cl -) = +1,36 B.
J 2 + 2e = 2J - или 2J - - 2e = J 2 , E 0 (J 2 /2J -) = +0,54 B.
По величине потенциала полуреакций можно судить об окислительно-восстановительных свойствах систем. Более высокий по своей алгебраической величине потенциал указывает на более высокую окислительную способность окислителя. Более низкий потенциал свидетельствует о более высокой восстановительной способности восстановителя.
Таким образом, согласно потенциалам, Cl 2 - более сильный окислитель, чем J 2 , а ион J - - более сильный восстановитель, чем Cl - .
В зависимости от степени окисления элемента в веществе он может проявлять различные функции в ОВ-реакциях. По этому признаку можно выделить три группы веществ и соединений.
1. Типичные окислители .
Из простых веществ только окислительными свойствами обладают F 2 и O 2 , атомы которых имеют наивысшую электроотрицательность. Сильными окислителями являются также Cl 2 и J 2 , но в отличие от фтора и кислорода в некоторых реакциях они могут проявлять и восстановительные свойства.
Из соединений только окислительными свойствами обладают те, которые содержат элементы в высших степенях окисления: Mn(+7) HMnO 4 , KMnO 4 , в растворе ион MnO 4 -
Cr(+6) H 2 Cr 2 O 7 , K 2 Cr 2 O 7 , в растворе нейтральном и кислом
ион Cr 2 O 7 2-
H 2 CrO 4 , K 2 CrO 4 , в щелочной среде ион СrO 4 2-
Bi(+5) NaBiO 3 – нерастворим в воде
Pb(+4) PbO 2 - нерастворим в воде
Fe 3+ FeCl 3 , в растворе ионы Fe 3+ + e = Fe 2+
Sn 4+ SnCl 4 , в растворе ионы Sn 4+ + 2e = Sn 2+
S(+6) H 2 SO 4 (конц) – сильный окислитель
N(+5) HNO 3 – сильный окислитель в любой концентрации
Cl(+7) HClO 4 , KClO 4 – сильнейшие окислители
Сильные окислители характеризуются значениями потенциалов Е 0 Ox / Red > +1 В.
Если Е < 0 В – это свидетельствует о слабых окислительных свойствах системы.
2. Типичные восстановители .
Только восстановительные свойства проявляют металлы в свободном состоянии: Me 0 – ne = Me n + .
Особенно активными восстановительными свойствами обладают металлы, стоящие в ряду напряжений левее водорода (чем левее, тем активнее).
Из соединений только восстановительными свойствами обладают те, которые содержат элементы в низших степенях окисления – это соединения, содержащие, например, ионы Cl - , Br - , J - , S 2- , Se 2- , Te 2- , азот в степени окисления (-3) в молекуле NH 3 или ионе NH 4 + , кислород в степени окисления
(-2) в молекуле Н 2 О или ионе ОН - .
Сильные восстановители характеризуются значениями потенциалов Е 0 Ox / Red < 0 В.
Если Е > +0,5 В – это свидетельствует о слабых восстановительных свойствах системы.
3. Соединения, обладающие ОВ-двойственностью .
Если элемент в составе простого вещества или соединения находится в промежуточной степени окисления (ни высшей, ни низшей), то он может проявлять как окислительные, так и восстановительные свойства. Это зависит от второго участника реакции.
Например, элементарная сера S 0 в реакции с сильным окислителем проявляет восстановительные свойства и может окисляться до S(+6) (до ионов SO 4 2-), а в реакциях с сильным восстановителем – проявляет окислительные свойства и восстанавливается до S 2- .
S 0 + 2e = S 2- S 0 - 6e = S (+6)
3s 3p 3s 3p 3s 3p 3s 3p
Возможность и направленность ОВ-реакций
Возможность осуществления и самопроизвольного протекания ОВ-реакции определяется двумя условиями:
1. Наличие в системе окислителя и восстановителя.
2. Обязательное соотношение потенциалов Е окислителя > Е восстановителя
Рассмотрим ОВ-реакцию, о которой известно, что она самопроизвольно протекает в прямом направлении. Вспомним гальванический элемент Даниэля-Якоби. Суммарный ОВ-процесс, протекающий в ГЭ самопроизвольно, отражается уравнением: Zn + CuSO 4 = ZnSO 4 + Cu или в ионном виде Zn 0 + Cu 2+ = Zn 2+ + Cu 0 .
Запишем полуреакции: Cu 2+ + 2e = Cu 0 , E 0 (Cu 2+ /Cu) = +0,34 B,
окислитель
Zn 0 – 2e = Zn 2+ , E 0 (Zn 2+ /Zn) = -0,76 B,
восстановитель
В гальваническом элементе данные полуреакции разделены пространственно, что позволяет преобразовать энергию химической реакции в электрическую. Эта же реакция, проведенная в пробирке, идет самопроизвольно в том же направлении, только энергия ее рассеивается.
Разность потенциалов окислителя и восстановителя – есть ЭДС окислительно-восстановительной реакции (ЭДС гальванического элемента). При стандартных условиях Е 0 = Е 0 окислителя – Е 0 восстановителя.
Изменение свободной энергии Гиббса для ОВ-реакции DG 0 = -RTlnK = -zFE 0 , где F – константа Фарадея, z – число электронов, передаваемых восстановителем окислителю за один пробег этой реакции.
Самопроизвольное протекание процесса возможно, если DG 0 < 0, это возможно, если Е 0 >0, т.е. Е 0 окислителя >Е 0 восстановителя.
1. Возможно ли самопроизвольное протекание реакции: CuCl 2 + Fe = Cu + FeCl 2 ?
Окислитель Cu 2+ + 2e = Cu 0 , E 0 (Cu 2+ /Cu) = +0.34 B.
Восстановитель Fe 0 - 2e = Fe 2+ , E 0 (Fe 2+ /Fe) = -0.44 B.
E 0 окислителя > Е 0 восстановителя - реакция возможна.
2. Возможно ли совместное сосуществование ионов в растворе Fe 3+ , Cl - , J - ?
Сосуществование ионов возможно при отсутствии между ними каких-либо химических реакций.
Среди указанных ионов есть типичный окислитель – Fe 3+ и типичные восстановители – Cl - и J - .
Проверим, возможно ли между ними химическое взаимодействие в виде ОВ-реакции.
Fe 3+ + e = Fe 2+ , E 0 = +0.77 B
2Cl - - 2e = Cl 2 , E 0 = +1.36 B
2J - - 2e = J 2 , E 0 = +0.54 B
Между ионами Fe 3+ и J – возможен ОВ-процесс. Следовательно, совместное сосуществование указанных ионов в растворе без изменения их степеней окисления невозможно.
Участие среды (Н + , ОН - , Н 2 О) в ОВ-реакциях
1. Состояние ионов в растворе .
При проведении ОВ-реакций в водных растворах необходимо учитывать, что в результате этих реакций происходит изменение ионного состава растворов. Чтобы отразить эти изменения, составляют уравнения в ионной форме . При этом руководствуются общими правилами составления ионных уравнений, т.е. записывают сильные электролиты в виде ионов, а неэлектролиты, слабые электролиты, газы и осадка – в виде молекул. В электронную схему включают только реально существующие ионы . При этом следует помнить, что, во-первых, элементы с высокой степенью окисления входят в состав сложных кислородсодержащих ионов, и, во-вторых, свободные ионы О 2- в растворе не существуют .
В щелочной среде катионы металлов образуют труднорастворимые гидроксиды (кроме щелочных металлов и Ca 2+ , Sr 2+ , Ba 2+ . Амфотерные гидроксиды растворяются в избытке щелочи с образованием гидроксокомплексов (см. таблицу).
2. Зависимость ОВ-потенциала реакций от концентрации ионов Н + (или ОН -).
Если ионы Н + или ОН - участвуют в равновесном процессе между окисленной и восстановленной формами, то потенциал такой системы зависит от их концентрации (см уравнение Нернста).
ПРИМЕР. Какая среда благоприятствует протеканию реакции KJ + KJO 3 ® /J 2 / ?
Составим схему реакции в ионном виде, найдем окислитель и восстановитель:
J - + JO 3 - ® /J 2 / - реакции такого типа называются реакциями конмутации или
выравнивания степеней окисления
2J - - 2e = J 2 , Е 0 (J 2 /2J -) = +0.54 B - потенциал этой реакции от среды не зависит
восстановитель
2JO 3 - + 10e + 6H 2 O = J 2 + 12OH - , Е 0 (2JO 3 - /(J 2 + 12OH -)) = +0.26 B – в ходе прямой реакции
окислитель накапливаются ионы ОН - , т.е. среда становится щелочной.
Поскольку Е окислителя < Е восстановителя, реакция между иодидом и иодатом калия в нейтральной и щелочной среде невозможна.
2JO 3 - + 10e + 12H + = J 2 + 6H 2 O, E 0 ((2JO 3 - +12Н +)/J 2) = +1,09 В – кислотная среда
способствует смещению равновесия в сторону прямой
реакции, окислительные свойства иодат-ионов возрастают.
В кислотной среде Е окислителя > Е восстановителя, реакция будет протекать самопроизвольно.
Составим уравнение реакции, учитывая два основополагающих принципа:
1) число атомов любого элемента в левой и правой частях уравнения должно быть одинаковым;
2) чмсло электронов, отданных восстановителем, должно быть равно числу электронов, принятых окислителем (принцип электронного баланса) .
´ 5 ½ 2J - - 2e = J 2
´ 1 ½ 2JO 3 - + 10e + 12H + = J 2 + 6H 2 O
_______
10J - + 2JO 3 - + 12H + = 6J 2 + 6H 2 O
5J - + JO 3 - + 6H + = 3J 2 + 3H 2 O
Чтобы уравнять число электронов, отданных иодид-ионами и принятых иодат-ионами, необходимо первую полуреакцию умножить на 5. После сложения уравнений полуреакций получим уравнение ОВ-реакции в ионной форме. Поскольку все коэффициенты получились четные, то можно их сократить в два раза. Далее можно записать молекулярное уравнение, сохраняя все коэффициенты, полученные в ионном уравнении. Ионы Н + вводят в раствор, добавляя сильную кислоту. Обычно используется разбавленная серная кислота. Соляную и азотную кислоты применяют реже, так как они могут сами участвовать в ОВ-реакции: НС1 как восстановитель за счет ионов С1 - , а HNO 3 как сильный окислитель за счет N(+5). В молекулярной форме уравнение реакции принимает вид:
5KJ + KJO 3 + 3H 2 SO 4 = 3J 2 + 3H 2 O + 3K 2 SO 4 . Ионы калия и сульфат-ионы записывают в виде соли сульфата калия.
3. При взаимодействии одних и тех же веществ в различных средах могут образовываться различные продукты реакции.
1) Cr 3+ + окислитель ¾OH - ® / СrO 4 2- + продукты восстановления окислителя/
Cr 3+ + окислитель ¾H + ® / Сr 2 O 7 2- + продукты восстановления окислителя/
2) KMnO 4 + восстановитель ¾ H + ® / Mn 2+ + продукты окисления восстановителя/
малиновый бесцветный
KMnO 4 + восстановитель ¾Н 2 О® / MnО 2 ¯ + продукты окисления восстановителя/
малиновый темный коричневый
KMnO 4 + восстановитель ¾ОН - ® / MnО 4 2- + продукты окисления восстановителя/
малиновый зеленый
Составление уравнений ОВ-реакций
1. Найти окислитель и восстановитель среди исходных веществ.
2. Предположить продукты реакции на основании знания химических свойств участвующих в реакции веществ или опытных данных.
ПРИМЕЧАНИЕ: В реакциях, идущих в разбавленных водных растворах, не образуются
оксиды металлов (кроме MnO 2), только соли!!!
Оксиды неметаллов SO 2 , SO 3 , N 2 O, NO, NO 2 , как правило, образуются в
реакциях с участием концентрированной серной кислоты или азотной
кислоты. В других случаях записывают ионы –SO 4 2- , NO 3 - .
3. Выбрать соответствующую среду, если она не указана заранее. Помнить, что большинство
реакций протекает в кислой среде. Щелочная среда менее желательна, т.к. могут протекать
побочные процессы (например, осаждение труднорастворимых основных солей и
гидроксидов).
4. Записать полуреакции в соответствии с правилами написания ионных уравнений. Каждая
полуреакция должна быть уравнена по элементам и зарядам.
ПРИМЕЧАНИЕ: При написании полуреакций с участием кислородсодержащих ионов нередко
возникают избыточные атомы кислорода в одной из частей уравнений.
Необходимо уравнять этот кислород. Это достигается одним из следующих
А) В кислой среде избыток атомов кислорода связывают ионами водорода (на каждый ион кислорода
требуется два иона водорода) О(-2) + 2Н + ® Н 2 О
SO 3 2- - 2e + H 2 O = SO 4 2- + 2H +
Б) В щелочной среде избыток атомов кислорода связывают молекулами воды (на каждый ион
кислорода требуется одна молекула воды) О(-2) + Н 2 О ® 2ОН -
SO 3 2- - 2e + 2ОН - = SO 4 2- + Н 2 О
В) В нейтральной среде избыток атомов кислорода следует связывать одним из двух первых способов, но так, чтобы в левой части уравнения получались молекулы воды.
5. По принципу электронного баланса ураниваем число отданных и принятых электронов, умножая каждую полуреакцию на соответствующий коэффициент.
6. Записать суммарное ионное уравнение.
7. Записать полное молекулярное уравнение, т.е. ввести те ионы, которые в ионной реакции не участвовали. Все коэффициенты, полученные в ионном уравнении реакции, сохраняются.
Ионы Н + вводят в раствор, добавляя обычно разбавленный раствор H 2 SO 4 . Разбавленные растворы соляной и азотной кислоты применяют реже, как правило, в тех случаях, когда они являются непосредственными участниками реакции.
Ионы ОН - вводят в раствор, добавляя разбавленные растворы щелочей NaOH, KOH.
1. KMnO 4 + Na 2 SO 3 ------ H + ---® / Mn 2+ , SO 4 2- /
окислитель восстановитель
Перманганат калия – типичный окислитель за счет Mn(+7). Сульфит натрия – обладает ОВ-двойственностью, поскольку сера находится в промежуточной степени окисления S(+4). В присутствии сильного окислителя сульфит натрия проявляет свойства восстановителя.
Перманганат-ионы в кислой среде восстанавливаются до ионов Mn 2+ (малиновый раствор перманганата калия обесцвечивается). Сера в сульфит-ионе окисляется до S(+6), т.е. образуются сульфат-ионы SO 4 2- .
Среда задана. Записываем полуреакции.
2 ½ MnO 4 - +5e +8H + = Mn 2+ + 4H 2 O
5 ½SO 3 2- - 2e + H 2 O = SO 4 2- + 2H +
________________________________________________________
2 MnO 4 - + 5 SO 3 2- + 16H + + 5H 2 O = 2Mn 2+ + 5SO 4 2- + 8H 2 O + 10H +
2 MnO 4 - + 5 SO 3 2- + 6H + = 2Mn 2+ + 5SO 4 2- + 3H 2 O
Записываем молекулярное уравнение реакции:
2KMnO 4 + 5Na 2 SO 3 + 3H 2 SO 4 = 2MnSO 4 + K 2 SO 4 + 5Na 2 SO 4 + 3H 2 O
В правой части уравнения 8 сульфатных группировок – 5 образовались в результате ОВ-реакции, а 3 – внесены в раствор с серной кислотой.
7 ¯ +4 +6 +6
2. KMnO 4 + Na 2 SO 3 ------ ОН - ---® / MnО 4 2- , SO 4 2- /
окислитель восстановитель
Поскольку задана щелочная среда, то в уравнениях полуреакций не должно быть Н + -ионов!!!
2 ½ MnO 4 - +e = MnО 4 2-
1 ½SO 3 2- - 2e + 2ОН - = SO 4 2- + Н 2 О
________________________________________________________
2 MnO 4 - + SO 3 2- + 2ОН - = 2MnО 4 2- + SO 4 2- + H 2 O
2KMnO 4 + Na 2 SO 3 + 2NaOH = 2Na 2 MnO 4 + K 2 SO 4 + H 2 O
7 ¯ +4 +4 +6
3. KMnO 4 + Na 2 SO 3 ----H 2 O---® / MnO 2 ¯, SO 4 2- /
окислитель восстановитель
По условию задана нейтральная среда, следовательно, в левой части уравнений полуреакций могут быть только молекулы воды.
2 ½ MnO 4 - +3e + 2Н 2 О = MnО 2 ¯ + 4OН -
3 ½SO 3 2- - 2e + H 2 O = SO 4 2- + 2H +
________________________________________________________
2 MnO 4 - + 3 SO 3 2- + 7H 2 O = 2MnО 2 + 3SO 4 2- + 8ОН - + 6H +
6Н 2 О + 2ОН -
После приведения подобных членов получаем:
2 MnO 4 - + 3 SO 3 2- + H 2 O = 2MnО 2 + 3SO 4 2- + 2ОН -
2KMnO 4 + 3Na 2 SO 3 + H 2 O = 2MnO 2 +3Na 2 SO 4 + 2KOH
Как видно из уравнения, среда в результате реакции становится щелочной.
4. Cu 0 + HNO 3 (разбавленная) ® / Сu 2+ , NO /
Среда проведения данной реакции задана (молчаливо) исходными веществами (азотной кислотой).
3 ½ Cu – 2e = Cu 2+
2 ½NO 3 - + 3e + 4H + = NO + 2H 2 O
____________________________________________________
3Cu + 2NO 3 - + 8H + = 3Cu 2+ + 2NO + 4H 2 O
Две молекулы HNO 3 необходимы для окисления меди, а шесть молекул HNO 3 вводятся дополнительно для создания среды. Суммарное число молекул кислоты – 8 (восемь ионов Н +).
3Cu + 8HNO 3 = 3Cu(NO 3) 2 + 2NO + 4H 2 O
Участие пероксида водорода Н 2 О 2 в ОВ-реакциях.
В пероксиде водорода степень окисления кислорода (-1): H ¾O¾O¾H
Эта степень окисления кислорода не является устойчивой, поэтому кислород стремится перейти в устойчивые степени окисления (-2) или (0).
Таким образом, пероксид водорода обладает ОВ-двойственностью и в зависимости от среды проявляет сильные окислительные или восстановительные свойства.
Н 2 О 2 как окислитель. Н 2 О 2 + 2е + 2Н + = 2Н 2 О, Е 0 = +1,76 В
Н 2 О 2 + 2е = 2ОН - , Е 0 = +0,878 В
В кислой среде пероксид водорода является сильным окислителем.
Н 2 О 2 как восстановитель. Н 2 О 2 – 2е = О 2 + 2Н + , Е 0 = +0,868 В
Н 2 О 2 – 2е + 2ОН - = О 2 + 2Н 2 О, Е 0 = -0,076 В
В щелочной среде пероксид водорода является сильным восстановителем.
2. Используя метод ионно-электронного баланса, расставьте коэффициенты в следующих схемах реакций.
Cr 2 (SO 4) 3 + H 2 O 2 + NaOH Na 2 CrO 4 + Na 2 SO 4 + H 2 O
MnSO 4 + Br 2 + NaOH MnO 2 + NaBr + Na 2 SO 4 + H 2 O
KMnO 4 + MnSO 4 + H 2 O MnO 2 + H 2 SO 4 + H 2 O
NaBr + H 2 SO 4 + NaBrO 3 = Br 2 + Na 2 SO 4 + K 2 SO 4
NaBr + NaBrO 3 + H 2 SO 4 Br 2 + Na 2 SO 4 + H 2 O
KBr + KMnO 4 + H 2 SO 4 K 2 SO 4 + MnSO 4 + Br 2 + H 2 O
KI + KIO 4 + H 2 SO 4 K 2 SO 4 + I 2 + Н 2 О
SnCl 2 + K 2 Cr 2 O 7 + HCl SnCl 4 + CrCl 3 + KCl + H 2 O
H 2 SO 4 + KMnO 4 MnSO 4 + O 2 + K 2 SO 4 + H 2 O
NaI + H 2 SO 4 I 2 + H 2 S + Na 2 SO 4 + H 2 O
SO 2 + NaIO 3 + H 2 O I 2 + Na 2 SO 4 + H 2 SO 4
Sn + HNO 3 N 2 O + Sn(NO 3) 2 + H 2 O
Bi 2 S 3 + HNO 3 Bi(NO 3) 3 + NO + S + H 2 O
HNO 2 + HMnO 4 Mn(NO 3) 2 + HNO 3 + H 2 O
KNO 2 + KMnO 4 + H 2 SO 4 KNO 3 + MnSO 4 + K 2 SO 4 + H 2 O
Sb 2 S 3 + HNO 3 HSbO 3 + H 2 SO 4 + NO 2 + H 2 O
HNO 2 + HCl + KMnO 4 KNO 3 + Mn(NO 3) 2 + H 2 O + KCl
SnCl 2 + NaOH + Bi(NO 3) 3 Bi + Na 2 SnO 3 + H 2 O
As 2 S 3 + HNO 3 H 3 AsO 4 + H 2 SO 4 + NO + H 2 O
KIO 3 + KI + HCl KCl + I 2 + H 2 O
H 3 PO 3 + KMnO 4 + HNO 3 H 3 PO 4 + KNO 3 + Mn(NO 3) 2 + H 2 O
HMnO 4 + NaCl + H 2 SO 4 MnSO 4 + Cl 2 + Na 2 SO 4 + H 2 O
Bi(NO 3) 3 +K 2 SnO 2 + KOH Bi + K 2 SnO 3 + KNO 3 + H 2 O
KMnO 4 + H 2 O 2 O 2 + H 2 O + KOH + MnO 2
PH 3 + KMnO 4 + H 2 SO 4 H 3 PO 4 + MnSO 4 + K 2 SO 4 + H 2 O
K 2 Cr 2 O 7 + H 2 O 2 + H 2 SO 4 O 2 + Cr 2 (SO 4) 3 + K 2 SO 4 + H 2 O
Cr 2 (SO 4) 3 + Br 2 + NaOH Na 2 CrO 4 + NaBr + Na 2 SO 4 + H 2 O
KBr + KMnO 4 + H 2 O MnO 2 + Br 2 + KOH
Co + HNO 3 Co(NO 3) 2 + N 2 + H 2 O
Hg + NaNO 3 + H 2 SO 4 Hg 2 SO 4 + Na 2 SO 4 + NO + H 2 O
3. Энергетика и направление химических процессов
3.1. Химическая термодинамика
Термодинамика изучает возможность и невозможность самопроизвольного перехода системы из одного состояния в другое и энергетические эффекты этих переходов. Во многих случаях процессы в термодинамических системах протекают при постоянном объеме или постоянном давлении. Из первого закона термодинамики следует, что при этих условиях теплота Q является функцией состояния. При постоянном объеме теплота равна изменению внутренней энергии
Q V =U ,
а при постоянном давлении – изменению энтальпии Н (от греч. enthalpy – «нагреваю»)
Q p =Н =U +pV .
Символ во всех случаях изменения термодинамических функций означает разность последних между конечным и исходным состоянием системы, в частности
Н = Н 2 –Н 1 .
Единица измерения энтальпии: Дж, или кДж, кДж/моль.
Изменение энтальпии Н равно тепловому эффекту химической реакции, протекающей в изобарно-изотермических условиях (р = const, T = const), когда единственным видом работы является работа расширения газа. Если Н < 0, процесс сопровождается выделением теплоты в окружающую среду (экзотермическая реакция), если Н > 0, процесс идет с поглощением теплоты (эндотермическая реакция).
Для того чтобы облегчить сравнение энтальпий различных химических реакций, используют понятие «стандартного состояния». Стандартное состояние – это состояние чистого вещества при давлении 1атм и заданной температуре . Энтальпию реакции между веществами, находящимися в стандартных состояниях при температуре T , обозначают (r означает «reaction»). В термохимических уравнениях указывают не только формулы веществ, но и их агрегатные состояния или кристаллические модификации.
Тепловой эффект химического процесса, протекающего в условиях р , Т = const, W = p V , не зависит от пути его протекания, а зависит от природы и физического состояния исходных веществ и продуктов реакции (закон Гесса ).
Практическое значение закона Гесса состоит в том, что с его помощью можно вычислить неизвестную теплоту реакции путем комбинирования термохимических уравнений других изученных реакций.
Следствие 1 закона Гесса . С термохимическими уравнениями реакций можно обращаться как с алгебраическими уравнениями. Если реакция превращения вещества 1 в вещество 2: 1 2, характеризуется изменением энтальпии H 1 2 , а реакция 3 2 характеризуется H 3 2 , то реакция 1 3 характеризуется изменением энтальпии:
H 1 3 =H 1 2 –H 3 2 .
Следствие 2 закона Гесса . Тепловой эффект химической реакции равен разности сумм энтальпий образования продуктов реакции и исходных веществ с учетом стехиометрических коэффициентов:
где
n
–
стехиометрические
коэффициенты в уравнении реакции,
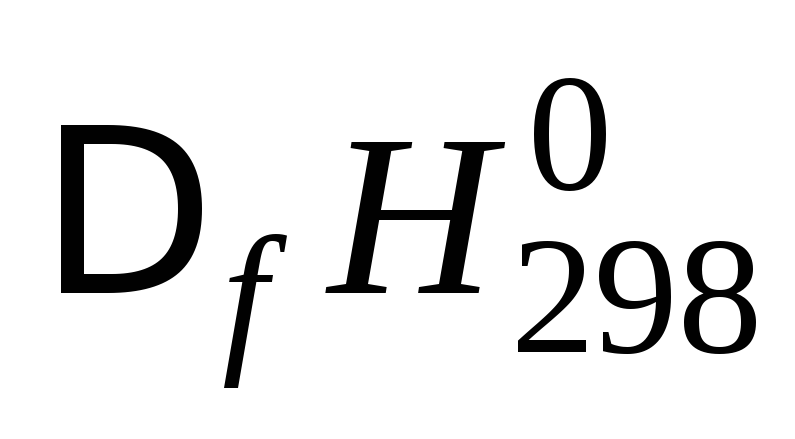 –
стандартные энтальпии образования
веществ.
–
стандартные энтальпии образования
веществ.
Стандартной энтальпией (теплотой ) образования вещества (f означает «formation») при заданной температуре называют энтальпию реакции образования одного моля этого вещества из элементов, находящихся в наиболее устойчивом стандартном состоянии. Энтальпия образования наиболее устойчивых простых веществ в стандартном состоянии при любой температуре равна нулю. Стандартные энтальпии образования веществ при температуре 298 К приведены в справочниках. Энтальпия образования соединения – мера его термодинамической устойчивости.
Следствие 3 закона Гесса. Тепловой эффект химической реакции равен разности сумм энтальпий сгорания исходных веществ и продуктов реакции с учетом стехиометрических коэффициентов:
где
n
–
стехиометрические
коэффициенты;
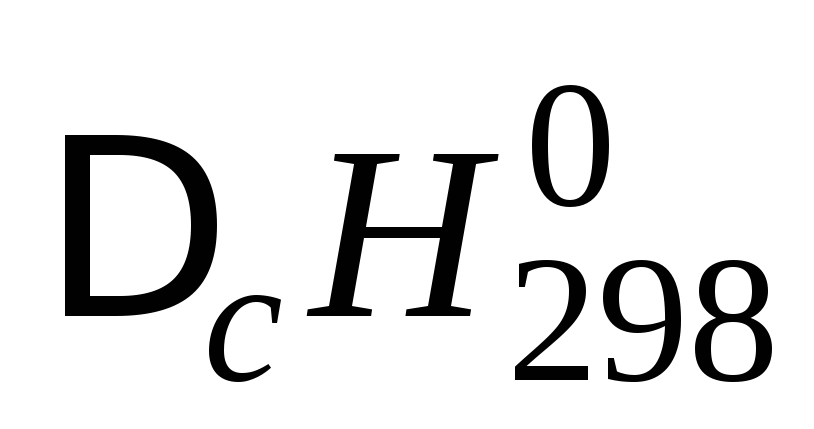 – энтальпии сгорания веществ.
– энтальпии сгорания веществ.
Стандартной энтальпией (теплотой ) сгорания вещества называют энтальпию реакции полного окисления одного моля вещества. Это следствие обычно используют для расчета тепловых эффектов органических реакций.
В технических расчетах используют удельную теплоту сгора- ния Q T , которая равна количеству теплоты, выделяющейся при сгорании 1 кг жидкого или твердого вещества и 1 м 3 газообразного вещества до образования высших оксидов:
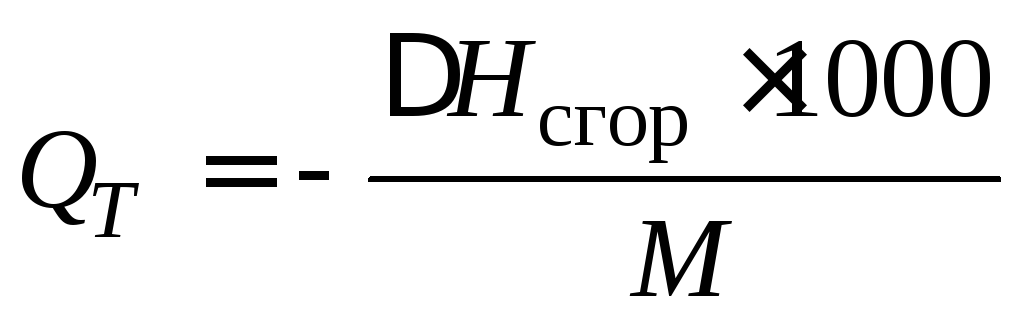 ,
или
,
или
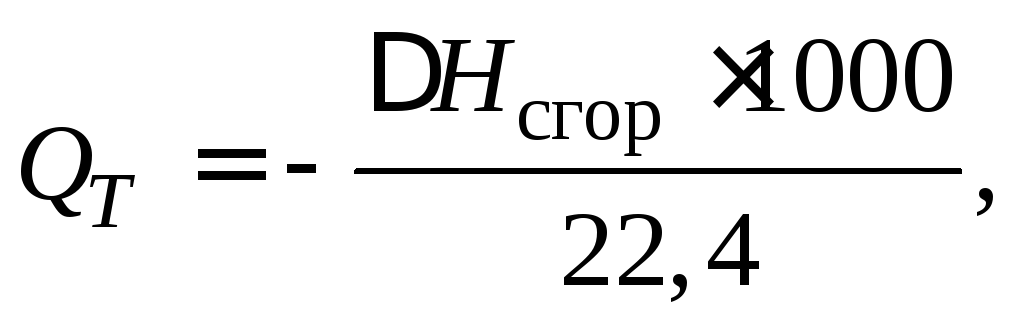
где М – масса 1 моль вещества; 22,4 л – объем 1 моль газа.
Если расчет теплоты сгорания ведется применительно к реакции с образованием жидкой воды, то удельная теплота сгорания называется высшей, а для реакции с образованием газообразной воды – низшей.
Энтропия S – так же, как и энтальпия, является термодинамической функцией состояния системы:
S =R lnW ,
где R – молярная газовая постоянная, Дж/моль К; W – термодинамическая вероятность состояния системы.
Термодинамической вероятностью состояния системы называется число микросостояний, с помощью которых осуществляется данное макросостояние.
Величина
S
прямо пропорциональна lnW
,
поэтому энтропия является мерой
неупорядоченности системы. Единица
измерения энтро-пии,
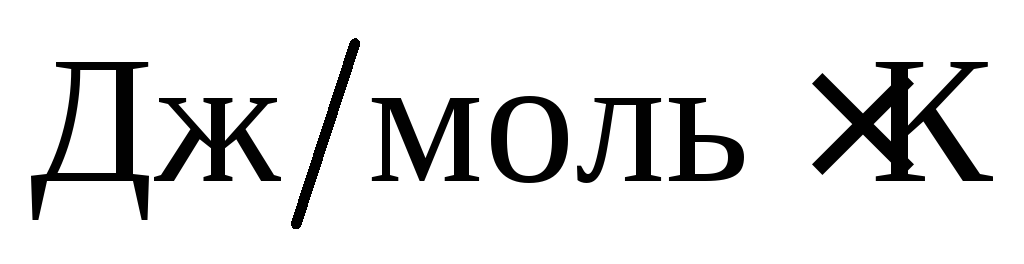 .
.
Ее значение увеличивается с ростом температуры и уменьшается с ее понижением. При повышении давления энтропия газа уменьшается, а при понижении – увеличивается.
На величину S влияют все факторы, связанные с природой вещества, например, полярность однотипных молекул – S HCl (г) < S HB r (г) < < S HI (г) , молярная масса молекул – S (F 2) < S (Cl 2) < S (Br 2).
Энтропия возрастает при переходе вещества из кристаллического состояния в жидкое и из жидкого в газообразное. Усложнение молекул также сопровождается ростом энтропии.
Стандартное изменение энтропии в химической реакции при Т = 298 К легко вычислить, используя таблицы термодинамических величин, в которых приводятся стандартные энтропии веществ S 0 при Т = 298 К.
Изменение энтропии r S в процессе химической реакции можно подсчитать, используя следствие из закона Гесса:
где
n
–
стехиометрические
коэффициенты в уравнении реакции;
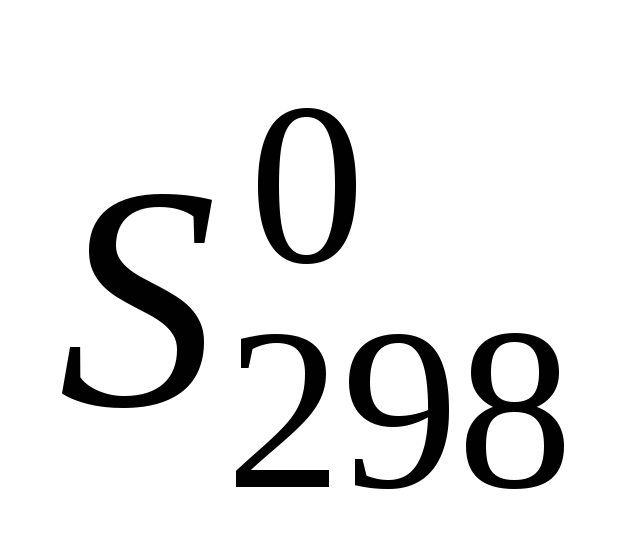 – стандартные энтропии образования
веществ.
– стандартные энтропии образования
веществ.
При химических взаимодействиях одновременно изменяются энтальпия и энтропия системы, откуда возникла идея сопоставления энтальпийного r Н и энтропийного Т r S факторов химической реакции.
Если тенденция к порядку и беспорядку в системе одинакова, то Н = Т S , что является математическим условием равновесного состояния системы, из которого ее можно вывести только путем внешнего воздействия.
В процессе перехода системы из одного состояния в другое происходят изменения Н Т S .
Устойчивость любой системы определяется соотношением энтальпийного и энтропийного факторов, которые объединяются функцией, называемой энергией Гиббса G , равной
G = H – T S , [G ] = кДж/моль или кДж.
Изменение энергии Гиббса учитывает одновременно изменение энтальпии и энтропии системы, суммируя тенденции к порядку и беспорядку при переходе системы из одного состояния в другое. Именно поэтому G – критерий, определяющий направление самопроизвольного протекания химических процессов.
Из уравнения G = H – T S следует:
если Н < 0 и S > 0, то всегда G < 0, т. е. реакция, протекающая с выделением теплоты и увеличением степени беспорядка, возможна при всех температурах;
если Н > 0 и S < 0, то всегда G > 0, т. е. реакция с поглощением теплоты, сопровождающаяся увеличением степени порядка, невозможна ни при каких температурах;
во всех остальных случаях (Н < 0 и S < 0 и если Н > 0 и S > 0), знак G < 0 зависит от соотношения членов Н и S ;
чем выше температура, тем большее значение приобретает член Т S , и при высоких температурах даже эндотермические реакции становятся самопроизвольными.
Стандартную энергию Гиббса реакции рассчитывают по следствию закона Гесса:
где
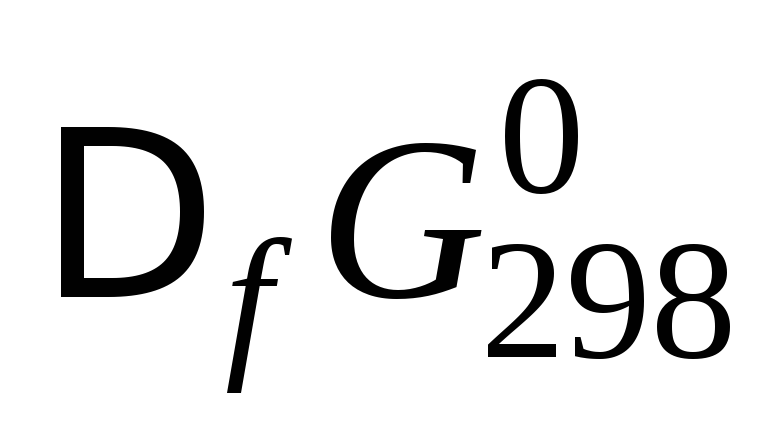 –
стандартные значения энергии Гиббса.
–
стандартные значения энергии Гиббса.
Стандартные значения энергий Гиббса образования простых веществ в стандартных состояниях и модификациях равны нулю.
Изменение стандартной энергии Гиббса при химической реакции (р, T = const) рассчитывается по формуле
Если
пренебречь изменением
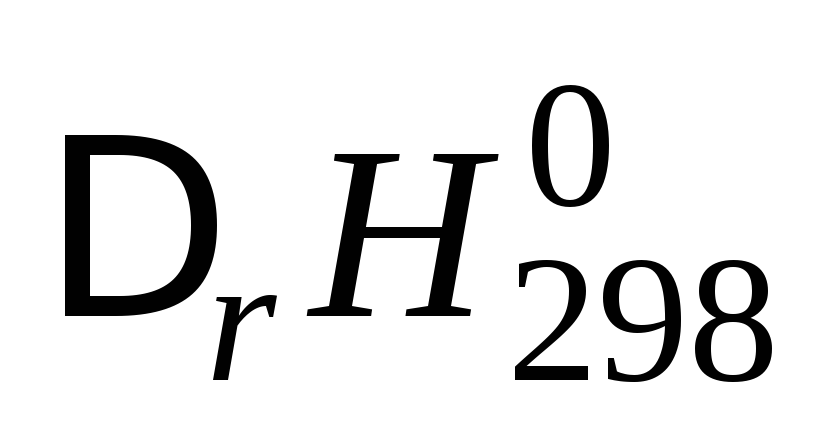 и
и с увеличением температуры, то можно
определить температуруТ
равн,
при которой устанавливается равновесие
химической реакции для стандартного
состояния реагентов:
с увеличением температуры, то можно
определить температуруТ
равн,
при которой устанавливается равновесие
химической реакции для стандартного
состояния реагентов:
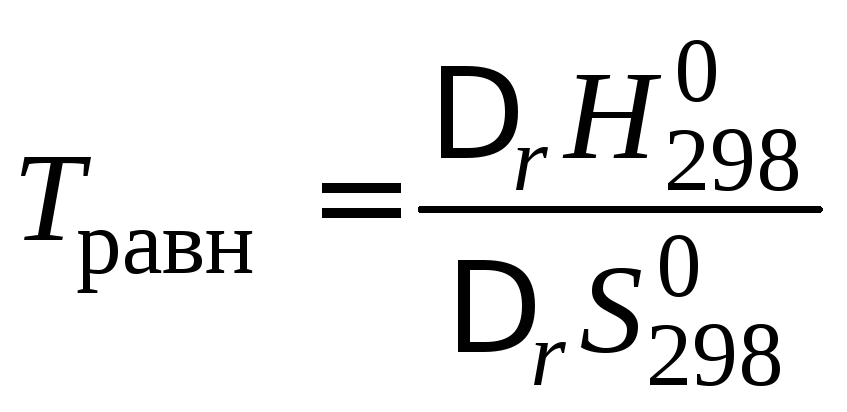 .
.
Если реагенты находятся в состояниях, отличных от стандартного, то изменение энергии Гиббса рассчитывается по уравнению, получившему название изотермы Вант-Гоффа , которое для реакции аА + b В = сС + dD записывается в виде
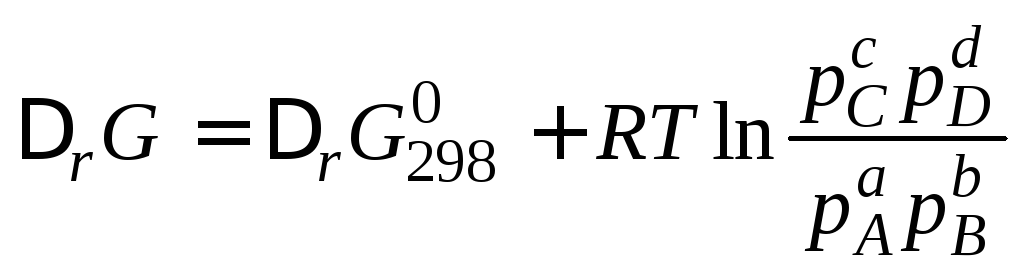 ,
,
где р (А , В , С , D ) – относительные парциальные давления соответствующих газов.
Учитывая,
что
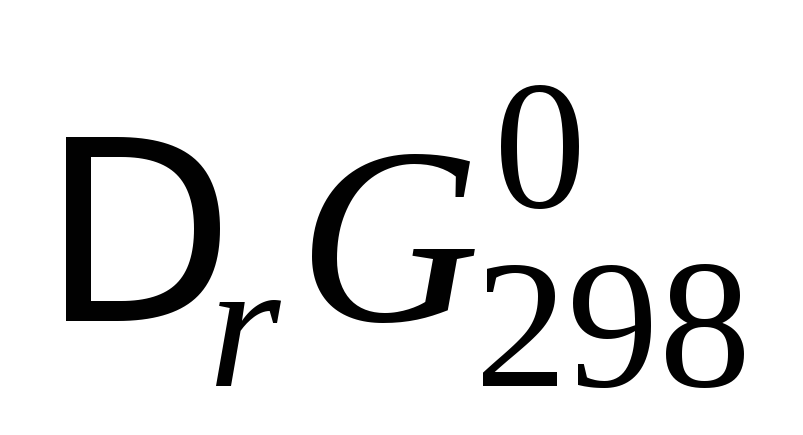 =
–
RT
lnK
,
где K
– константа равновесия, то изотерма
Вант-Гоффа будет иметь вид:
=
–
RT
lnK
,
где K
– константа равновесия, то изотерма
Вант-Гоффа будет иметь вид:
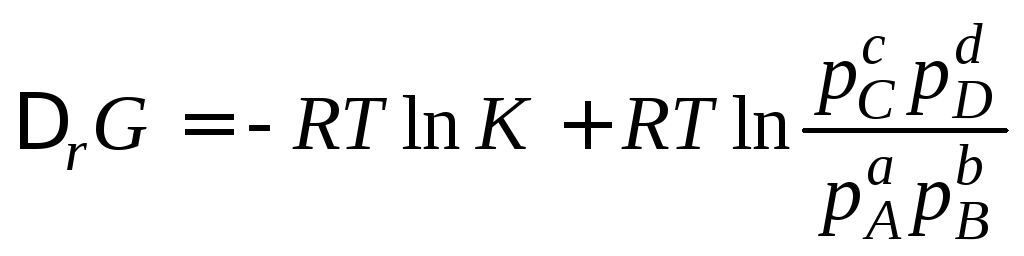 .
.
- Манная каша на молоке: пропорции и рецепты приготовления Манная каша 1 порция
- Суп-пюре из брокколи с сыром Рецепт крем супа из брокколи с сыром
- Гороскоп: характеристика Девы, рождённой в год Петуха
- Причины выброса токсичных веществ Несгораемые углеводороды и сажа
- Современный этап развития человечества
- Лилия яковлевна амарфий Могила лилии амарфий
- Значение имени мариям Имя марьям значение происхождение

 Live Journal
Live Journal Facebook
Facebook Twitter
Twitter