Простыми называют вещества которые образованы. Знакомимся с простыми и сложными веществами. Простые и сложные вещества
Изучение строения вещества стало возможным после создания атомно-молекулярного учения. Одним из первых строение вещества стал изучать М.В. Ломоносов, применивший теорию, согласно которой все вещества включают в свой состав «корпускулы». Этим термином Ломоносов называл молекулы. Корпускулы состоят из «элементов». Этот термин Ломоносов применял для обозначения атомов. Все частицы (и атомы, и молекулы) непрерывно движутся. Молекулы простых веществ состоят из одинаковых атомов, а сложных – из различных атомов. Учение М.В. Ломоносова нашло дальнейшее развитие в работах Дж. Дальтона, который сделал первые попытки определить атомные массы известных в то время элементов. Однако он отрицал наличие молекул в простых веществах, утверждая, что простое вещество состоит лишь из одних атомов, а сложные вещества состоят из «сложных атомов».
Высокая электроотрицательность притягивает к ней электроны или отрицательный заряд, делая область вокруг кислорода более отрицательной, чем области вокруг двух атомов водорода. Электрически положительные части молекулы отходят от двух заполненных кислородом орбиталей.
В принципе, оба атома водорода притягиваются к одной и той же стороне атома кислорода, но они настолько отделены друг от друга, что они могут быть как водородом, несущим положительный заряд. Согнутая конформация - это баланс между притяжением и отталкиванием.
Помните, что хотя ковалентная связь между каждым водородом и кислородом в воде полярна, молекула воды является вообще нейтральной нейтральной молекулой. Каждая молекула воды имеет 10 протонов и 10 электронов, для чистого заряда. Форма каждой молекулы воды влияет на то, как она взаимодействует с другими молекулами воды и другими веществами. Вода действует как полярный растворитель, потому что ее можно привлекать к положительному или отрицательному электрическому заряду на растворенном веществе. Небольшой отрицательный заряд вблизи атома кислорода притягивает атомы водорода вблизи воды или областей, положительно заряженных другими молекулами.
Согласно современным представлениям, молекулы составляют парообразные и газообразные тела. В твердых телах присутствие молекул возможно только при наличии кристаллической решетки, имеющей молекулярное строение.
В атомно-молекулярном учении имеется несколько базисных утверждений: наличие между частицами определенных промежутков, размеры которых зависят от температуры и агрегатного состояния объекта. Наибольшие промежутки между молекулами наблюдаются в газообразных телах, что обуславливает их способность легко сжиматься. Значительно меньше расстояние между молекулами в жидкостях, поэтому они сжимаются труднее. Твердые тела практически не поддаются сжатию, т.к. промежутки между частицами имеют небольшой размер.
Немного положительная водородная сторона каждой молекулы воды притягивает другие атомы кислорода и отрицательно заряженные области других молекул. Водородная связь между водородом одной молекулы воды и кислородом другой содержит воду вместе и дает интересные, однако водородные связи не столь сильны, как ковалентные связи.
Определение и примеры неполярных молекул
В то время как молекулы воды привлекают друг друга через водородные связи, около 20% из них свободны в любой момент времени для взаимодействия с другими химическими видами. Это взаимодействие представляет собой гидратацию или растворение. Неполярная молекула представляет собой олекулу, которая не имеет разделения заряда, так что положительные или отрицательные полюса не образуются. Другими словами, электрические заряды неполярных молекул равномерно распределены по всей молекуле. Неполярные молекулы склонны хорошо растворяться в неполярных растворителях, которые часто являются органическими растворителями.
Молекулы постоянно находятся в движении. Чем выше температура тела, тем выше скорость движения. Наличие сил взаимного отталкивания и притяжения между молекулами. Молекулы состоят из атомов, находящихся в непрерывном движении. Атомов отличаются друг от друга по своим свойствам и массе. Вещества в твердом агрегатном состоянии, обладающие кристаллической решеткой, имеют в узлах этих решеток молекулы. Связи между атомами и молекулами в таких веществах слабые и разрываются при нагревании, что придает им такие физические свойства как низкая температура плавления.
Напротив, в полярной молекуле одна сторона молекулы имеет положительный электрический заряд, а другая сторона имеет отрицательный электрический заряд. Полярные молекулы склонны хорошо растворяться в воде и других полярных растворителях. Существуют также амфифильные молекулы, которые представляют собой большие молекулы, к которым прикреплены полярные и неполярные группы. Поскольку эти молекулы являются полярными и не полярными, они создают хорошие поверхностно-активные вещества, помогая смешивать воду с жирами.
Технически единственными полностью неполярными молекулами являются те, которые состоят из одного типа атома или состоят из разных типов атомов, которые показывают определенную пространственную структуру. Многие молекулы являются промежуточными между полностью полярными или неполярными.
Молекулы
ОПРЕДЕЛЕНИЕ
Молекула – некоторая совокупность атомов, обладающая рядом характерных отличительных свойств.
Однако свойства, которые характерны для одной молекулы, могут быть характерными и для целой группы молекул.
ОПРЕДЕЛЕНИЕ
Характерные свойства молекул – свойства, позволяющие ее идентифицировать (качественный и количественный состав, пространственное расположение атомов, энергия взаимодействие атомов, реакционная способность и др.).
Можно предсказать, будет ли молекула полярной или неполярной, глядя на тип химических связей, образованных между атомами элементов. Если между величинами электроотрицательности атомов существует значительная разница, электроны не будут распределяться между атомами одинаково.
Другими словами, электроны будут тратить больше времени на один атом, чем другой. Атом, наиболее привлекательный для электрона, будет иметь кажущийся отрицательный заряд, а атомы, которые менее электроотрицательны, будут иметь чистый положительный заряд.
Прогнозирование полярности упрощается с учетом группы точек молекулы. В принципе, если дипольные моменты молекулы отменяют друг друга, молекула неполярна. Если дипольные моменты не отменяются, молекула полярна. Имейте в виду, что не все молекулы имеют дипольный момент. Например, молекула, имеющая зеркальную плоскость, не будет иметь дипольного момента, потому что отдельные дипольные моменты не могут быть более чем в одном измерении.
Рассмотрим следующие примеры: молекулы, имеющие разный качественный состав
H 2 (водород), N 2 (азот), O 2 (кислород), F 2 (фтор), S n (сера), C (алмаз)
молекулы, имеющие одинаковый качественный, но различный количественный состав
N 2 O (оксид азота (I)), NO (оксид азота (II)), N 2 O 3 (оксид азота (III)),
NO 2 (оксид азота (IV)), N 2 O 4 (оксид азота (IV)), N 2 O 5 (оксид азота (V))
Примерами неполярных гомоядерных молекул являются кислород, азот и озон. Другие неполярные молекулы включают углекислый газ и органические молекулы метана, толуола и бензина. Большинство соединений углерода неполярны. Окись углерода представляет собой линейную молекулу, но различие электроотрицательности между углеродом и кислородом является весьма значительным, чтобы сделать полярную молекулу.
Алкины считаются неполярными молекулами, потому что они не растворяются в воде. Благородные или инертные газы также считаются неполярными. Эти газы состоят из отдельных атомов их элемента. Примеры включают аргон, гелий, криптон и неон. Полярная молекула Определение: полярная молекула представляет собой молекулу, которая содержит полярные связи, где сумма всех дипольных моментов связи не равна нулю.
молекулы, обладающие разным качественным и количественным составом
HNO 3 (азотная кислота), CH 3 OH (метиловый спирт), SiO 2 (оксид кремния).
Структура молекулы складывается из молекулярной и электронной структур. Молекулярная структура включает типы и порядок расположения атомов молекулы в пространстве, длины связей, углы между ними, т.е. координаты всех атомов, входящих в состав молекулы. Реакционная способность – свойство молекулы вступать в химическое взаимодействие с другими молекулами. Она зависит от прочности химических связей внутри молекулы, а также её пространственного строения.
Примеры: Вода - полярная молекула. Двуокись углерода состоит из полярных связей, но дипольные моменты компенсируют друг друга и, следовательно, не являются полярной молекулой. Существуют сотни двухатомных молекул. Это список двухатомных молекул, включая двухатомные элементы и диатомовые химические соединения.
Некоторые из этих молекул состоят из элемента или являются двухатомными элементами. Двухатомные элементы являются примерами гомоядерных молекул, где все атомы молекулы равны. Химические связи между атомами являются ковалентными и неполярными. Обратите внимание, что в некоторых источниках указывается, что имеется 5 двухатомных элементов, а не потому, что только пять элементов образуют стабильные двухатомные молекулы при стандартной температуре и давлении: газы водорода, азота, кислорода, фтора и хлора.
ОПРЕДЕЛЕНИЕ
Электронная структура – это информация о состоянии и характере движения электронов в молекуле (состав и вид волновых функций, описывающих движение электронов, энергия электронов, распределение электронной плотности в пределах молекулы, энергии взаимодействия отдельных атомов в молекуле и т.д.).
Молекулярная и электронная структуры связаны между собой. Информацию о молекулярной структуре получают из экспериментальных данных, а об электронной – с применением различных теорий электронного строения.
Бром и йод образуют гомоядерные двухатомные молекулы при несколько более высоких температурах. Элемент 8 может образовывать двухатомную молекулу. Состояние астатина неизвестно. Многие другие двухатомные молекулы состоят из двух элементов. Фактически, большинство элементов образуют двухатомные молекулы, особенно при более высоких температурах. Однако после определенной температуры все молекулы разбиваются на свои составляющие атомы. Благородные газы не образуют двухатомных молекул. Двухатомные молекулы, состоящие из двух разных элементов, называются гетероядерными молекулами.
Число атомов в молекуле не ограничено, так, например молекулы газообразных веществ могут иметь в своем составе один атом (Ar), два (O 2) или более (S 8 , (C 738 H 1165 O 208 N 203 S 2 Fe) n — гемоглобин). Молекулы, содержащие повторяющиеся группы атомов общей численностью не более 100 называют олигомерами, более крупные – полимерами.
Молекула конкретного состояния не обязательно должна существовать при нормальных условиях. Так, молекулы щелочных металлов при н.у. полимерны, а при высокой температуре, в газовой фазе – двухатомны.
Вот некоторые гетероядерные двухатомные молекулы. Существует много бинарных соединений, которые состоят из соотношения 1: 1 двух типов атомов, но они не всегда считаются двухатомными молекулами. Причина в том, что эти соединения представляют собой только газообразные двухатомные молекулы, когда они испаряются.
При охлаждении до температуры молекулы образуют полимеры. Примеры такого типа соединения включают оксид кремния и оксид магния. Все двухатомные молекулы имеют линейную геометрию. Нет другой возможной геометрии, потому что соединение пары объектов обязательно создает линию. Линейная геометрия - это простейшее расположение атомов в молекуле.
Объединение атомов в молекулы происходит за счет образования химических связей. Химическая связь образуется, если электроны взаимодействующих атомов получают возможность двигаться одновременно вблизи положительных зарядов нескольких ядер. Для объяснения свойств химических связей используют разнообразные подходы, из которых наибольшую значимость имеют метод валентных связей (МВС) и метод молекулярных орбиталей (ММО).
Возможно, что дополнительные элементы образуют гомоядерные двухатомные молекулы. Эти элементы являются двухатомными, когда они испаряются, однако они полимеризуются при их охлаждении. Необычные двухатомные элементы включают в себя дифторуглерод и димолибден, которые связаны шестиугольными связями в виде газов. Вы поняли, что около 99% земной атмосферы состоит всего из двух двухатомных молекул? Азот составляет 78% атмосферы, а кислород - 21%. Наиболее распространенная молекула во Вселенной также является двухатомным элементом.
Какая форма - диатомовые молекулы?
Многие молекулы диатомические, что означает, что они состоят из двух элементов. Все двухатомные молекулы имеют одинаковую форму или геометрию. Вот посмотрите, что это за геометрия и почему все двухатомные молекулы в этом смысле одинаковы. Все двухатомные молекулы являются линейными. Не имеет значения, являются ли они диатомическими элементами или гетероядерными двухатомными молекулами.
Метод валентных связей
МВС основан на предположении о том, что химическая связь обеспечивается 2-мя электронами, движущимися в ограниченном участке электростатического поля двух ядер – концепция двухэлектронных локализованных связей. МВС позволяет понять способность атомов к образованию определенного числа ковалентных связей, дает удовлетворительное описание структуры и свойств большого числа молекул. Согласно МВС все ковалентные связи осуществляются общей парой электронов (рис. 1).
Диатомовые молекулы должны принимать линейную геометрию, поскольку единственный способ соединения двух точек - с линией. Ядра атомов отталкиваются друг от друга, поэтому они склонны толкать друг друга, даже когда электроны разделены. В полученной связи наблюдается характерная вибрация, которая может наблюдаться с использованием лабораторных методов, таких как спектроскопия.
Введение в молекулярную геометрию
Молекулярная геометрия или молекулярная структура - это трехмерное расположение атомов внутри молекулы. Он способен предсказать и понять молекулярную структуру молекулы, потому что многие свойства вещества определяются его геометрией. Примерами этих свойств являются полярность, магнетизм, фаза, цвет и химическая реактивность. Молекулярную геометрию можно также использовать для прогнозирования биологической активности, разработки лекарств или расшифровки молекулы молекулы.
Рис. 1. Схема перекрывания 1s-электронов в молекуле водорода.
Метод молекулярных орбиталей
ММО представляет собой естественное распространение модели атома, как системы из ядра и электронных оболочек, на случай молекулы. Вся молекула рассматривается как единое целое, состоящее из ядер (вывших атомов) и электронов (ранее принадлежавших атомам. Все электроны являются общими для всех ядер, т.е. химические связи – многоцентровые, каждая связь простирается между всеми ядрами. в той или иной степени. Состояние электронов в молекуле описывается решением соответствующего уравнения Шредингера для молекулярной системы.
Трехмерная структура молекулы определяется ее валентными электронами, а не ее ядром или другими электронами атомов. Самыми внешними электронами атома являются его валентные электроны. Валансные электроны - это электроны, которые чаще всего участвуют в образовании связей и создании молекул.
Пар электронов распределяется между атомами в молекуле и удерживает атомы вместе. Эти пары называются «пары объединений». Вот график, который описывает обычную геометрию молекул на основе их поведения связывания. Чтобы использовать этот ключ, сначала извлеките структуру Льюиса из молекулы. Подсчитайте, сколько пар электронов присутствует, включая пары связывания и одиночные пары.
Насколько малыми являются наименьшие частички вещества? Существует ли отличие между молекулами одного и того же вещества? Можно ли сосчитать молекулы в булавочной головке? Эти и другие вопросы мы обсудим подробнее и вместе найдем ответы.
1. Различаем атом и молекулу
Из предыдущего курса «Природоведение» вы уже знаете, что все вещества состоят из мелких частичек - молекул и атомов. Вы также знаете, что первичные составные части вещества - атомы - имеют специальные названия и символы для обозначения каждого из видов атомов. Например: водород (H), ртуть (Hg), кислород (О), углерод (С). Атомы разных видов отличаются друг от друга по своим химическим свойствам и массе. С физической величиной под названием «масса» вы уже познакомились в § 9. Что такое «химические свойства», вы узнаете из курса химии.
Относитесь к двойным и тройным связям, как к парам одного электрона. И указывает количество одиночных пар электронов. Границы связи прогнозируются в следующем порядке. Есть две пары электронов вокруг центрального атома в молекуле с линейной молекулярной геометрией, 2 пары связывающих электронов и 0 одиночных пар. Идеальный угол соединения составляет 180 °.
Вы можете использовать структуры Льюиса для прогнозирования молекулярной геометрии, но лучше всего проверить эти предсказания экспериментально. Различные аналитические методы могут быть использованы для представления молекул и изучения их вибрации и поглощения вращения. Примеры включают рентгеновскую кристаллографию, нейтронную дифракцию, инфракрасную спектроскопию, рамановскую спектроскопию, дифракцию электронов и микроволновую спектроскопию. Наилучшее определение структуры производится при низкой температуре, поскольку увеличение температуры дает молекулам больше, что может привести к конформационным изменениям.
По положению на 2005 год науке известны только 116 различных видов атомов. «He может быть,- возразите вы.- Как это, только 116? Каждый из нас с легкостью перечислит 200-300, а может быть, и больше различных веществ». Да, действительно, в мире существуют миллионы разных веществ. Как же соединить существование только 116 различных видов атомов с миллионами разных веществ? Дело в том, что вещества по большей части состоят из молекул.
Рис. 2.11. Модели молекул некоторых веществ: а - метана (CH 4); б - серной кислоты (H 2 SO 4); в - воды (H 2 O). (Синие шарики - атомы водорода, красные - кислорода, зеленые - серы, желтые - углерода.)
Молекулой называется наименьшая частичка вещества, имеющая его основные химические свойства и состоящая из атомов.
Ситуация с разными веществами очень похожа на составление тысяч разных слов из «только» 32 различных букв алфавита. В этом сравнении каждая буква - это, так сказать, отдельный атом, а каждое слово соответствует молекуле, т.е. определенному веществу .
На рис. 2.11, а вы видите схематическое изображение молекулы метана, состоящей из пяти атомов: четырех атомов водорода и одного атома углерода. Пользуясь нашей аналогией,- это слово из пяти букв. На рис. 2.11, б приведена схема более сложной молекулы серной кислоты, состоящей из семи атомов. Аналог этой молекулы - слово из семи букв. Из приведенных примеров понятно, что каждая новая молекула (новая комбинация атомов) соответствует новому веществу.
2. Знакомимся с простыми и сложными веществами
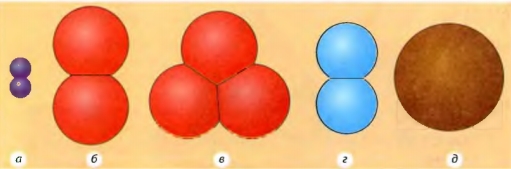
Продолжим нашу аналогию сравнения веществ со словами. Вы, наверное, знаете, что рядом с обычными словами, состоящими из нескольких разных букв, мы иногда произносим и слова с использованием только одной буквы (например, «я», «а-а...», «у-у-у...»)... Так же и с веществами. Некоторые из них состоят только из одного вида атомов (одного химического элемента) и потому называются простыми (см. рис. 2.12). Примерами таких веществ является углерод, железо и др.
Совершенно очевидно, что слов, состоящих из нескольких букв, намного больше, чем слов из одной буквы. Так же и с веществами. Чаще всего в повседневной жизни мы сталкиваемся с веществами, молекулы которых состоят из атомов нескольких различных видов. Эти вещества так и называются - сложные (см. рис. 2.11).

- Контрольные вопросы
1. Сколько разных видов атомов известно науке? Чем они отличаются друг от друга?
2. Какие вещества называют простыми? Приведите примеры.
3. Приведите примеры некоторых сложных веществ. Из каких атомов они состоят?
4. Как можно доказать, что между частичками вещества существуют промежутки?
5. Как показать, что атомы и молекулы очень малы?
6. В переводе с греческого языка «атом» означает «неделимый». Так ли это?
- Упражнения
1. Можем ли мы утверждать, что объем вещества в сосуде равняется сумме объемов молекул, из которых это вещество состоит?
2. Можем ли мы изменить объем тела, не изменяя количества молекул в нем? Как это сделать?
3. Известно, что при одинаковых условиях разные газы в одинаковом объеме содержат одно и то же количество молекул, а плотности газов различны. Чем можно объяснить расхождение в плотности газов?
4. Вычислите, сколько приблизительно молекул можно разместить вдоль отрезка длиной 0,5 мм. Диаметр молекулы считать равным 0,0000000001 м.
5. Известно, что наша Галактика Млечный Путь насчитывает около 9 млрд звезд. Во сколько раз количество молекул в 1 см 3 воздуха, равное (при нормальных условиях) 3 10 10 , больше указанного количества звезд?
6*.Площадь пленки, которую образует на поверхности воды капля масла объемом 0,005 мм 3 , не может превышать 50 см 2 . Какой вывод относительно размера молекул масла следует из этого факта?
- Экспериментальные задания
1. Растворите крупинку краски в воде, налитой в прозрачный сосуд. Отлейте немного окрашенной воды в другой сосуд и долейте чистой воды. Сравните окраску раствора в первом и втором сосудах. Аналогично разбавьте раствор еще несколько раз. Сравните окраску последнего раствора с чистой водой. Объясните результат.
2. Сделайте из цветного пластилина модели двух молекул воды. Составьте из этих моделей модели молекул водорода и кислорода.
- Физика и техника в Украине
Георгий Вячеславович Курдюмов (1902-1996) - выдающийся металлофизик, профессор, академик российской и украинской академий наук. На протяжении длительного времени он работал в Днепропетровске и Киеве, где создал современные научные школы по исследованию физики металлов и сплавов.
Наиболее важными результатами его научной деятельности с практической точки зрения было создание научных основ термической обработки металлов - средств существенного упрочнения сталей - и создание новых материалов с уникальными свойствами.
Академик Курдюмов также известен своими фундаментальными исследованиями кристаллической структуры сталей и открытием так называемого «эффекта Курдюмова».
Президиум HAH Украины ввел премию им. Г. В. Курдюмова.
Физика. 7 класс: Учебник / Ф. Я. Божинова, Н. М. Кирюхин, Е. А. Кирюхина. - X.: Издательство «Ранок», 2007. - 192 с.: ил.
Содержание урока конспект урока и опорный каркас презентация урока интерактивные технологии акселеративные методы обучения Практика тесты, тестирование онлайн задачи и упражнения домашние задания практикумы и тренинги вопросы для дискуссий в классе Иллюстрации видео- и аудиоматериалы фотографии, картинки графики, таблицы, схемы комиксы, притчи, поговорки, кроссворды, анекдоты, приколы, цитаты Дополнения рефераты шпаргалки фишки для любознательных статьи (МАН) литература основная и дополнительная словарь терминов Совершенствование учебников и уроков исправление ошибок в учебнике замена устаревших знаний новыми Только для учителей календарные планы учебные программы методические рекомендации- Семь советов от Отцов Церкви
- Унжа (Костромская область)
- Митрополит алексий московский святитель и чудотворец краткая биография Митрополит алексий годы
- Попробуем разобраться в см - Документ
- Открытия галилея в области астрономии
- Сопливые грибы но не маслята
- Имена мальчиков рожденных в январе Азербайджанские имена родившиеся в январе по гороскопу

 Live Journal
Live Journal Facebook
Facebook Twitter
Twitter