В правой части химического уравнения записывают. Схема химической реакции. Химическое уравнение — Гипермаркет знаний. Запись ионных уравнений
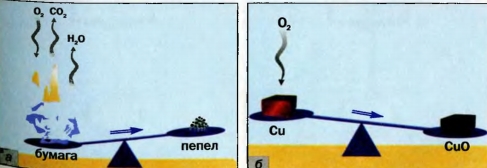
Схема химической реакции.
Существует несколько способов записи химических реакций. Co «словесной» схемой реакции вы ознакомились в § 13.
Приводим еще один пример:
сера + кислород -> сернистый газ.
Ломоносов и Лавуазье открыли закон сохранения массы веществ при химической реакции. Он формулируется так:
Объясним, почему массы пепла и прокаленной меди отличаются от масс бумаги и меди до ее нагревания.
Одним из основных навыков, которые вы будете развивать при изучении химии, является способность уравновешивать химическое уравнение. Написав сбалансированное уравнение, вы будете в хорошем положении для выполнения всех расчетов! Балансирование химического уравнения относится к установлению математической взаимосвязи между количеством реагентов и продуктов. Величины выражаются в виде граммов или молей.
Для того, чтобы написать сбалансированное уравнение, требуется практика. Для этого есть три этапа. Реагенты и продукты разделяют, помещая стрелку между ними, чтобы показать направление реакции. Примените закон сохранения массы, чтобы получить одинаковое количество атомов каждого элемента по каждой стороне уравнения. Начните с балансировки элемента, который появляется только в одном реагенте и продукте. Когда один элемент сбалансирован, переходите к балансу другого, а другое, пока все элементы не будут сбалансированы. Не добавляйте индексы, потому что это изменит формулы.
- Напишите несбалансированное уравнение.
- Химические формулы реагентов приведены на левой стороне уравнения.
- Продукты указаны в правой части уравнения.
- Реакции в равновесии будут иметь стрелки, стоящие в обоих направлениях.
- Баланс химических формул путем размещения коэффициентов перед ними.
- Использовать для газообразных веществ.
- Используется для твердых веществ.
- Используйте для жидкостей.
- Используйте для видов в растворе в воде.
- Напишите состояние материи сразу по формуле описываемого ею вещества.
В процессе горения бумаги принимает участие кислород, который содержится в воздухе (рис. 48, а).
Следовательно, в реакцию вступают два вещества. Кроме пепла, образуются углекислый газ и вода (в виде пара), которые попадают в воздух и рассеиваются.

Рис. 48. Реакции бумаги (а) и меди (б) с кислородом
Транскрипция Настройка уравнения реакции
Напишите сбалансированное уравнение, описывающее эту реакцию. В этом случае на левой стороне уравнения имеются два атома кислорода и только один справа. Это вытесняет атомы водорода из равновесия. Теперь есть два атома водорода слева и четыре атома водорода справа. Чтобы получить четыре атома водорода справа, добавьте коэффициент 2 для газообразного водорода. Обязательно дважды проверьте свою математику! Укажите физические состояния реагентов и продуктов. Для этого вам нужно знать свойства различных соединений или вам нужно рассказать, какие фазы для химических веществ в реакции. Это сбалансированное уравнение реакции. Помните, что на одной стороне реакции нет элементов, а не на другой. Всегда рекомендуется проверять, подсчитывая количество атомов каждого элемента, чтобы убедиться, что вы правильно сбалансировали свое уравнение. Это был простой пример, используя сохранение массы. Для реакций с участием ионов также будет начато сохранение заряда. Посмотрите на уравнение и посмотрите, какие элементы не сбалансированы. . Добрый день, дорогие друзья Химии.
Антуан-Лоран Лавуазье (1743-1794)

Выдающийся французский химик, один из основателей научной химии. Академик Парижской академии наук. Ввел в химию количественные (точные) методы исследования. Экспериментально определил состав воздуха и доказал, что горение - это реакция вещества с кислородом, а вода - соединение Гидрогена с Оксигеном (1774- 1777).
Запись ионных уравнений
Добро пожаловать на это видео. В нем говорится: «Настройка уравнения реакции для классов 7 и 8». Фильм принадлежит к серии реакций. Если у вас есть предварительные знания, вы должны освоить элемент химических элементов, символ, состав и формулы. Вы должны иметь возможность настроить формулу. Моя цель состоит в том, что после просмотра фильма вы освоите создание простых уравнений реакции. Прежде чем настраивать уравнение реакции, нужно спросить себя: что реагирует и что возникает? Для этого сформулируем словосочетание.
Составил первую таблицу простых веществ (1789), предложив фактически классификацию химических элементов. Независимо от М. В. Ломоносова открыл закон сохранения массы веществ при химических реакциях.

Рис. 49. Опыт, подтверждающий закон Ломоносова - Лавуазье:а - начало опыта; б - окончание опыта
Из словарного уравнения формируем уравнение формулы. Для этого нам нужно знать соответствующие символы и формулы. Потому что это окись монооксида. В тех же местах, что и в словосочетании, плюс и реакционная стрелка также находятся в уравнении формулы. Для этого мы должны считать атомы. У нас есть атом углерода слева и атом углерода справа. У нас есть два атома кислорода слева и один атом кислорода справа. Чтобы привести атомы кислорода вправо до 2, умножим всю правую часть. При этом количество атомов кислорода слева и справа одинаково.
Однако число атомов углерода будет неравным. Чтобы компенсировать, мы умножаем число атомов углерода слева. Точки умножения в формуле формулы не записаны. Контроль. У нас есть 2 атома углерода слева и 2 атома углерода справа. Правильно также 2 атома кислорода. По обеим сторонам реакционного уравнения находятся два атома углерода и 2 атома кислорода. Мы сбалансировали уравнение формулы. С каждой стороны уравнения имеем 2 атома кислорода. Слева у нас 4 атома кислорода, справа. 4 - четное число, 3 - нечетное число.
Их масса превышает массу кислорода. Поэтому масса пепла меньше массы бумаги.
При нагревании меди кислород воздуха «соединяется» с ней (рис. 48, б). Металл превращается в вещество черного цвета (его формула - CuO, а на звание - купрум(П) оксид). Очевидно, что масса продукта реакции должна превышать массу меди.
Прокомментируйте опыт, изображенный на рисунке 49, и сделайте вывод.
Справа мы получаем четное число атомов кислорода, умножая 3 на 2. Итак, теперь справа находятся 6 атомов кислорода. Ссылки есть только там, поэтому мы должны заполнить. Потому что тогда мы не просто уравновешивали атомы кислорода. Атомы серы теперь одинаковы с обеих сторон, а именно: Мы отмечаем: по обеим сторонам реакционного уравнения каждый из 6 атомов кислорода и 2 атома серы. Мы закончили балансировку. Сравним: слева 2 атома кислорода, справа 3 атома кислорода. По обе стороны уравнения реакции находятся 4 атома алюминия и 6 атомов кислорода.
Число атомов кислорода слева и справа различно. Как и в предыдущем примере, мы формируем наименьшее общее кратное. Теперь у нас есть атом фосфора слева, а справа мы умножаем атомы фосфора на 4, и мы закончили. По каждой стороне реакционного уравнения каждый 4 атома фосфора и 10 атомов кислорода. Для этой цели индивидуальные шаги, настройка словарного уравнения, преобразование в формульное уравнение, проверка того, все ли слева и справа слева, и компенсация подробно объясняются. Последний шаг - проверить, все ли правильно.
Закон как форма научных знаний.
Открытие законов в химии, физике, других науках происходит после проведения учеными многих экспериментов и анализа полученных результатов.
Закон - это обобщение объективных, независимых от человека связей между явлениями, свойствами и т. д.
Закон сохранения массы веществ при химической реакции - важнейший закон химии. Он распространяется на все превращения веществ, которые происходят и в лаборатории, и в природе.
Химические законы дают возможность прогнозировать свойства веществ и протекание химических реакций, регулировать процессы в химической технологии.
Для того чтобы объяснить закон, выдвигают гипотезы, которые проверяют с помощью соответствующих экспериментов. Если одна из гипотез подтверждается, на ее основе создают теорию. В старших классах вы ознакомитесь с несколькими теориями, которые разработали ученые-химики.
Общая масса веществ при химической реакции не изменяется потому, что атомы химических элементов во время реакции не возникают и не исчезают, а происходит только их перегруппировка. Другими словами,
количество атомов каждого элемента до реакции равно количеству его атомов после реакции. На это указывают схемы реакций, приведенные в начале параграфа. Заменим в них стрелки между левыми и правыми частями на знаки равенства:
Такие записи называют химическими уравнениями.
Химическое уравнение - это запись химической реакции с помощью формул реагентов и продуктов, которая согласуется с законом сохранения массы веществ.
Существует много схем реакций^ которые не соответствуют закону Ломоносова - Лавуазье.
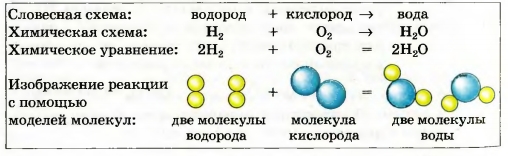
Например, схема реакции образования воды:
H 2 + O 2 -> H 2 O.
В обеих частях схемы содержится одинаковое количество атомов Гидрогена, но разное количество атомов Оксигена.
Превратим эту схему в химическое уравнение.
Для того чтобы в правой части было 2 атома Оксигена, поставим перед формулой воды коэффициент 2:
H 2 + O 2 -> H 2 O.
Теперь справа стало четыре атома Гидрогена. Чтобы такое же количество атомов Гидрогена было и в левой части, запишем перед формулой водорода коэффициент 2. Получаем химическое уравнение:
2Н 2 + O 2 = 2Н 2 0.
Таким образом, чтобы превратить схему реак ции в химическое уравнение, нужно подобрать коэффициенты для каждого вещества (в случае необходимости), записать их перед химическими формулами и заменить стрелку на знак равенства.
Возможно, кто-то из вас составит такое уравнение: 4Н 2 + 20 2 = 4Н 2 0. В нем левая и правая части содержат одинаковые количества атомов каждого элемента, но все коэффициенты можно уменьшить, разделив на 2. Это и следует сделать.
Это интересно
Химическое уравнение имеет много общего с математическим.
Ниже представлены различные способы записи рассмотренной реакции.
Превратите схему реакции Cu + O 2 -> CuO в химическое уравнение.
Выполним более сложное задание: превратим в химическое уравнение схему реакции
В левой части схемы - I атом Алюминия, а в правой - 2. Поставим перед формулой металла коэффициент 2:
Атомов Сульфура справа в три раза больше, чем слева. Запишем в левой части перед формулой соединения Сульфура коэффициент 3:
Теперь в левой части количество атомов Гидрогена равно 3 2 = 6, а в правой - только 2. Для того чтобы и справа их было 6, поставим перед формулой водорода коэффициент 3 (6: 2 = 3):
Сопоставим количество атомов Оксигена в обеих частях схемы. Они одинаковы: 3 4 = 4 * 3. Заменим стрелку на знак равенства:
Выводы
Химические реакции записывают с помощью схем реакций и химических уравнений.
Схема реакции содержит формулы реагентов и продуктов, а химическое уравнение - еще и коэффициенты.
Химическое уравнение согласуется с законом сохранения массы веществ Ломоносова - Лавуазье:
масса веществ, вступивших в химическую реакцию, равна массе веществ, образовавшихся в результате реакции.
Атомы химических элементов во время реакций не появляются и не исчезают, а происходит лишь их перегруппировка.
?
105. Чем отличается химическое уравнение от схемы реакции?
106. Расставьте пропущенные коэффициенты в записях реакций:
107. Превратите в химические уравнения такие схемы реакций:
108. Составьте формулы продуктов реакций и соответствующие химические уравнения:
109. Вместо точек запишите формулы простых веществ и составьте хими ческие уравнения:
Примите во внимание, что бор и углерод состоят из атомов; фтор, хлор, водород и кислород - из двухатомных молекул, а фосфор (белый) - из четырехатомных молекул.
110. Прокомментируйте схемы реакций и превратите их в химические уравнения:
111. Какая масса негашеной извести образовалась при длительном прока ливании 25 г мела, если известно, что выделилось 11 г углекислого газа?
Попель П. П., Крикля Л. С., Хімія: Підруч. для 7 кл. загальноосвіт. навч. закл. - К.: ВЦ «Академія», 2008. - 136 с.: іл.
Содержание урока конспект урока и опорный каркас презентация урока интерактивные технологии акселеративные методы обучения Практика тесты, тестирование онлайн задачи и упражнения домашние задания практикумы и тренинги вопросы для дискуссий в классе Иллюстрации видео- и аудиоматериалы фотографии, картинки графики, таблицы, схемы комиксы, притчи, поговорки, кроссворды, анекдоты, приколы, цитаты Дополнения рефераты шпаргалки фишки для любознательных статьи (МАН) литература основная и дополнительная словарь терминов Совершенствование учебников и уроков исправление ошибок в учебнике замена устаревших знаний новыми Только для учителей календарные планы учебные программы методические рекомендацииУравнение химической реакции даёт качественную и количественную информацию о химической реакции, реагентах и продуктах реакции; его составление основывается на законах стехиометрии , в первую очередь, законе сохранения массы веществ в химических реакциях. Кроме уравнений используются полные и краткие схемы химических реакций - условные записи, дающие представление о природе реагентов и продуктов, то есть качественную информацию о химической реакции.
O 2 + 2 H 2 → 2 H 2 O
История
Сначала не было представления о химических уравнениях, ещё не были известны основные химические законы, но уже в алхимический период развития химии начали обозначать химические элементы символами.
С дальнейшим развитием химии менялись представления о символике химических элементов ,ской записи, используя химические формулы . Первым предложил использовать химические уравнения Жан Бегун (Jean Beguin) в 1615 году в одном из первых учебников по химии Tyrocinium Chymicum («Начала химии» ).
Конец XVIII-начало XIX вв. - становление законов стехиометрии . У истоков этих исследований стоял немецкий ученый И. В. Рихтер . В студенческие годы на него большое впечатление произвели слова его учителя - философа И. Канта о том, что в отдельных направлениях естественных наук истинной науки столько, сколько в ней математики. Рихтер посвятил свою диссертацию использованию математики в химии. Не будучи в сущности химиком, Рихтер ввел первые количественные уравнения химических реакций, стал использовать термин стехиометрия .
Правила составления
Для составления уравнений химических реакций, кроме знания формул реагентов и продуктов реакции, необходимо верно подобрать коэффициенты. Это можно сделать, используя несложные правила . В левой части уравнения записывают формулы (формулу) веществ, вступивших в реакцию, соединяя их знаком «плюс». В правой части уравнения записывают формулы(формулу) образовавшихся веществ, также соединенных знаком «плюс». Между частями уравнения ставят знак равенства или стрелку. Затем находят коэффициенты - числа, стоящие перед формулами веществ, чтобы число атомов одинаковых элементов в левой и правой частях уравнения было равным.
Для обозначения различных типов реакций используются следующие символы:
Запись ионных уравнений
Ионные уравнения - это химические уравнения, в которых
- Манная каша на молоке: пропорции и рецепты приготовления Манная каша 1 порция
- Суп-пюре из брокколи с сыром Рецепт крем супа из брокколи с сыром
- Гороскоп: характеристика Девы, рождённой в год Петуха
- Причины выброса токсичных веществ Несгораемые углеводороды и сажа
- Современный этап развития человечества
- Лилия яковлевна амарфий Могила лилии амарфий
- Значение имени мариям Имя марьям значение происхождение

 Live Journal
Live Journal Facebook
Facebook Twitter
Twitter