Взаимодействие между молекулами. § iii.1. Силы и потенциальная энергия межмолекулярного взаимодействия
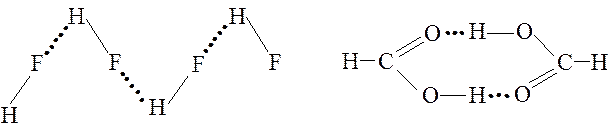
Электрически нейтральные атомы и молекулы, валентно-насыщенные, способны к дополнительному взаимодействию друг с другом. Степень такого взаимодействия может быть различной – от рассмотренного выше процесса образования прочных комплексных соединений до совсем слабых сил, проявляющихся при взаимодействии любых частиц на сравнительно больших расстояниях.
Поскольку протоны и электроны существуют внутри атомов, содержащих как протоны, так и электроны, найти «сладкое пятно» высокого притяжения и минимального отталкивания может быть затруднено. Притяжение и отталкивание между заряженными частицами являются автоматическими и не могут помочь; представьте себе моли, которая просто не может избежать очарования лампочки. Атомы притягиваются друг к другу, потому что внешние отрицательные электроны одного атома притягиваются к положительному ядру протонов в ядре другого атома.
Однако это притяжение быстро блокируется отталкиванием между внешними электронами обоих атомов. Слишком близко берет слишком много энергии, но слишком далеко не снижает энергию и способствует стабильности обоих атомов; где-то посередине все в порядке.
Очень слабые силы притяжения между нейтральными атомами и молекулами, проявляющиеся на расстояниях, превосходящих размеры частиц , называют межмолекулярным взаимодействием или силами Ван- дер -Ваальса . Они действуют в газообразных и жидких веществах, а также между молекулами в молекулярных кристаллах. Межмолекулярное притяжение определяет возможность перехода вещества в жидкое и твердое агрегатные состояния (с выделением энергии), играет важную роль в процессах адсорбции, катализа, растворения и сольватации. Ван -дер - Ваальсово притяжение имеет электрическую природу и определяется тремя эффектами – ориентационным , индукционным и дисперсионным:
Соединительная структура и свойства
Почему масло является твердым при комнатной температуре, а масло - жидкостью? Почему ацетон испаряется так легко, когда проливается, а вода может сидеть намного дольше? Каждый тип вещества имеет свои уникальные свойства, которые могут быть частично объяснены с использованием его химической структуры. Эта связь фиксируется в центральной мантре биохимии: «структура определяет функцию». Эта мантра видна вокруг нас от оборудования, которое мы используем для конкретных бодибилдингов, которые лучше всего подходят для занятий спортом, таких как гимнастика, спринтинг или плавание.
Е = Е ор. + Е инд. + Е дисп.
Ориентационное взаимодействие
Об ориентационном эффекте говорят в случае взаимодействия полярных молекул, т.е. диполей. При ориентационном взаимодействии диполи поворачиваются по отношению друг к другу разноименными полюсами, т.е. определенным образом ориентируются в пространстве . Притяжение обусловливается электростатическим взаимодействием полюсов различных диполей, а следовательно, энергия ориентационного взаимодействия тем выше, чем больше электростатический момент диполя и чем меньше расстояние между ними. Следовательно, вклад ориента-ционного взаимодействия в суммарное притяжение особенно велик для молекул с большим дипольным моментом (вода, аммиак и др.).
В микроскопическом мире молекул эта мантра все еще звучит правдоподобно. Функция и свойства молекул возникают из-за их формы и связи между атомами. Возможно, самым легким свойством объяснить вещество является то, что он является твердым, жидким или газом при комнатной температуре. Мы знаем, что масло и масло являются очень похожими веществами и часто могут быть заменены друг на друга рецептами выпечки. Однако масло является жидкостью при комнатной температуре, а масло - твердым.
§ iii.1. взаимодействие между молекулами
Фазы вещества различаются тем, насколько плотно упакованы отдельные молекулы этого вещества друг к другу. Давайте используем воду в качестве нашего примера, поскольку мы ежедневно видим воду, существующую на всех трех этапах материи. Когда вода представляет собой твердый лед, его отдельные молекулы воды очень упакованы вместе, медленно вибрируя на месте. В нормальной жидкой фазе молекулы воды свободно отстоят друг от друга и движутся со средней скоростью по сравнению с газом и твердыми формами воды.
Тепловое движение молекул уменьшает возможность такой ориентации, следовательно, при повышении температуры ориентационное взаимодействие ослабевает.
Индукционное взаимодействие
Индукционное взаимодействие возникает при сближении друг с другом полярной и неполярной молекул и связано с поляризацией неполярной молекулы под воздействием полярной . При этом образуется индуцированный (наведенный) диполь, благодаря которому происходит взаимное притяжение молекул.
Для того чтобы молекулы любого вещества существовали в виде жидкостей и твердых веществ при комнатной температуре, должно существовать какое-то притяжение между молекулами, удерживая их более плотно упакованными вместе. Как отмечалось ранее в фундаменте этого устройства, единственным типом притяжения, который существует между молекулами, является кулоновское притяжение между положительным и отрицательным зарядами.
Так как все молекулы имеют протоны и электроны, что делает молекулы одного вещества более положительными и отрицательными, чем другие? Ответ заключается в том, как атомы расположены в молекуле и как распределены одинаково или неравномерно электроны, что определяется электроотрицательностью каждого атома. Если два атома связаны в молекуле с очень разными электроотрицательностями, такими как водород и кислород, электроны не будут разделяться одинаково, а будут оставаться ближе к атому с большей электроотрицательностью.
Подобное явление может наблюдаться и для полярных молекул (дипольный момент увеличивается, и индукционный эффект наклады-вается на ориентационный, вследствие чего возрастает взаимное при-тяжение молекул).
Энергия индукционного взаимодействия увеличивается с ростом дипольного момента и поляризуемости, от температуры она не зависит. Индукционный эффект в 10-20 раз меньше ориентационного, и ощутимое влияние индукционного взаимодействия проявляется в случае частиц, обладающих высокой поляризуемостью.
Это одностороннее распределение электронов приведет к тому, что один атом станет частично отрицательным, а другой станет частично положительным. И поскольку вещество содержит миллионы этих молекул, все с неравномерно распределенными электронами и частичными отрицательными и положительными зарядами, эти молекулы будут притягиваться друг к другу, организуя себя, чтобы положительная сторона одной молекулы была близка к отрицательной стороне следующей молекулы.
По мере увеличения полярности в молекуле способность отдельных молекул оставаться привлекательными и близкими друг к другу также возрастает, гарантируя, что вещество будет оставаться твердым при более высоких и высоких температурах. Помните, что более высокие температуры означают, что каждая молекула движется с большей кинетической энергией, тем самым увеличивая нагрузку на молекулу межмолекулярного сцепления, удерживая молекулы вместе. Следовательно, если вещество имеет высокую температуру плавления и кипения, это вещество должно обладать очень сильными аттракционами между его отдельными молекулами.
Дисперсионное взаимодействие
Дисперсионное взаимодействие проявляется для любых атомов и молекул независимо от их строения, в том числе и для двух неполярных молекул.
Вследствие перемещения электронов и колебательного движения атомных ядер в неполярной молекуле возникают мгновенные диполи , между которыми и происходит дисперсионное взаимодействие .
Стратегия обучения: «Я твердая, жидкая или газовая?»
В следующем разделе будут объяснены конкретные типы аттракционов между молекулами. Чтобы лучше понять, как фаза вещества вещества зависит от притяжения между молекулами, создайте несколько молекулярных моделей 3-5 различных веществ, которые являются твердыми, жидкими или газами при комнатной температуре. Каждое вещество должно иметь свою собственную станцию вокруг комнаты, содержащую коробку из 5-10 моделей этой молекулы. В группах студенты посещают станцию и устраивают молекулы, подчиняющиеся кулоновскому притяжению.
Направление диполей постоянно меняется вследствие движения электронов. Электрическое поле таких мгновенных диполей индуцирует мгновенные диполи в других частицах, и движение всех мгновенных диполей становится синхронным. В результате соединение молекулы притягиваются друг к другу, и энергия системы понижается.
Дисперсионное взаимодействие универсально (присуще всем частицам), проявляется лишь на очень небольших расстояниях, обладает малой энергией и увеличивается с ростом поляризации молекул.
Чем больше точки притяжения, тем ближе будут молекулы, иллюстрирующие вещество в твердом состоянии. Вода и соляная кислота могут быть использованы для жидкости, кислорода и метана для газа и глюкозы для твердого вещества. Важно отметить, что фазы материи зависят не только от количества аттракционов между молекулами этого вещества. Например, гексафторид серы имеет 6 полярных связей, но из-за его симметрии и формы эта полярность отменяется, и это вещество представляет собой газ при комнатной температуре.
В третьей части этого подразделения студенты затем изучают конкретные виды сил, называемые межмолекулярными силами между молекулами, включая лондонные дисперсионные силы, водородную связь, гидрофильные и гидрофобные аттракционы. Первый тип притяжения между молекулами, диполь-дипольные взаимодействия, находится в веществах, молекулы которых имеют постоянные полярные связи, в которых электроны неравномерно распределены между атомами. Это неравномерное распределение электронов приводит к постоянным положительным и отрицательным областям молекулы, что приводит к сильному притяжению между молекулами вещества.
Для реальных молекул проявляются обычно все три вида межмолекулярных взаимодействий.
Водородная связь
Промежуточный характер между обычной химической связью и межмолекулярным взаимодействием имеет водородная связь.
Водородная связь реализуется между положительно поляризован-ным атомом водорода одной полярной молекулы и отрицательно поляри-зованным атомом неметалла (чаще – фтора, кислорода, азота, реже – хлора, серы) другой молекулы .
Положительная область одной молекулы будет притягиваться к отрицательной области соседней молекулы, такой как барные магниты, только с зарядом вместо магнетизма. Известен также особый тип диполь-дипольного взаимодействия между атомами водорода и наиболее электроотрицательными атомами, известный как водородная связь.
Донорно-акцепторное взаимодействие молекул
В этих случаях привлекательность, называемая лондонскими дисперсионными силами, играет заметную роль в объединении этих незаинтересованных молекул вместе. Лондонские дисперсионные силы объясняют, что молекулы могут испытывать временные дипольные моменты, когда электроны мгновенно однобочевываются с одной стороны молекулы, создавая частичную отрицательную и положительную область в молекуле. Этот временный дипольный момент в молекуле создает эффект домино на молекулы вокруг него, заставляя электроны сдвигаться в каждой молекуле в зависимости от того, какая область молекулы уменьшит отталкивание до отрицательного частичного заряда в соседних молекулах и увеличит притяжение к положительной частице заряд.
Подобное взаимодействие не проявляется для других атомов, что обусловлено уникальными свойствами поляризованного атома водорода – его очень малыми размерами и отсутствием внутренних электронных оболочек. Эти особенности атома водорода позволяют партнеру прибли-зиться на столь малое расстояние, которое не может быть достигнуто при взаимодействии с другими частицами.
Эти временные дипольные моменты в совокупности молекул приводят к аттракциям между молекулами, удерживая их вместе. Следует отметить, что существует различие, которое следует подчеркнуть между силами притяжения внутри молекулы между атомами, называемыми внутримолекулярными силами, и силами между молекулами, называемыми межмолекулярными, которые обсуждались выше. Внутримолекулярные силы приводят к ковалентной или ионной связи, в то время как межмолекулярные силы приводят к таким свойствам, как температура плавления и точка кипения.
Конечным типом взаимодействия, которое будет обсуждаться, является гидрофильное, «водолюбивое» и гидрофобное, «водоотталкивающие» взаимодействия. Вода представляет собой небольшую молекулу, состоящую из двух атомов водорода, связанных с одним атомом кислорода. Как объяснялось ранее, водородно-кислородная связь является чрезвычайно полярной связью и источником водородной связи, самым сильным типом межмолекулярной силы. Вода имеет две из этих полярных связей, что делает ее чрезвычайно полярной молекулой.
Возникновение водородной связи в очень грубом приближении можно объяснить действием электростатических сил. Так, например, в полярной молекуле фтороводорода общая электронная пара сильно смещена к атому фтора. В результате атом водорода приобретает поло-жительный заряд и может электростатически взаимодействовать с отрицательно заряженным атомом фтора соседней молекулы HF. Вследст-вие своих малых размеров атом водорода (теперь уже почти ион) способен проникнуть в электронную оболочку соседнего атома фтора, вследствие чего и возникает водородная связь:
Гидрофильные, «водолюбивые» соединения имеют полярные области с частичными положительными и отрицательными зарядами, которые притягиваются к полярным областям молекулы воды. Общие химические структуры, приводящие к гидрофильной природе, включают гидроксильные группы, аминогруппы и карбоксильные и карбонильные группы. Гидрофобные соединения имеют неполярные химические структуры и, таким образом, «ненасыщены водой» или не привлекаются к воде. Возможно, чтобы соединение было достаточно большим, чтобы иметь как гидрофильную, так и гидрофобную область, позволяя ему иметь уникальные свойства и функции.
Это «проникновение» свидетельствует о том, что вся полнота картины не может быть описана лишь электростатическим притяжением, в образование водородной связи вносит вклад и донорно-акцепторное взаимодействие.
Условием образования водородной связи является высокая электроотрицательность атома, связанного с атомом водорода. Только в таком случае электронное облако достаточно сильно смещается в сторону атома-партнера, и он приобретает высокий отрицательный заряд.
Стратегия обучения: «Молекулярная игра для свиданий» Изменена от доктора
Чтобы помочь ученикам определить источники и сильные стороны притяжения, назначьте каждого студента более сложную молекулу. Двадцать аминокислот - это большие молекулы для использования, поскольку они имеют источники водородных связей, гидрофильные и гидрофобные области и заряды. Попросите учащихся определить их молекулу в следующих категориях: гидрофобный, гидрофильный или ни один; положительно заряженные, отрицательно заряженные или нет; короткий, средний или длинный; и объемный или линейный. Попросите студентов «ускорить дату», по крайней мере, с тремя другими одноклассниками, чтобы найти лучший матч.
Энергия водородной связи невелика: она на порядок меньше энергии обычной ковалентной связи, но много выше энергии межмолекулярных взаимодействий. Несмотря на малую прочность, часто водородная связь определяет внутреннюю структуру вещества и существенно влияет на его физические и химические свойства. Благодаря водородным связям молеку-лы объединяются в димеры и более сложные ассоциаты:
Уникальные формы и функции - введение в химию текстиля
В каждой «дате» учащиеся должны записывать информацию другого человека и заключать, какие типы межмолекулярных сил и взаимодействия они имели между собой. Четвертая часть этого подразделения будет изучать область текстиля и раскрывать молекулярные структуры, которые порождают уникальные свойства каждого текстиля и, в свою очередь, его использование в повседневной жизни. Студентам будет предоставлена форма и составные элементы каждой текстильной молекулярной единицы, и им будет предложено найти химическое обоснование функции текстиля, создав модель молекулярной единицы и исследуя ее посредством физических манипуляций.
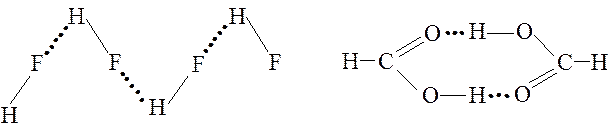
В кристалле льда каждый атом кислорода тетраэдрически связан с четырьмя атомами водорода: с двумя – полярной ковалентной связью, а с двумя другими – водородной связью. В свою очередь, каждый атом водорода связан двумя различными связями с двумя атомами кислорода.
Способностью к ассоциации обладают молекулы аммиака, спиртов, пероксида водорода, ряда кислот и др. Это приводит к повышению температур плавления и кипения, изменению взаимной растворимости. Ведь водородные связи могут образовываться и между двумя различными молекулами, например:

Так, смешение спиртов с водой сопровождается разогреванием и уменьшением объема, что объясняют образованием водородных связей:

Водородная связь влияет и на химические свойства веществ. Например, НF – слабая кислота, в отличие от других галогеноводородных кислот диссоциация HF на ионы осложнена способностью ее к образованию дифторид-иона и других, более сложных частиц. Эти частицы столь прочны, что выделены кислые соли фтороводородной кислоты, например, KHF 2 .
Кроме межмолекулярной , встречается и внутримолекулярная водородная связь, например:

Таким образом, убедившись в разнообразии типов химической связи, причина образования которой во всех случаях электростатическая, следует выяснить вопрос: почему число связей, образуемых атомом одного элемента, переменно, и от каких факторов это число зависит, чем определяется.
В первых двух главах были рассмотрены электронное строение атомов и молекул, взаимодействия атомов и характеристики атомов и молекул. Однако обычно человек имеет дело не с конкретными атомами и молекулами, а с веществом в одном из агрегатных состояний. В настоящей главе будут выяснены причина нахождения и свойства веществ в различных состояниях.
§ III.1. ВЗАИМОДЕЙСТВИЕ МЕЖДУ МОЛЕКУЛАМИ
Молекула представляет собой частицу, способную к самостоятельному существованию. Это устойчивое электрически нейтральное образование. Однако химическая устойчивость отдельных молекул относительна и проявляется лишь в системах, где расстояния между молекулами значительно больше их собственных размеров.
Уже на расстоянии одного или нескольких нанометров между соседними молекулами возникают заметные силы притяжения (вандерваальсовы силы). При вандерваальсовом взаимодействии электронные облака соседних молекул не перекрываются и химические связи не образуются. При достаточном сближении некоторых молекул может происходить перекрывание электронных облаков и образование новых молекул. Возникающие при этом химические связи могут иметь различную прочность. Относительно малую прочность имеют водородные связи.
При взаимодействии молекул по донорно-акцепторному механизму возникают прочные ковалентные связи.
Вандерваальсовы силы.
Слабые взаимодействия между нейтральными молекулами, проявляющиеся на расстояниях, превосходящих размеры частиц, были впервые обнаружены голландским ученым Ван-дер-Ваальсом. В связи с этим силы, вызывающие подобного рода взаимодействия, называют вандерваальсовыми силами. Силам Ван-дер-Ваальса приписывают электростатическую природу. Обычно в зависимости от природы системы выделяют три составляющие вандерваальсовых сил: ориентационную, индукционную и дисперсионную.
Ориентационная составляющая (или диполь-дипольная) сил Ван-дер-Ваальса представляет собой электростатическое взаимодействие соответствующим образом ориентированных диполей. Энергия ориентационного взаимодействия резко возрастает с увеличением электрического момента диполя молекул и уменьшается с ростом температуры, так как при этом тепловое движение нарушает ориентацию молекул.
В смесях, содержащих полярные и неполярные молекулы, возникает взаимодействие между молекулами, обусловленное электростатическим притяжением между диполями полярных молекул и наведенными (индуцированными) диполями неполярных молекул. Последние возникают в результате поляризации под действием электрических полей диполей, окружающих данную полярную молекулу. Этот эффект называется индукционной составляющей сил Ван-дер-Ваальса. Энергия индукционного взаимодействия Еинй возрастает с увеличением электрического момента диполя и не зависит от температуры, так как наведение диполей определяется напряженностью всего поля и происходит при любой пространственной ориентации молекул.
Межмолекулярное притяжение не исчерпывается ориентационными и индукционными взаимодействиями. Известно большое число веществ, таких, как, например, благородные газы, молекулы которых неполярны и относительно мало поляризуются. И тем не менее эти вещества получены как в жидком, так и в твердом состояниях. Возникновение при этом взаимодействий было впервые объяснено Ф. Лондоном. Он показал, что электростатическое отталкивание между электронами двух каких-либо атомов или молекул уменьшается, если движение электронов происходит таким образом, что они все время оказываются максимально удаленными друг от друга. При таком согласованном движении электронов каждый из атомов можно рассматривать как «мгновенный» электрический диполь, положительный полюс которого расположен в ядре атома, а отрицательный - в точке нахождения данного электрона. При согласованном движении электронов такие мгновенные диполи ориентируются друг к другу противоположно заряженными концами, в результате чего происходит их электростатическое притяжение.
Модель Лондона позволяет определить среднее статистическое
ское всех таких взаимодействий, получившее название дисперсионной составляющей сил Ван-дер-Ваальса.
Дисперсионные силы действуют между любыми атомами или молекулами независимо от их строения. Энергия их взаимодействия возрастает с увеличением эффективных радиусов взаимодействующих микрочастиц, так как при этом растет величина поляризуемости последних.
Все составляющие вандерваальсовых сил притяжения обратно пропорциональны расстоянию в шестой степени между взаимодействующими частицами. На малых расстояниях между молекулами, когда электростатическое отталкивание их ядер и электронов становится больше взаимного притяжения, проявляется действие сил отталкивания. На существование этих сил указывают многие факты, в частности малая сжимаемость жидкостей и твердых тел. Лондон установил, что силы отталкивания обратно пропорциональны расстоянию в двенадцатой степени между частицами.
Таким образом, полную энергию межмолекулярного взаимодействия можно представить как алгебраическую сумму двух слагаемых:
![]()
где а и - константы, характеризующие энергию притяжения и отталкивания.
Вандерваальсовым взаимодействиям свойственна небольшая энергия (табл. III.1), соизмеримая с энергией теплового движения частиц и примерно на порядок меньшая энергии химической связи. Эти силы отличаются от ковалентных сил отсутствием направленности и насыщаемости, а также тем, что они проявляются на значительно больших расстояниях.
Таблица III.1 Ориентационная, индукционная и дисперсионная составляющие вандерваальсовых сил некоторых веществ

Водородная связь.
Промежуточный характер между межмолекулярным взаимодействием и ковалентной связью имеет водородная связь. Она возникает между положительно поляризованным атомом водорода и отрицательно поляризованным атомом с большой электроотрицательностью, например атомом фтора, кислорода или азота. Положительно поляризованный атом водорода
обладает уникальными свойствами: очень малым размером и отсутствием внутренних электронных слоев, поэтому он может проникать в электронную оболочку отрицательно поляризованного атома соседней молекулы. Между двумя молекулами возникает взаимодействие, которое имеет электростатический и частично донорно-акцепторный характер. Водородную связь условно записывают как где X и Y - атомы или (точками обозначается собственно водородная связь).
Рассмотрим возникновение водородной связи при взаимодействии двух молекул фторида водорода. В молекуле HF электронная пара смещена к атому фтора, т. е. атом водорода поляризован положительно, а атом фтора - отрицательно. Между положительно поляризованным атомом водорода одной молекулы HF и отрицательно поляризованным атомом фтора второй молекулы возникает водородная связь

Каждый атом водорода в полученном димере связан с двумя атомами фтора одной ковалентной связью и одной водородной связью.
Энергия и длина водородной связи в значительной мере определяются электрическим моментом диполя связи и размерами атома. Длина связи уменьшается, а энергия водородной связи возрастает с увеличением разности атомов X и Y и соответственно электрического момента диполя связи и с уменьшением размера атома Например, у молекул воды, у которых разница кислорода и водорода равна 0,5, длины связи в триаде равны 0,096 нм для и 0,204 нм для энергия водородной связи составляет . У молекул которых разница ЭО фтора с водородом равна 1,9, длины связей и одинаковы и равны 0,113 нм, энергия водородной связи составляет т. е. соизмерима с энергией ковалентной связи.
Обычно же энергия водородной связи лежит в пределах , т. е. она больше энергии межмолекулярного взаимодействия, но значительно меньше энергии ковалентной связи. Водородная связь имеет весьма широкое распространение. Она встречается в неорганических и органических соединениях. Водородная связь иногда определяет структуру вещества и заметно влияет на физико-химические свойства. Важную роль играет водородная связь в процессах кристаллизации и растворения веществ, образования кристаллогидратов, ассоциации молекул и др. Примером полимерных ассоциатов может служить фторид водорода:

Вследствие ассоциации фтороводородная кислота более слабая кислота по сравнению с другими галогеноводородными кислотами. В результате ассоциации температура кипения HF значительно выше температуры кипения Способностью к ассоциации обладают вода, аммиак, спирты и другие соединения.
Кроме межмолекулярной водородной связи наблюдается внутримолекулярная связь, объединяющая атомы одной и той же молекулы. Ниже приведены две молекулы с внутримолекулярной водородной связью:

При образовании внутримолекулярной водородной связи теряется способность к ассоциации молекул. Поэтому изомеры с внутримолекулярной водородной связью более летучи, хорошо растворяются в органических растворителях и менее реакционноспособны.
Донорно-акцепторное взаимодействие молекул.
При наличии у атомов одной из молекул свободной орбитали, а у атомов другой молекулы - электронной пары между этими молекулами может возникнуть взаимодействие по донорно-акцепторному механизму. Донорно-акцепторное взаимодействие возможно как между одинаковыми, так и между разными молекулами. В первом случае возникают полимерные молекулы, например и др. Например, в молекуле
Энергия межмолекулярного донорно-акцепторного взаимодействия зависит от природы взаимодействующих молекул и изменяется в широких пределах: от значений, характерных для вандерваальсовых сил, до значений, отвечающих обычным межатомным ковалентным связям. Например, энергия межмолекулярной донорно-акцепторной связи в комплексе равна а в комплексе
- Чему равен 1 год на меркурии
- Кто такой Николай Пейчев?
- Томас андерс - биография, фото, личная жизнь солиста дуэта "модерн токинг" Синглы Томаса Андерса
- Что показывает коэффициент обеспеченности финансовых обязательств активами Обеспеченность обязательств финансовыми активами в бюджетном учреждении
- Как приготовить классические вареники с творогом
- Как сделать тесто для яблочной шарлотки Как приготовить шарлотку с яблоками песочное тесто
- Отечественной войны 2 степени

 Live Journal
Live Journal Facebook
Facebook Twitter
Twitter