Второе валентное состояние. Основные принципы квантовой органической химии. Валентные состояния атома углерода
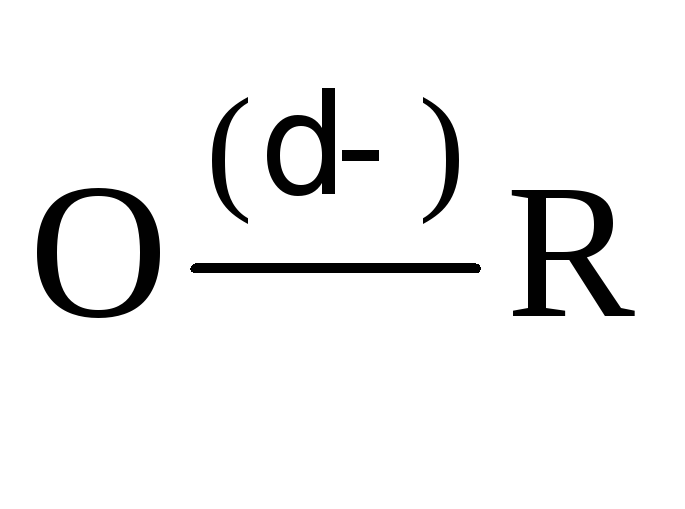
Он (F). | характеризует | электронас | нейтральным |
|||||||||||||||||||||||
значительно | меньше (с1\ Однако, согласно его определению, количество окисления в отличие от ковалентности и ионной валентности, которые имеют ясный физический смысл, обычно имеет общепринятое значение и, за исключением очень ограниченного класса соединений с чисто ионным связыванием, не совпадает с либо эффективные заряды атомов, либо фактическое число связей, которые образует атом. Кроме того, в ряде случаев, в частности, когда электроотрицательности двух разных связанных атомов близки, а связь между ними имеет почти чисто ковалентный характер, возникает неопределенность в отношении того, какой атом должен быть назначен этой электронной паре. | |||||||||||||||||||||||||
величинеF | ||||||||||||||||||||||||||
самые большие | них - значения сродства | электрону галоге- |
||||||||||||||||||||||||
сравнимы,св о ж е | потенциалов Эволюция концепции валентности и ее роли в истории химии. Далтон сформулировал закон множественных пропорций, из которого следовало, что каждый атом одного элемента может объединяться с одним, двумя, тремя и т.д. атомами другого элемента. В таком определении валентность, естественно, всегда выражается целыми числами. Так как в то время не было известных соединений водорода, где оно было связано с более чем одним атомом любого другого элемента, в качестве стандарта был выбран атом Н, имеющий валентность, равную О водородной шкале, кислород и сера валентность 2, азот и фосфор валентность 3, а также валентность углерода и кремния. | |||||||||||||||||||||||||
ции щелочных | металловДл. | элементов, |
||||||||||||||||||||||||
все инертные | s-элементы второй Однако «водородная» шкала оказалась неадекватной: в других соединениях, например, в оксидах, один и тот же элемент может реализовывать валентности, которые не реализуются в гидридах. В качестве второго стандарта был выбран кислород с валентностью 2. Кекуле постулировал принцип постоянной четырехвалентности углерода в органических соединениях. Бутлерова. Образование химической связи рассматривалось как результат взаимного насыщения двух валентных пар взаимодействующих атомов, множественные связи соответствовали насыщению нескольких валентностей от каждого атома и т.д. каждая связь считалась локализованной между двумя атомами и представлялась одной линией, соединяющей эти атомы. | значения |
||||||||||||||||||||||||
отрицательнып | теоретическим | поскольку | измерить |
|||||||||||||||||||||||
экспериментально | невозможно. Отсюда | |||||||||||||||||||||||||
вод, что все законченные электронные оболочки, а также «за- Молекулы стали представлены структурными формулами, которые особенно широко использовались в органической химии. Бутлеровские предположения позже легли в основу структурной теории, которая также рассматривала пространственное расположение атомов в молекуле. Периодический закон Менделеева показал зависимость валентности элемента от его местоположения в периодической системе. Элементы той же группы имеют одинаковую валентность, в большинстве случаев равную числу групп этого элемента; самая высокая валентность изменяется на 1 при переходе от одной группы к соседней группе. Эта зависимость сыграла чрезвычайно важную роль в развитии химии: зная только положение элемента в периодической системе, можно было определить ее валентные возможности, предсказать состав его соединений и затем синтезировать их. |
||||||||||||||||||||||||||
конфигурация | nsи2 яр | заполненных | ||||||||||||||||||||||||
подоболочек | 3 ), Mn(3d4s и | др.) нейтральных С помощью понятий формальной валентности химикам удалось обобщить и систематизировать огромное количество экспериментального материала по структуре, стехиометрическому составу и свойствам многих десятков и сотен тысяч органических и неорганических соединений. До электронной формулировки структуры вещества валентность обрабатывалась формально. Льюис постулировал, что химическая связь образована парой электронов, принадлежащих одновременно к обоим взаимодействующим атомам. Коссель предложил гипотезу, согласно которой электронная пара связи полностью переходит к одному из атомов с образованием ионной пары, удерживаемой в молекуле электростатическими силами. Согласно обеим гипотезам наиболее устойчивыми являются соединения, в которых валентные электроны распределены таким образом, что каждый атом окружен оболочкой, идентичной оболочке ближайшего инертного газа. |
||||||||||||||||||||||||
мов не только не способны присоединить дополнительный элек- |
||||||||||||||||||||||||||
трон, но скорее даже отталкивают его от себя. | оболочки, особенно |
|||||||||||||||||||||||||
Наоборот, | недостроенные | электронные Гипотеза Льюиса ознаменовала начало электронной теории ковалентной связи и ковалентности и гипотезы Косселя, начало теории ионной связи и гетеровалентности. Оба представляют собой крайний случай общей картины полярной связи, где электронная пара лишь частично смещается к одному из атомов, а степень смещения может изменяться от 0 до А-валентности атома в соединении, согласно классической электронная теория, равна числу ее неспаренных электронов, которые участвуют в связях, а максимальная валентность обычно представляет собой общее число электронов в ее валентной оболочке, т.е. число группы периодической системы, в которой элемент найденный. |
||||||||||||||||||||||||
которыхд о | завершенностин | одного электро- | ||||||||||||||||||||||||
обладают | значительным | положительным Элементы идентичных групп имеют одинаковое количество валентных электронов и в одинаковых подгруппах, одинаковые или очень похожие электронные конфигурации. Сходство структуры валентных оболочек атомов определяет сходство их соединений. Ковалентность и гетеровалентность отражают характеристики соответствующего типа химической связи. Для ковалентности важна насыщаемость связей, которая определяет существование молекул в виде дискретных частиц с определенным составом и структурой. Ковалентность распространена в органических соединениях и большинстве простых неорганических соединений. | сродствомк |
|||||||||||||||||||||||
трону. Так, галогены, которым нужен один электрон для создания |
||||||||||||||||||||||||||
замкнутой электронной оболочки s2 p6 , подобной оболочке инерт- |
||||||||||||||||||||||||||
ного газа, имеют F от 3,0 до 3,5 эВ. Относительно велики также |
||||||||||||||||||||||||||
те F | элементов,у С другой стороны, в случае гетеровалентности максимальное число ионов противоположного знака, способное распределяться вокруг данного иона, в основном определяется соотношениями их размеров. Ионная валентность распространена в сравнительно ограниченном классе соединений, главным образом в различных солях щелочных, щелочноземельных и некоторых других металлов. Классическое валентность и координационное число, как правило, не совпадают, а способность образовывать октаэдрические и тетраэдрические комплексы оказалась чрезвычайно распространенной и типичной для многих металлов и неметаллов, связанных сложным образом с положением элемент в периодической системе и ее валентность в исходном простом соединении. С развитием экспериментальных методов определения эффективных зарядов стало ясно, что эффективные заряды редко превышают значения 1 или 2 для положительно заряженных атомов и -1 для отрицательно заряженных атомов и обычно выражаются в дробных частях заряда электрона. | электроном | достраивается |
|||||||||||||||||||||||
s-подоболочка | ||||||||||||||||||||||||||
d-подоболочка Pd(Ni, Следовательно, для большинства неорганических соединений, простых и сложных, ионная теория не может считаться правильной. Оказалось, что тенденция формирования координационных соединений и насыщения координационных валентностей, как правило, чрезвычайно распространена и характерна для практически всех элементов и что рассмотрение валентности на основе только одного стехиометрического состава очень часто оказывается неубедительным без точных данных о структура соединений и геометрическое расположение ближайшей координационной сферы рассматриваемого атома. | F-l-2 эВ). | что многозарядные |
||||||||||||||||||||||||
Следует также | обратить | внимание | ||||||||||||||||||||||||
одноатомные | свободном В соединениях перехода и ряда непереходных элементов стало характерным использование дополнительной валентности из-за образования связи металл-металл, при которой расстояние между атомами металла оказалось значительно меньше, чем в отдельных металлах. В них нет абсолютно никакого классического валентного взаимодействия, и связь реализуется только через координационные валентности атомов металла и молекул лиганда. Для этого класса соединений стало необходимо понимание делокализованной валентности, которая характеризует целую совокупность атомов С в ароматическом кольце. Теперь стало ясно, что координационное число в комплексах, подобно валентности в простых соединениях, не является жестко специфической характеристикой элемента; для большого числа металлов были найдены комплексы со всеми промежуточными значениями координационного числа от 3 до 7, 8 и 9. | |||||||||||||||||||||||||
состояниин | е существуют,иб | ионы О", S~, | способны | |||||||||||||||||||||||
присоединить один,ате м болеедв а дополнительных электрона: теоретические значенияF лд ин я х отрицательны. Этот факт нуж-
но иметь в виду, встречая (и довольно часто) в учебной и научной литературе символы многозарядных отрицательных ионов.
Новые проблемы валентности возникли и в других областях химии. Было большое развитие в изучении свободных радикалов, в которых присутствуют трехвалентные атомы углерода. Также стало ясно, что валентность элементов может сильно различаться при изменении внешних условий, в частности температуры.
Благодаря успеху химии газообразных молекул за последние 20 лет было обнаружено большое количество соединений с промежуточными и необычными валентностями, которые не встречаются в соединениях в обычных условиях. В настоящее время установлено, что подавляющее большинство элементов может обладать переменной валентностью, образуя целую серию «валентно-ненасыщенных» соединений со всеми значениями от 1 до максимума, меняющимися на 1. Валантность не может считаться жестко специфичной характеристикой элемента; можно говорить только об относительной типичности или относительной стабильности различных значений валентности.
5. ВАЛЕНТНОЕ СОСТОЯНИЕ АТОМА
До сих пор мы ограничивались рассмотрением свойств атомов тольков основном состоянии, обладающем наинизшей энергией.Однако в целом ряде случаев основное состояние атома не обес- печивает для него той валентности, с которой он вступает в химическое соединениеВ. таких случаях необходимо обратитьсяк анализу некоторых возбужденных состояний атомов, называемыхи х
В элементах боковых групп отношения между типичными и менее типичными валентностями имеют более сложный характер. Таким образом, поиск общего определения валентности, который охватывал бы все известные типы соединений и который также предсказывал бы возможность или невозможность в принципе существования еще неизвестных классов соединений, представляет собой сложную проблему. Конечно, параллельно с «неклассическими» соединениями химики синтезировали многие сотни тысяч соединений, которые можно интерпретировать в рамках обычных классических концепций валентности.
валентными состояниями.
Так, все атомы второй группы Периодической системы в ос-
спарены два s-электрона. Чтобы эти атомы стали потенциально двухвалентными, один з пары внешних s-электронов долженс затратой значительной энергии перейти в р-состояние. Например: Bels2 2s2 + 77 ккал->Ве* Is2 2s2pl . Переход В или А1 в трехвалентное состояние также происходит путем перевода одного s-
Однако ясно, что все существующие индивидуальные определения валентности ограничены конкретными классами и типами соединений, в которых преобладает какой-либо один тип химического взаимодействия. В общем случае, однако, связи имеют промежуточный характер между чисто ионными и чисто ковалентными, и все виды взаимодействий происходят одновременно, но в разных количественных соотношениях. Они резко изменяются от класса к классу и более плавно от соединения к соединению в пределах одного класса. В отсутствие общего определения валентности трудность состоит в определении границ, где конкретное определение валентности перестает быть истинным, а другое определение заменяет его.
iЗвездочкой здесь обозначено валентное состояние Be; затрата энергии приводитсяв расчетен1 а | г-ат.
электронав р-состояние. Например:
В Is2 2s2 2p+127 ккал-^В* Is 2 2s2p x 2p y .
Наиболее подробно изучено образование валентного состояния в случае атома углерода. В низшем энергетическом состоя-
нии атом С может быть двухвалентным, так как во внешней обо- Решить эту проблему только на основе экспериментальных фактов и классических концепций невозможно. К тому же квантовая теория химической связи и валентности может оказать существенную помощь. Формирование молекулы из атомов энергетически выгодно, если электронные спины направлены в противоположных направлениях, когда притяжение электронов для ядра чужеродных атомов больше, чем энергия отталкивания между электронами и ядрами. Параллельная ориентация спинов приводит к отталкиванию атомов друг от друга. Позднее идеи Гейтлера и Лондона были распространены на многоатомные молекулы, что привело к созданию теории локализованных пар. Согласно этой теории валентность не просто связана с наличием неспаренного электрона, но также характеризуется состоянием, в котором этот электрон находится, или, в терминах теории химической связи, атомной орбитали, которую он занимает. Электроны атомов в молекуле в целом описываются «гибридными» орбиталями, которые в принципе могут включать любые валентные атомные орбитали в различных количественных соотношениях и в которых электронные облака сосредоточены вдоль направлений связей М-Х значительно больше, чем в простых атомных орбиталях. |
|||||||||||||||
толькодв | неспаренных электрона: Is 2 2s 2 2p^2p y . | ||||||||||||||
Единственный способ | объяснить | валентность, | |||||||||||||
с которой атомС | вступает | большинство | соединений, сос- |
||||||||||||
возбужденииег | путем перемещения одногои | ||||||||||||||
незанятое 2р2 -состояние | созданиите | ||||||||||||||
фигурации Is2 2s2px 2py 2pz . | Этот переход требует затраты энергии |
||||||||||||||
около 96 ккал. Однако валентные электроны в таком состоянии |
|||||||||||||||
неэквивалентны: одинниз | описывается | орбиталыо | |||||||||||||
сферической | симметрией,атр | орбиталями типар | |||||||||||||
отчетливой | направленностью (см.разд1). | Поэтомутр | |||||||||||||
связи, которые способен образовать такой углерод, будут отли-<
чатьсяо т четвертой. Этот вывод противоречит экспериментальным данным, согласно которым в таких соединениях, как метан СН4 или алмаз, углерод образует четыре эквивалентные тетраэдрические связи. Получить четыре эквивалентные связи можно, лишь отказавшись т четкого разделения атомных орбиталейн sа и -
р-орбитали и смешав их между собой со случайным направле-" нием спинов1 . Так возникло понятие смешанных, илигибридных, орбиталей (Полинг, 1931). В случае углерода и других элементов IV группы образование смеси из одной s- и трех р-орбиталей называется $р3 -гибридизацией; она приводит к четырем орбиталям,
ных типов гибридизации. Так, для того же углерода возможна тригональная, или $р2 ,-гибридизация, которая получается смешиванием трех орбиталей:s f p x ир у . При этом р^-орбиталь остается неизменной. Гибридные $р2 -орбитали расположены в одной плос-
120° другк | другу (рис. 10,6). Такая гибриди- |
|||||||
помогает понять геометрию | углеродав | графитеил и |
||||||
этилене С2 Н4 . Другой важныйти | гибридизации называется диа- |
|||||||
гональным, | или sp; он образуется | путем смешивания | s- и одной |
|||||
из р-орбиталейп и неизменности двух других р-орбиталей. Воз- |
||||||||
никающие | образомдв | sp-орбитали располагаются д |
||||||
другу,те. . | находятся а | одной* прямой. Такой |
||||||
тип гибридизации объясняет линейную конфигурацию молекулы
ацетилена С2 Н2. | элементов |
||||
Гибридизация типа sp3 характернаидл |
|||||
IV группы, особенно для | кремния и | германия. Переходные ме- |
|||
таллы образуют валентные | состояния | сложным -путем |
|||
1 По этой причине валентное состояние атома | является | спектроскопи- |
|||
чески наблюдаемым. | |||||
смешиванием s-, иp- d-орбиталей. Такая гибридизация осуще* ствляется благодаря тому, что энергии уровней 3rf, 4s и4р для никеля, например, различаются не более чем на 4 эВ. Это обеспе-
Рис. 10 sp3 (а) иsp 2 (б) -гибридные атомные орбитали
чивает возможность эффективного смешивания. При определен-
ной комбинации этих орбиталей получаются очень четко направленные гибридные атомные орбитали (АО). Например, комбина-
Т а б л иа4ц |
||||
Основные | типы гибридизации | |||
Гибридные орбитали |
||||
ИсходныеА | конфшурация |
|||
линейные | ||||
тригональные |
||||
пирамидальные |
||||
тригональные |
||||
5 /73 | тетраэдрические | |||
dsp2 | тетрагональные |
|||
бипирамидальные |
||||
пирамидальные |
||||
тетрагональные |
||||
d?sp3 | октаэдрические | |||
тригональные | призматические |
|||
ция sp 3 d 2 дает шесть октаэдрических орбиталей. В табл. 4 при-
ло м данном случае валентном состоянии решается однозначнои
просто. Например, для таких элементов II группы, как Be, Mg, nZC , иdHg , среди возможных возбужденных конфигураций наи-
более выгодна sp. Энергия возбуждения конфигурацииsd приблизительно вдвО"е больше, и поэтому она не участвует в обра-
Т абл и ца 5
Потенциалы ионизации, сродство и энергии возбуждения (эВ) валентных состояний некоторых элементов
Валентная | Валентная | ||||||||||||
зовании валентного состояния этих элементов. Но для других элементов этой группы - Са, Sr, Ba и Ra - энергии возбуж-
элементов является сложной смесью s-, p- и d-состояний. Такая ситуация затрудняет использование понятия валентного состояния
те х случаев, когда выбор валентного состояния атома может быть сделан достаточно определенно.
6. ОРБИТАЛЬНЫЕ ЭЛЕКТРООТРИЦАТЕЛЬНОСТИ
Если нанести а график (рис11.) логарифмы всех последовательных потенциалов ионизации, включая сродствок электрону,
кретным энергетическим группам, или слоям, характеризующимся
различной прочностью связи электронов. Однако при постоянном
п зависимостьlg 7, отi почти линейна. Это означает, что в пре-
делах одного электронного слоя энергия, требуемая на последо-
вательную ионизацию, может быть | точно передана | степенным |
&E(i)=ai+bi2 + ci* +... |
||
(а, Ь, с...- эмпирические константы), | в котором с достаточно хо- |
|
рошим приближением можно ограничиться двумя первыми членами
удаленных | электронов | |||||||||||||||||||||
иона. Тогда | производная | энергии атома | заряду с | |||||||||||||||||||
рассматриваться | потенциал, | |||||||||||||||||||||
который действует на электрон на дан- |
||||||||||||||||||||||
ной орбитали | ||||||||||||||||||||||
получила | название орби- | |||||||||||||||||||||
тальной электроотрицательности. | ||||||||||||||||||||||
определения | эмпирических |
|||||||||||||||||||||
достаточно | рассмотреть |
|||||||||||||||||||||
энергиюв | зависимости т | |||||||||||||||||||||
орбиталиАО | является |
|||||||||||||||||||||
свободнойпр | однократно | |||||||||||||||||||||
полностью | ||||||||||||||||||||||
Произвольно | ||||||||||||||||||||||
энергетической | шкалы, за- | |||||||||||||||||||||
соответствующихсо | ||||||||||||||||||||||
стояний атома: | ||||||||||||||||||||||
(!)=/; E(2)=/+F, | ||||||||||||||||||||||
11. Логарифмы после-гд/ е | потенциал | ионизации, | ||||||||||||||||||||
довательных | потенциалов | F - сродство к электрону. | ||||||||||||||||||||
ионизации | Отсюда легко найти | |||||||||||||||||||||
в зависимости | а = -L(3/_F), b =- (F - l)9 | |||||||||||||||||||||
ионизации | ||||||||||||||||||||||
Х(0 = dA | ||||||||||||||||||||||
Следовательно, | ||||||||||||||||||||||
Из этих результатов следует, что орбитальная | электроотрица- | |||||||||||||||||||||
тельность | константа, | состояния | ионизации |
|||||||||||||||||||
атома. Наибольший интерес | представляет значение | |||||||||||||||||||||
1 Предположение о непрерывности и дифференцируемости функции | ||||||||||||||||||||||
приводит к | представлению | заселенности | орбитали, | |||||||||||||||||||
принимать | нецелочисленные значения. | |||||||||||||||||||||
Водородная связь – результат взаимодействия молекул, содержащих сильно электроотрицательные элементы (O, N, F, реже S, Cl, Br), которые имеют свободную электронную пару, и молекул с а к т и в н ы м и атомами водорода. Активными называются атомы водорода, соединенные с другими атомами сильно полярной ковалентной связью.
Обозначается водородная связь серией точек или пунктиром:
.
. . . . . . . . . . . . . . .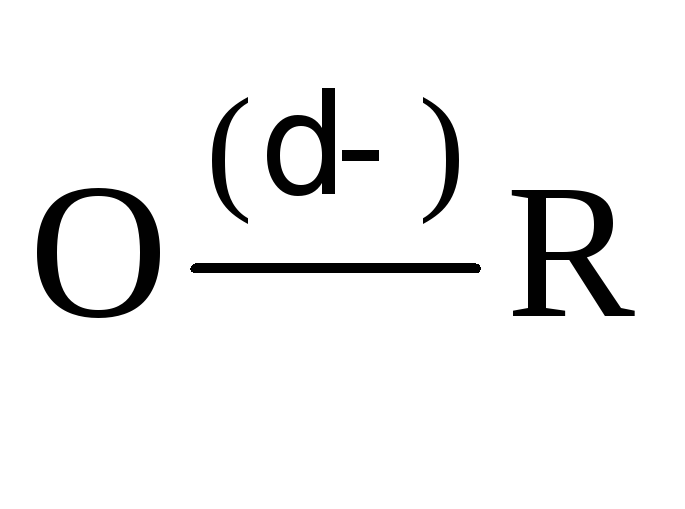
 .
. . . . . . . . . . . . . . . . .
.
. . . . . . . . . . . . . . . . .

По характеру водородная связь является электростатической, ее прочность всего 1…8 ккал/моль (по сравнению, например, с 110 ккал/моль для ковалентной связи O – H). Она может быть как межмолекулярной (вода, низшие спирты и др.), так и внутримолекулярной (именно водородными связями фиксируются вторичная и третичная структуры белков и нуклеиновых кислот).
Несмотря на малую прочность, водородная связь играет огромную роль в природе, в значительной мере определяя многие свойства различных веществ.
1.8. Валентные состояния атома углерода
Определяющим будущую структуру молекулы является тип гибридизации орбиталей ее центрального атома (соединенного с несколькими другими атомами). В органической химии центральным является атом углерода (могут быть также N, О, S).
Гибридизация – образование из разных простых атомных орбиталей гибридных орбиталей, усредненных по форме и по энергиям, и ориентированных в пространстве симметрично относительно друг друга. Тип гибридизации, вид и количество возникающих при этом гибридных орбиталей определяются видом и количеством простых атомных орбиталей, вступающих в гибридизацию (см. рис. 1, 2, 3).
Атом
углерода в возбужденном состоянии имеет
на втором (валентном) энергетическом
уровне четыре неспаренных электрона
(C*,
2s
I 

 ,).
Для него возможны три варианта гибридизации
и, соответственно, три валентных состояния
атома углерода.
,).
Для него возможны три варианта гибридизации
и, соответственно, три валентных состояния
атома углерода.
1.8.1. Первое валентное состояние атома углерода (sp3)
При образовании атомом углерода четырех простых (одинарных двухэлектронных) связей с другими атомами из четырех его орбиталей (одной s - и трех p -) образуются четыре гибридные sp 3 -орбитали, ориентированные в пространстве под тетраэдрическими углами друг к другу (рис. 1).

Рис. 1. sp 3 -гибридизация орбиталей и тетраэдрическая (объемная) ориентация гибридных sp 3 -орбиталей – первое валентное состояние атома углерода
1.8.2. Второе валентное состояние атома углерода (sp2)
В соединениях с двойной (четырехэлектронной) связью между атомами углерода последний связан с тремя другими атомами. В этом случае гибридизуются три орбитали (одна s - и две p -орбитали) и образуются три sp 2 -орбитали, ориентированные в одной плоскости под углами 120º друг к другу. Оставшаяся негибридной p -орбиталь ориентирована перпендикулярно этой плоскости – второе валентное состояние атома углерода (рис. 2).

Рис. 2. sp 2 - гибридизация орбиталей и плоскостная (XZ) ориентация гибридных sp 2 -орбиталей. Негибридная p Y -орбиталь ориентирована по оси Y – второе валентное состояние атома углерода
- Отечественной войны 2 степени
- День полного освобождения Ленинграда от фашистской блокады
- Манная каша на молоке: пропорции и рецепты приготовления Манная каша 1 порция
- Суп-пюре из брокколи с сыром Рецепт крем супа из брокколи с сыром
- Гороскоп: характеристика Девы, рождённой в год Петуха
- Причины выброса токсичных веществ Несгораемые углеводороды и сажа
- Современный этап развития человечества

 Live Journal
Live Journal Facebook
Facebook Twitter
Twitter