Виды химической связи в органических соединениях. Химические связи в органических соединениях. Образование ковалентной связи
В состав большинства органических соединений входит всего лишь несколько основных элементов: углерод, водород, азот, кислород, сера и значительно реже другие элементы. Таким образом, все многообразие органических соединений определяется, с одной стороны, их качественным и количественным составом, а с другой – порядком и характером связей между атомами.
Многочисленные научные статьи публикуются каждый день в области органической химии. Подумайте об этом, в жанре, который касается только одного элемента - углерод, учитывая столь высокие темпы публикации, можно задаться вопросом, как исследователям удается не хватать новых идей. По-видимому, возможность углеродной химии имеет большое пространство, которое предстоит исследовать после сотен лет истории, и горизонт даже продолжает расширяться.
Из них 80 процентов являются органическими соединениями на основе углерода. В пределах периодической таблицы, состоящей из более чем 100 элементов, углерод имеет особый статус, который можно назвать «царем всех элементов». Существует несколько причин, по которым углерод является таким особым элементом, и один из них обусловлен его способностью образовывать устойчивую связь с рядом других элементов «гетероатома». Углерод образует связи не только с общими неметаллическими элементами, такими как водород, кислород, азот, сера, фосфор и галогены, но также и с большинством металлических элементов.
1.1 Электроотрицательность элементов
Электроотрицательность атома – это его способность притягивать элементы. Значения электроотрицательности не имею значимости констант, а показывают лишь относительную способность атомов притягивать электроны сильнее или слабее при образовании с другими атомами.
Атомы, расположенные в ряду электроотрицательности перед углеродом и имеющие значение электроотрицательности меньше чем 2,5, повышают электронную плотность на атоме углерода при образовании связи с ним. Наоборот, атомы, значение электроотрицательности которых превышает 2,5, понижают электронную плотность на атоме углерода при образовании связи.
Многие из соединений, основанных на углерод-гетероатомной связи, являются обычными реагентами, обнаруженными на полках химических лабораторий. Не говоря уже о таких главных примерах, как реагент Гриньяра, гидроборирование и реакция Виттига, связь углерод-гетероатом всегда была следствием развития органической химии. Для органических синтетических реакций использовались даже относительно менее знакомые элементы тяжелого металла, такие как гафний, рений и висмут. Карбины молибдена и рутения раньше были довольно экзотическими соединениями, но не так давно, но стали основными регуляторами после появления катализатора метатезиса олефинов Граббса.
1.2 Ионная связь
Электронная конфигурация для любого атома может образовываться двумя различными способами. Один из них – перенос электронов: атомы одного элемента отдают электроны, которые переходят к атомам другого элемента. В данном случае между этими атомами образуется так называемая ионная (электровалентная, гетерополярная) связь :
Развитие новой химической связи всегда является самой важной границей химии, и поэтому она постоянно привлекает большой интерес и энергию от научного сообщества. С тех пор известно, что ксенонные соединения с различными номерами окисления известны, и многие из них являются фторидами и оксидами.
Известно также, что ксенон образует связь с углеродом. Сообщается, что для работы в качестве сильного фторирующего агента это соединение, возможно, имеет интересный шанс превратиться в реагент. Чтобы выяснить, могут ли они реагировать с углеродом, вероятно, существует конкуренция между лабораториями по всему миру. Высокая коммуникабельность углерода распространяется на сферу радиоактивных элементов. Актинидные элементы, такие как уран, нептуний, плутоний и америций, также сложны с циклооктатетраеном с образованием сэндвичевых молекул, обычно называемых «горячие сэндвичи».
Атом, отдавший электроны, превращается в положительный ион (катион ); атом, принявший электрон, - в отрицательный ион (анион ).
Отличительными чертами ионных соединений являются мгновенность протекания реакций, диссоциация и сольватация ионов в водных растворах, высокие температуры плавления и кипения, растворимость в полярныхе растворителях, электрическая проводимость растворов и расплавов.
Взаимное расположение химических связей
У больших атомов действительно есть удивительные свойства. В лучшем случае из моего поиска литературы самым тяжелым элементом, который образует связь с углеродом, является эйнштейний с атомным номером. Среди меньших элементов, чем это, есть только несколько, которые, как известно, не связывают с углеродом; примерами являются некоторые из благородных газов, таких как гелий, неон и аргон, и крайне короткоживущие виды, такие как франция.
Кстати, если партнер не ограничивается углеродом, самым тяжелым элементом, когда-либо подготовленным в качестве соединения, является калий с атомным номером. Изотоп, используемый в исследовании, имел период полураспада всего 11 секунд, что говорит нам о невероятно высоком уровне экспериментальная изощренность. Учитывая, что в списке элементов все еще могут быть комнаты, которые потенциально могут образовывать связь с углеродом.
Гетерополярная связь возникает между атомами, сильно отличающимися по электроотрицательности.
1.3 Ковалентная связь
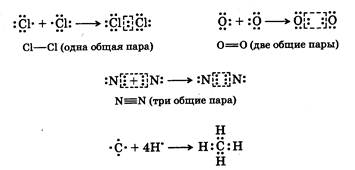
При взаимодействии атомов, равных или близких по электроотрицательности, переноса электронов не происходит. Образование электронной конфигурации для таких атомов происходит вследствие обобщения двух, четырех или шести электронов взаимодействующими атомами. Каждая из обобщенных пар электронов образует одну ковалентную (гомеополярную) связь :
Элемент не найден в периодической таблице
Большинство людей, вероятно, никогда не слышали об этом «элементе», однако, поскольку оно не встречается нигде в периодической таблице. Существует элементальная частица, называемая мюон. Эта частица в 207 раз тяжелее электрона и может иметь либо положительный, либо отрицательный заряд. Положительно заряженный мюон захватывает электрон при столкновении с образованием водородоподобного «атома», называемого мюонием, который считается одним из «экзотических атомов», не имеющих ни протона, ни нейтрона.
![]()
Важнейшими физическими параметрами ковалентной связи являются те, которые характеризуют их симметрию, размеры, электрические и термохимические свойства.
Длина связи – это равновесное расстояние между центрами ядер и оно зависит от того, с какими другими атомами они связаны. Так, длина связи С-С в зависимости от окружения изменяется в пределах 0,154 – 0,14 нм.
Персиваль и его группа использовали мюоний в качестве эквивалента водородного радикала при изучении реакционной способности двойных связей углерод-кремний. В этом исследовании было обнаружено соединение, в котором мюоний связан с углеродом. Как исследовательский метод органической химии, это очень нетипичный, но впечатляющий подход.
Тема: Введение в органическую химию
Удивительно, что любые значимые данные могут быть собраны в тот мгновенный период времени, но, по мнению экспертов в области исследования элементарных частиц, мюоний фактически принадлежит к группе долгоживущих частиц, и его анализ относительно прост. Например, позитроний также, как известно, образует соединение, но он живет в течение наносекунд, поэтому его обнаружение «немного затруднено». Физические химики, безусловно, имеют совсем другое представление о времени, но такая междисциплинарная лаборатория должна быть отличным местом где рождаются увлекательные исследования.
Валентные углы – углы между линиями, соединяющими связываемые атомы. Знание длины связей и валентных углов необходимо для построения правильной пространственной модели, представления о распределении электронной плотности и используется при квантово-химических расчетах.
Энергия разрыва химической связи – это энергия, затрачиваемая на разрыв этой связи или выделяющаяся при ее образовании в расчете на моль частиц. В случае молекул, содержащих две или более одинаковых связи, различают энергию разрыва одной из этих связей или среднюю энергию разрыва этих связей. Чем выше энергия химической связи, тем прочнее связь. Связь считается прочной, или сильной, если ее энергия превышает 500 кДж/моль, слабой – если ее энергия меньше 100 кДж/моль. Если при взаимодействии атомов выделяется энергия менее 15 кДж/моль, то считается, что химическая связь не образуется, а наблюдается межмолекулярное взаимодействие. Прочность связи обычно уменьшается с увеличением ее длины.
Урок: Ковалентная связь в органических соединениях
Живые существа состоят из атомов, но в большинстве случаев эти атомы не просто плывут по отдельности. Вместо этого они обычно взаимодействуют с другими атомами. Например, атомы могут быть связаны сильными связями и организованы в молекулы или кристаллы. Или они могут образовывать временные, слабые связи с другими атомами, с которыми они сталкиваются или расправляются. И сильные связи, которые удерживают молекулы вместе, и более слабые связи, которые создают временные связи, необходимы для химии наших тел и для существования самой жизни.
Полярность химических связей – характеристика химической связи, показывающая изменение распределения электронной плотности в пространстве вокруг ядер в сравнении с распределением электронной плотности в образующих данную связь нейтральных атомах. Знание полярности связи необходимо для суждения о распределении электронной плотности в молекуле, следовательно, о характере ее реакционной способности.
Основной ответ заключается в том, что атомы пытаются достичь самого стабильного состояния, которое они могут. Многие атомы становятся стабильными, когда их валентная оболочка заполнена электронами или когда они удовлетворяют правилу октета. Если атомы не имеют такой договоренности, они «хотят» достичь этого, получая, теряя или разделяя электроны через облигации.
Некоторые атомы становятся более устойчивыми, получая или теряя целый электрон. Когда они это делают, атомы образуют ионы или заряженные частицы. Электронный выигрыш или потеря могут дать атому заполненную самую внешнюю электронную оболочку и сделать ее энергетически более стабильной.
Поляризуемость связи выражается в смещении электронов связи под влиянием внешнего электрического поля, в том числе и другой реагирующей частицы. Поляризуемость определяется подвижностью электронов. Электроны тем подвижнее, чем дальше они находятся от ядер.
1.4 Разрыв связей
Разрыв ковалентной связи между двумя атомами может происходить по-разному:
Ионы бывают двух типов. Катионы представляют собой положительные ионы, образованные потерей электронов. Отрицательные ионы образуются путем усиления электронов и называются анионами. Когда один атом теряет электрон, а другой атом получает этот электрон, процесс называется переносом электрона. Хорошим примером переноса электронов являются атомы натрия и хлора.
Натрий только имеет один электрон в своей внешней электронной оболочке, поэтому для натрия легче доносить этот один электрон, чем найти еще семь электронов для заполнения внешней оболочки. Хлор, с другой стороны, имеет семь электронов в своей внешней оболочке.
В случае а каждый атом отделяется с одним электроном, что приводит к образованию частиц, называемых радикалами и обладающих высокой реакционной способностью вследствие наличия неспаренного электрона; такой разрыв называют гомолитическим расщеплением связи. В случаях б и в один атом может удерживать оба электрона, оставляя другой атом без электронов, в результате чего возникают отрицательный и положительный ионы соответственно. Если атомы R и Х неидентичны, расщепление может идти по одному из таких путей в зависимости от того, какой атом – R или Х – удерживает пару электронов. Такого рода разрывы носят название гетеролитического расщепления и приводят к образованию ионной пары.
Натрий переносит один из своих валентных электронов на хлор, в результате образуется ион натрия и ион хлорида. Когда натрий и хлор объединяются, натрий будет жертвовать его один электрон, чтобы освободить его оболочку, и хлор будет принимать этот электрон, чтобы заполнить его оболочку. Оба иона теперь удовлетворяют правилу октета и имеют полные внешние оболочки. Поскольку число электронов больше не равно числу протонов, каждый атом теперь является ионом и имеет заряд 1 или -1.
В общем случае потеря электрона одним атомом и усиление электрона другим атомом должно происходить одновременно: для того, чтобы атом натрия потерял электрон, он должен иметь подходящего реципиента, такого как атом хлора. Ионные связи представляют собой связи, образованные между ионами с противоположными зарядами. Например, положительно заряженные ионы натрия и отрицательно заряженные ионы хлорида притягивают друг друга, чтобы сделать хлорид натрия или поваренную соль. Столовая соль, как и многие ионные соединения, не состоит только из одного иона натрия и одного хлорида, вместо этого она содержит много ионов, расположенных в повторяющемся, предсказуемом трехмерном рисунке. 1 ^ 1 1 начальный верхний индекс, 1, концевой верхний индекс.
Глава 1. Природа химических связей в органических соединениях При этом образуются три гибридные орбитали, расположенные в одной плоскости под углом 120° друг к другу (плоскость равностороннего треугольника). Третья 2р-орбиталь, не принимающая участия в гибридизации, сохраняет свою прежнюю форму и располагается в плоскости, перпендикулярной плоскости гибридных орбиталей. Такое состояние атома углерода называется вторым валентным состоянием (рис. 2). sp-Гибридизация происходит при смешении одной 2s- и одной 2р- орбитали: 2p sp 1s При этом образуются две гибридные орбитали, расположенные на одной прямой линии. Остальные две 2р-орбитали, не участвующие в гибридиза- ции, располагаются во взаимно перпендикулярных плоскостях. При таком ти- пе гибридизации атом углерода находится в третьем валентном состоянии (рис. 3). Y Z Y sp2 2 py Z sp 2 2 pz sp 2 pz X X sp sp 2 2 pz 120 0 2 py Рис. 2. Электронные орбитали атома углерода Рис. 3. Электронные орбитали атома углерода во втором валентном состоянии в третьем валентном состоянии 11 Раздел 1. Теоретические основы органической химии § 3. Типы химической связи в органических соединениях Наиболее распространенным типом химической связи в органиче- ских соединениях является ковалентная связь. Она образуется за счет перекрывания орбиталей двух атомов с образованием общей электрон- ной пары. Ковалентная связь может быть простой (одинарной), двойной и тройной. Простая (одинарная) или σ(сигма)-связь – связь между атома- ми, осуществляемая одной парой электронов, максимальная плотность которых расположена на линии, соединяющей центры этих атомов. Такая связь может быть образована при перекрывании орбита- лей как s-, так и 2р-электронов, а также электронов орбиталей, находя- щихся в состоянии sp3-, sp2- и sр-гибридизации. Кратная химическая связь – это связь, образованная обоб- ществлением двух или трех электронных пар. Кратная связь может быть двойной (в случае двух пар электро- нов) или тройной (с участием трех пар электронов). Кратные связи состоят из одной σ-связи и одной или двух π-связей. В этом слу- чае σ-связь образуется в результате перекрывания sр2 -гибридных орбиталей, а π-связь негибридизованных 2р-орбиталей. Электроны, принимающие участие в образовании π-связи, называют π- электронами. Молекула с ковалентной связью может быть неполярной, если связанные этой связью атомы имеют одинаковую электроотрица- тельность (например, в случае молекулы водорода). Если же один из атомов обладает большим сродством к электрону и по этой при- чине электронная плотность смещена в его сторону, то такая моле- δ+ δ- кула или связь будет полярной. Так, в формуле СН 3 Сl знаки δ+ и δ- означают, что на атоме хлора имеется избыточная электронная плотность (частичный отрицательный заряд), а на атоме углерода – их дефицит (частичный положительный заряд). Смещение электрон- ной плотности можно показать стрелкой: СН3 → С1. Чем больше раз- ница в электроотрицательности атомов, связанных ковалентной свя- зью, тем более полярна молекула (или связь). Практически все ковалентные связи полярны (за исключением симметричных моле- кул). Полярность является важной характеристикой химических свя- зей, во многом определяя физические и химические свойства и по- 12 Глава 1. Природа химических связей в органических соединениях ведение органических соединений. От наличия того или иного за- ряда на атоме зависит его реакционная способность. В ряде органических соединений присутствуют семиполярные (от англ. semi – «наполовину»), или ковалентно-координационные связи. Такие связи совмещают в себе свойства ковалентных и ионных связей. Графически их обозначают стрелкой, указывающей направление сме- щения электронов. Примером такой связи является одна из связей N-O в O R N нитрогруппе: O . Эта структура показывает, что связи атома азота с двумя атомами кислорода неравноценны. Одна из них является типичной двойной ко- валентной связью. Во второй, кроме пары валентных электронов, обра- зующих ковалентную связь, имеют место разноименные заряды на ато- мах азота и кислорода. Таким образом, связь N-O в нитрогруппе является и ковалентной, и ионной. Водородная связь возникает между атомами, имеющими свободную электронную пару (кислород, азот, сера и др.), и водородом, который связан с другим атомом высокополярной ковалентной связью. В этом случае водород обладает довольно высокой протонной подвижностью, в результате чего возникает связь особого типа. Возникновение такой связи между молекулами этилового спирта можно изобразить в виде схемы: О-Н О-Н О-Н С2Н5 С2 Н 5 С2Н5 Водородные связи гораздо менее прочны, чем обычные ковалент- ные; их энергия составляет всего 12,5–21 кДж/моль. Также их влияние сильно отражается на химических и физических свойствах веществ. Водородная связь играет огромную роль в живой природе, в про- цессах крашения, в приготовлении некоторых полимерных материа- лов, во многих системах, используемых в качестве строительных рас- творов и вяжущих материалов. § 4. Типы разрыва ковалентных связей Напомним, что ковалентная связь образована парой «валентных» электронов. При протекании химической реакции происходит разрыв ко- 13 Раздел 1. Теоретические основы органической химии валентной связи в реагирующих молекулах. При этом образуются проме- жуточные частицы – интермедиаты. Такие частицы, как правило, неус- тойчивы и быстро вступают в дальнейшие реакции. Различают гетеро- и гомолитические виды разрыва связи. Гетеролитический разрыв связей возникает при полном смеще- нии электронного облака в молекуле в сторону одного из атомов. Химическая связь может разрываться по двум направлениям: A В А ++ В- A В А -+ В+ При этом происходит образование органических ионов – активных заряженных частиц. Время жизни таких ионов незначительно. Однако их роль в органической химии велика, так как многие реакции протека- ют с их участием. К гетеролитическому разрыву склонны сильно по- лярные и легкополяризуемые связи. Разрыву способствуют раствори- тели с высокой диэлектрической проницаемостью и большой полярностью. При гетеролитическом разрыве ковалентной связи для атома уг- лерода возможно образование карбаниона и карбкатиона (иона карбо- ния). Карбкатионы – интермедиаты, в которых атом углерода име- ет три ковалентные связи и положительный заряд R 3C+ . Они обра- зуются в том случае, если электронная пара смещается от атома углеро- да. При этом углеродный атом теряет электрон: -е- С* С+ 1s 2 2s1 2р 3 1s 2 2s1 2р 2 карбкатион Такой разрыв реализуется в молекулах, в которых присутствуют более электроотрицательные атомы или группы, чем углерод: 14 Глава 1. Природа химических связей в органических соединениях С Сl С+ + Сl- Карбанионы – интермедиаты, в которых атом углерода имеет три ковалентные связи и отрицательный заряд за счет наличия неподеленной электронной пары. Такие частицы образуются при смещении электронной пары к атому углерода, при этом атом углерода принимает электрон: +е- С* С- 1s 2 2s1 2р3 1s 2 2s 2 2р3 карбанион Это реализуется в молекулах, содержащих атомы или заместители ме- нее электроотрицательные, чем углерод: + С Н С- + Н карбанион Присоединение к углеродному атому или отрыв от него двух или более электронов связаны с очень большой затратой энергии, поэтому получение высокозарядных углеродных ионов – маловероятный про- цесс. Гомолитический разрыв ковалентной связи заключается в разъеди- нении связующей электронной пары. При таком разрыве связи образу- ются свободные радикалы: A В hν А +В Свободные радикалы – электронейтральные частицы, в кото- рых атом углерода трехвалентнен и имеет один неспаренный элек- трон (не путать с понятием радикала как мысленно выделяемого фраг- мента молекулы). Радикальному разрыву подвергаются обычно неполярные или ма- лополярные связи (С–С, N–N, C–N) при высокой температуре, под дей- 15 Раздел 1. Теоретические основы органической химии ствием ультрафиолетового света или радиоактивного излучения. Обра- зовавшиеся при гомолитическом разрыве связи радикалы и свободные атомы неустойчивы и способны существовать лишь непродолжительное время. Эти промежуточные частицы подвергаются дальнейшим пре- вращениям, переходя в устойчивые конечные продукты. Так, например, радикал метил CH 3 может стабилизироваться путем димериза- ции: СН3 + СН 3 ® Н 3С:С3Н ГЛАВА 2. ТЕОРИЯ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ § 5. Классификация органических соединений В настоящее время известно огромное число органических соеди- нений. Для сведения их в компактную и легкую для понимания систему необходимо провести классификацию. За основу классификации орга- нических соединений берут различные признаки. 1. Классификация по природе углеводородного скелета. Основу любого органического вещества составляет последователь- ность химически связанных атомов углерода – его углеродный скелет. Различают следующие типы углеродного скелета: а) ациклический – углеродные цепи неразветвленные (нормальные) (I) и разветвленные (II), содержащие одинарные и кратные (двойные, тройные) связи: С С-С-С-С-С С-С-С-С-С-С С=С-С С º С-С С I II III IV б) карбоциклический – циклические углеродные цепи, содержащие насыщенные (V – VI) и сопряженные связи (ароматические, VII): С С С С С С С С С С С С С С С V VI VII в) гетероциклический – циклические цепи, содержащие углеродные и другие атомы – O, N, S (VIII и IX): 16 Глава 2. Теория органических соединений O N VIII IX Органические вещества с углеродными цепями типа I и II называют соединениями жирного ряда, ациклическими или алифатическими. Со- единения с углеродными циклами, изображенными формулами V и VI, называют алициклическими. Схемой VII изображен углеродный скелет бензола – важнейшего представителя ароматических соединений. Фор- мулы VIII и IX показывают, что в состав гетероциклического кольца входят атомы не только углерода, но и других элементов – гетероатомы (от греч. «гетерос» – разный). Здесь название «углеродный скелет» ус- ловно, так как в него входят не только атомы углерода. Все эти схемы показывают последовательность химической связи атомов, но не пере- дают их пространственного расположения. Так, неразветвленная угле- родная цепь на самом деле имеет зигзагообразную форму и может быть по-разному изогнута в пространстве. 2. Классификация по природе функциональной группы. «Органическая химия есть химия углеводородов и их производ- ных» – говорил К. Шорлеммер еще в ХIХ веке. При этом под производ- ными он имел в виду вещества, получаемые при введении функцио- нальных групп в молекулы углеводородов. Таким образом, органические соединения по вышеуказанному признаку могут делиться на углеводороды и их производные. Углеводороды – органические соединения, в молекулы которых входят атомы лишь двух элементов: углерода и водорода. Их клас- сификацию можно представить следующим образом: углеводороды алифатические циклические насыщенные ненасыщенные насыщенные ароматические (предельные) (непредельные) (предельные) (арены) Сn H 2n-6 алканы С n H 2n+2 алкены Сn H 2n алкины Сn H 2n-2 циклоалканы С n H 2n В большинстве органических молекул, помимо углерода и водоро- да, содержатся атомы других элементов. Именно от них в первую оче- 17 Раздел 1. Теоретические основы органической химии редь зависят химические свойства органических веществ. Эти атомы (кислород, азот, сера и др.) входят в состав особых группировок, назы- ваемых функциональными группами. Присутствие той или иной функ- циональной группы, связанной с радикалом (углеводородный остаток), определяет принадлежность органических соединений к определенным классам. Общее число известных в настоящее время функциональных групп весьма велико и даже в больших курсах органической химии рас- сматривается лишь часть их. Основные функциональные группы и от- вечающие им классы органических соединений приведены в табл. 1. Таблица 1 Функциональные группы и классы органических соединений Функциональные Класс соединений Типичные представители группы название формула Галогены -F, -Cl, Галогенопроизвод- Йодметан CH3-I -Br, -I ные Гидроксил -ОН Спирты Метанол CH3-OH Фенолы Фенол C6H5-OH Карбонил >C=O Альдегиды Этаналь О СН 3 С Н Кетоны Диметилкетон Н 3С СН3 С О Карбоксил Карбоновые кисло- Уксусная кисло- О -CООН ты та СН3 С ОН Нитрогруппа Нитросоединения Нитробензол С6Н5-NO2 -NO2 Аминогруппа Амины Этиламин С2Н5-NH2 -NH2 Диазогруппа Диазосоединения Хлористый бен- С6Н5-N2Cl -N2X зилдиазоний Меркаптогруппа Тиолы (меркаптаны, Метантиол CH3-SH -SH тиоспирты) Сульфогруппа Сульфокислоты Бензолсульфо- С6Н5-SO3H -SO3H кислота Металлы Металлоорганиче- Метиллитий CH3-Li ские соединения 18 Глава 2. Теория органических соединений Полифункциональными называют соединения, содержащие не- сколько одинаковых функциональных групп. Гетерофункциональными называют органические соединения, ха- рактеризующиеся присутствием в молекуле нескольких различных функциональных групп. В основу данного пособия положен принцип разделения органиче- ских соединений на углеводороды и их производные. Для каждого класса органических соединений характерно существова- ние гомологического ряда. Такие ряды являются подтверждением основного закона природы – перехода количественных изменений в качественные. Гомологическим рядом (от греч. homos – «последовательный») называют ряд соединений с близкими химическими и закономерно изменяющимися физическими свойствами, в котором каждый член отличается от предыдущего на одну группу СН2. Понятие гомологии, введенное в органическую химию, часто позволяет сделать выводы о химических свойствах отдельных соединений с однотип- ной структурой, зная общие свойства гомологического ряда в целом. Такая систематизация органических соединений облегчает изучение органиче- ской химии. Достаточно изучить свойства типичного представителя ря- да, чтобы иметь понятие о свойствах ряда в целом. Гомологические ря- ды соединений, рассматриваемых в данном пособии, будут приводиться в соответствующих параграфах. § 6. Изомерия При исследовании неорганических соединений молекулярная формула чаще всего служит «визитной карточкой» соединения и отра- жает состав только этого вещества. Так, формула H2SO4, несомненно, является формулой серной кислоты, NaHCO3 – бикарбоната натрия. В орга- нической химии одну и ту же молекулярную формулу могут иметь разные вещества из-за яв- ления изомерии. Изомерия была открыта в 1823 г. Ю. Либи- хом, показавшим, что серебряная соль гремучей кислоты Ag-О-N=C и изоцианат серебра Ag- N=C=O имеют один и тот же состав, но совершен- но разные свойства. Термин «изомерия» предло- жен в 1830 г. И. Берцелиусом. Объяснить же явление изомерии стало 19 Раздел 1. Теоретические основы органической химии возможным лишь после создания теории химического строения А.М. Бутлерова. Изомерия – явление существования веществ, одинаковых по составу и молекулярной массе, но различающихся последовательно- стью соединения атомов или расположением их в пространстве и вследствие этого по химическими и физическим свойствам. Изомеры – вещества, имеющие одинаковый состав и моле- кулярную массу, но различное химическое строение. Различают два основных вида изомерии: структурную и простран- ственную (стереоизомерию). Структурные изомеры отличаются друг от друга последовательно- стью связей между атомами в молекуле. Пространственные (стерео- изомеры) изомеры отличаются друг от друга пространственным распо- ложением атомов в молекуле. Структурную изомерию подразделяют на: 1) изомерию углеродного скелета; 2) изомерию функциональной группы; 3) изомерию положения кратной связи или функциональной группы. Изомерия углеродного скелета обусловлена различным порядком связи между атомами углерода, образующими скелет молекулы. Так, может существовать только один алифатический насыщенный углево- дород с тремя атомами углерода – пропан. Углеводородов такого же ти- па с четырьмя атомами С может быть уже два: н-бутан и изобутан, с тремя атомами – три: н-пентан, изопентан и неопентан: СН3 СН3 СН3 СН 2 СН 2 СН3 СН3 СН СН3 СН3 С СН3 н-бутан изобутан СН3 неопентан СН3 СН 2 СН 2 СН 2 СН3 СН3 СН СН 2 СН3 н-пентан СН3 изопентан Для углеводорода C20H42 возможно 366 319 изомеров. Изомерия функциональной группы обусловлена различием состава функциональной группы, определяющей химические свойства данного класса соединений. Так, формула С2Н6О может соответствовать двум 20
Некоторые ионы упоминаются в физиологии как электролиты. Эти ионы необходимы для проведения нервных импульсов, мышечных сокращений и водного баланса. Многие спортивные напитки и диетические добавки обеспечивают эти ионы заменой потерянных из организма через потоотделение во время физических упражнений.
Другой способ, которым атомы могут стать более стабильными, - это обмен электронами, образуя ковалентные связи. Ковалентные связи более распространены, чем ионные связи в молекулах живых организмов. Одну, две или три пары электронов можно распределять между атомами, что приводит к однократным, двойным или тройным связям, соответственно. Чем больше электронов разделено между двумя атомами, тем сильнее будет их связь.
- Манная каша на молоке: пропорции и рецепты приготовления Манная каша 1 порция
- Суп-пюре из брокколи с сыром Рецепт крем супа из брокколи с сыром
- Гороскоп: характеристика Девы, рождённой в год Петуха
- Причины выброса токсичных веществ Несгораемые углеводороды и сажа
- Современный этап развития человечества
- Лилия яковлевна амарфий Могила лилии амарфий
- Значение имени мариям Имя марьям значение происхождение

 Live Journal
Live Journal Facebook
Facebook Twitter
Twitter