Строение электронных слоев атома. Энергетические подуровни. Что будем делать с полученным материалом
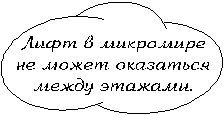
6.1. Особенности микромира
Законы, по которым "живут"частицы микромира (электроны, нуклоны, атомы, молекулы) сильно отличаются от законов макромира (нашего мира – мира физических тел). Многое в поведении этих частиц наш мозг, эволюционировавший в макромире, просто не в состоянии себе представить. Поэтому с некоторыми особенностями таких частиц, особенностями, которые нам кажутся неожиданными и странными, нам придется просто смириться.
Периодическая таблица представляет собой расположение всех известных химических элементов в информационном массиве. Текущая конфигурация периодической таблицы эволюционировала с годами как по структуре, организации, так и по количеству элементов. Он продолжает передавать массу полезной информации о каждом из более чем 114 элементов.
Что будем делать с полученным материалом
Каждый элемент содержит ключевую информацию. Атомная масса представляет собой среднюю массу всех изотопов этого элемента в единицах атомной массы.
- Символ - это сокращенное английское или латинское имя элемента.
- Атомное число представляет собой число протонов в атоме этого элемента.
- Атомную массу иногда называют атомным весом.
Из основного свойства заряженных тел и частиц следует, что неподвижными электроны в атоме быть не могут. Ведь в этом случае они, притянувшись к ядру, просто упали бы на него, и атом перестал бы существовать. Следовательно, электроны в атоме движутся. Но уже Резерфорду было ясно, что просто вращаться вокруг ядра электроны не могут. В то время уже были известны законы электродинамики, в соответствии с которыми вращающийся вокруг ядра электрон обязан постепенно терять свою энергию, что должно приводить в конце концов, к его падению на ядро. Эта исключительно сложная проблема хоть и не всегда последовательно, но была решена в первой трети ХХ века в результате работ многих выдающихся физиков: Нильса Бора, Альберта Эйнштейна, Эрвина Шрёдингера, Вернера Гейзенберга, Макса Борна и многих других ученых. С основными выводами из этих работ мы с вами и познакомимся.
Каждый столбец называется группой или семьей. Элементы внутри одной группы имеют одинаковое количество валентных электронов и будут вести себя так же в химических реакциях. Элементы также идентифицируются по типу, который идентифицирует некоторые свойства более высокого уровня. Примеры типов включают металлы, неметаллы, переходные металлы и металлоиды.
Электронная конфигурация показывает, как электроны элемента расположены в их энергетических оболочках, как показано в трехсимвольных кодах. Первый символ указывает уровень энергии, второй - подколонку, а третий - количество электронов в этой подколенной оболочке.
Изучая электроны, атомы, молекулы, а также процессы их взаимодействия, мы будем использовать некоторые модели , позволяющие нам все же получить более или менее наглядное представление об изучаемых объектах. При этом необходимо помнить, что любая модель описывает реальность с той или иной степенью точности и может быть использована только в той области, для которой она создавалась.
Электроотрицательность - это мера способности элемента привлекать электроны в химической связи. Атомы с подобными электроотрицательностями будут иметь тенденцию делиться электронами друг с другом, образуя ковалентные связи. Однако, если разница электроотрицательности слишком велика, один атом будет «красть» электрон от другого, образуя ионную связь.
Вы когда-нибудь задумывались, как на самом деле использовать периодическую таблицу элементов? Получите подробный обзор различных разделов периодической таблицы, включая конфигурацию электронной оболочки, атомную массу, химические символы, электроотрицательность и т.д. с этим руководством.
Из частиц микромира нас интересует прежде всего электрон. И хотя свойства, проявляемые электроном в различных условиях, вы будете изучать в курсе физики, мы с вами кратко познакомимся с тремя основными особенностями поведения электронов в атоме .
Первая особенность.Энергия свободного электрона , так же как и энергия тела, может изменяться непрерывно, но энергия связанного электрона, в частности электрона в атоме, может принимать только вполне определенные значения .
Выполнение модели было продемонстрировано количественной интерпретацией спектров атома водорода, но его пределы в интерпретации спектров атомов с несколькими электронами. Это, однако, противоречит законам классической физики и не может быть использовано для объяснения атомной связи. Вопрос о внутренней структуре материи касался человека с древности, когда греческие естествоиспытатели создали атом понятия для самых маленьких неделимых частиц, из которых строится материя. Эта атомная форма была впервые изучена с помощью все более мощных научных методов, внутренняя структура атомов была дополнительно исследована.
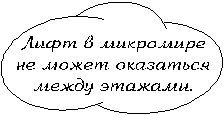 Схематически это
изображено на рис. 6.1, где слева на оси энергии
жирной линией показаны возможные значения
энергии свободного электрона, а справа на такой
же оси отдельными точками – значения энергии
электрона в атоме. Таким образом, электрон в
атоме может находиться только во вполне
определенных состояниях
.
Схематически это
изображено на рис. 6.1, где слева на оси энергии
жирной линией показаны возможные значения
энергии свободного электрона, а справа на такой
же оси отдельными точками – значения энергии
электрона в атоме. Таким образом, электрон в
атоме может находиться только во вполне
определенных состояниях
.
На основе своего знаменитого эксперимента рассеяния Е. впервые сформулировал утверждение о том, что масса атома преимущественно расположена в ядре и что отрицательные электроны вращаются вокруг положительного ядра. Однако, согласно законам классической физики, атомы не должны быть устойчивыми, поскольку привлекают положительные и отрицательные частицы, а электроны должны попасть в положительно заряженное атомное ядро.
Он использовал первые выводы современной квантовой механики и сформулировал так называемые постулаты, в которых он предположил, что законы классической физики неприменимы в атомном поле и должны быть заменены другими законами. Если электроны вращаются вокруг ядра на устойчивых путях, центробежная сила должна быть в точности равна притягивающей силе электрона через положительный заряд ядра.
При переходе электрона из одного состояния в другое энергия поглощается или выделяется порциями – квантами энергии. Поэтому первая особенность поведения электрона часто называется принципом квантования его энергии. Эта особенность была постулирована датским физиком Нильсом Бором в 1913 году и в дальнейшем получила блестящее экспериментальное подтверждение.
Постулат. Из всех теоретически возможных электронных путей некоторые дискретные круговые орбиты считаются допустимыми, на которых электрон может двигаться без излучения. Постулат Когда электрон изменяется с одной орбиты на другую, энергия излучается или поглощается в виде световых квантов.
Постулат Разрешенные орбиты соответствуют определенному энергетическому уровню электрона. Если электрон меняет орбиту, энергия, излучаемая или поглощенная, соответствует разности энергий орбит. Это позже было названо основным квантовым числом и в основном определяло положение энергетических уровней электронов.
Вторая особенность. Электрон в одних случаях проявляет свойства частицы вещества, а в других – волновые свойства. Такая двойственность поведения электрона и других микрочастиц (дуализм) – одно из общих свойств материи (и вещества, и поля). Оно называется "корпускулярно-волновой дуализм" или "дуализм волна-частица " .
С моделью бурильной колонны можно было вычислить как радиус атома водорода, так и линейный спектр водорода. Но даже на втором тяжелом атоме, гелий, рассчитанный атомный радиус отклонялся отчетливо от экспериментально определенного значения. Линейный спектр атомов с несколькими электронами, Например, щелочных металлов были сложнее структурированы и не могут быть точно объяснены моделью Бора.
Он объяснил тонкую структуру линейных спектров появлением эллиптических орбит, как это наблюдалось в астрономии. Эти электроны также могут «обходить» вокруг ядра. Это электронное занятие оболочек находится в полном согласии со структурой периодической системы элементов. Полностью покрытые оболочки с 2, 8 и 18 электронами соответственно представляют собой стабильные конфигурации электронов. Обнаружено, что все элементы в основной группе имеют одинаковую конфигурацию валентных электронов, что приводит к существенным сходным химическим свойствам.
Волновые свойства электрона проявляются, например, при прохождении потока электронов через тончайшую кристаллическую пленку. Поток электронов ведет себя так, как будто через эту пленку прошли волны, то есть, подвергается дифракции(огибание волнами встречающегося на их пути препятствия,если его размер сопоставим с длиной волны) и интерференции(увеличение гребней и уменьшение впадин волн при наложении их друг на друга) (смысл этих явлений понятен из рисунка 6.2, на котором показаны схемы дифракции и интерференции волн на поверхности воды при встрече препятствия с одним, или двумя отверстиями). Эту особенность поведения электрона предсказал французский физик Луи де Бройль в 1924 году, а в 1926 году американский физик Клинтон Девиссон впервые наблюдал дифракционную картину при взаимодействии потока электронов с металлами. В настоящее время волновые свойства электронов широко используются при исследовании строения различных веществ.
С другой стороны, элементы в периоде имеют самую высокую занятую оболочку. Однако дальнейшие заявления о химической связи были невозможны. Несмотря на свою высокую эффективность, теоретическое построение этой более старой квантовой механики было непротиворечивым, но было балансирующим актом между классической физикой и квантовой теорией, поэтому в теории было много критиков. Он был заменен современной квантовой механикой в конце 1920-х годов. Однако эта модель намного сложнее и менее понятна.
Как вы знаете, старые тамицеро, в серии мы проходим через периодическую таблицу, останавливаясь в элементе в каждой статье и рассказывая о ее химических характеристиках, обнаружении, свойствах, опасностях, наиболее важных соединениях и курьезах в целом. Мы пытаемся, в принципе, показать, как все элементы являются «особыми» в некотором роде и как они связаны с нашей повседневной жизнью так или иначе с очень небольшим исключением. Конечно, сегодня нет сомнений в том, что это так, потому что без элемента сегодняшнего дня вы бы рухнули, как пудинг, пока ваши мышцы развязывают непроизвольные спазмы: забавная, но неудачная сцена.

Третья особенность. Чем с большей точностью определяют положение электрона в пространстве, тем с меньшей точностью можно определить его скорость . И наоборот, чем с большей точностью определяют скорость электрона (абсолютную величину и направление), тем с меньшей точностью можно определить его положение в пространстве . Это утверждение, а оно справедливо и для других микрочастиц, называется "принцип неопределенностей" . Этот принцип был сформулирован немецким физиком Вернером Гейзенбергом в 1927 году. Принцип неопределенностей "лишает "летящий электрон траектории. Действительно, если мы в какой-то момент точно знаем положение электрона, то мы принципиально ничего не знаем о его скорости и в следующий момент времени можем обнаружить электрон в любой другой точке атома, правда, с разной вероятностью .
В последней записи серии мы изучили элемент из девятнадцати протонов, и сегодня мы посвятим один из двадцати протонов. Это элемент «обманчивого»: он очень распространен, но вы, вероятно, никогда не видели его чистым. Поэтому мы будем говорить о действительно многогранном элементе: кальция.
Кальций, как и для калия, очень близок к стабильному: если он теряет только два электрона из двадцати, когда он нейтрален, он имеет электронную структуру элемента из восемнадцати протонов, который является стабильным. Как мы уже говорили несколько раз в серии, очень близкое к тому, чтобы быть стабильным, означает чрезвычайно неустойчивый, какой кальций: очень редко видеть его чистым. Если он оставлен в воздухе, за очень короткое время он реагирует с ним и образует оксиды и другие соединения, поэтому необходимо проявлять большую осторожность, чтобы сохранить его в металлической форме.
Теорию вероятностей изучает математика, а мы лишь воспользуемся несколько упрощенным определением этого понятия.
В нашем случае вероятность обнаружения электрона в какой-либо точке электронной оболочки атома показывает, насколько часто "он там бывает".
МИКРОМИР,
МАКРОМИР, ПРИНЦИП КВАНТОВАНИЯ, ДУАЛИЗМ
ВОЛНА-ЧАСТИЦА, ПРИНЦИП
НЕОПРЕДЕЛЕННОСТЕЙ,ВЕРОЯТНОСТЬ.
1.Приведите
примеры физических явлений, при которых
происходит непрерывное изменение
а) потенциальной энергии, б) кинетической
энергии.
2.Перечислите основные особенности поведения
электрона в атоме. Чем поведение электрона
отличается от поведения любого физического тела?
3.Как вы думаете, где можно провести границу между
микромиром и макромиром?
4.В каких случаях при переходе электрона в атоме
из одного состояния в другое энергия выделяется,
а в каких – поглощается?
5.Разделите следующие утверждения на три группы:
а) достоверно, б) вероятно, в) невозможно.
Когда он увидел это, Дэви увидел это как «на самом деле», и не так, как мы обычно видим, когда думаем об этом. Как вы видите просто по внешнему виду, кальций, поскольку он соответствует положению периодической таблицы, является металлом. Мало того, что это металл «очень металлический», из-за этого крайнего наклона избавиться от двух электронов, которые отделяют его от стабильности. Он проводит электричество лучше, чем медь, хотя мы не можем использовать его для этого, потому что он будет длиться так же мало, как металл при открытом воздухе.
Но об этом мы говорили в одно мгновение. В том, что люди часто думают, когда говорят о «кальцие», есть вещи, которые содержат его как часть соединений, и в этом случае обычно это белые вещества - молоко, кости или известь. Название кальция происходит от латинского кальцисса, что означает известь, которая относится к более чем одному соединению кальция. Оксид кальция с относительной легкостью получается из известняковых пород: карбонат кальция чрезвычайно распространен в земной коре, и если он достаточно нагревается, он разлагается следующим образом.
- Земля вращается вокруг Солнца.
- Земля вращается вокруг Марса.
- Автобус подойдет к остановке в течение ближайшей минуты.
- Завтра будет дождь.
- Завтрашний день будет солнечным.
- Первый человек, встреченный вами завтра на улице, будет мужчина.
Попытайтесь оценить вероятность этих событий.
6.2. Орбитали. Квантовые числа
Потому что дело в том, что оксид кальция реагирует с несколькими вещами, поэтому нередко видеть его таким, какой он есть. Опасность, конечно, в том, что живые существа имеют воду в количестве, а реакция с окисью кальция вызывает известь, чтобы обезвоживать наши ткани, «крадя» воду и при этом выделяя много тепла. он обезвоживает нас и сжигает нас в одно и то же время. Таким образом, извести можно использовать в качестве дезинфицирующего средства. Однако, хотя мертвый известняк является довольно сильной базой, он не вызывает такой насильственной реакции.
Необычные свойства электрона, его
двойственная природа, особый характер движения
не укладываются в рамки классической механики.
Поведение электрона и других микрочастиц
изучает квантовая
или волновая механика
.
В квантовой механике поведение электрона
описывается довольно сложным уравнением,
которое называется волновым уравнением
или уравнением
Шрёдингера
(по имени Эрвина Шрёдингера –
австрийского физика, предложившего это
уравнение в 1926 году). Точное решение уравнения
Шрёдингера возможно только для системы из двух
частиц, например, для атома водорода. Для более
сложных атомов уравнение решается приближенно с
использованием ЭВМ. Решая уравнение Шрёдингера,
можно найти возможные состояния электрона в
атоме (атомные
орбитали
, АО).
Здесь вы можете увидеть, как некоторые дельцы создают «бассейн с подогревом» с окисью кальция и водой. Гидроксид кальция, кстати, также имеет приятный белый цвет. Гидроксид кальция. Но помимо карбоната кальция из известняка или мрамора существует еще один очень распространенный минерал в разных формах, через который мы также имели контакт с кальцием, не зная его в течение многих лет: это гипс, который является не чем иным, как сульфатом гидратированного кальция.
Выезд из Алжеза в Куэнка, Испания. Мы также используем другие соединения кальция для различных целей. Наконец, большая часть кальция, с которым мы знакомы, имеет биологическое происхождение, снова в соединениях, которые имеют очень часто белый цвет, поэтому мы думаем о «белом», когда говорим о кальции, несмотря на его реальный внешний вид чистый - тот, что изображен на фотографии выше. Карбонат кальция сам по себе является частью многих оболочек, оболочек и жестких беспозвоночных структур, и многие осадочные породы имеют именно это биологическое происхождение.
Чтобы избежать громоздких
приближенных вычислений, часто применяют
упрощенную модель атома, которая называется "одноэлектронное
приближение "
. В рамках этой модели
предполагается, что каждый электрон ведет себя в
атоме независимо от остальных электронов этого
атома – тогда решение уравнения Шрёдингера
сильно упрощается. В химии в большинстве случаев
бывает достаточно этой простейшей модели,
поэтому ее чаще всего и используют.
Составив уравнение Шрёдингера для какого-нибудь
атома и решив его, можно определить, какие
состояния возможны для электрона в данном атоме
(в рамках модели "одноэлектронное приближение
"эти состояния и называют орбиталями
).
Затем можно вычислить, какой энергией обладает
электрон в каждом из этих состояний, а также
найти и другие, очень важные характеристики
атома. С некоторыми из них мы еще познакомимся.
Уравнение Шрёдингера можно составить не только
для атома, но и для молекулы (системы, состоящей
из нескольких атомных ядер и электронов). Решая
такое уравнение, можно найти возможные состояния
электрона не в отдельном атоме, а в молекуле
(правда, расчеты в этом случае очень сложны,
трудоемки и, естественно, приближенны). Эти
состояния тоже называются орбиталями, но в
отличие от орбиталей атома – атомных орбиталей
их называют молекулярными
орбиталями
(МО).
Чтобы найти возможные состояния
электрона в атоме, нам не обязательно составлять
и решать уравнение Шрёдингера. Эта работа
проделана во второй четверти ХХ века как самим
Шрёдингером, так и многими его последователями. В
соответствии с этим уравнением каждая атомная
орбиталь однозначно характеризуется набором из
трех целых чисел, которые называются квантовыми
числами
. Числа эти получили особые названия и
обозначения:
главное квантовое число
– n
,
орбитальное квантовое число
– l
и
магнитное квантовое число
– m
.
Так как не все состояния электрона в атоме
возможны, то и сочетания этих чисел могут быть
отнюдь не любые, а только те, которые
удовлетворяют следующим трем правилам.
Главное квантовое число (n ) может принимать любые целочисленные положительные значения:
n = 1, 2, 3, …,
Орбитальное квантовое число (l
)
может
принимать любые целочисленные значения от нуля
до n
– 1:
l
= 0, 1, 2, … , (n
– 1).
Магнитное квантовое число
(m
)
может
принимать любые целочисленные значения от – l
до + l
, включая ноль:
m
= – l
, … , –1, 0, +1,… ,+ l.
Рассмотрев последовательно возможные
наборы квантовых чисел, выясним, в каких
состояниях может находиться электрон в атоме (то
есть, какие АО возможны).
Пусть главное квантовое число n
= 1, тогда
орбитальное квантовое число l
= 0 и магнитное
квантовое число m
= 0, и только нулю. Таким
образом, при n
= 1 возможна только одна АО.
При n
= 2 орбитальное квантовое число l
может уже принимать два значения: 0 и 1, но не
больше. Каждому из этих значений соответствуют
свои возможные значения m
: при l
= 0
магнитное квантовое число тоже равно только
нулю, а при l
= 1 магнитное квантовое число
может принимать уже три значения: –1, 0 и 1. Таким
образом, при n
= 2 мы получаем следующие наборы
квантовых чисел:
| n = 2 | n = 2 | n = 2 | n = 2 |
| l = 0 | l = 1 | l = 1 | l = 1 |
| m = 0 | m = –1 | m = 0 | m = 1 |
и всё, никакие другие наборы квантовых
чисел при n
= 2 невозможны. Следовательно,
число АО при n
= 2 равно четырем.
Рассуждая аналогично, мы можем получить и другие
АО. Результат приведен в первых четырех столбцах
таблицы 13. Эта таблица может быть продолжена и
для других значений главного квантового числа.
Набор атомных орбиталей определяется ограничениями, наложенными на значения квантовых чисел.
Используя квантовые числа, мы можем
"назвать "полученные орбитали, то есть
приписать каждой из них свой символ
. Символ
АО состоит из цифры и строчной латинской буквы,
например: 2s
, 3p
, 4f
. Цифра соответствует
главному квантовому числу, а буква символизирует
значение орбитального квантового числа по
следующему правилу: l
= 0 соответствует
буква s
, l
= 1 соответствует буква p
, l
= 2 – буква d
, l
= 3 – буква f
и далее по
алфавиту. Например:
1s
-АО обозначает орбиталь с n
= 1 и l
= 0;
2p
-АО обозначает орбиталь с n
= 2 и l
= 1;
3d
-АО обозначает орбиталь с n
= 3 и l
= 2.
Символы орбиталей приведены в последней колонке
таблицы 13.
Те же символы используются и для обозначения
электронов, находящихся на этих орбиталях, то
есть, в этих состояниях:
2p
-электрон – электрон на 2p
-АО,
4f
-электрон – электрон на 4f
-АО и т. д.
Поведение электрона на орбитали зависит еще от
одной его необычной характеристики, называемой спином
.
Эта специальная (не имеющая аналогов в макромире)
характеристика микрочастиц, определяющая их
магнитные свойства. Для ее учета используется
четвертое квантовое число – спиновое
. Оно
обозначается буквой s
. У разных частиц
спиновое квантовое число бывает разным, но для
электрона оно может принимать только два
значения: s
= 1/2 и s
= –1/2.
Таким образом, электрон в атоме полностью и
однозначно характеризуется четырьмя квантовыми
числами (n
, l
, m
и s
), три из которых (n
,
l
и m
) характеризуют орбиталь этого
электрона, а четвертое (s
) – его спин
Таблица 13 .Наборы значений квантовых чисел для различных АО
Обозначение АО |
||||
| Одна | ||||
0 |
Одна Три |
2s |
||
0 |
Одна Три Пять |
3s |
||
0 |
0 |
Одна Три Пять Семь |
4s |
В дальнейшем мы с вами будем использовать обозначения атомных орбиталей, приведенные в последней колонке таблицы 13.
АТОМНАЯ
ОРБИТАЛЬ, МОЛЕКУЛЯРНАЯ ОРБИТАЛЬ, КВАНТОВЫЕ
ЧИСЛА.
1.Составьте символы атомных
орбиталей, для которых а) n
= 2, l
= 0;
б) n
= 3, l
= 0; в) n
= 3, l
=
2.Какие значения n
и l
соответствуют а) 4s
-АО,
б) 4р
-АО, в) 5d
АО, a) 6p-
АО?
3.Сколько в атоме s
-орбиталей, р
-орбиталей, d
-орбиталей?
4.Сколько в атоме 2р
-орбиталей, 3s
-орбиталей,
4d
-орбиталей, 4f
-орбиталей? Докажите, что их
именно столько.
5.Сколько орбиталей атома имеют символ 5p
, 6s
,
4d
, 5f
? Каким квантовым числом отличаются
орбитали с одинаковым символом?
6.Среди приведенных наборов квантовых чисел n
,
l
и m
выберите те, которым соответствуют
АО. Укажите символы этих АО: а) n
= 2, l
= 0, m
= 0; б) n
= 3, l
= 3, m
= 1; в) n
= 2, l
= 1, m
= 2; г) n
= 3, l
= 2, m
= – 1; д) n
= 3, l
= 0, m
= 2; е) n
= 3, l
= 1, m
= 0.
6.3. Энергия атомных орбиталей. Электронные уровни и подуровни
 Узнав, какие орбитали
возможны в атоме, постараемся теперь выяснить,
какова их энергия, ведь роль энергии во всех
процессах, протекающих во Вселенной, очень
велика. Это относится и к микромиру, и к Космосу.
Узнав, какие орбитали
возможны в атоме, постараемся теперь выяснить,
какова их энергия, ведь роль энергии во всех
процессах, протекающих во Вселенной, очень
велика. Это относится и к микромиру, и к Космосу.
Энергия АО (Е
АО) может быть
как рассчитана из уравнения Шрёдингера, так и
определена экспериментально, что давно уже
сделано для атомов практически всех элементов.
Но при изучении химии эти точные абсолютные
значения используются редко. Обычно бывает
достаточно знать, энергия какой орбитали больше,
а какой меньше, а также, сильно или слабо
различаются по энергии соседние орбитали. Такую
информацию дает, например, рис. 6.3, где на оси
энергии нанесены значения энергии орбиталей
атома менделевия (одного из последних элементов,
электронное строение атома которого определено
экспериментально), как занятых электронами, так и
некоторых свободных. Значения нанесены на ось
без строгого соблюдения масштаба, так как при
увеличении главного квантового числа разница
между значениями энергии АО уменьшается очень
сильно, поэтому сделанный в масштабе рисунок был
бы ненагляден. Есть и еще одна причина, по которой
эту шкалу обычно изображают без соблюдения
масштаба: по мере возрастания заряда ядра
энергия одних и тех же орбиталей существенно
уменьшается, но при этом общая закономерность
распределения орбиталей по энергии остается
неизменной. Изображенная на рис. 13 шкала точнее
отражает одну из уже известных нам особенностей
поведения электрона в атоме (сравни с рис. 11).
Как видите, последовательность состояний
довольно сложная. Обычно для большей наглядности
получившуюся шкалу несколько видоизменяют.
Обратите внимание, что энергия АО зависит от n
и от l
, поэтому кроме оси Е
АО вводят
еще одну ось. Чаще всего это ось l
. На
получившемся поле отмечают положение энергии
различных орбиталей, но не точками, а маленькими
квадратиками, так называемыми "квантовыми
ячейками"
. При этом, кроме увеличения
наглядности, появляется возможность показать
число разных орбиталей с одинаковой энергией.
Рядом с квантовыми ячейками
обязательно обозначают символы орбиталей. В
результате получается так называемая энергетическая
диаграмма атома
.
Энергетическая диаграмма может отражать
электронное строение реального атома, тогда на
ней показывают положения электронов (как это
делается мы подробно разберем в параграфе 6.5). Но
можно составить энергетическую диаграмму так,
чтобы показать последовательность энергий еще
не занятых электронами орбиталей – для
произвольного многоэлектронного атома такая
диаграмма приведена на рис. 6.4.

В случае атома водорода, у которого – только один электрон, картина сильно упрощается. Как видно из энергетической диаграммы (рис. 6.5), у атома водорода энергия орбитали зависит только от главного квантового числа n .
От магнитного квантового числа m энергия орбитали не зависит, на энергетической диаграмме орбитали с одинаковыми n и l , но с разным магнитным квантовым числом m , имеющие одинаковую энергию, группируются вместе, образуя электронный подуровень (ЭПУ) (см. рис. 6.4).
Число орбиталей на любом ЭПУ равно числу возможных значений m (см. табл. 13). Так, 2p -, 3p -, 4p - и других орбиталей p-подуровней – по три, а 3d -, 4d -, 5d - и других d -орбиталей – по пять. В общем случае число орбиталей на любом подуровне равно 2l + 1.
Поскольку все орбитали подуровня имеют одинаковый символ, тем же символом обозначают и сам подуровень. Так, 1s -подуровень (1s -ЭПУ) образован одной 1s -АО, а 4f -ЭПУ – семью 4f -АО.
На энергетической диаграмме условно принято располагать орбитали по возрастанию магнитного квантового числа, например, для 3d -ЭПУ
| 3d | |||||
| –2 | –1 | 0 | +1 | +2 |
левая квантовая ячейка символизирует орбиталь с m = –2, следующая – с m = –1 и далее до m = 2.

Подуровни с одинаковым значением главного квантового числа объединяют в электронные уровни (ЭУ).
Так, 2s - и 2р -подуровни образуют второй электронный уровень; 3s -, 3p - и 3d -подуровни образуют третий электронный уровень.
На энергетических диаграммах,
показанных на рис. 6.4 и 6.5, подуровни одного уровня
соединены прямыми линиями. В случае атома
водорода эти линии горизонтальны, а в случае
многоэлектронного атома – наклонны. Полезно
знать, что число подуровней на одном уровне равно
номеру этого уровня (то есть главному квантовому
числу n
), а число орбиталей на том же уровне
равно n
2 .
Иногда электронные уровни называют
"энергетическими уровнями". Это устаревшее,
но все еще часто употребляемое название
справедливо для атома водорода, но совершенно не
отражает характер электронных оболочек
многоэлектронных атомов (энергия атомных
орбиталей одного электронного уровня у них
разная). Именно при изучении электронной
структуры атома водорода (простейшего атома!) это
название и возникло.
Точно так же электронные подуровни иногда
называют "энергетическими подуровнями". Это
название допустимо, так как отражает реальность:
в пределах подуровня у любого атома энергии АО
действительно
равны. Но для того, чтобы не
создавать лишней путаницы, его не стоит
употреблять.
ЭНЕРГИЯ
АО, КВАНТОВАЯ ЯЧЕЙКА, ЭНЕРГЕТИЧЕСКАЯ ДИАГРАММА
АТОМА, ЭЛЕКТРОННЫЙ УРОВЕНЬ, ЭЛЕКТРОННЫЙ
ПОДУРОВЕНЬ.
1.Энергия
какого из электронов одного и того же атома, 1s
или 2s
, больше? Какой из них слабее связан с
ядром?
2.На какой орбитали, 1s
-АО атома водорода или 1s
-АО
атома гелия, электроны имеют большую энергию? Где
они прочнее связаны с ядром?
3.Какие орбитали образуют четвертый электронный
уровень?
4.Определите число АО на а) 3s
-ЭПУ, б) 4f
-ЭПУ.
5.Сколько электронных подуровней образуют
а) третий электронный уровень, б) пятый
электронный уровень, в) седьмой электронный
уровень?
6.4. Электронные облака. Форма и размер электронного облака
Разобравшись с энергией электронов, попробуем понять, как же движутся электроны в атоме, обладая различными значениями энергии, и вообще, находясь в различных состояниях (на разных орбиталях).
Из-за особенностей поведения электрона, с которыми мы познакомились в первом параграфе, нам, жителям макромира, представить себе характер такого движения невозможно. Это связано с тем, что в макромире, в соответствии с представлениями современной физики, для него просто нет никаких аналогий. Однако положение не безнадежно – мы можем воспользоваться моделью поведения электрона в атоме, в которой используется представление об электронном облаке (ЭО).

Чтобы понять, что это такое, допустим, что мы можем очень много раз "сфотографировать" электрон в атоме (например, в атоме водорода), то есть точно зафиксировать его положение в каждый момент времени. Принцип неопределенностей нам это не запрещает. Наложив друг на друга эти "фотографии", мы получим картину, показанную на рисунке 6.6 а . Если же мы будем фиксировать только положение электрона на плоскости, в которой лежит ядро, то изображение получится несколько иным (см. рис. 6.6 б ). Оба эти рисунка дают нам представление об электронном облаке: рисунок а – вид этого облака со стороны, а рисунок б – сечение облака плоскостью, проходящей через ядро. Рисунок а отражает внешний вид облака, а рисунок б дает представление о его внутреннем строении.
В разных местах электронного облака
вероятность обнаружить электрон может быть
разная.
Различная плотность точек в разных частях
рисунка 6.6 соответствует разной вероятности
нахождения электрона в этих частях электронного
облака.
Вероятность обнаружить электрон в какой-либо
части облака характеризуется физической
величиной, называемой электронная плотность (r е).
Она определяется как отношение числа электронов
(N
е) к объему (V
), который они
равномерно заполняют (см. § 5.9):
Чем больше электронная плотность, тем
выше вероятность нахождения электрона в этой
части облака (и тем гуще расположены точки на рис.
6.6).
Электронная плотность резко уменьшается с
увеличением расстояния от ядра, но теоретически
равна нулю только на бесконечном от него
расстоянии. Отсюда следует, что YI не имеет четких
границ. В сторону ядра электронная плотность
уменьшается еще более резко и вблизи него
практически равна нулю.
Электронное облако характеризуется размером,
формой и распределением в нем электронной
плотности.
Все, что мы говорили об электронном облаке,
относится к ЭО одной орбитали, но электрон может
находиться на разных орбиталях. Естественно, что
электронные облака в этих случаях тоже будут
разные, то есть, будут отличаться по размеру,
форме и распределению электронной плотности.
Как мы уже отмечали, электронное облако не имеет
четких границ, края его как бы размыты в
пространстве. Что же понимать под размером
такого объекта, и как описать его форму?
Для ответа на эти вопросы нам придется более
детально разобраться в том, как
"устроены"некоторые электронные облака, то
есть, каково их строение. А строение такого
необычного объекта, как электронное облако,
характеризуется лишь распределением по его
объему электронной плотности. Сначала
познакомимся со строением самых простых
электронных облаков.
|
|
Начнем с 1s
-ЭО. В верхней части рис. 6.7
изображено сечение этого облака плоскостью,
проходящей через ядро атома. В нижней части
рисунка помещен график, показывающий, как
меняется электронная плотность в этом облаке.
Такой график мог бы построить некий очень
маленький "наблюдатель ", пролетающий через
атом по оси x
и непрерывно измеряющий при этом
электронную плотность. Точно такой же график
построил бы наш "наблюдатель", если бы
пролетал через 1s
-ЭО по любому другому
направлению, но обязательно через центр облака.
Следовательно, в 1s
-ЭО распределение
электронной плотности не зависит от направления,
и форма этого облака – шарообразная.
Но не всегда легко представить себе форму
электронного облака, рисуя лишь графики
распределения электронной плотности. Поэтому
обычно форму электронного облака характеризуют
его граничной поверхностью
.
В качестве граничной поверхности выбирают такую
поверхность, внутри которой общая вероятность
обнаружить электрон достаточно велика (например:
90; 95 или даже 99 %). Но таких поверхностей для
каждого облака можно выбрать множество, поэтому
среди них выбирают одну – поверхность, на
которой в любой точке вероятность нахождения
электрона одинакова. Есть и другой способ выбора
граничной поверхности. В этом случае среди
поверхностей с одинаковой (в любой точке)
электронной плотностью выбирают поверхность, на
которой электронная плотность крайне
незначительна (например, 0,01 или 0,001 е/>A 3 ,
то есть 1,6? 10 9 или 1,6? 10 8 Кл/м 3).
Выбранные этими двумя способами граничные
поверхности по внешнему виду мало отличаются
друг от друга.
Построим граничную поверхность 1s -ЭО. На рис. 6.7 вспомогательные линии, относящиеся к этому построению, изображены пунктиром. В результате мы получим две сферы: внешнюю (а ) и внутреннюю (б ), между которыми вероятность обнаружить электрон равна 90 %. Внутренняя сфера мала, находится вблизи ядра и при образовании атомом химических связей ее присутствие никак не проявляется, поэтому обычно говорят, что 1s -ЭО имеет форму шара.
По-иному устроено 2p
-ЭО (рис. 6.8). Оно
состоит из двух одинаковых частей, симметричных
относительно центра облака. Между ними, на
плоскости m
(перпендикулярной плоскости
чертежа), электрон находиться не может. Граничная
поверхность 2p
-ЭО (ее сечение обозначено на
рисунке буквой а
) похожа по форме на две
половинки апельсина и представляет собой тело
вращения
(простейшими телами вращения
являются цилиндр, конус, шар и тор (приближенную
форму тора имеет бублик) с осью x
. Если
наш "наблюдатель"полетит через это облако
вдоль оси x
, то график, который он построит, не
будет сильно отличаться от такого же графика для
1s
-ЭО, только высота максимумов будет немного
меньше. По любому другому направлению (кроме
лежащих в плоскости m
), например, вдоль прямой f
,
электронная плотность будет еще меньше, но
максимумы кривой останутся на тех же расстояниях
от ядра (см. нижний график). Это постоянство
максимумов характерно и для других электронных
облаков, что позволяет нам выбрать в каждом
облаке сферу "с "
с радиусом, в конце
которого электронная плотность по этому
направлению максимальна.
Такой постоянный радиус и характеризует размер
электронного облака. Этот радиус называют радиусом
электронного облака
и обозначают r
ЭО.
В случае рассмотренных нами орбиталей именно на
этом расстоянии от ядра вращался бы электрон,
если бы он не обладал волновыми свойствами.

2p
-подуровень образован тремя
орбиталями, следовательно, в атоме может быть три
2p-
ЭО. А так как электроны взаимно
отталкиваются, эти облака располагаются в
пространстве так, чтобы максимумы их электронной
плотности находились как можно дальше друг от
друга. Это возможно только в том случае, если оси
облаков будут взаимно перпендикулярны, например,
направлены вдоль осей прямоугольной системы
координат. Поэтому 2p-
ЭО так и обозначают: 2р
х -,
2р
y - и 2p
z -ЭО (рис. 6.9). Если каждое
из этих облаков образовано одним или двумя
электронами, то суммарное электронное облако
всех электронов подуровня за счет сложения
электронной плотности будет иметь шарообразную
форму (как у 1s-ЭО). Такую же шарообразную форму
будут иметь суммарные электронные облака любого
подуровня, если, конечно, каждое из отдельных
облаков будет образовано одним или двумя
электронами.
Форма и строение других электронных
облаков сложнее. Так 2s
-ЭО, будучи также, как и
все s
-облака шарообразным, двухслойное (рис.
6.10 а
). Внутри внешнего слоя с главным
максимумом электронной плотности есть еще один
слой со значительно меньшей электронной
плотностью.
3p
-ЭО состоит из четырех частей (рис. 6.10 б
).
Две большие области похожи по форме на половинки
2p-
ЭО, но ближе к ядру расположены еще две
маленькие области с меньшей электронной
плотностью. В пространстве оси 3p
-электронных
облаков, так же, как и оси 2p-
ЭО, взаимно
перпендикулярны.
С увеличением главного квантового числа n
форма электронных облаков (c одинаковым l
)
все более и более усложняется, но внешние области
таких облаков остаются похожими, геометрически
почти подобными.
Еще сильнее усложняется форма облаков с
увеличением орбитального квантового числа.
Рассмотрим форму 3d
-облаков. Из пяти облаков
этого подуровня четыре по форме совершенно
одинаковы, а пятое от них отличается (рис. 6.11)(На
самом деле ситуайция с пятым облаком несколько
сложнее) Каждое из четырех одинаковых 3d
-облаков
образовано четырьмя областями, напоминающими по
форме округлые апельсиновые дольки. Пятое облако
состоит из трех частей, две из которых отдаленно
напоминают 2р
-облако, а третья образует
похожий на тор поясок вокруг первых двух.
Размеры электронных облаков зависят от заряда ядра: чем больше заряд ядра, тем оно сильнее притягивает электрон и тем меньше размер электронного облака. При одном и том же заряде ядра размер облака зависит, прежде всего, от главного квантового числа n . Наглядно эта зависимость представлена на рис. 6.12 в виде диаграммы размеров электронных облаков . На этой диаграмме по вертикальной оси отложены (без строгого соблюдения масштаба) значения радиусов электронных облаков, а по горизонтальной оси – орбитальное квантовое число. Положения радиусов ЭО на диаграмме символически отмечены кружочками.

Радиусы электронных облаков с одинаковыми значениями главного квантового числа примерно равны, а с разными значениями n – сильно отличаются. Из-за этого электронная оболочка атома оказывается слоистой.(Точные квантово-механические расчеты показывают, что радиусы облаков одного слоя немного различаются, но эти различия незначительны)
Электронный слой образован облаками орбиталей одного электронного уровня. Так, первый электронный слой образован одним 1s -ЭО, второй – одним 2s -ЭО и тремя 2р -ЭО, третий – одним 3s -ЭО, тремя 3р -ЭО и пятью 3d -ЭО. Общее число электронных облаков в любом электронном слое равно n 2 , где n - главное квантовое число, которое служит одновременно и номером электронного слоя.
Облака одного слоя, отличающиеся только значениями магнитного квантового числа, соответствуют орбиталям одного подуровня. В случае р -подуровней разным значениям m соответствует только разная ориентация электронных облаков. У облаков одного ЭПУ с большим значением l , например, у 3d -облаков, отличается еще и форма.
ЭЛЕКТРОННОЕ
ОБЛАКО, ГРАНИЧНАЯ ПОВЕРХНОСТЬ ЭО, ФОРМА ЭО,
РАДИУС ЭО, ДИАГРАММА РАЗМЕРОВ ЭО, ЭЛЕКТРОННЫЙ
СЛОЙ.
1.Существуют ли в Природе электронные облака? А
электроны?
2.Попробуйте найти аналогии между электронной
оболочкой и многоэтажным жилым домом
оригинальной архитектуры.
3.Почему положение граничной поверхности
электронного облака выбирается произвольно
(точнее - конвенционально)?
4.Опишите изменение электронной плотности,
зафиксированное "наблюдателем",
пролетевшим через 1s
-ЭО вдоль прямых а и б (рис.
6.13). 
5.Опишите изменение электронной плотности,
зафиксированное "наблюдателем",
пролетевшим через 2р
-ЭО а) сквозь центр атома
по направлению, перпендикулярному оси x
(рис.6.8); б) параллельно оси x
, вне сферы
наибольшей электронной плотности; в) параллельно
оси x
, захватывая сферу наибольшей
электронной плотности.
6. Какие электронные облака образуют второй
электронный слой?
7.Чем отличаются друг от друга электронные облака
орбиталей со следующими наборами квантовых
чисел: а) n
= 2, l
= 0, m
= 0 и n
= 2, l
= 1, m
= 0; б) n
= 2, l
= 1, m
= 0 и n
= 2, l
= 1, m
= 1; в) n
= 1, l
= 0, m
= 0 и n
= 2, l
= 0, m
= 0?
8.Сколько электронных облаков образуют полностью
заполненный четвертый электронный слой?
9.Какое электронное облако одного и того же атома
больше по размерам а) 2р
-ЭО или 3р
-ЭО, б) 2р
-ЭО
или 3s
-ЭО, в) 1s
-ЭО или 2р
-ЭО?
10.Какое из электронных облаков больше: 1s
-ЭО
атома водорода, или 1s
-ЭО атома гелия?
11.Как вы думаете, во сколько раз радиус 1s-ЭО атома
урана меньше радиуса такого же облака атома
водорода?
12.У каких из перечисленных ниже электронных
облаков одного и того же атома примерно
одинаковые размеры: 1s-ЭО, 4p-ЭОб 3d-ЭО, 4s-YI, 3s-ЭО?
6.5. Электроны в атоме
В любом атоме число АО теоретически
бесконечно, а число электронов конечно. Как же
электроны "размещаются "в электронной
оболочке?
Возьмем (конечно, мысленно) ядро атома с атомным
номером Z
и Z
электронов. Будем
последовательно "бросать "по одному
электрону в сторону взятого ядра. Электроны
будут притягиваться ядром и занимать (заполнять)
какие-то орбитали. Какие? В какой
последовательности?
Чтобы ответить на эти вопросы, мы должны
познакомиться с законами (принципами, правилами)
заполнения АО электронами, иными словами, с законами
построения электронной оболочки
.
Первый закон (принцип наименьшей энергии ): электроны в атоме занимают орбитали с наименьшими из возможных значениями энергии . Иными словами, суммарная энергия всех электронов атома должна быть минимальной . Если это так, то такое состояние атома называется основным или невозбужденным . Это устойчивое состояние атома. Любое другое состояние атома называется возбужденным .
Основное состояние атома – состояние атома с наименьшей энергией. |
Используя энергетическую диаграмму атома и символически изображая на ней электроны в виде стрелок, направленных вверх (s = 1 / 2) или вниз (s = – 1 / 2), мы можем проиллюстрировать принцип наименьшей энергии:

При желании мы можем воспользоваться
аналогией из макромира: электроны, заполняя
орбитали, ведут себя подобно воде, заполняющей
стакан. Вода всегда заполняет стакан снизу вверх
и никогда – наоборот.
Если бы электроны
"руководствовались"только принципом
наименьшей энергии, то все Z
электронов
нашего атома оказались бы на 1s
-орбитали. Но
этого не происходит, потому что существует
второй закон (принцип Паули
): в атоме не
может быть даже двух электронов со всеми
четырьмя одинаковыми квантовыми числами
(швейцарский
физик Вольфганг Паули сформулировал, в несколько
иной форме, этот принцип в 1925 году).
Вспомним,
что атомная орбиталь характеризуется тремя
квантовыми числами (n
, l
, m
), а спиновое
квантовое число (s
) может принимать только два
значения, следовательно, на одной АО может
быть не более двух электронов
. Иными словами,
электронное облако может быть образовано только
одним или двумя электронами.
Орбиталь без электронов называют свободной
орбиталью
, орбиталь с одним электроном – орбиталью
с неспаренным электроном
, орбиталь с двумя
электронами – заполненной орбиталью
.

В обыденной жизни мы часто сталкиваемся с одним случайным аналогом принципа Паули: в железнодорожном вагоне дальнего следования действует принцип "один билет – один пассажир ". А ведь на железнодорожном билете тоже указаны четыре "дискретных параметра": дата, номер поезда, вагон и место.

Чтобы правильно разместить в атоме первые пять электронов, достаточно воспользоваться принципом наименьшей энергии и принципом Паули. Попробуем это сделать для такого атома (атома бора).
Для наглядного изображения электронного строения, или, как говорят, электронной конфигурации атома воспользуемся энергетической диаграммой многоэлектронного атома (рис. 6.4). На этой диаграмме внутри квантовых ячеек, с помощью стрелочек, изобразим электроны, находящиеся в тех состояниях, которые символизируют квантовые ячейки. В результате для атома бора мы получим энергетическую диаграмму, показанную на рис. 6.14.
У шестого электрона, который есть,
например, у атома углерода, "возникает
проблема": где ему на 2р
-ЭПУ выгоднее
разместиться – на свободной АО, или на АО с
неспаренным электроном. 
На этот вопрос отвечает третий закон, который
называется правилом Хунда
(немецкий физик
Фридрих Хунд сформулировал его в 1927 году).
Вспомним, что электрон – заряженная частица, и,
следовательно, электроны друг от друга
отталкиваются; а раз так, то им выгоднее
находиться на разных орбиталях одного подуровня,
так как электронные облака этих орбиталей в
пространстве не совпадают. Несколько упрощенно
правило Хунда звучит так: в пределах
подуровня электроны распределяются по орбиталям
таким образом, чтобы модуль суммы их спиновых
квантовых чисел был максимальным
.
Если шестой электрон сможет попасть на ту же
орбиталь, что и предыдущий, то сумма спиновых
квантовых чисел этих электронов по принципу
Паули обязательно будет равна 1/2 + (–1/2) = 0
(электроны должны быть с разными спинами). А если
этот электрон займет другую 2р
-АО, то сумма
спиновых квантовых чисел окажется равной 1/2 + 1/2 =
1, то есть больше, чем в первом случае. Модуль
суммы окажется больше, чем в первом случае, и
тогда, когда спиновые квантовые числа обоих
электронов будут отрицательными. Следовательно,
электроны занимают орбитали одного подуровня
сначала по одному и только потом по два
,
и
шестой электрон попадет на свободную р
-орбиталь
(рис. 6.15).

В жизни мы сталкиваемся с отдаленной аналогией правила Хунда: на конечной остановке незнакомые пассажиры, входя в троллейбус, обычно садятся сначала по одному на каждое сидение и только потом – по два.
Зная энергетическую структуру электронных оболочек атомов и законы, по которым электроны образуют эти оболочки, мы можем изобразить электронную конфигурацию атома почти любого элемента. Для этого нам нужно знать только заряд ядра. Можно, конечно, выбирать заряд ядра произвольно, но тогда мы вряд ли быстро обнаружим в строении электронных оболочек какую-то систему. Логично расположить атомы в порядке возрастания зарядов их ядер, начиная с +1е. Такой ряд называется естественным рядом элементов (ЕРЭ). То, что именно этот ряд может быть положен в основу классификации химических элементов, стало ясно после работ молодого английского физика Генри Мозли, вскоре после этого трагически погибшего в одном из сражений Первой мировой войны. Порядковый номер элемента в этом ряду равен числу протонов в ядре любого атома этого элемента и обозначается той же буквой – Z . Д. И. Менделеев, не доживший до открытия Мозли, располагал элементы в порядке возрастания атомных масс ("атомных весов ", как тогда говорили), хотя и чувствовал, что в основе ряда лежит какая-то более глубинная характеристика.
"Конструируя "электронные
оболочки атомов, мы будем изображать их
электронные конфигурации. Один из способов их
изображения – построение энергетической
диаграммы – мы уже разобрали. Второй способ –
написание электронной формулы атома
. С ним мы
познакомимся в процессе работы.
Первый элемент в ЕРЭ – водород. Единственный
электрон его атома по принципу наименьшей
энергии занимает 1s
-орбиталь, и электронная
формула атома водорода записывается так: 1s
1 .
Верхний индекс при символе орбитали означает
число электронов на ней. Единственное
электронное облако этого атома (1s
-ЭО)
образовано одним (неспаренным) электроном.
Второй элемент – гелий. Второй электрон в его
атоме также стремится к минимуму энергии и, если
он обладает противоположным спином, по принципу
Паули может занять ту же орбиталь. Электронная
формула атома гелия 1s
2 . Также
единственное электронное облако этого атома
образовано двумя электронами (парой электронов).
Третий электрон, появляющийся у атома лития, по
принципу Паули не может занять 1s
-орбиталь и
вынужден занимать большую по энергии 2s
-орбиталь,
образуя вокруг первого второе, большее по
размеру, электронное облако. Электронная формула
атома лития 1s
2 2s
1 .
Последний (четвертый) электрон атома следующего
элемента – бериллия – должен занять ту же 2s
-орбиталь,
так как на ней есть еще свободное место.
Электронная формула бериллия 1s
2 2s
2 ,
и его электронная оболочка состоит из двух
облаков, каждое из которых образовано парой
электронов. Энергетические диаграммы атомов
бора и углерода мы уже разбирали (рис. 24 и 25).
Электронные формулы атомов этих элементов – B 1s
2 2s
2 2p
1
и C 1s
2 2s
2 2p
2 .
2p
-подуровень продолжает заполняться и у
следующих элементов, до неона (Z
= 10)
включительно, у которого этот подуровень
оказывается полностью заполненным. Электронная
формула неона 1s
2 2s
2 2p
6 ,
а его электронная оболочка состоит из пяти
облаков: одного облака первого слоя (1s
-ЭО) и
четырех облаков второго слоя (одно 2s
- и три 2р
-ЭО),
причем все облака образованы парами электронов.
У атомов следующего элемента – натрия –
последний электрон вынужден занимать уже 3s
-орбиталь,
и с его электронного облака начинается
образование третьего электронного слоя.
Электронная формула натрия 1s
2 2s
2 2p
6 3s
1 .
Третий электронный слой (и, естественно, третий
электронный уровень) продолжает заполняться до
аргона включительно, но не заполняется
полностью, так как со следующего атома – атома
калия – начинается заполнение четвертого слоя.
Это происходит потому, что энергия оставшегося
незаполненным 3d
-подуровня больше, чем
энергия 4s
-подуровня. 3d
-подуровень
начинает заполняться только у атома скандия (Sc 1s
2 2s
2 2p
6 3s
2 3p
6 4s
2 3d
1)
после завершения заполнения 4s
-подуровня.
Продолжая заполнять электронами атомные
орбитали, можно получить электронные
конфигурации и атомов следующих элементов.
Необходимо только внимательно следить за
последовательностью подуровней (по рис. 14) и
строго соблюдать принцип наименьшей энергии,
принцип Паули и правило Хунда.
Электронные формулы атомов всех элементов
приведены в приложении 4.
ПРИНЦИП
НАИМЕНЬШНЙ ЭНЕРГИИ, ПРИНЦИП ПАУЛИ,
ПРАВИЛО
ХУНДА, ЕСТЕСТВЕННЫЙ РЯД ХИМИЧЕСКИХ ЭЛЕМЕНТОВ.
1.Сколько
всего электронов может находиться на а) 4s-ЭПУ, б)
4р-ЭПУ, в) 3d-ЭПУ, г) 5f-ЭПУ? 2.Сколько всего электронов
может находиться на каждом из первых пяти ЭУ?
Составьте общую формулу для такого подсчета.
3.Какое квантовое число – общее для всех
электронов внешнего электронного слоя?
Охарактеризуйте его значение.
4.Для атомов Na, Mg, Al, Si, P, S, Cl, Ar а) изобразите
энергетические диаграммы, б) составьте полные
электронные формулы.
Атом – это электронейтральная частица, состоящая из положительно заряженного ядра и отрицательно заряженных электронов.
Атом состоит из ядра (оно имеет положительный заряд) и электронов (они имеют отрицательный заряд). В целом атом электронейтрален.
Положительный заряд ядра атома равен порядковому номеру химического элемента.
Ядро атома – сложная частица. В ядре сосредоточена почти вся масса атома.
Заряд ядра определяют протоны. Причем число протонов равно (по величине) заряду ядра атома, т.е. порядковому номеру.
Число нейтронов N определяют по разности между величинами: «масса ядра» А и «порядковый номер» Z.
электроны, имеющие приблизительно равный запас энергии, находятся на приблизительно равном расстоянии от ядра и образуют энергетический уровень.
Изотопами называют атомы одного и того же химического элемента (одинаковое число протонов), различающиеся массой (разное число нейтронов).
Изотопы и их химические соединения отличаются друг от друга по физическим свойствам, но химические свойства у изотопов одного химического элемента одинаковы.
Форма атома - сферическая. Радиус ядра примерно в 100000 раз меньше радиуса атома.
Химический элемент - вид атомов (совокупность атомов) с одинаковым зарядом ядра (с одинаковым числом протонов в ядре).
Изотоп - совокупность атомов одного элемента с одинаковым числом нейтронов в ядре (или вид атомов с одинаковым числом протонов и одинаковым числом нейтронов в ядре).
Разные изотопы отличаются друг от друга числом нейтронов в ядрах их атомов.
Строение электронной оболочки атома
Атомная орбиталь - состояние электрона в атоме. Условное обозначение орбитали - . Каждой орбитали соответствует электронное облако.
Орбитали реальных атомов в основном состоянии бывают четырех типов: s, p, d и f.
Электронное облако - часть пространства, в которой электрон можно обнаружить с вероятностью 90 (или более) процентов.
Примечание: иногда понятия "атомная орбиталь" и "электронное облако" не различают, называя и то, и другое "атомной орбиталью".
Электронная оболочка атома слоистая. Электронный слой образован электронными облаками одинакового размера. Орбитали одного слоя образуют электронный ("энергетический") уровень, их энергии одинаковы у атома водорода, но различаются у других атомов.
Однотипные орбитали одного уровня группируются в электронные (энергетические) подуровни:
s-подуровень (состоит из одной s-орбитали), условное обозначение - .
p-подуровень (состоит из трех p-орбиталей), условное обозначение - .
d-подуровень (состоит из пяти d-орбиталей), условное обозначение - .
f-подуровень (состоит из семи f-орбиталей), условное обозначение - .
Энергии орбиталей одного подуровня одинаковы.
Порядок заполнения электронами орбиталей атома определяется тремя законами природы (формулировки даны упрощенно):
1. Принцип наименьшей энергии - электроны заполняют орбитали в порядке возрастания энергии орбиталей.
2. Принцип Паули - на одной орбитали не может быть больше двух электронов.
3. Правило Хунда - в пределах подуровня электроны сначала заполняют свободные орбитали (по одному), и лишь после этого образуют электронные пары.
Общее число электронов на электронном уровне (или в электронном слое) равно 2n2.
Распределение подуровней по энергиям выражается рядом (в прядке увеличения энергии):
1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p .
Валентные электроны - электроны атома, которые могут принимать участие в образовании химических связей. У любого атома это все внешние электроны плюс те предвнешние электроны, энергия которых больше, чем у внешних. Например: у атома Ca внешние электроны - 4s2, они же и валентные; у атома Fe внешние электроны - 4s2, но у него есть 3d6, следовательно у атома железа 8 валентных электронов. Валентная электронная формула атома кальция - 4s2, а атома железа - 4s23d6.
Орбиталь – пространство вокруг ядра, в котором наиболее вероятно нахождение электрона. Применительно к электрону можно сказать, что он ведет себя и как частица, и как волна, т. е. обладает, как и другие микрочастицы, корпускулярно-волновым дуализмом (двойственностью). С одной стороны, электроны как частицы производят давление, с другой стороны, движущийся поток электронов обнаруживает волновые явления, например дифракцию электронов.
- Что показывает коэффициент обеспеченности финансовых обязательств активами Обеспеченность обязательств финансовыми активами в бюджетном учреждении
- Как приготовить классические вареники с творогом
- Как сделать тесто для яблочной шарлотки Как приготовить шарлотку с яблоками песочное тесто
- Отечественной войны 2 степени
- День полного освобождения Ленинграда от фашистской блокады
- Манная каша на молоке: пропорции и рецепты приготовления Манная каша 1 порция
- Суп-пюре из брокколи с сыром Рецепт крем супа из брокколи с сыром

 Live Journal
Live Journal Facebook
Facebook Twitter
Twitter
