Что такое большой период в химии. Периодическая система химических элементов - графическое выражение периодического закона. Понятие о периодах и группы
Периодический закон, являющийся основой современной химии и объясняющий закономерности изменения свойств химических элементов, был открыт Д.И. Менделеевым в 1869 году. Физический смысл этого закона вскрывается при изучении сложного строения атома.
В XIX веке считалось, что атомная масса является главной характеристикой элемента, поэтому для классификации веществ использовали именно ее. Сейчас атомы определяют и идентифицируют по величине заряда их ядра (числу протонов и порядковому номеру в таблице Менделеева). Впрочем, атомная масса элементов за некоторыми исключениями (например, атомная масса калия меньше атомной массы аргона) увеличивается соразмерно их заряду ядра.
При увеличении атомной массы наблюдается периодическое изменение свойств элементов и их соединений. Это металличность и неметалличность атомов, атомный радиус и объем, потенциал ионизации, сродство к электрону, электроотрицательность, степени окисления, физические свойства соединений (температуры кипения, плавления, плотность), их основность, амфотерность или кислотность.
Сколько элементов в современной таблице Менделеева
Таблица Менделеева графически выражает открытый им периодический закон. В современной периодической системе содержится 112 химических элементов (последние – Мейтнерий, Дармштадтий, Рентгений и Коперниций). По последним данным, открыты и следующие 8 элементов (до 120 включительно), но не все из них получили свои названия, и эти элементы пока еще мало в каких печатных изданиях присутствуют.
Каждый элемент занимает определенную клетку в периодической системе и имеет свой порядковый номер, соответствующий заряду ядра его атома.
Как построена периодическая система
Структура периодической системы представлена семью периодами, десятью рядами и восемью группами. Каждый период начинается щелочным металлом и заканчивается благородным газом. Исключения составляют первый период, начинающийся водородом, и седьмой незавершенный период.
Периоды делятся на малые и большие. Малые периоды (первый, второй, третий) состоят из одного горизонтального ряда, большие (четвертый, пятый, шестой) – из двух горизонтальных рядов. Верхние ряды в больших периодах называются четными, нижние – нечетными.
В шестом периоде таблицы после лантана (порядковый номер 57) находятся 14 элементов, похожих по свойствам на лантан, – лантаноидов. Они вынесены в нижнюю часть таблицы отдельной строкой. То же самое относится и к актиноидам, расположенным после актиния (с номером 89) и во многом повторяющим его свойства.
Четные ряды больших периодов (4, 6, 8, 10) заполнены только металлами.
Элементы в группах проявляют одинаковую высшую валентность в оксидах и других соединениях, и эта валентность соответствует номеру группы. Главные подгруппы вмещают в себя элементы малых и больших периодов, побочные – только больших. Сверху вниз металлические свойства усиливаются, неметаллические – ослабевают. Все атомы побочных подгрупп – металлы.
Внимание, только СЕГОДНЯ!
Все интересное
Атомы состоят из субатомных частиц - протонов, нейтронов и электронов. Протоны представляют собой положительно заряженные частицы, которые находятся в центре атома, в его ядре. Вычислить число протонов изотопа можно по атомному номеру…
Сны способны менять реальность, если их воплотить в жизнь. Иногда именно в них человек находит ответы на свои вопросы. Случается даже то, что сны ученого становятся новой ступенью эволюции. Так было с Менделеевым и его периодическим законом. С чего…
Открытие периодического закона русским химиком Дмитрием Ивановичем Менделеевым стало вершиной развития химии в 19 веке. Совокупность знаний о свойствах 63 известных на тот момент элементов была приведена в стройную систему. Создание…
Периодическая система химических элементов – это уникальный справочный материал, который нужно правильно «читать», а затем воспользоваться полученной информацией. Помимо этого таблица Д.И. Менделеева считается разрешенным материалом на…
О металлических и неметаллических свойствах вещества целесообразно говорить в связи с периодической системой химических элементов. Таблица Менделеева устанавливает зависимость химических свойств элементов от заряда их атомного ядра. Все…
Химический элемент состоит из одинаковых атомов, обладающих совокупностью свойств. Эти свойства зависят от многих факторов, прежде всего от строения атома. Сколько электронных уровней в атоме, сколько электронов находится на самом внешнем уровне,…
Атом – это мельчайшая частица, которую разделить на составные части химическим путем невозможно. Атом состоит из положительно заряженного ядра за счет протонов (р) с зарядом + и нейтральных частиц нейтронов (n). Вокруг него вращаются электроны (),…
Открытие периодического закона и создание упорядоченной системы химических элементов Д.И. Менделеевым стали апогеем развития химии в XIX веке. Ученым был обобщен и систематизирован обширный материал знаний о свойствах элементов. Инструкция 1В XIX…
Протоны и нейтроны, содержащиеся в атомном ядре, называют нуклонами. Поскольку практически вся масса атома сосредоточена в его ядре, то массовое число атома означает количество нуклонов в ядре. С помощью периодической таблицы химических элементов…
Атомное ядро состоит из частиц с общим названием нуклоны. Известно два их вида – нейтроны и протоны. Количество нейтронов можно найти по массе атома, поскольку она практически равна массе атомного ядра (масса электронной оболочки пренебрежимо мала)…
Периодическая система химических элементов - графическое выражение периодического закона. Понятие о периодах и группы
Периодическая система химических элементов - это классификация химических элементов, основанная на определенных особенностях строения атомов химических элементов. Ее было составлено на основе Периодического закона, открытого в 1869 году Д. И. Менделеевым. В то время Периодическая система включала 63 химические элементы и по виду отличалась от современной. Теперь к Периодической системы входят около ста двадцати химических элементов.
Периодическую систему составлен в виде таблицы, в которой химические элементы расположены в определенном порядке: по возрастанию их атомных масс. Сейчас существует много видов изображения Периодической системы. Наиболее распространенным является изображение в виде таблицы с расположением элементов слева направо. Все химические элементы в Периодической системе объединены в периоды и группы. Периодическая система включает семь периодов и восемь групп. Периодами называют горизонтальные ряды химических элементов, в которых свойства элементов изменяются от типовых металлических до неметаллических. Вертикальные столбики химических элементов, которые содержат элементы, сходные по химическим свойствам, образуют группы химических элементов.
Первый, второй и третий периоды называют малыми , поскольку они содержат небольшое количество элементов (первый - два элемента, второй и третий - по восемь элементов). Элементы второго и третьего периодов называют типичными , их свойства закономерно изменяются от типичного металла до инертного газа. Все остальные периоды называют большими (четвертый и пятый содержат по 18 элементов, шестой - 32 и седьмой - 24 элементы). Особое сходство свойств проявляют элементы, находящиеся внутри больших периодов, в конце каждого четного ряда. Это так называемые триады : Железо - Кобальт - Никол, которые образуют семью Железа, и две другие: Рутений - Родий - Палладий и Осмий - Иридий - Платина, которые образуют семью платиновых металлов (платиноидов).
В нижней части таблицы Д. И. Менделеева расположены химические элементы, которые образуют семейство лантаноидов и семью актиноидов. Все эти элементы формально входящих в состав третьей группы и идут после химических элементов Лантана (номер 57) и Актинію (номер 89). Периодическая система элементов содержит десять рядов. Малые периоды (первый, второй и третий) состоят из одного ряда, большие периоды (четвертый, пятый и шестой) содержат по два ряда каждый. В седьмом периоде находится один ряд.
Каждый большой период состоит из четного и нечетного рядов. В парных рядах содержатся элементы металлы, в нечетных рядах свойства элементов меняются так, как в типовых элементов, то есть от металлических до выраженных неметаллических.
Каждая группа таблицы Д. И. Менделеева состоит из двух подгрупп: главной и побочной. В состав главных подгрупп входят элементы как малых, так и больших периодов, то есть главные подгруппы начинаются или с первого, или со второго периода. К состав побочных подгрупп входят элементы только больших периодов, то есть побочные подгруппы начинаются только с четвертого периода. Подгруппы образованы элементами с подобными свойствами. Главная подгруппа i группы содержит семейство щелочных металлов, VII группы - семейство галогенов, VIII группы инертных.
Свойства элементов в подгруппах закономерно изменяются с ростом относительной атомной массы. В главных подгруппах при увеличении атомной массы возрастают металлические свойства элементов и простых веществ, а неметаллические снижаются.
К четвёртому периоду периодической системы относятся элементы четвёртой строки (или четвёртого периода) периодической системы химических элементов. Строение периодической таблицы основано на строках для иллюстрации повторяющихся (периодических)… … Википедия
К пятому периоду периодической системы относятся элементы пятой строки (или пятого периода) периодической системы химических элементов. Строение периодической таблицы основано на строках для иллюстрации повторяющихся (периодических) трендов в… … Википедия
К седьмому периоду периодической системы относятся элементы седьмой строки (или седьмого периода) периодической системы химических элементов. Строение периодической таблицы основано на строках для иллюстрации повторяющихся (периодических) трендов … Википедия
К шестому периоду периодической системы относятся элементы шестой строки (или шестого периода) периодической системы химических элементов. Строение периодической таблицы основано на строках для иллюстрации повторяющихся (периодических) трендов в… … Википедия
К первому периоду периодической системы относятся элементы первой строки (или первого периода) периодической системы химических элементов. Строение периодической таблицы основано на строках для иллюстрации повторяющихся (периодических) трендов в… … Википедия
Ко второму периоду периодической системы относятся элементы второй строки (или второго периода) периодической системы химических элементов. Строение периодической таблицы основано на строках для иллюстрации повторяющихся (периодических) трендов в … Википедия
К третьему периоду периодической системы относятся элементы третьей строки (или третьего периода) периодической системы химических элементов. Строение периодической таблицы основано на строках для иллюстрации повторяющихся (периодических) трендов … Википедия
Включает гипотетические химические элементы, принадлежащие к дополнительной восьмой строке (или периоду) периодической системы. Систематизированные названия этих элементов переданы ИЮПАК к использованию. Ни один из этих элементов пока не был… … Википедия
Период строка периодической системы химических элементов, последовательность атомов по возрастанию заряда ядра и заполнению электронами внешней электронной оболочки. Периодическая система имеет семь периодов. Первый период, содержащий 2 элемента … Википедия
Короткая форма таблицы Менделеева основана на параллелизме степеней окисления элементов главных и побочных подгрупп: например, максимальная степень окисления ванадия равна +5, как у фосфора и мышьяка, максимальная степень окисления хрома равна +6 … Википедия
Книги
- Преобразования дифференциальных систем, не меняющие симметрий времени , Владимир Мироненко. В работе выведено уравнение для нахождения возмущений, не меняющих отображения за период периодической дифференциальной системы. Установлены достаточные условиясовпадения отображений за…
- Третий период периодической системы , Джесси Рассел. Эта книга будет изготовлена в соответствии с Вашим заказом по технологии Print-on-Demand. High Quality Content by WIKIPEDIA articles! К тре?тьему пери?оду периоди?ческой систе?мы относятся…
Исходя из определения периода можно сделать вывод об изменениях свойств элементов: слева направо свойства элементов изменяются отметаллических через амфотерные к неметаллическим. А следовательно свойства их соединений изменяются от основных через амфотерные к кислотным.
Например III период:
Такая закономерность имеется и в больших периодах, но металличность уменьшается значительно медленнее.
Группа – вертикальный ряд элементов, расположенных по мере увеличения заряда ядра атомов, и имеющих одинаковую электронную конфигурацию внешнего энергетического уровня, т.е. имеют одинаковое число электронов на внешних подоболочках. Отсюда элементы одной группы имеют одинаковую высшую положительную степень окисления (высшую валентность), равную номеру группы.
Таблица
|
Группы |
|||||||
Исключения: у фтора степень окисления – 1(F -1); Cu, Ag, Au проявляют степень окисления +1, +2, +3; элементы VIII группы не дают соединений со степенью окисления +8 (только Os, Ru, Xe дают соединения со степенью окисления+8: OsO 4 , RuO 4, XeO 4).
Группа – понятие широкое. В одну группу входят элементы с разными химическими свойствами. По химическим свойствам элементы группы делят на подгруппы: главные (А) и побочные(В).
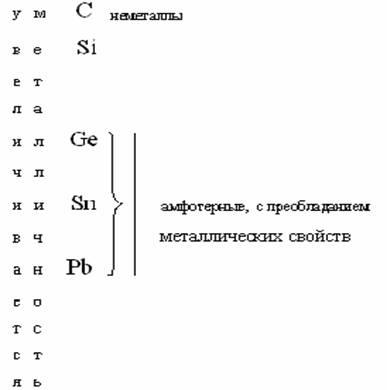
Главные подгруппы (А) начинаются во II периоде (элементами Li, Be, B, C, N, O, F) и благородные газы. Побочные подгруппы (В) начинаются в ІV периоде, куда также входят лантаноиды и актиноиды. Изменение химических свойств в главных ( А) подгруппах следующее: сверху вниз по группе свойства элементов изменяются от неметаллических через амфотерные к металлическим, а свойства их соединений от основных через амфотерные к кислотным. Например: ІV подгруппа А:

Если
в подгруппе А все
элементы металлы, то эта закономерность
остается, т.е. металличность сверху
вниз усиливается. Например, І группа
(подгруппа А): 19 K более металличен,
чем 3 Li,
а 55 Cs металличнее 19 K.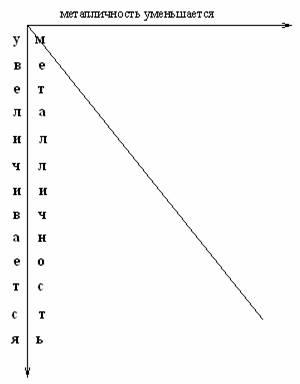
Чтобы учесть изменение химических свойств элементов по периоду и группе нужно периодическую систему разделить диагональю от H до At, и отметить изменение металличности по периоду и по группе.
Как видно из схемы, в левом нижнемуглурасполагаются металлы (самый металлич. Fe), а в правом верхнем – неметаллы (самый неметаллический F).
Амфотерные элементы занимают промежуточное положение между металлами и неметаллами .
Главные вопросы, которые возникли после открытия периодического закона:
1. Причины периодического изменения химических свойств элементов.
2. Причины деления групп на подгруппы.
3. Причины большого сходства лантаноидов и актиноидов.
4. Причина трёх исключений в несоответствии величины атомной массы и положения элемента в периодической системе.
На эти вопросы ученые получили ответ после изучения строения атома.
- Манная каша на молоке: пропорции и рецепты приготовления Манная каша 1 порция
- Суп-пюре из брокколи с сыром Рецепт крем супа из брокколи с сыром
- Гороскоп: характеристика Девы, рождённой в год Петуха
- Причины выброса токсичных веществ Несгораемые углеводороды и сажа
- Современный этап развития человечества
- Лилия яковлевна амарфий Могила лилии амарфий
- Значение имени мариям Имя марьям значение происхождение

 Live Journal
Live Journal Facebook
Facebook Twitter
Twitter