Углерод строение атома. Особенности строения атома углерода

ЦЕЛЬ И ЗАДАЧИ УРОКА: РАСКРЫТЬ ПРИЧИНЫ МНОГООБРАЗИЯ СОЕДИНЕНИЙ, ОБРАЗОВАННЫХ АТОМАМИ УГЛЕРОДА. ОБРАЗОВАТЕЛЬНЫЕ:1. РАСКРЫТЬ ОСОБЕННОСТИ СТРОЕНИЯ АТОМА УГЛЕРОДА И ОБРАЗОВАНИЕ ИМ ХИМИЧЕСКИХ СВЯЗЕЙ. РАССМО- ТРЕТЬ АЛЛОТРОПНЫЕ МОДИФИКАЦИИ АТОМА УГЛЕРОДА И ЗАВИСИМОСТЬ ИХ СВОЙСТВ ОТ СТРОЕНИЯ. 2. ПРОДОЛЖАТЬ ФОРМИРОВАТЬ ЗНАНИЯ УЧАЩИХСЯ О СТРОЕНИИ АТОМА, ХИМИЧЕСКОЙ СВЯЗИ И МЕХАНИЗМАХ ЕЕ ОБРАЗОВАНИЯ, АЛЛОТРОПИИ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ НА ПРИМЕРЕ УГЛЕРОДА; РАЗВИВАТЬ ТАКИЕ ПОНЯТИЯ КАК ГИБРИДИЗАЦИЯ, - И -СВЯЗИ. РАЗВИВАЮЩИЕ: РАЗВИВАТЬ У УЧАЩИХСЯ УМЕНИЯ УСТАНАВЛИВАТЬ ПСС, УМЕНИЕ АНАЛИЗИРОВАТЬ ИДЕЛАТЬ ВЫВОДЫ ВОСПИТАТЕЛЬНЫЕ: СПОСОБСТВОВАТЬ ОСОЗНАННОМУ ОТНОШЕНИЮ К НАУКЕ КАК ЧАСТИ ВСЕОБЩЕЙ КУЛЬТУРЫ, ВОСПИТЫВАТЬ САМОСТОЯТЕЛЬНОСТЬ.
3: Почему графен так важен? В настоящее время это самый тонкий, самый легкий и мощный человек на открытом воздухе. Отличная проводимость и высокая температура и очень гибкая. Графен может растягиваться равномерно на 20%. Исследователи признают, что новый материал более чем в 200 раз сильнее, чем сталь, хотя он полностью состоит из одного слоя атомов углерода. Графеновая мембрана не пропускает газы, в том числе атомы гелия, и в результате простой обработки материал может превращаться из идеального проводника в идеальный изолятор.
4: Для чего мы можем использовать графен? Возможности использования нового материала почти бесконечны. Благодаря низкому удельному сопротивлению, отличной теплопроводности и высокой скорости потока электронов графен может эффективно заменить кремний в процессорах. Более легкие и быстрые чипы, например, в телефонах, являются одним, но новый материал также можно использовать для создания сверхчувствительных и гибких сенсорных экранов.
ПЛАН: 1.Особенности строения атома углерода. 2. Образование химической связи между атомами углерода в простых веществах на примере графита, алмаза и карбина: (гибридизация, - и - связи). 3. Сравнительная характеристика аллотропных модификаций углерода.

Что может быть общего между пестрым букетом цветов и куском каменного угля? Что общего между разнообразным содержимым склянок, аккуратно расставленных на полках аптечных шкафов, и нефтью? Общего, конечно, мало! И долго пришлось бы искать такого чудака, который своей возлюбленной вместо духов решился бы преподнести… кусок каменного угля. Правда, в Париже была мода на бусы из… антрацита. Не нашлось бы, пожалуй, и врача, рекомендовавшего своим пациентам вместо лекарств натуральную нефть. Однако и черный, невзрачный, тускло поблескивающий в солнечных лучах кусок каменного угля, и пестрый букет цветов, и нефть все они содержат углерод, без которого невозможно существование ни медикаментов, ни большинства взрывчатых веществ, ни огромного множества так называемых органических соединений, из которых в свою очередь состоят организмы человека, животных и растений.

Он также размышляет над использованием графена в новых батареях и аккумуляторах: они экономят больше энергии за меньшее время и сохраняют его дольше. Прозрачный и прочный материал может быть идеальным защитным и нагревательным покрытием на стеклах или окнах.
Графен легко реагирует с другими металлами, изменяя его свойства. Исследователи из Манчестерского университета даже начали работу над сверхтонкими презервативами из нового, супер-сырьевого материала. 5: Почему мы не встретились с коммерческим использованием графена?
До недавнего времени основным препятствием для работы и исследований графена была высокая стоимость его производства и использования токсичных материалов в этом процессе. Польша может похвастаться успехом в этой научной расе, в том числе благодаря Институту электронных материалов, который производит наибольшее количество графена в Европе.
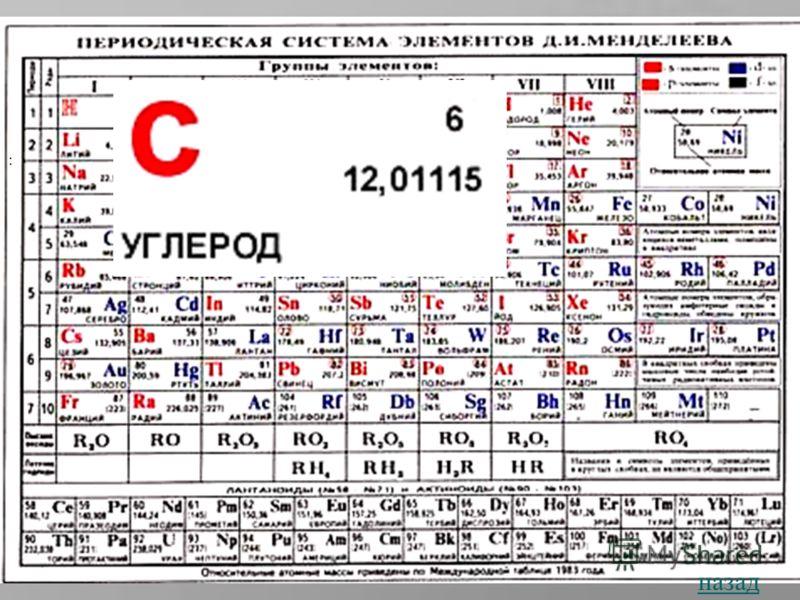
Элемент IVA группы 2-го периода ПЕРИОДИЧЕСКОЙ СИСТЕМЫ ЭЛЕМЕНТОВ; порядковый номер 6; атомная масса 12,01115.ПЕРИОДИЧЕСКОЙ СИСТЕМЫ ЭЛЕМЕНТОВ Электронная конфигурация в основном состоянии 1s 2 2s 2 2p 2. Дальше Электронная конфигурация атома углерода в возбужденном состоянии * 1s ² 2 s ¹ 2p³

Казалось бы, что-то, что мы знаем и используем в течение долгого времени, больше нас не удивит. Но уголь становится все более и более удивительным, и исследователи собирают самые престижные награды за свои исследования. Самая большая карьера разнообразия угля была в нанотехнологии, до недавнего времени только одной из тем научно-фантастических романов, которая постепенно становится реальностью.
Что заставляет уголь однажды принимать форму твердого алмаза, а в других случаях мягкий графит, когда-то хороший материал для электродов, а в другой раз он отлично работает как изолятор? Все зависит от распределения атомов в кристаллической решетке, что приводит к различным свойствам элемента. Это называется алотропией.
Углерод - особый элемент. Ни один другой химический элемент не способен образовывать такое многообразие соединений. Причина этого многообразия в том, что атомы углерода способны: соединяться друг с другом в цепи различного строения: открытые (неразветвленные, разветвленные), замкнутые: В невозбужденном состоянии атомы углерода практически не встречаются в соединениях. При образовании межатомных связей в молекулах происходит гибридизация электронов внешней оболочки по типу sp3 в алмазе, sp2 в графите и фуллеренах и sp в карбинах.

Наиболее известными аллотропными разновидностями углерода являются графит и алмаз, два материала с совершенно разными характеристиками. Графит - в отличие от алмаза - очень хороший проводник электрического тока, кроме того, он мягкий. Алмаз - изолятор и один из самых твердых материалов в природе. Различия связаны с тем, что атомы атомов образуют шестичленные кольца, соединенные сильными ковалентными связями только в одной плоскости. В каждом из этих шестичленных колец имеется шесть делокализованных электронов, так что графит является очень проводящим и часто используется в качестве материала электрода.
Одна s- и три р-орбитали смешиваются, и образуются четыре равноценные по форме и энергии sp 3 -гибридные орбитали. Для атома углерода этот процесс происходит по схеме:. Оси sp 3 -гибридных орбиталей направлены к вершинам правильного тетраэдра. Тетраэдрический угол между ними равен 109°28", что соответствует наименьшей энергии отталкивания электронов. дальше

Алмаз имеет совершенно другую структуру. Этот феноменально твердый угольный сорт формируется сильными ковалентными связями, которые соединяют каждый атом углерода с четырьмя другими. Его основные «кирпичи» - ячейка кристаллической решетки - это обычный тетраэдр. Никакие свободные электроны не появляются в структуре, поэтому алмаз электрически изолирован. Это хороший проводник тепла.
И алмаз, и графит известны с древних времен, и они, казалось, уже не могли нас удивить. Оказалось, что больше ничего плохого! Вероятно, самым новаторским использованием алмаза может быть спинтроника, преемник электроники, в которой вместо электрических токов используются магнитные токи.
АЛМАЗ Алмаз является диэлектриком, причем его электросопротивление одинаково по всем направлениям кристалла. Это связано с тем, что все валентные электроны входят в четыре равноценные -связи, а свободные - электроны, образующие облако, отсутствуют. Кристаллы алмаза имеют октаэдрическую форму, каждый атом кристаллической решетки расположен в центре тетраэдра из других атомов углерода. Все расстояния между атомами одинаковы (0,15445нм), как и углы между связями (109,5нм). Кристаллы алмаза бесцветны, отличаются высоким показателем преломления и твердостью Кристаллическое вещество, прозрачное, сильно преломляет лучи света, очень твёрдое, не проводит электрический ток, плохо проводит тепло, r = 3,5 г/см3; t°пл. = 3730°C; t°кип. = 4830°C. Атомы углерода находятся в sp3- гибридизации и образуют атомную кристаллическую решётку с прочными ковалентными s- связями.

Как вы знаете, электроны имеют ненулевой спин, квантовый признак, связанный с вращением и ответственный за магнитные свойства. Оба направления спина связаны с магнитным полем с противоположными ориентациями. Им могут быть назначены логические значения 0 и 1 и, таким образом, использовать спин для переноса информации.
Если элементная ячейка алмаза модифицирована так, что один атом углерода замещается атомом азота и смежным атомом углерода удаляется, модифицированный алмаз перестает быть изолятором и становится полупроводником с фантастическими свойствами, превосходным материалом для использования в спинотронных устройствах, работающих в комнатная температура. Пинтроника - это не просто уголь. На протяжении многих лет американские исследователи изучали лазерное испарение полупроводниковых материалов. Результаты были особенно интересны для графита.
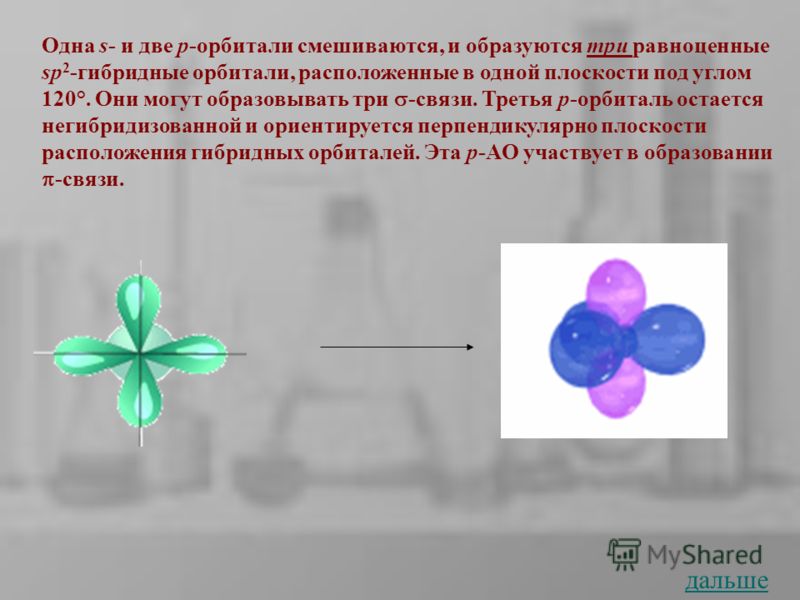
Одна s- и две p-орбитали смешиваются, и образуются три равноценные sp 2 -гибридные орбитали, расположенные в одной плоскости под углом 120°. Они могут образовывать три -связи. Третья р-орбиталь остается негибридизованной и ориентируется перпендикулярно плоскости расположения гибридных орбиталей. Эта р-АО участвует в образовании -связи. дальше
Сначала было замечено, что оно дает продукты в виде структур из нескольких десятков атомов. Оказалось, что каждый раз, когда испаряемый графит самоорганизуется в более сложные конфигурации, с особенно большим количеством комплексов, состоящих из 60 атомов углерода. Возник вопрос о структуре такого создания.
Таинственные системы атомов углерода напоминали скошенное двадцать вещей, построенное из пяти - и шестикольцевых колец, устроенных так, чтобы напоминать традиционный футбольный мяч. Эта структура, как и шар, пуста внутри. Фуллера, американского архитектора и философа, изобретателя геодезических куполов. Сегодня мы знаем, что фуллерены представляют собой целые семейства структур с по меньшей мере 60 атомами углерода, каждый из которых состоит из пяти и шестичленных колец. Он поглощает видимый свет во всем спектре, поэтому его можно использовать в фотогальванических ячейках.
ГРАФИТ Кристаллическое вещество, слоистое, непрозрачное, тёмно-серое, обладает металлическим блеском, мягкое, проводит электрический ток; r = 2,5 г/см3. В кристаллической решётке атомы углерода находятся в sp2- гибридном состоянии и образуют слои из шестичленных колец; между слоями действуют межмолекулярные силы. Графит представляет собой непрерывный ряд слоев, параллельных основной плоскости и состоящих из гексагонально связанных друг с другом атомов углерода. Расстояние между любыми соседними атомами углерода в плоскости слоя равно 0,1415нм, между соседними слоями 0,3354нм. Каждый атом в слое связан с тремя соседними, и углы между связями составляют 120нм. В связях участвуют три валентных электрона из четырех, оставшиеся электроны образуют общее электронное облако.

Поскольку фуллерены пустые посередине, они начали задаваться вопросом, может ли что-то вставить в пустоту. Оказалось, что они содержат лантаноиды и даже актиниды. Исследования показали, что такие «клетки» с элементами в середине имеют интересные свойства. Эксперименты носили чисто когнитивный характер, поскольку производство таких «захваченных» элементов очень дорого. До сих пор трудно рассчитывать на использование таких материалов в более широких масштабах.
С момента открытия углеродных «шариков» прошло более 20 лет, и мы все еще ждем практического применения этого материала. Его можно использовать, например, в качестве основного элемента датчика влажности. Адсорбция воды на углеродных структурах изменяет резонансную частоту кварцевого элемента. Датчик работает очень хорошо, и дополнительным преимуществом является его очень короткое время отклика.
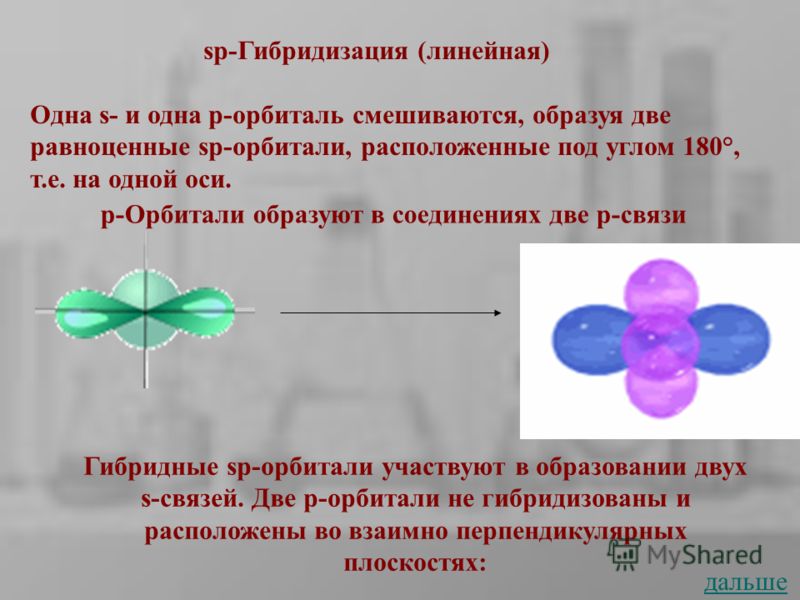
Sp-Гибридизация (линейная) Одна s- и одна р-орбиталь смешиваются, образуя две равноценные sp-орбитали, расположенные под углом 180°, т.е. на одной оси. p-Орбитали образуют в соединениях две p-связи Гибридные sp-орбитали участвуют в образовании двух s-связей. Две р-орбитали не гибридизованы и расположены во взаимно перпендикулярных плоскостях: дальше
Поскольку это один из самых важных параметров датчика, он определяет превосходство датчиков влажности фуллерен-кварца над конкурентами. Следуя этому примеру, другие исследователи обнаружили, что углеродные «шарики» являются сенсационным материалом для построения устройств обнаружения газа. Датчик может быть сконструирован путем применения фуллеренов к алюминиевому листу. Повышение или понижение концентрации газа преобразуется устройством в электрический сигнал. Контроль присутствия этого соединения в воздухе имеет решающее значение для экологии.
КАРБИН Он подразделяется на две модификации: с кумулированными связями =С=С=С= (β -карбин) и полииновыми связями -С С-С С- (-карбин). Эти модификации различаются по составу продуктов озонирования: Карбин- порошок черного цвета. В нем атомы углерода выстроены в одну прямую цепочку. Впервые карбин синтезирован в 60-х годах советскими химиками. Позднее он был найден в метеоритном кратере Рис в Баварии (Германия). По твердости он занимает промежуточное положение между графитом и алмазом. Он обладает полупроводниковыми свойствами. При нагревании переходит в графит.

В последние дюжины или около того лет фурор сделан из одномерных углеродных наноструктур, называемых нанорубиками. На снимках были показаны трубки, отношение длины к диаметру было почти невообразимо большим, настолько огромным, что их можно было рассматривать как одномерные объекты.
Как и графит, углеродные нанотрубки состоят из гексагональных колец, и каждый из атомов углерода, образующих их, имеет один свободный электрон. В результате они могут проводить электричество столько, сколько металлы или ведут себя как полупроводники в зависимости от их конструкции. Эти свойства были использованы для построения одного из первых транзисторов нанометрового размера. Это очень привлекательное решение для электронной промышленности, потому что транзисторы состоят из логических вентилей для процессоров и чипов памяти.
1. Атом углерода способен образовывать не только простые (одинарные), но и кратные (двойные, тройные) связи: 2. Он образует прочные связи почти с любым другим элементом. Эти уникальные свойства углерода объясняются сочетанием двух факторов: наличие на внешнем энергетическом уровне (2s и 2p) четырех электронов (поэтому атом углерода не склонен ни терять, ни приобретать свободные электроны с образованием ионов); малый размер атома (в сравнении с другими элементами IV группы). Вследствие этого углерод образует главным образом ковалентные, а не ионные связи, и проявляет ковалентность, равную 4. ВЫВОДЫ:

Транзисторам современных компьютеров приходится течь огромное количество электронов. Ограничивая их количество отдельными электронами, компьютеры могли работать намного быстрее. Интересно, что этот электрон после прохождения через нанотрубный транзистор сохраняет свое начальное квантовое состояние. Это эффект, который не наблюдается в обычных электронных схемах. Углеродные нанотрубки также встроены в суперконденсаторы. Благодаря своим электрическим свойствам и большой площади поверхности нанотрубные электроды очень эффективны.
Транзисторам современных компьютеров приходится течь огромное количество электронов. Ограничивая их количество отдельными электронами, компьютеры могли работать намного быстрее. Интересно, что этот электрон после прохождения через нанотрубный транзистор сохраняет свое начальное квантовое состояние. Это эффект, который не наблюдается в обычных электронных схемах. Углеродные нанотрубки также встроены в суперконденсаторы. Благодаря своим электрическим свойствам и большой площади поверхности нанотрубные электроды очень эффективны.
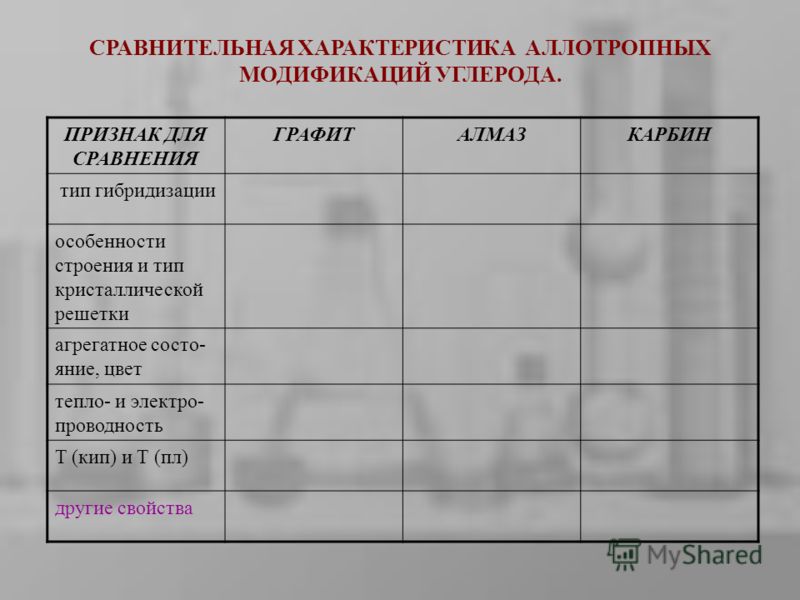
ПРИЗНАК ДЛЯ СРАВНЕНИЯ ГРАФИТАЛМАЗКАРБИН тип гибридизации особенности строения и тип кристаллической решетки агрегатное состо- яние, цвет тепло- и электро- проводность T (кип) и Т (пл) другие свойства СРАВНИТЕЛЬНАЯ ХАРАКТЕРИСТИКА АЛЛОТРОПНЫХ МОДИФИКАЦИЙ УГЛЕРОДА.
ДОМАШНЕЕ ЗАДАНИЕ: 1.Подготовить сообщение на одну из тем: «Многоликий углерод», «Искусственные алмазы», «Применение радиоактивного изотопа углерода в научных целях». 2. Заполнить последнюю строчку в таблице. 3. Рекламная кампания: Товар для рекламы – Углерод, Графит, Алмаз (по выбору). При выполнении домашнего задания 2 вы можете обратиться на сайты:

УГЛЕРОД, С (carboneum), неметаллический химический элемент IVA группы (C, Si, Ge, Sn, Pb) периодической системы элементов. Встречается в природе в виде кристаллов алмаза (рис. 1), графита или фуллерена и других форм и входит в состав органических (уголь, нефть, организмы животных и растений и др.) и неорганических веществ (известняк, пищевая сода и др.). Углерод широко распространен, но содержание его в земной коре всего 0,19%.
Углерод широко используется в виде простых веществ. Кроме драгоценных алмазов, являющихся предметом ювелирных украшений, большое значение имеют промышленные алмазы - для изготовления шлифовального и режущего инструмента. Древесный уголь и другие аморфные формы углерода применяются для обесцвечивания, очистки, адсорбции газов, в областях техники, где требуются адсорбенты с развитой поверхностью. Карбиды, соединения углерода с металлами, а также с бором и кремнием (например, Al 4 C 3 , SiC, B 4 C) отличаются высокой твердостью и используются для изготовления абразивного и режущего инструмента. Углерод входит в состав сталей и сплавов в элементном состоянии и в виде карбидов. Насыщение поверхности стальных отливок углеродом при высокой температуре (цементация) значительно увеличивает поверхностную твердость и износостойкость.
В природе существует множество различных форм графита; некоторые получены искусственно; имеются аморфные формы (например, кокс и древесный уголь). Сажа, костяной уголь, ламповая сажа, ацетиленовая сажа образуются при сжигании углеводородов при недостатке кислорода. Так называемый белый углерод получается сублимацией пиролитического графита при пониженном давлении - это мельчайшие прозрачные кристаллики графитовых листочков с заостренными кромками.
Историческая справка.
Графит, алмаз и аморфный углерод известны с древности. Издавна известно, что графитом можно маркировать другой материал, и само название «графит», происходящее от греческого слова, означающего «писать», предложено А.Вернером в 1789. Однако история графита запутана, часто за него принимали вещества, обладающие сходными внешними физическими свойствами, например молибденит (сульфид молибдена), одно время считавшийся графитом. Среди других названий графита известны «черный свинец», «карбидное железо», «серебристый свинец». В 1779 К.Шееле установил, что графит можно окислить воздухом с образованием углекислого газа.
Впервые алмазы нашли применение в Индии, а в Бразилии драгоценные камни приобрели коммерческое значение в 1725; месторождения в Южной Африке были открыты в 1867. В 20 в. основными производителями алмазов являются ЮАР, Заир, Ботсвана, Намибия, Ангола, Сьерра-Леоне, Танзания и Россия. Искусственные алмазы, технология которых была создана в 1970, производятся для промышленных целей.
Аллотропия.
Если структурные единицы вещества (атомы для одноатомных элементов или молекулы для полиатомных элементов и соединений) способны соединяться друг с другом в более чем одной кристаллической форме, это явление называется аллотропией. У углерода три аллотропические модификации - алмаз, графит и фуллерен. В алмазе каждый атом углерода имеет 4 тетраэдрически расположенных соседа, образуя кубическую структуру (рис. 1,а ). Такая структура отвечает максимальной ковалентности связи, и все 4 электрона каждого атома углерода образуют высокопрочные связи С-С, т.е. в структуре отсутствуют электроны проводимости. Поэтому алмаз отличается отсутствием проводимости, низкой теплопроводностью, высокой твердостью; он самый твердый из известных веществ (рис. 2). На разрыв связи С-С (длина связи 1,54 Å, отсюда ковалентный радиус 1,54/2 = 0,77 Å) в тетраэдрической структуре требуются большие затраты энергии, поэтому алмаз, наряду с исключительной твердостью, характеризуется высокой температурой плавления (3550° C).
Другой аллотропической формой углерода является графит, сильно отличающийся от алмаза по свойствам. Графит - мягкое черное вещество из легко слоящихся кристалликов, отличающееся хорошей электропроводностью (электрическое сопротивление 0,0014 Ом·см). Поэтому графит применяется в дуговых лампах и печах (рис. 3), в которых необходимо создавать высокие температуры. Графит высокой чистоты применяют в ядерных реакторах в качестве замедлителя нейтронов. Температура плавления его при повышенном давлении равна 3527° C. При обычном давлении графит сублимируется (переходит из твердого состояния в газ) при 3780° C.
Структура графита (рис. 1,б ) представляет собой систему конденсированных гексагональных колец с длиной связи 1,42 Å (значительно короче, чем в алмазе), но при этом каждый атом углерода имеет три (а не четыре, как в алмазе) ковалентные связи с тремя соседями, а четвертая связь (3,4 Å) слишком длинна для ковалентной связи и слабо связывает параллельно уложенные слои графита между собой. Именно четвертый электрон углерода определяет тепло- и электропроводность графита - эта более длинная и менее прочная связь формирует меньшую компактность графита, что отражается в меньшей твердости его в сравнении с алмазом (плотность графита 2,26 г/см 3 , алмаза - 3,51 г/см 3). По той же причине графит скользкий на ощупь и легко отделяет чешуйки вещества, что и используется для изготовления смазки и грифелей карандашей. Свинцовый блеск грифеля объясняется в основном наличием графита.
Волокна углерода имеют высокую прочность и могут использоваться для изготовления искусственного шелка или другой пряжи с высоким содержанием углерода.
При высоких давлении и температуре в присутствии катализатора, например железа, графит может превращаться в алмаз. Этот процесс реализован для промышленного получения искусственных алмазов. Кристаллы алмаза растут на поверхности катализатора. Равновесие графит алмаз существует при 15 000 атм и 300 K или при 4000 атм и 1500 K. Искусственные алмазы можно получать и из углеводородов.
- Как быстро и вкусно испечь пышки на кефире: рецепты и полезные советы
- Яблочная шарлотка с корицей
- Почему перед месячными надувается живот — внутренние и внешние причины
- Дебиторская задолженность в Excel с условным форматированием Отчет дебиторская задолженность по срокам долга
- Лфк для детей с нарушением осанки Упражнение для детей с нарушением осанки
- Генри Форд - Генри Форд. Мои достижения. Моя жизнь. Мои достижения Генри форд жизнь достижения онлайн
- Магний и кальций в каких продуктах содержится

 Live Journal
Live Journal Facebook
Facebook Twitter
Twitter