Характеристика ниобия. Ниобий – цена, добыча, основные характеристики и область применения этого химического элемента. Растворы щелочей не действуют на ниобий, но расплавленные щёлочи и углещелочные соли образуют ниобаты. При высокой температуре ниобий от
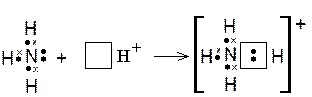
Почти на полстолетия меньше. Случилось так, что элемент № 41 был открыт дважды. Первый раз - в 1801 г. английский ученый Чарльз Хатчет исследовал образец черного минерала, присланного в Британский музей из Америки. Из этого минерала он выделил окисел неизвестного прежде элемента. Новый элемент Хатчет назвал колумбием, отмечая тем самым его заокеанское происхождение. А черный минерал получил название колумбита.
Нажмите на элемент 1 и повторите со всеми элементами одной и той же группы: соблюдайте их электронные структуры. Повторите процесс с элементами второго столбца. Все они имеют два электрона в самом внешнем слое. И благородные газы, расположенные в колонке справа? Они имеют самый полный полный слой.
Наконец, галогены, расположенные в предпоследнем столбце, не имеют электрона для завершения самого внешнего слоя. Группы, периоды и электронная конфигурация. Внутри той же группы все элементы имеют одинаковую электронную конфигурацию в своем последнем слое, в которой у них столько электронов, сколько число групп, в которых они находятся. В элементах того же периода последний электрон расположен в том же слое, который соответствует номеру периода. Вы можете проверить его, используя любой из доступных симуляторов. . Наконец, вы узнаете, как знать, где элемент находится в таблице, вы можете написать свою электронную конфигурацию, и, зная это, вы можете поместить элемент в таблицу.
Через год шведский химик Экеберг выделил из колумбита окисел еще одного нового элемента, названного танталом. Сходство соединений Колумбия и тантала было так велико, что в течение 40 лет большинство химиков считало: и Колумбии - один и тот же элемент.
В 1844 г. немецкий химик Генрих Розе исследовал образцы колумбита, найденные в Баварии. Он вновь обнаружил окислы двух металлов. Один из них был окислом известного уже тантала. Окислы были похожи, и, подчеркивая их сходство, Розе назвал элемент, образующий второй окисел, ниобием по имени Ниобы, дочери мифологического мученика Тантала.
Посмотрите на электронные структуры! Следующее изображение отражает выводы, которые вы можете получить. В зеленой зоне последний электрон находится в р-орбите, точно такой, который задан номером периода. Важно, чтобы вы использовали симулятор, пока у вас не будет четких областей таблицы.
Но он также не имеет электрона для завершения самого внешнего слоя, как это происходит с галогенами. В обоих случаях элементы помещаются в группу, с которой они имеют наиболее важные сходства. Кальций имеет атомное число. Он расположен в четвертом периоде и в группе. Поэтому его электронная структура в самом внешнем слое будет.
Впрочем, Розе, как и Хатчет, не сумел получить этот элемент в свободном состоянии.
Металлический ниобий был впервые получен лишь в 1866 г. шведским ученым Бломстрандом при восстановлении хлорида ниобия водородом. В конце XIX в. были найдены еще два способа получения этого элемента. Сначала Муассан получил его в электропечи, восстанавливая окись ниобия углеродом, а затем Гольдшмидт сумел восстановить тот же элемент алюминием.
Напишите свою электронную структуру или используйте симулятор для ее просмотра. В частности, их работа подтверждает, что аккреция Земли сначала происходила в очень сжатых условиях и заканчивалась более окисленными ударными эффектами. Образование планет было сложным процессом, сочетающим конденсацию, столкновение и аккрецию, включающие недифференцированные тела: хондриты. Одновременно с этим процессом образования примитивные планеты прошли большие этапы химической дифференциации, из которых извлечение металлического ядра является одним из самых важных.
А называть элемент № 41 в разных странах продолжали по-разному: в Англии и США - колумбием, в остальных странах - ниобием. Конец разноголосице положил Международный союз теоретической и прикладной химии (ИЮПАК) в 1950 г. Было решено повсеместно узаконить название элемента «ниобий», а за основным минералом ниобия так и закрепилось наименование «колумбит». Его формула (Fe, Mn) (Nb, Ta) 2 O 6 .
Соотношения элементов, составляющих породы мантии и коры, должны быть идентичны пропорциям хондритных метеоритов. Действительно, после конденсации на огнеупорные элементы не влияют явления испарения, и на литофильные элементы не влияет образование металлических ядер. И ниобий, и тантал классифицируются как огнеупорные и литофильные элементы и имеют одинаковую электронную структуру и ионный радиус. Эти очень специфические характеристики заставляют два элемента в своей классической конфигурации вести себя одинаково во время магматических процессов и побудили сообщество наук о Земле назвать эти два элемента «геохимическими близнецами».
Глазами химика.
Элементный ниобий - чрезвычайно тугоплавкий (2468° С) и высококипящий (4927° С) металл, очень стойкий во многих агрессивных средах. Все кислоты, за исключением плавиковой, не действуют на него. Кислоты-окислители «пассивируют» ниобий, покрывая его защитной окисной пленкой (Nb205). Но при высоких температурах химическая активность ниобия повышается! Если при 150-200° С окисляется лишь небольшой поверхностный слой металла, то при 900--1200° С толщина окисной пленки значительно увеличивается.
Применение в электрической технике
Этот вопрос давно обсуждался и известен как «парадокс ниобия». Планеты были сформированы в условиях кислородного давления очень изменчивыми, и этот предмет до сих пор плохо изучен, хотя и изначальный. Тематическая команда «Примитивная Земля» Клермон-Феррана сосредоточилась на этом параметре, чтобы понять его роль в «парадоксах ниобия». Эксперименты состоят в том, чтобы подвергнуть хондритный материал условиям, близким к условиям примитивных планет: высокое давление, высокая температура и контролируемое и переменное давление кислорода.
Ниобий! активно реагирует со многими неметаллами. С ним образуют соединения , . При этом ниобий может проявлять разные валентности - от двух до пяти. Но главная это-fc го элемента 5+. Пятивалентный ниобий! может входить кв состав соли и как катион, и как один из элементов аниона, что свидетельствует об амфотерном характере элемента В 41.
Сканируя широкий диапазон окислительно-восстановительных условий, ученые обнаружили, что фугитивность кислорода полностью контролирует поведение ниобия и тантала вопреки тому, что было предложено ранее. В нескольких исследованиях, в частности, было показано влияние давления, которое на самом деле оказалось незначительным. Их данные также привносят новые ограничения в понимание системы Земля-Луна, планеты Марса и астероида 4-Веста.
Редокс контроль фракционирования ниобия и тантала во время планетарной аккреции и образования сердечников. Атомные орбитали притягиваются к ядру при формировании анионов. Периодическая система многоэлектронных систем электронная конфигурация периодическая периодичность системы физико-химических свойств изображения молекул и формула Льюиса молекул в этой лекции из.
Соли ниобиевых кислот называют ниобатами. Их получают в результате обменных реакций после сплавления пятиокиси ниобия с содой:
Nb2О5 + 3Na2CО3 → 2Na3NbО4 + 3CО2
Довольно хорошо изучены соли нескольких ниобиевых кислот, в первую очередь метаниобиевой HNbО3, а также диниобаты и пентаниобаты (K4Nb2О7, K7Nb5О16 mH2O). А соли, в которых элемент № 41 выступает как катион, обычно получают прямым взаимодействием простых веществ, например 2Nb + 5Cl2 → 2NbCl5.
Применение в электродах и сплавах
Орбиталы в многоэлектронных атомах Электроны притягиваются к ядру, но также отталкиваются. Отталкивающие силы, вызванные другими электронами, защищают привлекательный эффект атомного ядра. Структура атома Почему это важно? Окончательная интерпретация всех химических явлений. Она должна основываться на структуре атомов.
Альтернативные способы производства
Химическая связь Свободные атомы в природе являются исключительно исключительными. Атомные элементы элементов пытаются взаимно слиться и создать молекулы элементов или соединений. Атомы химически связаны в молекулах. Большинство из них происходит в природе.
При сближении взаимодействующих атомов, например, атомов водорода, происходит перекрывание электронных облаков этих атомов. В результате перекрывания возрастает плотность отрицательного заряда в пространстве между ядрами атомов. Положительно заряженные ядра атомов притягиваются к отрицательно заряженной области перекрывания, что приводит к образованию устойчивой молекулы H 2 (рисунок 1.4). Образование химической связи возможно лишь в том случае, если спины взаимодействующих неспаренных электронов противоположно направлены.
Химическая связь - если атомы элементов не могут окончательно отделить существование - связь атомов с более крупными единицами более устойчива, чем свободные атомы - атомы разделяются связыванием электронов. Условия. Валанциальные электроны и химическая связь На внешнем энергетическом уровне находятся валентные электроны, которые могут участвовать в образовании химических связей. Валентные электроны часто представлены точками вокруг.
Наиболее устойчивая электронная конфигурация атомов. Химическое связывание Некоторые небольшие повторения Некоторые небольшие повторения Что такое атом? Маленький повтор Что такое атом? Атом - наименьшая частица материи, химически неделимая. Он состоит из атомного ядра, содержащего.
Рисунок 1.4 – Возникновение общей электронной пары
при взаимодействии атомов водорода и образовании молекулы H 2
Схематически образование ковалентной связи на примере образования молекул водорода, хлороводорода и азота можно показать следующим образом:
В этих схемах внешние электроны атомов обозначают точками вокруг химического символа атома; общие для двух атомов электронные пары в образовавшейся молекуле показывают точками между символами атомов. При записи графических (структурных) формул химическую связь обозначают чёрточкой, которая заменяет обозначение общей электронной пары:
Вы напишете ответы на тестовую карту, пожалуйста, не пишите тест. Йозеф Корманик Химические примеры. Это самое сильное межмолекулярное взаимодействие. Инновации в изучении молекулярной и клеточной биологии. Регламент. Цель лекции: познакомить студентов с принципом.
Слабые связывающие взаимодействия Повторение Что такое атом? Повторить повторение Что такое атом? Он состоит из атомного ядра, содержащего протоны и нейтроны. На Земле водород составляет около 15% атомов всех элементов. Химический компаундирование - это процесс, в котором вещества становятся более сложными более сложными веществами. Водород образует молекулы с двумя молекулами, легче, чем.
Химическая связь, образованная общей для двух атомов парой электронов, называется ковалентной связью . Валентность – это число химических связей, образуемых атомом данного элемента.
Выше рассмотрены примеры, в которых ковалентная связь образуется в результате взаимодействия неспаренных электронов, изначально принадлежавших двум различным атомам, и образования общей электронной пары. Такой механизм образования ковалентной связи называется обменным . Именно по обменному механизму образованы химические связи в молекулах водорода, хлороводорода и азота.
Дмитрий Иванович Менделеев организовал 63 известных. Соединения, строительные блоки которых состоят из атомов двух разных химических элементов. Тема: Семинар по химии. Содержание: общая химия, неорганическая химия, химические расчеты, основы аналитической химии. Класс: год и сентябрь. Количество часов: 2 часа в неделю. Коммунальные услуги: оборудование класса.
Органическая химия Год обучения - гастрономия. Инвестирование в инновации развития образования в молекулярной и клеточной биологии Этот проект финансируется совместно Европейским социальным фондом и государственным бюджетом Чешской Республики. Инвестиции в развитие образования.
Кроме обменного механизма существует донорно-акцепторный механизм образования ковалентной связи, сущность которого можно показать на
примере образования иона аммония. Атом азота в молекуле аммиака связан с тремя атомами водорода тремя ковалентными связями, образованными по обменному механизму (крестиками в формуле аммиака показаны электроны, изначально принадлежавшие атомам водорода). Кроме того, у атома азота есть два спаренных электрона (неподелённая электронная пара). Такая пара электронов тоже может участвовать в образовании ковалентной связи с другим атомом, если во внешнем электронном слое этого атома ест ь свободная орбиталь. Незаполненная орбиталь есть у иона водорода, который вообще лишён электронов. При взаимодействии молекулы аммиака с ионом водорода ковалентная связь возникает вследствие того, что неподелённая пара электронов атома азота занимает свободную орбиталь иона H + и становится общей для обоих атомов. В результате этого взаимодействия образуется ион аммония (NH 4 +):
Геометрия молекул Формулы Льюиса предоставляют информацию о том, какие атомы связаны связью и тем, что связано. Геометрическое расположение молекулы характеризуется: длиной связей. Вопрос: Химическая ссылка Тема: Химия Автор: Тина Усилия всех систем, даже атомов, достичь состояния с наименьшей энергией и стабильностью. Наиболее стабильной электронной конфигурацией атомов является.
Образовательная область: Научное образование Область образования: Химия Тематическая область: Общая. Атомное ядро и его устойчивость. Атом - наименьшая материальная и химически неделимая частица. Он состоит из ядра, содержащего протоны и нейтроны, и электронной оболочки. Элементарные частицы протонных нейтронов.
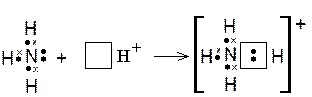
Именно по донорно-акцепторному механизму образованы ковалентные связи в комплексных ионах (см. раздел 3.1 «Понятие о комплексных соединениях»).
В задании № 1 студентам предлагается записать сокращённые электронные формулы и электронно-графические схемы атомов заданных элементов в основном и возбуждённом состояниях (если возбуждённое состояние может быть реализовано в химическом процессе), а также кратко охарактеризовать биологическую роль данного элемента в живых организмах.
Устойчивость редких газов Редкие газы очень стабильны. Электрохимический потенциал Стандартный водородный электрод Окислительно-восстановительные потенциалы Электрохимия баланса и действия в системах электрических зарядов Металлический кристалл, погруженный в дистиллированную воду.
Введение Материальные свойства и концепции, которые вы должны знать Что такое материал? Определение вещества, которое отвечает его требованиям для надежной функции и требуемого срока службы. Точно так же молекула, в которой число атомов больше единицы, должно соответствовать уменьшению потенциальной области.
Пример 1.1 азота в основном состоянии, проанализируйте возможность существования возбуждённых состояний и валентные возможности атома азота, охарактеризуйте биологическую роль азота в живых организмах.
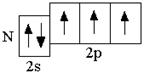
 Азот – p-элемент; у p-элементов валентными электронами (т.е. электронами, участвующими в образовании химических связей) являются электроны внешнего энергетического уровня, поэтому сокращённая электронная формула должна отражать строение внешнего энергетического уровня атома азота. Т.к. азот – элемент второго периода, то внешние электроны располагаются на втором энергетическом уровне, который образован одной s- и тремя p-орбиталями. Азот – p-элемент пятой группы, поэтому число электронов на внешнем уровне равно 5, из которых два располагаются на более низкой по энергии 2s-орбитали и ещё 3 – на p-орбиталях.
Азот – p-элемент; у p-элементов валентными электронами (т.е. электронами, участвующими в образовании химических связей) являются электроны внешнего энергетического уровня, поэтому сокращённая электронная формула должна отражать строение внешнего энергетического уровня атома азота. Т.к. азот – элемент второго периода, то внешние электроны располагаются на втором энергетическом уровне, который образован одной s- и тремя p-орбиталями. Азот – p-элемент пятой группы, поэтому число электронов на внешнем уровне равно 5, из которых два располагаются на более низкой по энергии 2s-орбитали и ещё 3 – на p-орбиталях.
Сокращённая электронная формула атома азота в основном состоянии: 2s 2 2p 3 . Поскольку на втором энергетическом уровне отсутствуют d-орбитали, то возбуждённое состояние атома азота не может быть реализовано. Поэтому атом азота может образовать за счёт трёх неспаренных электронов 3 ковалентные связи по обменному механизму и 1 связь по донорно-акцепторному механизму за счёт неподелённой электронной пары. Таким образом, максимальная валентность атома азота равна 4.
Азот – важнейший биогенный элемент, необходимый для существования животных и растений, он входит в состав аминокислот, важнейших биополимеров: белков, нуклеиновых кислот (ДНК, РНК), а также, витаминов, гормонов (например, адреналин, тироксин), нуклеопротеидов, хлорофилла, гемоглобина.
Пример 1.2 Запишите сокращённые электронно-графическую схему и электронную формулу атома ниобия в основном состоянии, проанализируйте возможность существования возбуждённых состояний и валентные возможности атома ниобия, охарактеризуйте биологическую роль ниобия.
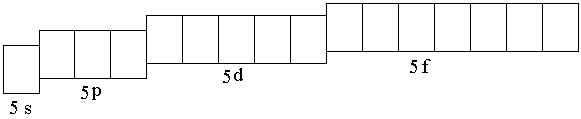
Ниобий – d-элемент; у d-элементов валентными электронами являются электроны внешнего энергетического уровня и d-предвнешнего подуровня. Поскольку ниобий элемент пятого периода, то сокращённая электронная формула должна отражать строение внешнего (пятого) энергетического уровня и
4d-подуровня. Пятый энергетический уровень образован одной s-, тремя p-,
пятью d- и семью f-орбиталями:
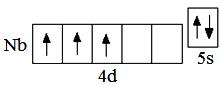
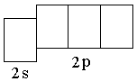
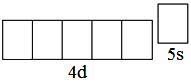 В атоме любого d-элемента в невозбуждённом состоянии из всех орбиталей внешнего энергетического уровня занята только s-орбиталь, поэтому остальные орбитали при записи сокращённой электронно-графической схемы можно не указывать. Таким образом, валентные электроны в атоме ниобия будут располагаться на 5s-орбитали внешнего уровня и 4d-орбиталях предвнешнего. На s-орбиталях внешнего уровня у атомов
В атоме любого d-элемента в невозбуждённом состоянии из всех орбиталей внешнего энергетического уровня занята только s-орбиталь, поэтому остальные орбитали при записи сокращённой электронно-графической схемы можно не указывать. Таким образом, валентные электроны в атоме ниобия будут располагаться на 5s-орбитали внешнего уровня и 4d-орбиталях предвнешнего. На s-орбиталях внешнего уровня у атомов
d-элементов располагаются 2 электрона (если нет «проскока» электрона). Ниобий – третий d-элемент пятого периода, поэтому на d-орбиталях будет находиться 3 электрона. Таким образом, электронная формула атома ниобия в невозбуждённом состоянии 4d 3 5s 2 . Следует обратить внимание, что общее число валентных электронов в атоме ниобия (5) равно номеру группы, в которой находится элемент. При возбуждении атома ниобия пара электронов на 5s-орбитали распаривается, и один из электронов переходит на 5p-орбиталь:
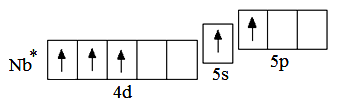
Сокращённая электронная формула атома ниобия в возбуждённом состоянии Nb* – 4d 3 5s 1 5p 1 . Как видно из электронно-графической схемы атома ниобия в возбуждённом состоянии, максимальная валентность атома ниобия равна 5.
Ниобий является неотъемлемым микроэлементом человеческого организма. Он концентрируется в костях, печени, мышцах, крови. Биологическая роль ниобия малоизучена. Известно, что ниобий гипоаллергенен: его можно безопасно использовать для введения в тело, так как он не вызывает биологического отторжения организмом. Это ценное свойство ниобия используется в восстановительной хирургии.

 Live Journal
Live Journal Facebook
Facebook Twitter
Twitter