Кристаллическая решетка водородной связи. Типы кристаллических решеток
Карточка № 1
10. Выполни задание. H 2 , Н Br , N а 2 О.
10 класс. Химическая связь. Типы кристаллических решеток. Карточка № 2
А) ковалентная полярная В) ковалентная неполярная С) ионная Д) металлическая Е) водородная
А) ковалентная полярная В) ковалентная неполярная С) ионная Д) металлическая Е) водородная
В твердом теле атомы расположены разнообразным образом, но всегда близки друг к другу, образуя кристаллическую решетку. В то время как в некоторых телах электроны хорошо связаны с атомами, в других же некоторые из этих частиц остаются с определенной свободой движения в кристалле. Это то, что отличает электропроводность проводящих тел изоляции. В проводящих телах многие электроны свободно движутся в кристалле неупорядоченным образом, то есть во всех направлениях. И именно потому, что оно хаотично, это движение не приводит к смещению заряда через кристалл.
5. Только σ - связи в веществах ряда:
10. Выполни задание. Составьте схемы образования молекул веществ: О 2 , Н Cl , К Br .
10 класс. Химическая связь. Типы кристаллических решеток. Карточка № 3
А) ковалентная В) ионная С) металлическая Д) водородная Е) нет ответа
А) ковалентная полярная В) ковалентная неполярная С) ионная Д) металлическая Е) водородная
При нагревании кончика металлического стержня образуются атомы, образующие его, и те, которые находятся вблизи него. Электроны увеличивают свои колебания, а энергия распространяется на самые внутренние атомы. В этом типе кристалла свободные электроны служат средством распространения тепла - они сталкиваются с более быстрыми атомами, ускоряют и увеличивают колебания более медленных. Поэтому возможность лучшей теплопроводности зависит от наличия свободных электронов в кристалле. При изучении явления электропроводности отмечается, что когда разность потенциалов подается через электрический источник к стенкам металлического кристалла, свободные электроны приобретают упорядоченное движение: они начинают двигаться от полюса отрицательный для положительного полюса, формирующий ориентированный электронный поток на поверхности металла, поскольку, поскольку он работает с зарядами одного и того же сигнала, они ищут большее расстояние между ними.
А) молекулы В) анионы С) ионы Д) катионы Е) изотопы
А)К и
5. Ионная связь есть в:
А) СO 2 В) Na ОН С) Fe Д) NaCl Е) SiO 2
10. Выполни задание. Составьте схемы образования молекул веществ: N 2 , Н Cl , N а Br .
10 класс. Химическая связь. Типы кристаллических решеток. Карточка № 4
А) ковалентная полярная В) ковалентная неполярная С) ионная Д) металлическая Е) водородная
Чем больше свободных электронов в проводнике, тем лучше проводимость. Атомы металла имеют большую тенденцию потерять электроны последнего слоя и превратиться в катионы. Однако эти электроны одновременно притягиваются к другим ионам, которые затем снова теряют его и т.д. поэтому, хотя преобладают положительные ионы и свободные электроны, атомы металла считаются электрически нейтральными.
Атомы остаются внутри сети не только геометрическими последствиями, но и потому, что они имеют особый тип химической связи, называемый металлической связью. Объединение атомов, занимающих «узлы» кристаллической решетки, происходит через валентные электроны, которыми они разделяют. Результирующая компоновка представляет собой сетку, состоящую из положительных ионов и электронного облака.
А) ковалентная В) ионная С) металлическая Д) водородная Е) нет ответа
А) Н 2 В) F 2 С) Br 2 Д) О 2 Е) N 2
А) ковалентная полярная В) ковалентная неполярная С) ионная Д) металлическая Е) водородная
А) ионная В) молекулярная С) атомная Д) металлическая Е) нет ответа
А) молекулы В) радикалы С) ионы Д) катионы Е) изотопы
10. Выполни задание. Составьте схемы образования молекул веществ: Cl 2 , Н 2 О, N а J .
Короче говоря, металлическая связь происходит между двумя атомами металла. В связи с этим все вовлеченные атомы теряют электроны из своих внешних слоев, движутся более или менее свободно между ними, образуя электронное облако. Что происходит, когда устанавливается связь между двумя атомами с разницей электроотрицательности более 1, 7? В этом случае наибольший электронный пучок, наконец, разрывает один или несколько электронов от менее электроотрицательного атома, что приводит к образованию двух противоположных зарядовых ионов.
Ионная связь представляет собой электростатическое притяжение между двумя ионами противоположного электрического заряда, то есть катионом и анионом. Этот тип связи образуется между металлом и неметаллическим покрытием. Металл дает один или несколько электронов неметаллам, что приводит к образованию положительного иона, называемого катионом, и отрицательного иона, называемого анионом. Примером ионной связи является хлорид натрия. Хлорид имеет значительно более высокую электроотрицательность натрия.
10 класс. Химическая связь. Типы кристаллических решеток. Карточка № 5
А) ковалентная полярная В) ковалентная неполярная С) ионная Д) металлическая Е) водородная
А) ковалентная полярная В) ковалентная неполярная С) ионная Д) металлическая Е) водородная
А) ковалентная полярная В) ковалентная неполярная С) ионная Д) металлическая Е) водородная
Натрий только имеет валентный электрон, а хлор имеет семь электронов валентности. Это создает электростатическое притяжение между двумя элементами, которые достигают октета. Образование ионной связи между натрием и хлором. Основное различие между ковалентной связью и ионной связью заключается в том, что в ковалентной связи прямая связь между двумя атомами проявляется как совместное использование электронного дуплекса; в ионной связи это не происходит, потому что катионы и анионы не зависят друг от друга и сливаются только при электростатическом притяжении.
А) молекулы В) анионы С) ионы Д) катионы Е) изотопы
А) ковалентная полярная В) ковалентная неполярная С) ионная Д) металлическая Е) водородная
8. Молекулярную кристаллическую решетку имеет:
А) ионная В) молекулярная С) атомная Д) металлическая Е) нет ответа
10. Выполни задание. Составьте схемы образования молекул веществ: H 2 , N Н 3 , NaCl .
В ионной связи отсутствует образование молекулярной орбитали или молекулы, но происходит образование кристаллической решетки. Ионные соединения не образуются молекулами, а противоположными заряженными ионами, которые образуются для образования трехмерных кристаллических решеток, где силы отталкивания между ионами того же заряда минимальны, а силы притяжения между противоположными заряженными ионами максимальны, Ионные соединения являются твердыми.
![]()
Энергия, выделяемая образованием кристаллической решетки за счет электростатического взаимодействия между положительными ионами и отрицательными ионами, называется ретикулярной энергией. Сетка сетчатой энергии зависит от характеристик ионов: она возрастает с увеличением зарядов ионов и уменьшается их размер.
10 класс. Химическая связь. Типы кристаллических решеток. Карточка № 6
А) ковалентная полярная В) ковалентная неполярная С) ионная Д) металлическая Е) водородная
А) ковалентная В) ионная С) металлическая Д) водородная Е) нет ответа
3. Ионная связь есть в:
А) 2 В) 4 С) 5 Д) 8 Е) 6
А) молекулы В) анионы С) ионы Д) катионы Е) изотопы
А)К и
А) ионная В) молекулярная С) атомная Д) металлическая Е) нет ответа
10. Выполни задание. Составьте схемы образования молекул веществ: J 2 , Н Cl , К 2 О.
10 класс. Химическая связь. Типы кристаллических решеток. Карточка № 7
1. Химическая связь, образованная посредством общей электронной пары:
А) ковалентная В) ионная С) металлическая Д) водородная Е) нет ответа
2. Химическая связь, образованная между атомами неметаллов с небольшой разницей в электроотрицательности:
А) ковалентная полярная В) ковалентная неполярная С) ионная Д) металлическая Е) водородная
Е) ионная и ионная
А) J 2 , H 2 В) С 2 Н 5 ОН, СН 3 СООН С) NaCl , ВаСl 2 Д) Fe , Cu Е) О 2 , Н 2 О
А) Н 2 В) F 2 С) Br 2 Д) О 2 Е) N 2
8. Ионную кристаллическую решетку имеет:
А) СO 2 В) Br 2 С) Fe Д) NaCl Е) SiO 2
А) ионная В) молекулярная С) атомная Д) металлическая Е) нет ответа
10. Выполни задание. Составьте схемы образования молекул веществ: О 2 , Н Cl , Na 2 О.
10 класс. Химическая связь. Типы кристаллических решеток. Карточка № 8
1. Химическая связь, возникающая между атомами, положительными ионами металла и свободнодвижущимися между ними электронами:
А) ковалентная В) ионная С) металлическая Д) водородная Е) нет ответа
2. Химическая связь, образованная между атомами металлов и неметаллов с большой разницей в электроотрицательности:
А) ковалентная полярная В) ковалентная неполярная С) ионная Д) металлическая Е) водородная
А) Н 2 S В) H 2 O С) HF Д) NH 3 Е) NH 4 Cl
А) Н 2 В) F 2 С) Br 2 Д) О 2 Е) N 2
А) ковалентная полярная В) ковалентная неполярная С) ионная Д) металлическая Е) водородная
А) ионная В) молекулярная С) атомная Д) металлическая Е) нет ответа
9. Только σ - связи в веществах ряда:
А) С 2 Н 6 и СO 2 В) С 2 Н 6 и H 2 S С) С 2 Н 6 и SO 3 Д) С 2 Н 6 и SO 2 Е) С 2 Н 6 и СO
10. Выполни задание. Составьте схемы образования молекул веществ: Н 2 , Н 2 О, NaF .
10 класс. Химическая связь. Типы кристаллических решеток. Карточка № 9
1. Химическая связь, образованная посредством общей электронной пары:
А) ковалентная В) ионная С) металлическая Д) водородная Е) нет ответа
2. Химическая связь, образованная между атомами неметаллов с одинаковой электроотрицательностью:
А) ковалентная полярная В) ковалентная неполярная С) ионная Д) металлическая Е) водородная
3. Вещество с ковалентной полярной связью:
А) Al 2 O 3 В) O 3 С) H 2 О Д) NaCl Е) Ag
4. Заряженные частицы, в которые превращаются атомы в результате отдачи или присоединения электронов, называются:
А) молекулы В) радикалы С) ионы Д) катионы Е) изотопы
5. Вид связи в веществах – электролитах:
А) Ковалентная неполярная, металлическая В) Ковалентная неполярная, ионная
С) Ионная, ковалентная сильнополярная Д) Металлическая, ионная
Е) Ковалентная неполярная, полярная
6. Вещества с металлической связью:
А) J 2 , H 2 В) Са, Cu С) NaCl , ВаСl 2 Д) С 2 Н 5 ОН, СН 3 СООН Е) О 2 , Н 2 О
7. Группа веществ с водородной связью:
А) J 2 , H 2 В) С 2 Н 5 ОН, СН 3 СООН С) NaCl , ВаСl 2 Д) Fe , Cu Е) О 2 , Н 2 О
8. Ионную кристаллическую решетку имеет:
А) СO 2 В) Br 2 С) Fe Д) Na ОН Е) SiO 2
9. Металлическая кристаллическая решетка не характерна для:
А) Меди В) Натрия С) Серебра Д) Цинка Е) Серы
10. Выполни задание. Составьте схемы образования молекул веществ: H 2 , Н Br , К 2 О.
10 класс. Химическая связь. Типы кристаллических решеток. Карточка № 10
1. Химическая связь, образованная за счет электростатического притяжения ионов:
А) ковалентная полярная В) ковалентная неполярная С) ионная Д) металлическая Е) водородная
2. Химическая связь, образованная между атомами неметаллов с небольшой разницей в электроотрицательности:
А) ковалентная полярная В) ковалентная неполярная С) ионная Д) металлическая Е) водородная
3. Ряд веществ с ковалентной неполярной связью:
А) СаF 2 , NaF , КBr В) О 2 , Н 2 , Cl 2 С) N Н 3 , Н 2 О, НBr
Д) Al , Na , F е Е) Н 2 О, F е 2 О 3 , НCl
4. Заряженные частицы, в которые превращаются атомы в результате отдачи электронов, называются:
А) молекулы В) анионы С) ионы Д) катионы Е) изотопы
5. Только σ - связи в веществах ряда:
А) С 2 Н 6 и СO 2 В) С 2 Н 6 и H 2 S С) С 2 Н 6 и SO 3 Д) С 2 Н 6 и SO 2 Е) С 2 Н 6 и СO
6. Водородную связь могут образовывать между собой:
А) СН 4 В) СН 3 СООН С) С 3 Н 8 Д) СаО Е) NaH
7. Металлическую и ионную связи может образовывать:
А) Селен В) Теллур С) Калий Д) Кремний Е) Бор
8. Молекулярную кристаллическую решетку имеет:
А) СаO В) Na ОН С) Fe Д) NaCl Е) SO 2
9. Металлическую кристаллическую решетку имеет:
А) Ag B ) Br C ) Se Д) Хе Е) Kr
10. Выполни задание. Составьте схемы образования молекул веществ: О 2 , Н Br , К Cl .
10 класс. Химическая связь. Типы кристаллических решеток. Карточка № 11
1. Химическая связь, возникающая между атомами, положительными ионами металла и свободнодвижущимися между ними электронами:
А) ковалентная В) ионная С) металлическая Д) водородная Е) нет ответа
2. Химическая связь, образованная между атомами металлов и неметаллов с большой разницей в электроотрицательности:
А) ковалентная полярная В) ковалентная неполярная С) ионная Д) металлическая Е) водородная
3. Заряженные частицы, в которые превращаются атомы в результате принятия электронов, называются:
А) молекулы В) анионы С) ионы Д) катионы Е) изотопы
4. Пара химических элементов, между которыми образуется ковалентная полярная связь:
А)К иF В) Na и Cl C ) Н и Р Д) О и О Е) Fe и Fe
5. Ионная связь есть в:
А)Mg В) NaCl C ) Br 2 Д) HCl Е) F 2
6. Водородная связь может образоваться между молекулами:
А) Фтора В) Хлора С) Серы Д) Воды Е) Водорода
7. Порядок связи равен двум в молекуле:
А) Н 2 В) F 2 С) Br 2 Д) О 2 Е) N 2
8. Атомную кристаллическую решетку имеет:
А) СO 2 В) Na ОН С) Fe Д) NaCl Е) SiO 2
9. Кристаллическая решетка алмаза:
А) ионная В) молекулярная С) атомная Д) металлическая Е) нет ответа
10. Выполни задание. Составьте схемы образования молекул веществ: О 2 , Н Cl , Са Cl 2 .
10 класс. Химическая связь. Типы кристаллических решеток. Карточка № 12
1.Химическая связь, образованная между атомами неметаллов с одинаковой электроотрицательностью:
А) ковалентная полярная В) ковалентная неполярная С) ионная Д) металлическая Е) водородная
2. Химическая связь, образованная посредством общей электронной пары:
А) ковалентная В) ионная С) металлическая Д) водородная Е) нет ответа
3. Ковалентная полярная связь образована по донорно-акцепторному механизму в молекуле:
А) Н 2 S В) H 2 O С) HF Д) NH 3 Е) NH 4 Cl
4. Ковалентная неполярная связь присутствует у всех веществ группы:
А)Mg , КCl В) NaF , N О C ) Br 2 , О 2 Д) HCl , СО 2 Е) Н 2 S , О 2
5. Порядок связи равен трем в молекуле:
А) Н 2 В) F 2 С) Br 2 Д) О 2 Е) N 2
6. Вид химической связи в молекуле H 2 O :
А) ковалентная полярная В) ковалентная неполярная С) ионная Д) металлическая Е) водородная
7. Молекулярная кристаллическая решетка будет в:
А)Mg В) NaF C ) С Д) H 2 О Е) SiO 2
8. Кристаллическая решетка поваренной соли:
А) ионная В) молекулярная С) атомная Д) металлическая Е) нет ответа
9. Заряженные частицы, в которые превращаются атомы в результате отдачи или присоединения электронов, называются:
А) молекулы В) радикалы С) ионы Д) катионы Е) изотопы
10. Выполни задание. Составьте схемы образования молекул веществ: N 2 , Н 2 О, N а J .
10 класс. Химическая связь. Типы кристаллических решеток. Карточка № 13
1. Химическая связь, образованная между атомами неметаллов с небольшой разницей в электроотрицательности:
А) ковалентная полярная В) ковалентная неполярная С) ионная Д) металлическая Е) водородная
2. Химическая связь, образованная за счет электростатического притяжения ионов:
А) ковалентная полярная В) ковалентная неполярная С) ионная Д) металлическая Е) водородная
3. Вещества с ковалентной связью в группе:
А) Br 2 , NaH , MgO , KCl В) РН 3 , N 2 О 5 , СаО, ВаСl 2 С) Н 2 О, СS 2 , НJ , РН 3
Д) As 2 S 3 , AlCl 3 , O 2 , N 2 Е) НCl, SiH 4 , К 2 О, ВаBr 2
4. Вид химической связи в молекуле К 2 O :
А) ковалентная полярная В) ковалентная неполярная С) ионная Д) металлическая Е) водородная
5. Заряженные частицы, в которые превращаются атомы в результате отдачи электронов:
А) молекулы В) анионы С) ионы Д) катионы Е) изотопы
6. Вид химической связи между молекулами HF :
А) ковалентная полярная В) ковалентная неполярная С) ионная Д) металлическая Е) водородная
7. Металлическая кристаллическая решетка будет в:
А)Mg В) NaF C ) Н 2 Д) HCl Е) O 2
8. Молекулярную кристаллическую решетку имеет:
А) CuSO 4 В) Na ОН С) Fe Д) NaCl Е) СO 2
9. Кристаллическая решетка графита:
А) ионная В) молекулярная С) атомная Д) металлическая Е) нет ответа
10. Выполни задание. Составьте схемы образования молекул веществ: Cl 2 , N Н 3 , NaBr .
10 класс. Химическая связь. Типы кристаллических решеток. Карточка № 14
1. Химическая связь, образованная между атомами металлов и неметаллов с большой разницей в электроотрицательности:
А) ковалентная полярная В) ковалентная неполярная С) ионная Д) металлическая Е) водородная
2. Химическая связь, возникающая между атомами, положительными ионами металла и свободнодвижущимися между ними электронами:
А) ковалентная В) ионная С) металлическая Д) водородная Е) нет ответа
3. Ионная связь есть в:
А)Са В) N 2 О 5 C ) Br 2 Д) Na 2 О Е) F 2
4. Число электронов, участвующих в образовании химической связи в молекуле N 2:
А) 2 В) 4 С) 5 Д) 8 Е) 6
5. Вид химической связи в кристаллической сере
А) ионная В) ковалентная полярная С) водородная
Д) ковалентная неполярная Е) металлическая
6. Заряженные частицы, в которые превращаются атомы в результате принятия электронов, называются:
А) молекулы В) анионы С) ионы Д) катионы Е) изотопы
7. Пара химических элементов, между которыми образуется ковалентная полярная связь:
А)К иF В) Na и Cl C ) Н и Н Д) Н и N Е) Са и Са
8. Металлическая кристаллическая решетка не характерна для:
А) Меди В) Бора С) Серебра Д) Цинка Е) Натрия
9. Кристаллическая решетка брома:
А) ионная В) молекулярная С) атомная Д) металлическая Е) нет ответа
10. Выполни задание. Составьте схемы образования молекул веществ: Н 2 , Н Cl , К 2 О.
10 класс. Химическая связь. Типы кристаллических решеток. Карточка № 15
1. Химическая связь, образованная посредством общей электронной пары:
А) ковалентная В) ионная С) металлическая Д) водородная Е) нет ответа
2. Химическая связь, образованная между атомами неметаллов с небольшой разницей в электроотрицательности:
А) ковалентная полярная В) ковалентная неполярная С) ионная Д) металлическая Е) водородная
3. Соединения с ковалентной полярной связью в группе:
А) NaCl , СаО В) Cl 2 , Н 2 С) Н 2 S , КCl Д) СО 2 , Н 2 О Е) F е, CuO
4. Тип кристаллической решетки вещества и вид связи, образованные элементами с сокращенными электронными конфигурациями атомов… 3 s 1 и …3 s 2 3 р 5
А) атомная и ковалентная неполярная В) молекулярная и ковалентная неполярная
С) молекулярная и ковалентная полярная Д) металлическая и металлическая
Е) ионная и ионная
5. Вещества с металлической связью:
А) J 2 , H 2 В) Fe , Mg С) NaCl , ВаСl 2 Д) С 2 Н 5 ОН, СН 3 СООН Е) О 2 , Н 2 О
6. Группа веществ с водородной связью:
А) J 2 , H 2 В) С 2 Н 5 ОН, СН 3 СООН С) NaCl , ВаСl 2 Д) Fe , Cu Е) О 2 , Н 2 О
7. Порядок связи равен трем в молекуле:
А) Н 2 В) F 2 С) Br 2 Д) О 2 Е) N 2
8. Ионную кристаллическую решетку имеет:
А) СO 2 В) Br 2 С) Fe Д) NaCl Е) SiO 2
9. Кристаллическая решетка аммиака:
А) ионная В) молекулярная С) атомная Д) металлическая Е) нет ответа
10. Выполни задание. Составьте схемы образования молекул веществ: О 2 , Н Cl , К 2 О.
10 класс. Химическая связь. Типы кристаллических решеток. Карточка № 16
1. Химическая связь, возникающая между атомами, положительными ионами металла и свободнодвижущимися между ними электронами:
А) ковалентная В) ионная С) металлическая Д) водородная Е) нет ответа
2. Химическая связь, образованная между атомами металлов и неметаллов с большой разницей в электроотрицательности:
А) ковалентная полярная В) ковалентная неполярная С) ионная Д) металлическая Е) водородная
3. Ковалентная неполярная связь присутствует у всех веществ группы:
А)MgS , КCl В) NaF , N О C ) Br 2 , Н 2 Д) HCl , Si О 2 Е) Н 2 S , СО 2
4. Ковалентная полярная связь образована по донорно-акцепторному механизму в молекуле:
А) Н 2 S В) H 2 O С) HF Д) NH 3 Е) NH 4 Cl
5. Порядок связи равен двум в молекуле:
А) Н 2 В) F 2 С) Br 2 Д) О 2 Е) N 2
6. Атомную кристаллическую решетку имеет:
А) С В) Na ОН С) Fe Д) NaCl Е) СО 2
7. Вид химической связи в молекуле H 2 O :
А) ковалентная полярная В) ковалентная неполярная С) ионная Д) металлическая Е) водородная
8. Кристаллическая решетка алмаза:
А) ионная В) молекулярная С) атомная Д) металлическая Е) нет ответа
9. Только σ - связи в веществах ряда:
А) С 2 Н 6 и СO 2 В) С 2 Н 6 и H 2 S С) С 2 Н 6 и SO 3 Д) С 2 Н 6 и SO 2 Е) С 2 Н 6 и СO
10. Выполни задание. Составьте схемы образования молекул веществ: Н 2 , Н 2 О, К F .
10 класс. Химическая связь. Типы кристаллических решеток. Карточка № 17
1. Химическая связь, образованная посредством общей электронной пары:
А) ковалентная В) ионная С) металлическая Д) водородная Е) нет ответа
2. Химическая связь, образованная между атомами неметаллов с одинаковой электроотрицательностью:
А) ковалентная полярная В) ковалентная неполярная С) ионная Д) металлическая Е) водородная
3. Вещество с ковалентной полярной связью:
А) Al 2 O 3 В) O 3 С) PH 3 Д) NaCl Е) Ag
4. Заряженные частицы, в которые превращаются атомы в результате отдачи или присоединения электронов, называются:
А) молекулы В) радикалы С) ионы Д) катионы Е) изотопы
5. Вид связи в веществах – электролитах:
А) Ковалентная неполярная, металлическая В) Ковалентная неполярная, ионная
С) Ионная, ковалентная сильнополярная Д) Металлическая, ионная
Е) Ковалентная неполярная, полярная
6. Вещества с металлической связью:
А) J 2 , H 2 В) Fe , Cu С) NaCl , ВаСl 2 Д) С 2 Н 5 ОН, СН 3 СООН Е) О 2 , Н 2 О
7. Группа веществ с водородной связью:
А) J 2 , H 2 В) С 2 Н 5 ОН, СН 3 СООН С) NaCl , ВаСl 2 Д) Fe , Cu Е) О 2 , Н 2 О
8. Ионную кристаллическую решетку имеет:
А) СO 2 В) Br 2 С) Fe Д) NaCl Е) SiO 2
9. Металлическая кристаллическая решетка не характерна для:
А) Меди В) Натрия С) Серебра Д) Цинка Е) Углерода
10. Выполни задание. Составьте схемы образования молекул веществ: H 2 , Н Br , N а 2 О.
10 класс. Химическая связь. Типы кристаллических решеток. Карточка № 18
1. Химическая связь, образованная за счет электростатического притяжения ионов:
А) ковалентная полярная В) ковалентная неполярная С) ионная Д) металлическая Е) водородная
2. Химическая связь, образованная между атомами неметаллов с небольшой разницей в электроотрицательности:
А) ковалентная полярная В) ковалентная неполярная С) ионная Д) металлическая Е) водородная
3. Ряд веществ с ковалентной неполярной связью:
А) СаF 2 , NaF , КBr В) О 2 , Н 2 , Cl 2 С) N Н 3 , Н 2 О, НBr
Д) Al , Na , F е Е) Н 2 О, F е 2 О 3 , НCl
4. Заряженные частицы, в которые превращаются атомы в результате отдачи электронов, называются:
А) молекулы В) анионы С) ионы Д) катионы Е) изотопы
5. Только σ - связи в веществах ряда:
А) С 2 Н 6 и СO 2 В) С 2 Н 6 и H 2 S С) С 2 Н 6 и SO 3 Д) С 2 Н 6 и SO 2 Е) С 2 Н 6 и СO
6. Водородную связь могут образовывать между собой:
А) СН 4 В) С 2 Н 5 ОН С) С 3 Н 8 Д) СаО Е) NaH
7. Металлическую и ионную связи может образовывать:
А) Селен В) Теллур С) Бор Д) Кремний Е) Натрий
8. Молекулярную кристаллическую решетку имеет:
А) СO 2 В) Na ОН С) Fe Д) NaCl Е) SiO 2
9. Металлическую кристаллическую решетку имеет:
А) Ag B ) Br C ) Se Д) Хе Е) Kr
10. Выполни задание. Составьте схемы образования молекул веществ: О 2 , Н Cl , К Br .
10 класс. Химическая связь. Типы кристаллических решеток. Карточка № 19
1. Химическая связь, возникающая между атомами, положительными ионами металла и свободнодвижущимися между ними электронами:
А) ковалентная В) ионная С) металлическая Д) водородная Е) нет ответа
2. Химическая связь, образованная между атомами металлов и неметаллов с большой разницей в электроотрицательности:
А) ковалентная полярная В) ковалентная неполярная С) ионная Д) металлическая Е) водородная
3. Заряженные частицы, в которые превращаются атомы в результате принятия электронов, называются:
А) молекулы В) анионы С) ионы Д) катионы Е) изотопы
4. Пара химических элементов, между которыми образуется ковалентная полярная связь:
А)К иF В) Na и Cl C ) Н и Р Д) О и О Е) Fe и Fe
5. Ионная связь есть в:
А)Mg В) NaF C ) Br 2 Д) HCl Е) F 2
6. Водородная связь может образоваться между молекулами:
А) Фтора В) Хлора С) Фтороводорода Д) Серы Е) Водорода
7. Порядок связи равен двум в молекуле:
А) Н 2 В) F 2 С) Br 2 Д) О 2 Е) N 2
8. Атомную кристаллическую решетку имеет:
А) СO 2 В) Na ОН С) Fe Д) NaCl Е) SiO 2
9. Кристаллическая решетка алмаза:
А) ионная В) молекулярная С) атомная Д) металлическая Е) нет ответа
10. Выполни задание. Составьте схемы образования молекул веществ: N 2 , Н Cl , N а Br .
10 класс. Химическая связь. Типы кристаллических решеток. Карточка № 20
1.Химическая связь, образованная между атомами неметаллов с одинаковой электроотрицательностью:
А) ковалентная полярная В) ковалентная неполярная С) ионная Д) металлическая Е) водородная
2. Химическая связь, образованная посредством общей электронной пары:
А) ковалентная В) ионная С) металлическая Д) водородная Е) нет ответа
3. Ковалентная полярная связь образована по донорно-акцепторному механизму в молекуле:
А) Н 2 S В) H 2 O С) HF Д) NH 3 Е) NH 4 Cl
4. Ковалентная неполярная связь присутствует у всех веществ группы:
А)Mg , КCl В) NaF , N О C ) Br 2 , О 2 Д) HCl , СО 2 Е) Н 2 S , О 2
5. Порядок связи равен трем в молекуле:
А) Н 2 В) F 2 С) Br 2 Д) О 2 Е) N 2
6. Вид химической связи в молекуле H 2 O :
А) ковалентная полярная В) ковалентная неполярная С) ионная Д) металлическая Е) водородная
7. Молекулярная кристаллическая решетка будет в:
А)Mg В) NaF C ) С Д) HCl Е) SiO 2
8. Кристаллическая решетка поваренной соли:
А) ионная В) молекулярная С) атомная Д) металлическая Е) нет ответа
9. Заряженные частицы, в которые превращаются атомы в результате отдачи или присоединения электронов, называются:
А) молекулы В) радикалы С) ионы Д) катионы Е) изотопы
10. Выполни задание. Составьте схемы образования молекул веществ: Cl 2 , Н 2 О, N а J .
10 класс. Химическая связь. Типы кристаллических решеток. Карточка № 21
1. Химическая связь, образованная между атомами неметаллов с небольшой разницей в электроотрицательности:
А) ковалентная полярная В) ковалентная неполярная С) ионная Д) металлическая Е) водородная
2. Химическая связь, образованная за счет электростатического притяжения ионов:
А) ковалентная полярная В) ковалентная неполярная С) ионная Д) металлическая Е) водородная
3. Вещества с ковалентной связью в группе:
А) Br 2 , NaH , MgO , KCl В) РН 3 , N 2 О 5 , СаО, ВаСl 2 С) Н 2 О, СS 2 , НJ , РН 3
Д) As 2 S 3 , AlCl 3 , O 2 , N 2 Е) НCl, SiH 4 , К 2 О, ВаBr 2
4. Вид химической связи в молекуле К 2 O :
А) ковалентная полярная В) ковалентная неполярная С) ионная Д) металлическая Е) водородная
5. Заряженные частицы, в которые превращаются атомы в результате отдачи электронов:
А) молекулы В) анионы С) ионы Д) катионы Е) изотопы
6. Вид химической связи между молекулами H 2 O :
А) ковалентная полярная В) ковалентная неполярная С) ионная Д) металлическая Е) водородная
7. Металлическая кристаллическая решетка будет в:
А)Mg В) NaF C ) Н 2 Д) HCl Е) O 2
8. Молекулярную кристаллическую решетку имеет:
А) CuSO 4 В) Na ОН С) Fe Д) NaCl Е) SO 2
9. Кристаллическая решетка графита:
А) ионная В) молекулярная С) атомная Д) металлическая Е) нет ответа
10. Выполни задание. Составьте схемы образования молекул веществ: H 2 , N Н 3 , NaCl .
10 класс. Химическая связь. Типы кристаллических решеток. Карточка № 22
1. Химическая связь, образованная между атомами металлов и неметаллов с большой разницей в электроотрицательности:
А) ковалентная полярная В) ковалентная неполярная С) ионная Д) металлическая Е) водородная
2. Химическая связь, возникающая между атомами, положительными ионами металла и свободнодвижущимися между ними электронами:
А) ковалентная В) ионная С) металлическая Д) водородная Е) нет ответа
3. Ионная связь есть в:
А)Са В) N 2 О 5 C ) Br 2 Д) NaCl Е) F 2
4. Число электронов, участвующих в образовании химической связи в молекуле N 2:
А) 2 В) 4 С) 5 Д) 8 Е) 6
5. Вид химической связи в кристаллической сере
А) ионная В) ковалентная полярная С) водородная
Д) ковалентная неполярная Е) металлическая
6. Заряженные частицы, в которые превращаются атомы в результате принятия электронов, называются:
А) молекулы В) анионы С) ионы Д) катионы Е) изотопы
7. Пара химических элементов, между которыми образуется ковалентная полярная связь:
А)К иF В) Na и Cl C ) Н и Н Д) Н и N Е) Са и Са
8. Металлическая кристаллическая решетка не характерна для:
А) Меди В) Углерода С) Серебра Д) Цинка Е) Натрия
9. Кристаллическая решетка брома:
А) ионная В) молекулярная С) атомная Д) металлическая Е) нет ответа
10. Выполни задание. Составьте схемы образования молекул веществ: J 2 , Н Cl , К 2 О.
10 класс. Химическая связь. Типы кристаллических решеток. Карточка № 23
1. Химическая связь, образованная посредством общей электронной пары:
А) ковалентная В) ионная С) металлическая Д) водородная Е) нет ответа
2. Химическая связь, образованная между атомами неметаллов с небольшой разницей в электроотрицательности:
А) ковалентная полярная В) ковалентная неполярная С) ионная Д) металлическая Е) водородная
3. Соединения с ковалентной полярной связью в группе:
А) NaCl , СаО В) Cl 2 , Н 2 С) Н 2 S , НCl Д) О 2 , Н 2 О Е) F е, CuO
4. Тип кристаллической решетки вещества и вид связи, образованные элементами с сокращенными электронными конфигурациями атомов… 3 s 1 и …3 s 2 3 р 5
А) атомная и ковалентная неполярная В) молекулярная и ковалентная неполярная
С) молекулярная и ковалентная полярная Д) металлическая и металлическая
Е) ионная и ионная
5. Вещества с металлической связью:
А) J 2 , H 2 В) Fe , C а С) NaCl , ВаСl 2 Д) С 2 Н 5 ОН, СН 3 СООН Е) О 2 , Н 2 О
6. Группа веществ с водородной связью:
А) J 2 , H 2 В) С 2 Н 5 ОН, СН 3 СООН С) NaCl , ВаСl 2 Д) Fe , Cu Е) О 2 , Н 2 О
7. Порядок связи равен трем в молекуле:
А) Н 2 В) F 2 С) Br 2 Д) О 2 Е) N 2
8. Ионную кристаллическую решетку имеет:
А) СO 2 В) Br 2 С) Fe Д) NaCl Е) SiO 2
9. Кристаллическая решетка углекислого газа:
А) ионная В) молекулярная С) атомная Д) металлическая Е) нет ответа
10. Выполни задание. Составьте схемы образования молекул веществ: О 2 , Н Cl , Na 2 О.
10 класс. Химическая связь. Типы кристаллических решеток. Карточка № 24
1. Химическая связь, возникающая между атомами, положительными ионами металла и свободнодвижущимися между ними электронами:
А) ковалентная В) ионная С) металлическая Д) водородная Е) нет ответа
2. Химическая связь, образованная между атомами металлов и неметаллов с большой разницей в электроотрицательности:
А) ковалентная полярная В) ковалентная неполярная С) ионная Д) металлическая Е) водородная
3. Ковалентная неполярная связь присутствует у всех веществ группы:
А)MgS , КCl В) NaF , N О C ) Br 2 , N 2 Д) HCl , Si О 2 Е) Н 2 S , СО 2
4. Ковалентная полярная связь образована по донорно-акцепторному механизму в молекуле:
А) Н 2 S В) H 2 O С) HF Д) NH 3 Е) NH 4 Cl
5. Порядок связи равен двум в молекуле:
А) Н 2 В) F 2 С) Br 2 Д) О 2 Е) N 2
6. Атомную кристаллическую решетку имеет:
А) СO 2 В) Na ОН С) Fe Д) NaCl Е) С
7. Вид химической связи в молекуле H 2 O :
А) ковалентная полярная В) ковалентная неполярная С) ионная Д) металлическая Е) водородная
8. Кристаллическая решетка алмаза:
А) ионная В) молекулярная С) атомная Д) металлическая Е) нет ответа
9. Только σ - связи в веществах ряда:
А) С 2 Н 6 и СO 2 В) С 2 Н 6 и H 2 S С) С 2 Н 6 и SO 3 Д) С 2 Н 6 и SO 2 Е) С 2 Н 6 и СO
10. Выполни задание. Составьте схемы образования молекул веществ: Н 2 , Н 2 О, NaF .
Агрегатные (от лат. Aggrego - присоединяю) состояния вещества - состояния одного и того же вещества в различных интервалах (перерывах) температур и давлений.
Агрегатными состояниями принято считать газообразное, жидкое и твердое. Для некоторых веществ существует еще и состояние «плазмы». Простейшими примерами существования одной и той же вещества в этих трех агрегатных состояниях, которые наблюдаются в повседневной жизни, с лед, вода и водяной пар. Невидимая водяной пар всегда присутствует и в окружающем нас воздухе. Вода существует в интервале температур от О градусов до 100 ° С, лед - при температурах, ниже О градусов. При температурах выше 100 ° С и нормальном атмосферном давлении, молекулы воды существуют только в газообразном состоянии - в виде водяного пара. Вода, лед и водяной пар это одно и то же вещество с химической формулой h2O
Различные агрегатные этапы существуют в каждой вещества. Отличаются они не молекулами, а тем, как эти молекулы расположены и как движутся
10.Кристалическое состояние вещества. Типы кристаллических решеток. Основные характеристики элементарной КР.
Кристаллическая решетка - пространственная структура, характеризующаяся упорядоченным расположением атомов, молекул или ионов. Большинство веществ в твердом состоянии образует кристаллическую решетку. В зависимости от природы частиц, находящихся в воображаемых узлах кристаллической решетки, и от того, какие силы взаимодействия между ними преобладают, различают атомные, молекулярные, ионные и металлические решетки.
Молекулярные кристаллические решетки
.
Молекулярными называются кристаллические решетки, в узлах которых находятся молекулы. Такие решетки при обычных условиях имеют: иод (I2), кристаллическая сера (S8), лед (H2O), сахароза (C12H22O11), нафталин (C10H8) и др. При очень низких температурах и высоких давлениях кристаллические решетки образуют также водород (H2), азот (N2), хлороводород (HCl) и другие ковалентные соединения. Межмолекулярные взаимодействия в кристаллах значительно слабее ковалентных и ионных связей. Поэтому молекулярные кристаллы плавятся при низких температурах, имеют высокую летучесть. Вещества с молекулярной кристаллической решеткой относят к веществам молекулярного строения.
Атомные кристаллические решетки .
Атомными называются кристаллические решетки, в узлах которых находятся атомы, связь между которыми ковалентная. Такие решетки образуют как простые вещества, например, алмаз, графит, так и сложные, например, кремнезем (кварц, SiO 2) и др. Благодаря наличию прочных ковалентных связей атомы надежно удерживаются в узлах кристаллической решетки. Такие вещества в стандартных условиях твердые, нелетучие, с высокой температурой плавления, они практически не растворяются в воде. Вещества с атомной кристаллической решеткой, как и с ионной, относят к веществам немолекулярного строения, их химическая формула выражает не состав молекулы, а количественное отношение между атомами в целом кристалле. Обычно состав веществ немолекулярного строения выражают формульной единицей. Например, запись SiO 2 означает, что в кристалле кварца на каждый атом кремния приходится два атома кислорода.
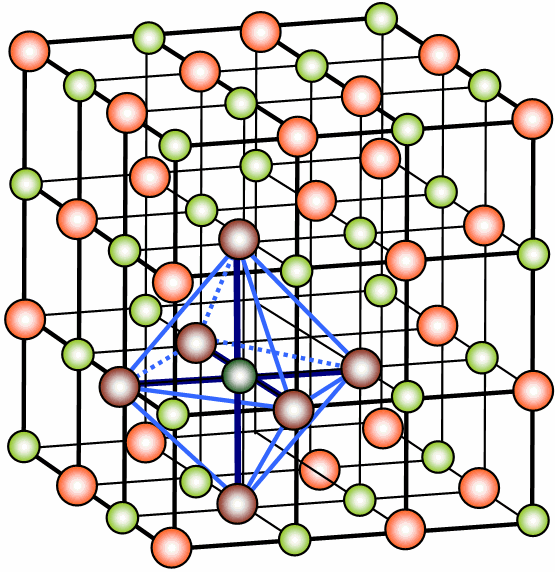
Ионные кристаллические решетки .
Ионными называются кристаллические решетки, в узлах которых находятся заряженные частицы - ионы, которые связаны прочными ионными связями. Такие решетки имеют все соли, основания, многие оксиды металлов и др. Сильное взаимное притяжение разноименных ионов обеспечивает устойчивость кристаллической решетки. Такие вещества в стандартных условиях твердые, нелетучие, с высокой температурой плавления, однако многие из них хорошо растворяются в воде. Вещества с ионной кристаллической решеткой, как и с атомной, относят к веществам немолекулярного строения. Их химическая формула также выражает не состав молекулы, а количественное отношение между ионами в целом кристалле. Обычно состав веществ немолекулярного строения выражают формульной единицей, например, запись NaCl означает, что в кристалле хлорида натрия на каждый катион натрия Na + приходится один хлорид-ион Cl – . Хотя на самом деле каждый катион окружен шестью анионами и, наоборот, вокруг каждого аниона размещается 6 катионов. Поэтому для таких веществ правильнее использовать термин «формульная единица» вместо «формула».
Металлические кристаллические решетки .
Металлическими называются кристаллические решетки, в узлах которых находятся катионы металлов, а в пространстве между ними непрерывно перемещаются свободные обобществленные электроны («электронный газ»). Электроны электростатически притягивают катионы металлов, обеспечивая стабильность кристаллической решетки. Общность строения кристаллических решеток у всех металлов определяет наличие у них общих физических свойств: пластичности (ковкости), высокой электро- и теплопроводности, металлического блеска. Важнейшим химическим свойством металлов является их восстановительная активность - способность отдавать электроны при реакциях с простыми и сложными веществами, т.е. переходить в катионы.
Характеристика:
Элементарная ячейка - в геометрии, физике твёрдого тела и минералогии, в частности при обсуждении кристаллической решётки, минимальная ячейка, отвечающая единичной решёточной точке структуры с трансляционной симметрией в 2D, 3D или других размерностях. Фактически это минимальный воображаемый объём кристалла, параллельные переносы (трансляции) которого в трёх измерениях позволяют построить трёхмерную кристаллическую решётку в целом.
Содержимое элементарной ячейки позволяет охарактеризовать всю структуру минерала. Часть структуры, охватываемая элементарной ячейкой, состоит из атомов, удерживаемых вместе благодаря электронным связям. Такие мельчайшие ячейки, бесконечно повторяющиеся в трехмерном пространстве, образуют кристалл. Элементарная ячейка не является физическим телом, её можно передвигать по структуре параллельно самой себе, независимо от выбора начала координат ячейка будет содержать те же атомы в прежних количествах, так как структура периодична. Элементарная ячейка и представляет собой такой минимальный период в трёх измерениях.
Применяемые в кристаллографии элементарные ячейки имеют вид параллелепипедов, их форма и размер определяются заданием трёх некомпланарных трансляций (векторов) решётки, то есть трёх не лежащих в одной плоскости ребер ячейки. Ячейка полностью определяет решётку. Обратное неверно: в одной и той же решётке выбор ячейки может совершаться по-разному.
Ячейка, построенная на трёх кратчайших некомпланарных трансляциях решётки, называется основной ячейкой. Объём такой ячейки минимален, она содержит всего один узел кристаллической решётки, и относится поэтому к примитивным ячейкам. Нередко такая ячейка оказывается низкосимметричной, при том, что симметрия самой структуры выше. В таком случае выбирают другую, высокосимметричную ячейку большего объёма, с дополнительными узлами решётки (непримитивная, или центрированная ячейка).
При помощи рентгеноструктурного анализа определяются размеры элементарной ячейки минерала, его сингонию, вид симметрии и пространственную группу симметрии, а также расшифровывают кристаллическую структуру.
11.Классификация кристаллов по типу связей. Жидкие кристаллы
Ионная связь
- образуется между разноименно заряженными ионами веществ. В узлах кристаллической решетки - ионы. Энергия взаимодействия кулоновская.
Гетерополярная связь
- связь между правильно чередующимися в узлах кристаллической решетки положительными и отрицательными ионами. Общее свойство - диэлектрики, высокие точки плавления и большая теплота сублимации.
Ковалентная связь
- характерна для кристаллической решетки полупроводников. Химическая связь между нейтральными атомами. гомеополярная связь.
Обшей характерные свойства - высокие температуры плавления и теплота сублимации, высокая механическая прочность, малая электропроводность.
Водородная связь
- происходит между молекулами содержащими атом водорода(лед, HF);
Ван-дер-Вальсова связь
- В узлах кристаллической решетки находятся молекулы, и связь между ними Ван-дер-Вальсова. Силы дипольно-ориентационные или дисперсионные. Свойства кристалла% низкие точки плавления, связь слабая, кристалл не прочный.
Металлическая связь - в этих кристаллах общие для всей кристаллической решетки электроны выполняют роль клея. Свойства прочность, электропроводность.
Анизотропия
- свойство характерное для всех кристаллов, неодинаковость свойств по разным направлениям.
Она проявляется из-за различного расстояния между молекулами в кристалле по разным направлениям.
Жидкие кристаллы (сокращённо ЖК) - это фазовое состояние, в которое переходят некоторые вещества при определенных условиях (температура, давление, концентрация в растворе). Жидкие кристаллы обладают одновременно свойствами как жидкостей (текучесть), так и кристаллов (анизотропия). По структуре ЖК представляют собой вязкие жидкости, состоящие из молекул вытянутой или дискообразной формы, определённым образом упорядоченных во всем объёме этой жидкости. Наиболее характерным свойством ЖК является их способность изменять ориентацию молекул под воздействием электрических полей, что открывает широкие возможности для применения их в промышленности. По типу ЖК обычно разделяют на две большие группы: нематики и смектики. В свою очередь нематики подразделяются на собственно нематические и холестерические жидкие кристаллы
- Чему равен 1 год на меркурии
- Кто такой Николай Пейчев?
- Томас андерс - биография, фото, личная жизнь солиста дуэта "модерн токинг" Синглы Томаса Андерса
- Что показывает коэффициент обеспеченности финансовых обязательств активами Обеспеченность обязательств финансовыми активами в бюджетном учреждении
- Как приготовить классические вареники с творогом
- Как сделать тесто для яблочной шарлотки Как приготовить шарлотку с яблоками песочное тесто
- Отечественной войны 2 степени

 Live Journal
Live Journal Facebook
Facebook Twitter
Twitter